一种食蟹猴双边腓骨截骨术制作的骨缺损模型的构建方法与流程
本发明涉及生物医学研究
技术领域:
,特别涉及一种食蟹猴双边腓骨截骨术制作的骨缺损模型的构建方法。
背景技术:
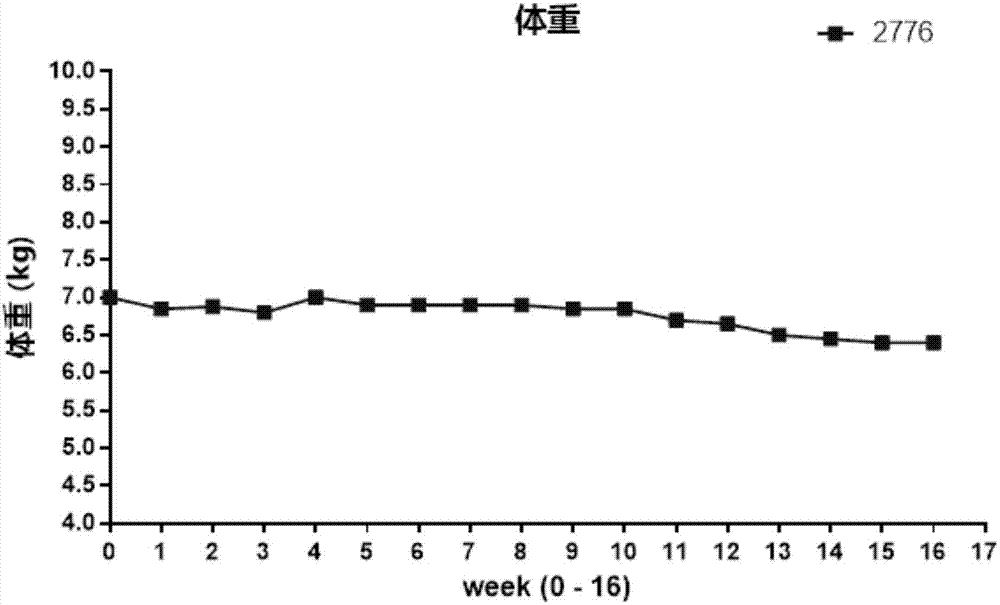
:骨缺损指骨的结构完整性被破坏,是临床常见病,也是骨科治疗的难题之一。目前,治疗骨缺损的方法有自体骨和异体骨移植、组织工程技术和基因治疗法及生长因子、物理治疗法的辅助治疗等。创伤、感染、肿瘤、骨髓炎手术清创、以及各种先天性疾病是导致骨缺损的主要原因。在啮齿类动物与灵长类动物所观察到的药效往往和人类身上有很大不同,一定程度上限制了医疗技术的进步。故急需建立一种食蟹猴双边腓骨截骨术制作的骨缺损模型,为探明骨缺损发生的病因及有效的临床治疗方案提供与人类更为相关的实验数据。技术实现要素:鉴于以上问题,本发明提供了一种食蟹猴双边腓骨截骨术制作的骨缺损模型,为探明骨缺损发生的病因及有效的临床治疗方案提供与人类更为相关的实验数据。为了实现上述发明目的,本发明提供以下技术方案:一种食蟹猴双边腓骨截骨术制作的骨缺损模型的构建方法,包括以下步骤:a.动物麻醉:肌肉注射0.05mg/kg阿托品,5-10min后,肌肉注射4mg/kg氯胺酮,进行麻醉,此后使用含1.5-5%异氟烷的0.8-1.5l/min氧气做维持麻醉;b.术肢固定:实验猴被带入手术室,置仰卧位,将手术肢固定,随后在对侧肢上行同样的操作步骤,实验猴两足均被包裹后,使用预先开口以供足部伸出的手术铺巾覆盖其身体;c.手术过程:在手术肢上,于腓骨末端用手术刀做一个小型刺切口,用一根1.2mm直径,10cm长的克氏针从腓骨末端插入,在确保克氏针固定后,将其插入腓骨骨髓腔2cm,随后在腓骨上做一个4-5cm长的正面切口,钝性分离其上的肌肉,使腓骨暴露,使用手持牵开器将腓骨周围软组织牵开,形成约1cm宽的开口,使用无菌笔在腓骨上标记出需要行截骨术的部位,用牙科钻的震荡锯头在腓骨上切除1.5cm长的部分,截骨术完成后,检查骨断端,确保没有残余骨膜覆盖在骨截面处,将此前置于腓骨末端的克氏针继续插入,横跨截断处,插入对侧断端1cm深,切断远端腓骨外露的克氏针,将切断后的断端使用冲头和骨科锤钉入腓骨内;d.术后处理:术后3天,实验猴将持续接受不少于0.02mg/kg丁丙诺啡肌肉注射,每天两次,间隔约8小时;手术结束时及术后3天,使用头孢曲松钠50mg/kg肌注,以防止感染;术后3天,每天至少2次监测动物的疼痛,不舒适,肢体使用缺陷和其它生命体征。所述步骤b,需要保证所有手术过程均在麻醉和严格的无菌条件下进行,动物接受手术的当天,将手术肢端的毛发剃除,并使用碘伏及70%乙醇清洁消毒周围手术区域,将实验猴手术肢使用碘伏360°方位消毒备皮,手术肢近端及躯干铺无菌手术铺巾,手术肢足部使用无菌弹力绷带包裹。所述步骤c,在切除过程中,使用带针无菌注射器向腓骨及其周边喷撒无菌盐水降温,以防切割处温度过高引起断端的热损伤。所述步骤d,待动物从麻醉中恢复后,即可允许实验猴正常负重及活动,食物和水将被置于笼底,以保证动物可以容易获取,同时为刺激实验猴术后的食欲,会额外提供水果和蔬菜。所述造模完成后,选用微型ct扫描,触诊,生物力学测试及病理切片指标等对模型进行评价,均证明造模成功,与临床一致性很高。本发明的优点和有益效果在于提供了一种食蟹猴双边腓骨截骨术制作的骨缺损模型,为探明骨缺损发生的病因及有效的临床治疗方案提供与人类更为相关的实验数据。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。图1为每周体重测量数据。图2为x光影片。图3为病理切片。具体实施方式下面结合附图和实施例,对本发明的具体实施方式作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。实施例1.实验动物将实验动物饲养在普通级动物房中,单笼饲养,保持室内温度为20-29℃,相对湿度40-70%,荧光灯12小时循环照明,照明时间为08:00-20:00,动物自由取食,自由饮水,饮用水均为经净水器净化后的自来水,符合who饮用水规范。实施例2.麻醉首先肌肉注射0.05mg/kg阿托品。5-10min后,肌肉注射4mg/kg氯胺酮,进行麻醉。此后使用含1.5-5%异氟烷的0.8-1.5l/min氧气做维持麻醉。实施例3.手术过程动物接受手术的当天,将手术肢端的毛发剃除,并使用碘伏及70%乙醇清洁消毒围手术区域。随后实验猴被带入手术室,置仰卧位。将手术肢四周悬浮固定,使用碘伏360度方位消毒备皮。手术肢近端及躯干铺无菌手术铺巾。手术肢足部使用无菌弹力绷带包裹,以保证手术过程中始终无菌。随后将手术肢固定。随后在对侧肢上行同样的操作步骤。当实验猴两足均被包裹后,使用预先开口以供足部伸出的手术铺巾覆盖其身体。在手术肢上,于腓骨末端用手术刀做一个小型刺切口。用一根1.2mm直径,10cm长的克氏针从腓骨末端插入,在确保克氏针固定后,将其插入腓骨骨髓腔2cm。随后在腓骨上做一个4-5cm长的正面切口,钝性分离其上的肌肉,使腓骨暴露。使用手持牵开器将腓骨周围软组织牵开,形成约1cm宽的开口。使用无菌笔在腓骨上标记出需要行截骨术的部位。用牙科钻的震荡锯头在腓骨上切除1.5cm长的部分。在切除过程中,使用带针无菌注射器向腓骨及其周边喷撒无菌盐水降温,以防切割处温度过高引起断端的热损伤。截骨术完成后,检查骨断端,确保没有残余骨膜覆盖在骨截面处。将此前置于腓骨末端的克氏针继续插入,横跨截断处,插入对侧断端1cm深。切断远端腓骨外露的克氏针,将切断后的断端使用冲头和骨科锤钉入腓骨内。实施例4.术后护理术后3天,实验猴将持续接受丁丙诺啡至少0.02mg/kg肌肉注射,每天两次,间隔约8小时。如有必要可继续给与。手术结束时及术后3天,使用头孢曲松钠50mg/kg肌注,以防止感染。术后3天,每天至少2次监测动物的疼痛,不舒适,肢体使用缺陷和其它生命体征。根据上述情况和兽医的推荐,使用镇痛药的剂量和时间可能有更改。如果动物的疼痛超越了上述镇痛剂的有效范围,动物护理人员须联系兽医和实验负责人来确定下一步行动。所有动物必须密切监测直至从麻醉中恢复。从麻醉中恢复后,即可允许实验猴正常负重及活动。食物和水将被置于笼底,以保证动物可以容易获取。同时为刺激实验猴术后的食欲,会额外提供水果和蔬菜。实施例5.体重每周测量一次动物体重。每周体重测量数据见图1和表1。相对来说,动物在整个16周的实验周期中体重维持稳定,仅有少量波动。表1每周体重实施例6.x射线检查在术后及每两周间隔用x射线检查术腿的断端连接线,愈合组织形成和骨恢复过程。x射线影片如图2所示。实施例7.取材手术及麻醉前取血3-5ml,以监测健康状态。分离血清,用于后续的抗体水平检测。在实验终点,即手术16周后,将动物安乐死并取出截骨术后修复的骨段。该骨段暴露后,使用振动锯从克氏针上方处将腓骨截断。用经无菌生理盐水浸泡过的纱布海绵将该骨段包裹,放置于50ml离心管中,保存于-20℃。以便后续使用mts858材料试验机进行扭转生物力学检测。在进行骨生物力学检测前,使用微型ct生成骨片段的三维成像及体积骨矿密度。微型ct的测量数据bvf(骨体积分数),bmc(骨矿含量)和bmd(骨矿密度)见表2。bmc显示实际的矿化组织含量,可以看见手术显著减少了骨缺损部位的矿化组织。表2微型ct数据动物编号处理bvf(%)bmc(mg)bmd(mg/cc)2776-左侧手术0.27454.5122447.63630712147-左侧未手术0.6254280.8371680.1473生物力学测试的结果进一步验证了微型ct观测到的结果,手术愈合后的骨组织的力学数据,包括最大扭矩,刚度以及断裂能相比正常组有显著降低。动物2776左侧腓骨解剖取材时可由手轻易扭动,故其样本没有测试的必要。所以相关数据均为0。表3扭力测试数据生物力学测试后,将样本转移到10%中性甲醛中进行组织固定。将未脱钙的,经过上述扫描的样本制作切片,使用台盼蓝染色及未染色的切片进行骨愈合的病理学评价。病理切片均证明造模成功,成模典型,与临床一致性很高。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1