一种豆芋叶黄酮类提取物及其制备方法和应用与流程
本发明涉及功能食品技术领域,尤其涉及一种豆芋叶黄酮类提取物及其制备方法和应用。
背景技术:
美国豆芋(apioamericanamedikus)是一种多年生豆科植物,原产于美国西部,食用部分为地下块茎,是一种天然的高蛋白、高钙食品。日本早在20世纪80年代就已成功将美国豆芋开发为保健品并推广到市场,我国也于2009年将美国豆芋引入种植,并在浙江省部分地区得到很好的栽培与推广。许多研究表明美国豆芋对高血压、糖尿病和高脂血症等慢性病具有明显的改善效果。
美国豆芋用于保健食品开发多为块茎部分,关于其地上部分例如花和叶子的报道很少,应用相对欠缺。
近年来,国内外的研究发现,豆芋的地上部分含有丰富的游离氨基酸、总皂苷、维生素,尤其是类黄酮,有着广阔的开发空间。有研究表明,美国豆芋花总皂苷具有α-葡萄糖苷酶抑制作用并且豆芋花提取物可以显著改善糖尿病小鼠的高血糖症状(谭娇,丁兰,蔡仁祥,等.美国豆芋花总皂苷制备及其α-葡萄糖苷酶抑制活性[j].核农学报.2017,31(7):1355-1364;jinkawamura,emimiura.investigationofthesafetyandantihyperglycemiceffectofapiosamericanaflowerintakeasafoodmaterialinnormalanddiabeticmice[j].foodscienceandtechnologyresearch,2015,21(3):453-462.)。
豆芋叶中含有丰富的总皂苷、总黄酮和异黄酮类物质(戚利潮,杨芸芸,郑子桓,等.美国豆芋不同部位生化特征成分分析[j].浙江农业科学.2016,57(4):529-534.)。但目前并未发现有对美国豆芋叶黄酮类物质的提取方法与降血糖活性的相关报道。此外,美国豆芋叶目前基本处于废弃状态,未能开发利用,造成了资源的浪费。
糖尿病是一种以糖代谢紊乱为主要特征的内分泌代谢综合疾病,而ii型糖尿病占了糖尿病人群中的绝大多数,这类病人的血清中不存在胰岛素自身抗体及胰岛细胞抗体,不依赖胰岛素注射生存,这使得对该病的治疗成了一大难题。
天然产物由于其来源天然、生产成本低廉、毒副作用小,成为当今研究的热点。现已从动植物等天然资源中发现一些活性成分如黄酮类、多糖类、皂苷类、生物碱类、多肽类、不饱和脂肪酸、多酚类物质等具有降糖作用,称为降血糖功能因子。相关研究表明,黄酮类化合物在体外和体内水平均有较好的抗糖尿病作用(蓝晓雪,杨洁.黄酮类化合物降血糖功能研究进展[j].安徽农业科学.2016.44(17):255-257.)。肝脏是胰岛素作用的靶器官,是参与糖代谢调控的重要器官,在糖原合成、糖异生等过程中起到关键作用。
技术实现要素:
本发明提供了一种豆芋叶黄酮类提取物及其制备方法和应用,该豆芋叶黄酮类提取物中富含黄酮,尤其是牡荆素和夏佛塔苷,能够有效抑制α-葡萄糖苷酶的活性、促进细胞的糖代谢,具有降血糖活性。
本发明提供的豆芋叶黄酮类提取物,含有质量分数为78~87%的总黄酮;其中,所述总黄酮中含有牡荆素和夏佛塔苷;以豆芋叶黄酮类提取物为基准,所述牡荆素的质量分数为45~50%,所述夏佛塔苷的质量分数为19~24%。
本发明提供了一种豆芋叶黄酮类提取物的制备方法,包括以下步骤:
(1)取豆芋叶粉末,置于乙醇水溶液中,进行超声波浸提,获得浸提液;
(2)将所述浸提液静置12~18h后,冷冻离心,收集上清液;
(3)取所述上清液,经过柱分离、洗脱后,收集黄色液体,得到分离液;
(4)将所述分离液进行浓缩、预冷冻和冷冻干燥,获得豆芋叶黄酮类提取物。
所述豆芋叶粉末为美国豆芋叶经烘干、粉碎、过20目筛后获得。
作为优选,步骤(1)中,所述乙醇水溶液中乙醇的体积分数为55~70%;豆芋叶粉末与乙醇水溶液的用量比为1g:25~30ml。该体积分数下的乙醇水溶液可以更好地溶解黄酮类物质,除去醇不溶性物质;在该料液比下,可以保证豆芋叶粉末中的黄酮类物质充分浸提,避免乙醇的浪费。
作为优选,步骤(1)中,所述超声波浸提的频率为100~200w;温度为30~35℃;时间为20~35min。在该条件下的超声波浸提既有利于将黄酮类物质充分浸提出来,又可以尽量减少温度及超声波对黄酮类物质活性结构的破坏。
豆芋叶中含有多糖等水溶性物质,这些物质不溶于较高浓度的乙醇水溶液中,因此,在低温下静置12~18h后可以使这些物质充分沉淀,有利于后续黄酮类物质的分离纯化。
作为优选,步骤(2)中,所述浸提液静置时的温度为4~8℃;所述冷冻离心的转速为3000~4000rpm,温度为4~8℃,时间为20~30min。该温度下既有利于杂质充分析出沉淀,又可以减少黄酮类物质活性的降低。
步骤(3)中,过柱分离采用的树脂为ab-8大孔树脂;洗脱液采用质量分数为60~80%的乙醇水溶液。作为优选,所述上清液先进行减压浓缩,回收乙醇,获得浓缩液,再进行过柱分离。该类型的大孔树脂更利于黄酮类物质的富集、分离与纯化,并且该体积分数下的乙醇洗脱液可以得到较高回收率和纯度的黄酮类物质。
步骤(4)中,所述分离液先经旋转蒸发除去乙醇,再进行预冷冻后,最后经真空冷冻干燥至恒重,得到豆芋叶黄酮类提取物。
作为优选,所述预冷冻的温度为-70~-80℃,时间为15~20h。
本发明提供的豆芋叶黄酮类提取物还可用于制备降血糖食品或药物中的应用。
本发明还提供了豆芋叶黄酮类提取物在抑制α-葡萄糖苷酶活性、促进细胞糖代谢中的应用。具体地,所述细胞糖代谢为细胞葡萄糖消耗能力和细胞内糖原合成量。
进一步地,所述细胞为hepg2肝细胞。hepg2细胞来源于人体肝组织,具有肝细胞的功能和形态,可以采用该细胞模型观察美国豆芋叶黄酮类提取物的降糖作用。
作为优选,所述豆芋叶黄酮类提取物的浓度为100μg/ml。经实验发现,当豆芋叶黄酮类提取物浓度为100μg/ml时,可以提升hepg2细胞2.3倍的葡萄糖摄取能力,并显著提高细胞内糖原合成量。
与现有技术相比,本发明具有以下有益效果:
(1)本发明以豆芋叶为对象提取黄酮类物质,得到的豆芋叶黄酮类提取物富含黄酮,尤其是牡荆素和夏佛塔苷,能够有效抑制α-葡萄糖苷酶的活性、促进细胞的糖代谢,具有降血糖活性。
(2)本发明采用超声波浸提、过柱分离、冷冻干燥的方法提取豆芋叶中的黄酮类物质,得到的豆芋叶黄酮类提取物纯度高,总黄酮含量高,进一步提高了豆芋叶黄酮类提取物的降血糖活性。
附图说明
图1为实施例1制备的美国豆芋叶黄酮类提取物的高效液相色谱图。
图2为应用例1中实施例1制备的美国豆芋叶黄酮类提取物对α-葡萄糖苷酶活性的抑制作用结果。
图3为应用例1中实施例4制备的美国豆芋叶黄酮类提取物对hepg2细胞的毒性作用结果。
图4为应用例1中实施例4制备的美国豆芋叶黄酮类提取物提高hepg2细胞对葡萄糖的消耗作用结果。
图5为应用例1中不同浓度的豆芋叶黄酮类提取物以及对照溶液处理细胞后的荧光显微镜照片;
其中,a为对照组;b为二甲双胍组;c为浓度为50μg/ml豆芋叶黄酮类提取物处理组;d为浓度为100μg/ml豆芋叶黄酮类提取物处理组。
图6为应用例1中实施例4制备的美国豆芋叶黄酮类提取物提高hepg2细胞对葡萄糖的摄取作用结果。
图7为应用例1中实施例4制备的美国豆芋叶黄酮类提取物提高hepg2细胞对糖原合成的结果。
具体实施方式
下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施例,但本发明的保护范围不仅限于此。
下列实施例中采用的总黄酮的测定方法为:
(1)量取芦丁对照品10mg,加无水乙醇定容至50ml,即得浓度为200μg/ml的芦丁标准溶液;
(2)吸取对照品溶液0、0.1、0.2、0.3、0.4、0.5ml分别置于1.5ml离心管中,加水补足至0.5ml;然后,加质量分数为5%亚硝酸钠0.04ml,摇匀,静置6min;加质量分数为10%硝酸铝0.04ml,摇匀,静置6min;加质量分数为4%氢氧化钠0.4ml,用体积分数为60%的乙醇定容至1ml,摇匀,静置12min;得到标准样品,待用。
(3)于510nm波长下测定步骤(2)制得的标准样品吸光度,并以芦丁标准浓度值为横坐标,以吸光度为纵坐标,绘制标准曲线;得到标准曲线回归方程:y=0.0065x+0.0351(r2=0.9997)。
(4)取各实施例制得的豆芋叶黄酮类提取物待测样品,按上述标准曲线制定的方法测定吸光值,并根据标准曲线计算待测样品的总黄酮含量。
实施例1
一种豆芋叶黄酮类提取物的制备方法,具体步骤如下:
(1)取美国豆芋叶,烘干、粉碎,过20目筛,得到豆芋叶粉末;
(2)取10g步骤(1)得到的美国豆芋叶粉末,向其中加入300ml食品级体积分数为60%的乙醇水溶液,在30℃、180w频率下超声波处理30min;再在4℃条件下静置18h;静置后,在4℃、4000rpm下冷冻离心30min,收集上清液;
(3)取步骤(2)的上清液,40℃下减压浓缩至50ml,回收乙醇,得到浓缩液;
(4)将步骤(3)得到的浓缩液置于大孔树脂(ab-8大孔树脂)中分离,用食品级体积分数为60%的乙醇水溶液洗脱,收集黄色液体,在40℃下减压浓缩,回收乙醇,得到分离液;
(5)将步骤(4)得到的分离液置于-80℃下冷冻18h,再放入冷冻干燥机内冷凝温度-50℃、真空度10pa下干燥至恒重后,得到152mg的美国豆芋叶黄酮类提取物。
测定本实施例制得的美国豆芋叶黄酮类提取物中的总黄酮含量,结果为:每1g美国豆芋叶黄酮类提取物中含有832mg当量的芦丁。
经hplc检测,实施例制得的美国豆芋叶黄酮类提取物中牡荆素和夏佛塔苷的质量百分比分别为48%和22%,见图1。
对比例1
本对比例除以下内容与实施例1不同外,其余内容与实施例1完全相同;具体为:静置时间由18h改为6h。
测定本对比例制得的美国豆芋叶黄酮类提取物中的总黄酮含量,结果为:每1g美国豆芋叶黄酮类提取物中含有568mg当量的芦丁。多糖等醇不溶性杂质未能充分沉淀,使提取物中黄酮类含量降低。
经hplc检测,实施例制得的美国豆芋叶黄酮类提取物中牡荆素和夏佛塔苷的质量百分比分别为29%和15%。
对比例2
本对比例除以下内容与实施例1不同外,其余内容与实施例1完全相同;具体为:静置时间由18h改为24h。
测定本对比例制得的美国豆芋叶黄酮类提取物中的总黄酮含量,结果为:每1g美国豆芋叶黄酮类提取物中含有672mg当量的芦丁。静置时间过长导致提取物中黄酮类物质的降解,使最终得到的提取物纯度降低。
经hplc检测,实施例制得的美国豆芋叶黄酮类提取物中牡荆素和夏佛塔苷的质量百分比分别为34%和16%。
实施例2
本实施例除以下内容与实施例1不同外,其余内容与实施例1完全相同;具体为:
步骤(2)中,乙醇水溶液的体积分数由60%改为55%;超声波处理的频率由180w改为150w,时间由30min改为20min;冷冻离心的转速由4000rpm改为3000rpm,时间由30min改为25min。
得到的美国豆芋叶黄酮类提取物的质量为138mg。
测定本实施例制得的美国豆芋叶黄酮类提取物中的总黄酮含量,结果为:每1g美国豆芋叶黄酮类提取物中含有769mg当量的芦丁。
经hplc检测,实施例制得的美国豆芋叶黄酮类提取物中牡荆素和夏佛塔苷的质量百分比分别为45%和19%。
实施例3
本实施例除以下内容与实施例1不同外,其余内容与实施例1完全相同;具体为:
步骤(2)中,乙醇水溶液的体积分数由60%改为65%,体积由300ml改为250ml;超声波处理的时间由30min改为35min;步骤(3)中,浓缩后的体积由50ml改为40ml。
得到的美国豆芋叶黄酮类提取物的质量为143mg。
测定本实施例制得的美国豆芋叶黄酮类提取物中的总黄酮含量,结果为:每1g美国豆芋叶黄酮类提取物中含有782mg当量的芦丁。
经hplc检测,实施例制得的美国豆芋叶黄酮类提取物中牡荆素和夏佛塔苷的质量百分比分别为44%和20%。
实施例4
本实施例除以下内容与实施例1不同外,其余内容与实施例1完全相同;具体为:
步骤(2)中,静置时间由18h改为12h;乙醇水溶液的体积分数由60%改为70%,体积由300ml改为250ml;步骤(3)中,浓缩后的体积由50ml改为45ml;步骤(4)中,乙醇水溶液的体积分数由60%改为70%。
得到的美国豆芋叶黄酮类提取物的质量为160mg。
测定本实施例制得的美国豆芋叶黄酮类提取物中的总黄酮含量,结果为:每1g美国豆芋叶黄酮类提取物中含有865mg当量的芦丁。
经hplc检测,实施例制得的美国豆芋叶黄酮类提取物中牡荆素和夏佛塔苷的质量百分比分别为47%和23%。
应用例1性能测试
一、α-葡萄糖苷酶抑制活性
以实施例1制备的美国豆芋叶黄酮类提取物为样品,测试其体外α-葡萄糖苷酶抑制活性。
α-葡萄糖苷酶通过水解α-1,4糖苷键从淀粉和有关多糖的非还原端切下葡萄糖,人体对淀粉、糊精、蔗糖等碳水化含物的吸收和利用依赖于该酶的活性。因此,通过观测α-葡萄糖苷酶活性的变化情况,可获得药物抑制血糖的效果,与动物模型实验比较,是一种操作性强且高效的实验方法。
具体步骤如下:
a)配制0、0.4、0.8、1.6、3.2mg/ml的豆芋叶黄酮类提取物溶液。
b)取50μl、酶浓度为0.1u/ml的α-葡萄糖苷酶,加入50μl上述配制好的豆芋叶黄酮类提取物溶液,37℃,静置反应20min。
c)向步骤(b)中加入50μl、浓度为0.0116mol/l的对硝基苯基-α-d-吡喃葡萄糖苷,37℃,静置5min。
d)向步骤(c)中加入1mol/l的碳酸钠溶液100μl,终止反应,405nm波长下测得od值;提取物的终浓度为0、0.08、0.16、0.32、0.64mg/ml。
e)抑制率公式=(1-a样品405/a对照405)×100%。
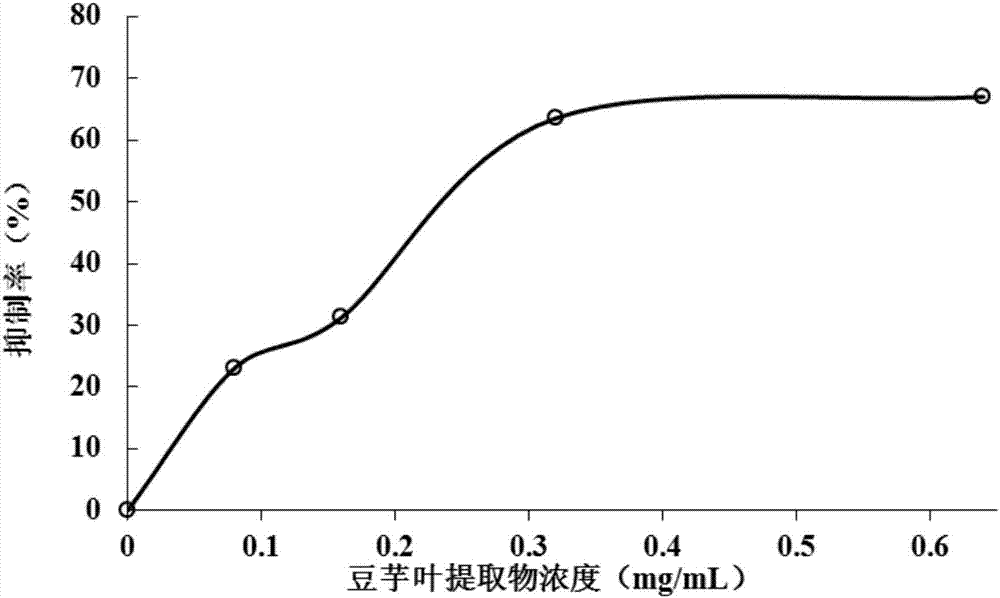
实验结果表明(见图2),实施例1中的美国豆芋叶黄酮类提取物对α-葡萄糖苷酶的半抑制浓度为0.23mg/ml。
二、hepg2肝细胞的降血糖活性
以实施例4制备的美国豆芋叶黄酮类提取物为样品,测试其对hepg2肝细胞的降血糖活性
1、细胞毒性实验
收集对数期的hepg2细胞,将细胞接种到96孔细胞培养板中(浓度为5x103个细胞/孔),孵育24h后,用不同浓度的豆芋叶黄酮类提取物处理细胞,对照组加入等体积培养基,24h后,每孔加入终浓度为0.5mg/ml的mtt,37℃下孵育4h。生成的沉淀物溶解于150μl的dmso中,用酶标仪在570nm检测吸光值。
细胞存活率=a样品570/a对照570×100%。
实验结果表明(见图3),豆芋叶黄酮类提取物浓度在10-400μg/ml时对细胞均无损伤作用,说明该提取物在此浓度范围内是安全的,可以用于后续的细胞水平降血糖活性检测。
2、hepg2细胞葡萄糖消耗实验
收集对数期的hepg2细胞,将细胞接种到96孔细胞培养板中(密度为5x103个细胞/孔),孵育24h后,用不同浓度的豆芋叶黄酮类提取物处理细胞,对照组加入等体积培养液,二甲双胍作为阳性对照(浓度为2mm)。24h后,弃去孔中原有的培养液并用pbs缓冲液清洗3次,然后每个孔中加入等体积的相同培养液继续培养12h。
收集培养液,使用葡萄糖试剂盒测定培养液中的葡萄糖消耗量。按照参考文献的方法,采用mtt法检测细胞的存活率以矫正数据,具体步骤同“细胞毒性实验”。
实验结果表明(见图4),100μg/ml的豆芋叶黄酮类提取物可以提升hepg2细胞约150%的葡萄糖消耗能力,效果接近降糖药物二甲双胍,具有较好的降糖效果。柱形图上方不同的字母代表各处理组间具有显著性差异(p<0.05)。
3、hepg2细胞葡萄糖摄取实验
2-nbdg是一种标记了荧光探针的葡萄糖类似物,可以检测一定时间内细胞对葡萄糖的摄取情况,具体步骤如下:
收集对数期的hepg2细胞,将细胞接种到24孔细胞培养板中(密度为2.5x104个细胞/孔),孵育24h后,用不同浓度的豆芋叶黄酮类提取物处理细胞,对照组加入等体积培养液,二甲双胍作为阳性对照(浓度为2mm)。24h后,弃去培养液,用pbs冲洗3遍后每孔加入浓度为100μm的2-nbdg(pbs配制),37℃下孵育30min,弃去含有2-nbdg的pbs缓冲液,并用pbs清洗,去除残留荧光试剂,于荧光显微镜下观察。拍摄的荧光照片用图像分析软件对荧光强度进行定量分析。
实验结果表明(见图5、6),100μg/ml的豆芋叶黄酮类提取物可以提升hepg2细胞2.3倍的葡萄糖摄取能力,效果与阳性对照二甲双胍相当。柱形图上方不同的字母代表各处理组间具有显著性差异(p<0.05)。
4、hepg2细胞糖原合成实验
a)葡萄糖标曲制作:配制0,7.5,15,30,60μg/ml的葡萄糖溶液。取0.5ml于1.5ml离心管,加入1ml0.2%蒽酮(98%浓硫酸配制),100℃水浴加热20min,于620nm处测od值。并以葡萄糖浓度值为横坐标,以吸光度为纵坐标,制作标准曲线,为y=0.0035x+0.00839(r2=0.9957)。
b)收集对数期的hepg2细胞,将细胞接种到6cm培养皿(密度为4x105个细胞/皿),孵育24h后,用不同浓度的豆芋叶黄酮类提取物处理细胞,对照组加入等体积培养液,二甲双胍作为阳性对照(浓度为2mm)。24h后,弃去培养液,用pbs冲洗3遍后每孔加入1mlpbs缓冲液,用细胞刮收集细胞于离心管内(空离心管先称重)。4℃、4000rpm下离心5min。弃去上清液,自然晾干,再次称取质量,得到细胞重量。
c)每个离心管中加入0.5ml30%koh溶液,沸水浴30min,流水冷却。
d)每个离心管中加入1.5ml无水乙醇,静置30min,4℃、12000rpm下离心15min,弃去上清液。
e)沉淀溶解于0.5ml蒸馏水中,加入1ml0.2%蒽酮(98%浓硫酸配制),100℃水浴加热20min,于620nm处测od值。代入葡萄糖标曲公式可得对应的葡萄糖浓度,再除以相应的细胞质量,就得到单位质量细胞的糖原合成量。
f)实验结果表明(见图7),100μg/ml的豆芋叶黄酮类提取物可以显著提高细胞内糖原合成量,对于促进细胞内葡萄糖的代谢具有较好的效果。柱形图上方不同的字母代表各处理组间具有显著性差异(p<0.05)。
- 还没有人留言评论。精彩留言会获得点赞!