DEM1的功能与用途的制作方法
本发明属于生命科学技术领域,具体涉及dem1的功能与用途。
背景技术:
大肠癌是常见的恶性肿瘤,大肠癌的发生与高脂肪低纤维素饮食、大肠慢性炎症、大肠腺瘤、遗传因素和其他因素如:血吸虫病、盆腔放射、环境因素(如土壤中缺钼)、吸烟等有关。
大肠癌早期无症状,或症状不明显,仅感不适、消化不良、大便潜血等。随着癌肿发展,症状逐渐出现,表现为大便习惯改变、腹痛、便血、腹部包块、肠梗阻等,伴或不伴贫血、发热和消瘦等全身症状。肿瘤因转移、浸润可引起受累器官的改变。大肠癌因其发部位不同而表现出不同的临床症状及体征。
(1).右半结肠癌:右半结肠的主要临床症状为食欲不振、恶心、呕吐、贫血、疲劳、腹痛。右半结肠癌导致缺铁性贫血,表现疲劳、乏力、气短等症状。右半结肠因肠腔宽大,肿瘤生长至一定体积才会出现腹部症状,这也是肿瘤确诊时,分期较晚的主要原因之一。
(2).左半结肠癌:左半结肠肠腔较右半结肠肠腔窄,左半结肠癌更容易引起完全或部分性肠梗阻。肠阻塞导致大便习惯改变,出现便秘、便血、腹泻、腹痛、腹部痉挛、腹胀等。带有新鲜出血的大便表明肿瘤位于左半结肠末端或直肠。病期的确诊常早于右半结肠癌。
(3).直肠癌:直肠癌的主要临床症状为便血、排便习惯的改变及梗阻。癌肿部位较低、粪块较硬者,易受粪块摩擦引起出血,多为鲜红或暗红色,不与成形粪便混和或附于粪柱表面,误诊为“痔”出血。病灶刺激和肿块溃疡的继发性感染,不断引起排便反射,易被误诊为“肠炎”或“菌痢”。癌肿环状生长者,导致肠腔缩窄,早期表现为粪柱变形、变细,晚期表现为不全性梗阻。
(4).肿瘤浸润及转移症:大肠癌最常见的浸润形式是局部侵犯,肿瘤侵及周围组织或器官,造成相应的临床症状。肛门失禁、下腹及腰骶部持续疼痛是直肠癌侵及骶神经丛所致。肿瘤细胞种植转移到腹盆腔,形成相应的症状和体征,直肠指检可在膀胱直肠窝或子宫直肠窝内扪及块物,肿瘤在腹盆腔内广泛种植转移,形成腹腔积液。大肠癌的远处转移主要有两种方式:淋巴转移和血行转移。肿瘤细胞通过淋巴管转移至淋巴结,也可通过血行转移至肝脏、肺部、骨等部位。
大肠癌的发病机制不清楚,目前通过健康与大肠癌肿瘤组织进行对比的方法筛选的差异性基因大多没有功能,没有相应药物干预,应用性不强。
技术实现要素:
为了克服现有技术中所存在的问题,本发明的目的在于提供dem1在大肠癌中的功能与用途。
为了实现上述目的以及其他相关目的,本发明采用如下技术方案:
本发明的第一方面提供了dem1抑制剂用于制备大肠癌治疗药物的用途。
所述大肠癌治疗药物至少具有以下功用之一:能够抑制大肠癌细胞的增殖、诱导大肠癌细胞的凋亡、抑制大肠癌细胞克隆形成能力、抑制大肠癌细胞成瘤能力、减缓大肠癌瘤体生长。
所述大肠癌包括结肠癌和直肠癌。
优选地,所述dem1抑制剂是指对于dem1具有抑制效果的分子。
对于dem1具有抑制效果包括但不限于:抑制dem1活性,或者抑制dem1基因转录或表达。
所述dem1抑制剂可以为sirna、shrna、抗体、小分子化合物。
如本发明实施例列举的,所述dem1抑制剂可以为sirna或shrna。所述sirna或shrna的靶序列如seqidno.1所示。
所述大肠癌治疗药物必然包含dem1抑制剂,并以dem1抑制剂作为前述功用的有效成分。
所述大肠癌治疗药物中,发挥前述功用的有效成分可仅为dem1抑制剂,亦可包含其他可起到类似功用的分子。
所述大肠癌治疗药物可以为单成分物质,亦可为多成分物质。
所述大肠癌治疗药物的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
所述大肠癌治疗药物主要针对的对象为哺乳动物,如啮齿类动物、灵长类动物等。
本发明的第二方面,提供一种治疗大肠癌的方法,为向对象施用dem1抑制剂。
所述的对象为哺乳动物或所述哺乳动物的大肠癌细胞。所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述灵长目动物优选为猴、猿或智人。所述大肠癌细胞可为离体大肠癌细胞,包括但不限于ht-29细胞和sw620细胞。
所述对象可以是罹患大肠癌的患者或期待治疗大肠癌的个体,或者所述对象为大肠癌患者或期待治疗大肠癌的个体的离体大肠癌细胞。
所述dem1抑制剂可以在接受大肠癌治疗前、中、后向对象施用。
本发明的第三方面,提供了一种大肠癌治疗药物,包括有效量的dem1抑制剂及药用载体。
本发明的第四方面,提供了一种大肠癌联合治疗药物组合,包括有效量的dem1抑制剂和至少一种其他大肠癌治疗药物。
所述其他大肠癌治疗药物是指除了dem1抑制剂以外的大肠癌治疗药物。
所述联合治疗药物组合可以是以下形式中的任意一种:
一)将dem1抑制剂和其他大肠癌治疗药物分别制成独立的制剂,制剂的剂型可相同或不同,给药途径亦可相同或不同。
当其他大肠癌治疗药物为抗肿瘤抗体时,一般采用胃肠外给药型。当其他大肠癌治疗药物为化疗药物时,给药形式可以比较丰富,可以是胃肠道给药亦可以是非胃肠道给药。一般推荐针对各化疗药物的已知给药途径给药。
二)将dem1抑制剂和其他大肠癌治疗药物配置成复方制剂。在将dem1抑制剂和其他大肠癌治疗药物采用相同给药途径给药并同时施加时,可采用将两者配置成复方制剂的形式。
本发明第五方面,提供了一种大肠癌治疗方法,为向对象施用有效量的dem1抑制剂,以及向对象施用有效量的其他大肠癌治疗药物和/或向对象实施其他大肠癌治疗手段。
可以同步地或顺序地给予有效量的dem1抑制剂和至少一种有效量的其他大肠癌治疗药物。
基于dem1为本发明首次新发现的大肠癌治疗靶点,在与dem1抑制剂以外的其他大肠癌治疗药物联合用药中,至少可以起到疗效相加的效果,进一步增强对于大肠癌的抑制。
所述其他大肠癌治疗药物包括但不限于:抗肿瘤抗体、化疗药物或靶向型药物等。
所述dem1抑制剂可以是胃肠道给药或者胃肠外给药。所述其他大肠癌治疗药物可以是胃肠道给药或者胃肠外给药。对于抗肿瘤抗体或化疗药物,一般采用胃肠外给药。
本发明的第六方面,提供dem1的其他新用途,所述dem1抑制剂至少具有以下功用之一:能够抑制大肠癌细胞的增殖、诱导大肠癌细胞的凋亡、抑制大肠癌细胞克隆形成能力、抑制大肠癌细胞成瘤能力、减缓大肠癌瘤体生长。
与现有技术相比,本发明具有如下有益效果:
本发明经过广泛而深入的研究,首次发现,dem1可作为大肠癌治疗靶点,抑制dem1的表达能够抑制大肠癌细胞的增殖、诱导大肠癌细胞的凋亡、抑制大肠癌细胞克隆形成能力、抑制大肠癌细胞成瘤能力、减缓大肠癌瘤体生长。因此,本发明从临床病人样本组织水平、细胞功能水平和分子水平对大肠癌的发病机理及大肠癌的临床治疗提供有力的科学证据。
附图说明
图1:dem1蛋白在癌、癌旁的胞浆中表达有差异。
图2a:经shrna慢病毒感染3天后,实验组ht-29细胞中dem1基因在mrna水平的表达量受到抑制。
图2b:经shrna慢病毒感染3天后,实验组ht-29细胞中dem1基因在mrna水平的表达量受到抑制。
图2c:实验组ht-29中dem1基因的外源表达在蛋白质水平有显著的敲减作用。
图2d:经shrna慢病毒感染后,实验组ht-29细胞的增殖速率受到显著抑制。
图2e:经shrna慢病毒感染后,实验组ht-29细胞的增殖速率受到显著抑制。
图2f:shrna慢病毒感染后,实验组ht-29细胞集落数目减少。
图2g:shrna慢病毒感染6天后,实验组发生凋亡的ht-29细胞显著增加。
图3a:经shrna慢病毒感染3天后,实验组sw620细胞中dem1基因在mrna水平的表达量受到抑制。
图3b:经shrna慢病毒感染3天后,实验组sw620细胞中dem1基因在mrna水平的表达量受到抑制。
图3c:实验组sw620细胞中dem1基因的外源表达在蛋白质水平有显著的敲减作用。
图3d:经shrna慢病毒感染后,实验组sw620细胞的增殖速率受到显著抑制。
图3e:经shrna慢病毒感染后,实验组sw620细胞的增殖速率受到显著抑制。
图3f:shrna慢病毒感染后,实验组sw620细胞集落数目减少。
图3g:shrna慢病毒感染6天后,实验组发生凋亡的sw620细胞显著增加。
图4a:dem1基因敲减以后,裸鼠形成的肿瘤体积明显减小。
图4b:dem1基因敲减以后,裸鼠形成的肿瘤体积明显减小。
图4c:相比nc组,dem1基因敲减的kd组瘤体生长减缓(p<0.05)。
图4d:相比nc组,dem1基因敲减的kd组瘤体生长减缓(p<0.05)。
具体实施方式
本发明在研究中发现,dem1可作为大肠癌治疗靶点,抑制dem1的表达能够抑制大肠癌细胞的增殖、诱导大肠癌细胞的凋亡、抑制大肠癌细胞克隆形成能力、抑制大肠癌细胞成瘤能力、减缓大肠癌瘤体生长。
dem1抑制剂
指对于dem1具有抑制效果的分子。对于dem1具有抑制效果包括但不限于:抑制dem1活性,或者抑制dem1基因转录或表达。所述dem1抑制剂包括但不限于sirna、shrna、抗体、小分子化合物。
抑制dem1活性是指使dem1活力下降。优选地,相比抑制前,dem1活力下降至少10%,较佳的降低至少30%,再佳的降低至少50%,更佳的降低至少70%,最佳的降低至少90%。
抑制dem1基因转录或表达是指:使dem1的基因不转录,或降低dem1的基因的转录活性,或者使dem1的基因不表达,或降低dem1的基因的表达活性。
本领域技术人员可以使用常规方法对dem1的基因转录或表达进行调节,如基因敲除、同源重组,干扰rna等。
dem1的基因转录或表达的抑制可以通过pcr及westernblot检测表达量验证。
优选地,与野生型相比,dem1基因转录或表达降低至少10%,较佳的降低至少30%,再佳的降低至少50%,更佳的降低至少70%,又佳的降低至少90%,最佳地dem1基因完全没有表达。
小分子化合物
本发明中指由几个或几十个原子组成,分子质量在1000以下的化合物。
dem1抑制剂制备药物
以dem1抑制剂为主要活性成分或主要活性成分之一制备药物。通常,药物中除了有效成分外,根据不同剂型的需要,还会包括一种或多种药学上可接受的载体或辅料。
“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。
“药学上可接受的载体或辅料”应当与dem1抑制剂相容,即能与其共混而不会在通常情况下大幅度降低药物组合物的效果。可作为药学上可接受的载体或辅料的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如甲基纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醉、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如tween;润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
本发明中,除非特别说明,药物剂型并无特别限定,可以被制成针剂、口服液、片剂、胶囊、滴丸、喷剂等剂型,可通过常规方法进行制备。药物剂型的选择应与给药方式相匹配。
联合治疗药物组合和施用方法
所述联合治疗药物组合可以是以下形式中的任意一种:
一)将dem1抑制剂及其他抗肿瘤药物分别制成独立的制剂,制剂的剂型可相同或不同,给药途径亦可相同或不同。使用时,可几种药同时使用,也可几种药先后使用。先后给药时,应当在先用药物仍对机体有效的期间内向机体施加其他药物。
二)将dem1抑制剂及其他抗肿瘤药物配置成复方制剂。在将dem1抑制剂及其他抗肿瘤药物采用相同给药途径给药并同时施加时,可采用将两者配置成复方制剂的形式。
抗体常用的用药方法为静脉注射、静脉滴注或动脉灌注。其用法用量可参考现有技术。
小分子化合物常用的用药方法可以是胃肠道给药或者是胃肠外给药。sirna、shrna、抗体则一般采用胃肠外给药。可以是局部给药亦可以为全身给药。
可以同步的或顺序地给予有效量的dem1抑制剂及有效量的其他大肠癌药物。使用时,可将有效量的dem1抑制剂及有效量的其他大肠癌药物同时使用,也可将有效量的dem1抑制剂及有效量的其他大肠癌药物先后使用。先后给药时,应当在先用药物仍对生物体有效的期间内向生物体施加其他药物。
化疗药物包括烷化剂(如尼莫司汀、卡莫司汀、洛莫司汀、环磷酰胺、异环磷酰胺和甘磷酰芥等)、抗代谢药(如去氧氟鸟苷、多西弗鸟啶、氟尿嘧啶、巯嘌呤、甲氨蝶呤等核苷酸类似物)、抗肿瘤抗生素(如放线菌素d、阿霉素和柔红霉素等抗生素)、抗肿瘤动植物成分药(如长春瑞滨、紫杉醇、三尖杉酯碱、伊立替康、泰索帝和长春碱等)、抗肿瘤激素药(如阿他美坦、阿那曲唑、氨鲁米特、来曲唑、福美坦和他莫昔芬等)以及如顺铂、达卡巴嗪、奥沙利铂、乐沙定、可铂奥沙、米托蒽醌和丙卡巴肼等常用化疗药。
靶向型药物包括egfr阻断剂如吉非替尼(gefitinib、iressa和易瑞沙)和埃罗替尼(erlotinib、tarceva)、特定细胞标志物的单克隆抗体如西妥昔单抗(cetuximab、erbitux)和抗her-2单抗(赫赛汀,trastuzumab、herceptin)、酪氨酸激酶受体抑制剂如克唑替尼(crizotinib、xalkori)、抗肿瘤血管生成药物如bevacizumab、endostatin和bevacizumab等、bcr-abl酪氨酸激酶抑制剂如imatinib和dasatinib、抗cd20单抗如rituximab、igfr-1激酶抑制剂如nvp-aew541、mtor激酶抑制剂如cci-779、泛素-蛋白酶体抑制剂如bortezomib等。
其他肿瘤治疗手段可选自手术切除、射频消融、氩氦超导手术治疗、激光消融治疗、高强度聚焦超声以及放射治疗包括x-刀、r-刀、3d-crt和imrt中的一种或多种。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
实施例1dem1基因功能研究
(一)临床大肠癌组织芯片研究
将临床收集到38例大肠癌患者的大肠癌与癌旁组织共38对样本进行dem1的组织芯片分析,结果如图1、表1和表2所示,得出dem1蛋白在癌、癌旁的胞浆中表达有差异,p<0.05。
表1
表2
(二)针对dem1基因rnai慢病毒的制备
1.选择对dem1基因的有效sirna靶点,靶点序列如seqidno.1所示,具体为:5’-gattgatgagctgcactat-3’。
针对sirna靶点(seqidno.1),设计shrna,目的基因包含靶向发卡结构、转录终止序列以及允许慢病毒载体gv115(genechem,shanghai,china)插入的限制性酶切位点,而对比序列也具有使用相同技术合成的无目的基因的发卡结构。慢病毒成分由测序部分和生成部分构成。病毒的包装与净化系统为genechem(上海,中国)的慢病毒表达系统。
进一步地,所述shrna的序列如seqidno.2所示,具体为:
5’-gattgatgagctgcactatctcgagatagtgcagctcatcaatc-3’。
所述shrna对应的sirna的序列如seqidno.3所示,具体为:
5’-gauugaugagcugcacuau-3’。
而对比序列如seqidno.4所示,具体为:5’-ttctccgaacgtgtcacgt-3’。
(二)qpcr检测mrna水平dem1基因消减效率
将shrna慢病毒分别转染至ht-29和sw620大肠癌细胞中,结果如图2a和图2b所示,经shrna慢病毒感染3天后,实验组ht-29细胞中dem1基因在mrna水平的表达量受到抑制;如图3a和图3b所示,经shrna慢病毒感染3天后,实验组sw620细胞中dem1基因在mrna水平的表达量受到抑制。
(三)westernblot检测靶点降低dem1基因蛋白水平表达
如图2c所示,实验组ht-29中dem1基因的外源表达在蛋白质水平有显著的敲减作用。如图3c所示,实验组sw620细胞中dem1基因的外源表达在蛋白质水平有显著的敲减作用。
(四)celigo检测dem1基因消减对细胞增殖的影响
如图2e所示,经shrna慢病毒感染3天后,细胞铺于96孔板,铺板数为2000。celigo连续检测5天,发现实验组ht-29细胞的增殖速率受到显著抑制。提示dem1基因与ht-29的增殖能力显著相关。
如图3e所示,经shrna慢病毒感染3天后,细胞铺于96孔板,铺板数为2000。celigo连续检测5天,发现实验组sw620细胞的增殖速率受到显著抑制。提示dem1基因与sw620细胞的增殖能力显著相关。
(五)mtt检测dem1基因消减对细胞增殖的影响
如图2d所示,经shrna慢病毒感染3天后,细胞铺于96孔板,铺板数为2000。连续检测5天,发现实验组ht-29细胞的增殖速率受到显著抑制。提示dem1基因与ht-29的增殖能力显著相关。
如图3d所示,经shrna慢病毒感染3天后,细胞铺于96孔板,铺板数为2000。连续检测5天,发现实验组sw620细胞的增殖速率受到显著抑制。提示dem1基因与sw620的增殖能力显著相关。
(六)facs检测dem1基因消减对凋亡的影响
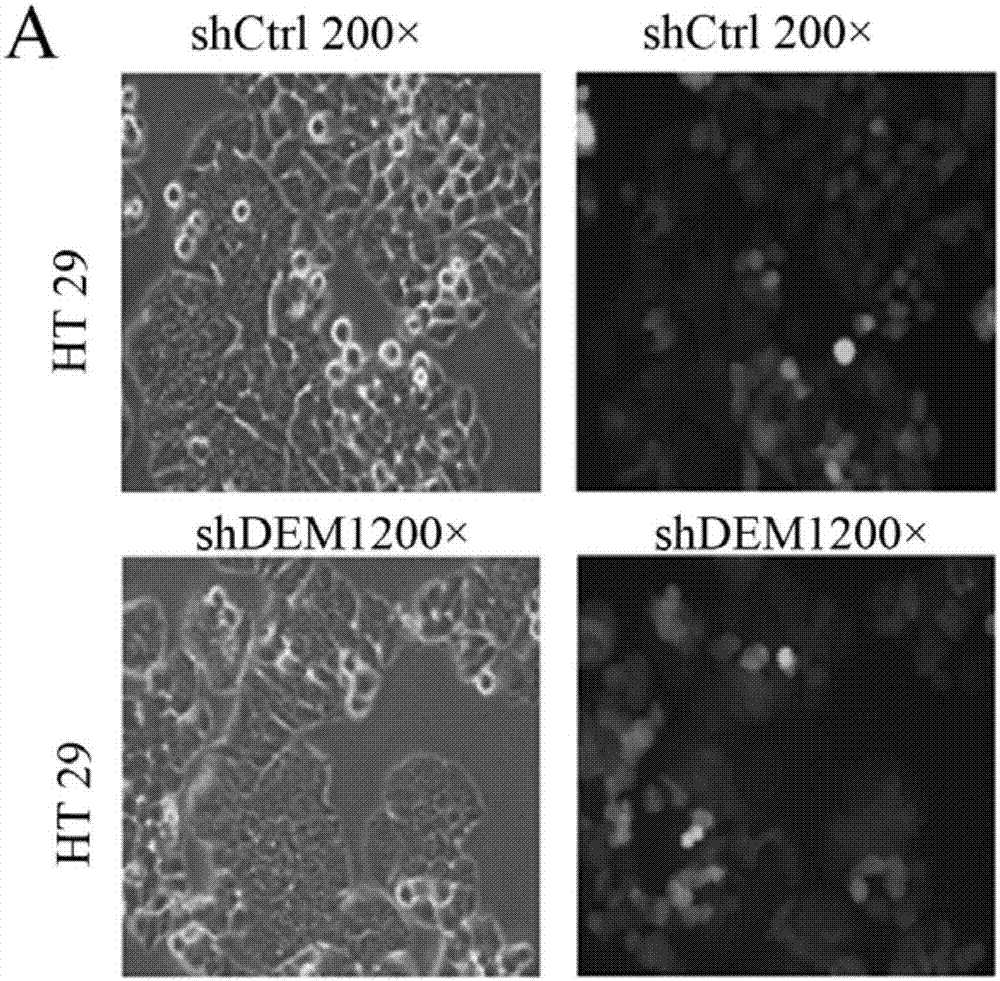
如图2g所示,shrna慢病毒感染6天后,实验组发生凋亡的ht-29细胞显著增加,提示dem1基因与ht-29细胞的凋亡显著相关。
如图3g所示,shrna慢病毒感染6天后,实验组发生凋亡的sw620细胞显著增加,提示dem1基因与sw620细胞的凋亡显著相关。
(七)检测dem1基因消减对细胞克隆形成能力的影响
如图2f所示,shrna慢病毒感染3天后,ht-29细胞铺于6孔板,铺板细胞数为600,15天后观察克隆数,结果发现:实验组ht-29细胞集落数目减少,提示dem1基因与ht-29细胞的克隆形成能力显著相关。
如图3f所示,shrna慢病毒感染3天后,sw620细胞铺于6孔板,铺板细胞数为600,15天后观察克隆数,结果发现:实验组sw620细胞集落数目减少,提示dem1基因与sw620细胞的克隆形成能力显著相关。
综上所述,综合上述实验结果,证实干扰目的基因dem1对结肠癌细胞ht-29和sw620细胞有抑制其增殖的作用。
实施例2dem1动物实验
继续在裸鼠成瘤实验中研究dem1的功能,将上一步中dem1慢病毒感染的细胞打入裸鼠,三周后与未转染的裸鼠进行对比,如图4a和图4b所示,发现dem1基因敲减以后,裸鼠形成的肿瘤体积明显减小,70%的裸鼠在三周内未形成明显肿瘤。如图4c和图4d所示,相比nc组,dem1基因敲减的kd组瘤体生长减缓(p<0.05)。
由上结论得出dem1是大肠癌细胞增殖的关键基因,下调dem1表达可以显著抑制大肠癌细胞增殖,诱导大肠癌细胞凋亡,可以为未来治疗大肠癌的药物研究提供方向。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
sequencelisting
<110>中南大学湘雅二医院
<120>dem1的功能与用途
<130>173059
<160>4
<170>patentinversion3.3
<210>1
<211>19
<212>dna
<213>artificial
<220>
<223>靶点序列
<400>1
gattgatgagctgcactat19
<210>2
<211>44
<212>dna
<213>artificial
<220>
<223>shrna的序列
<400>2
gattgatgagctgcactatctcgagatagtgcagctcatcaatc44
<210>3
<211>19
<212>dna
<213>artificial
<220>
<223>sirna的序列
<400>3
gauugaugagcugcacuau19
<210>4
<211>19
<212>dna
<213>artificial
<220>
<223>对比序列
<400>4
ttctccgaacgtgtcacgt19
- 还没有人留言评论。精彩留言会获得点赞!