脆弱拟杆菌提取物在制备防治炎症性肠病的药物或食品中的应用的制作方法
本发明涉及脆弱拟杆菌的应用技术领域,特别是涉及一种脆弱拟杆菌提取物在制备防治炎症性肠病的药物或食品中的应用。
背景技术:
炎症性肠病(inflammatoryboweldisease,ibd)是一组不明原因的慢性肠道炎症性疾病,包括溃疡性结肠炎(ulcerativecolitis,uc)和克罗恩病(crohn'sdisease,cd)。前者又称非特异性溃疡性结肠炎,是一种原因不明的直肠和结肠的炎症,病变主要限于大肠黏膜与黏膜下层。后者为一种慢性肉芽肿性炎症,病变可累及胃肠道各部位,而以末段回肠及临近结肠为主,多呈节段性、非对称性分布(蒋蔚茹.炎症性肠病的认识与治疗进展[j].上海医药,2010,05:207-210.)。炎症性肠病的发病机制尚未阐明,目前认为是基因上易感人群对肠道共生微生物产生过度的先天或后天免疫反应所致(蒋蔚茹.炎症性肠病的认识与治疗进展[j].上海医药,2010,05:207-210.)。
西方国家ibd发病年龄多呈双峰状分布,uc第一个发病年龄高峰为30-39岁,cd为20-29岁,uc和cd第二个发病年龄高峰为60-70岁,以第一个高峰病例数为多。亚洲国家ibd发病年龄第二高峰少见,uc和cd发病年龄高峰较西方国家延迟10年。
近20年来,ibd病例数在国内迅猛增加。1989-2007年间我国ibd文献报道病例数逐渐增多(hurw,ouyangq,chenxetal.analysisofthearticlesofinflammatoryboweldiseaseintheliteraturechinainrecentfifteenyears[j].chinjgastroenterol,2007,12:74-77.)。jiang等(jiangxl,cuihf.ananalysisof10218ulcerativecolitiscasesinchina[j].worldjgastroenterol,2002,8(1):158-161.)分析了1981-2000年国内文献报道的10218例uc患者,发现10年间病例数上升了3.08倍。wang等(wangy,ouyangq;apdw2004chineseibdworkinggroup.ulcerativecolitisinchina:retrospectiveanalysisof3100hospitalizedpatients[j].jgastroenterolhepatol,2007,22(9):1450-1455.)和中国ibd工作组(apdw2004chineseibdworkinggroup.retrospectiveanalysisof515casesofcrohn’sdiseasehospitalizationinchina:nationwidestudyfrom1990to2003[j].jgastroenterolhepatol,2006,21(6):1009-1015.)对1990-2003年间ibd住院患者进行回顾性研究,共收集3100例uc和515例cd患者,结果显示我国ibd住院患者呈逐渐增加趋势,粗略推测uc患病率约为11.6/10万,cd约为1.4/10万,增长情况与日本、韩国、新加坡等国家相似。
目前,对于炎症性肠病,其治疗药物主要包括以下几类:(1)氨基水杨酸类制剂、(2)肾上腺糖皮质激素(gcs)、(3)免疫抑制剂、(4)单克隆抗体、(5)抗生素。但是上述药物存在以下缺陷:氨基水杨酸类制剂有较大毒副作用,比如柳氮磺吡啶(sulfasalazine,sasp),其代谢产物磺胺吡啶会产生不良反应;gcs长期使用易产生不良反应;传统免疫抑制剂(比如硫唑嘌呤(aza)、6-巯基嘌呤(6–mp)及氨甲蝶呤(mtx))并不是对所有ibd患者均有效,而且不良反应较多;新型免疫抑制剂(比如环孢素a(csa)、他克莫司(fk506)和霉菌酚(mmf)等对ibd有效,但其疗效和安全性尚有待于进一步评价;目前对于中、重度ibd和高危病人,若采用前三种传统药物无效的,则会立即采用单克隆抗体诱导缓解,但是单克隆抗体价格昂贵,并且也存在潜在的危险性,如使用ifx的病人罹患结核或组织胞浆菌病等感染的可能性明显增加,此外,神经系统脱髓鞘病变、充血性心力衰竭以及淋巴瘤等疾病的患病率也有提高;抗生素也只能酌情选用,具有恶心、呕吐、肢端感觉异常等不良反应。
传统药物如氨基水杨酸类制剂、糖皮质激素、免疫抑制剂等不良反应较多,而单克隆抗体药物又价格昂贵,目前,对于炎症性肠病尚缺乏有效的治疗手段。因此有必要研究新型的能够治疗炎症性肠病的有效药物。
脆弱拟杆菌(bacteroidesfragilis)是革兰氏阴性厌氧细菌中拟杆菌属的成员,属于拟杆菌门,完全不同于厚壁菌门的双歧杆菌、乳酸菌等。拟杆菌属有25个菌种,仅来自人类的有10个菌种,仅来自动物的有10个菌种,来自人和动物的有5个菌种。脆弱拟杆菌是一种专性厌氧细菌,依培养基的不同和生长阶段的不同,菌体形态呈现多形性,一般条件下菌体为杆状、两端钝圆、着色深,中间色浅且不均匀,有荚膜、无芽胞、无动力,有些有空泡,菌体长短不一。依据能否合成、分泌脆弱拟杆菌肠毒素(bft)可将其分为产肠毒素型脆弱拟杆菌(enterotoxigenicbacteroidesfragilis,etbf)和非产肠毒素型脆弱拟杆菌(nontoxigenicbacteroidesfragilis,ntbf)。脆弱拟杆菌作为人及动物肠道正常菌群的一部分,主要存在于结肠中。此外,呼吸道、胃肠道及泌尿生殖道粘膜也可定植生长。
技术实现要素:
基于此,本发明提供了一种脆弱拟杆菌(bacteroidesfragilis)提取物的新应用。
具体技术方案如下:
脆弱拟杆菌提取物在制备防治炎症性肠病的药物或食品中的应用,所述脆弱拟杆菌提取物中含有脆弱拟杆菌荚膜多糖a。
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖a的分子量为5~75kd。
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖a的分子量为15kd~65kd;
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖a的分子量为25kd~55kd。
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖a的分子量为35kd~45kd。
在其中一些实施例中,所述脆弱拟杆菌提取物中脆弱拟杆菌荚膜多糖a的含量为60-75wt%。
在其中一些实施例中,所述脆弱拟杆菌为保藏编号为cgmccno.10685的脆弱拟杆菌zy-312。
在其中一些实施例中,所述脆弱拟杆菌提取物的制备方法包括以下步骤:(1)将发酵培养后的脆弱拟杆菌菌液离心沉淀,收集第一沉淀物,取所述第一沉淀物加入65-72℃的水,溶解后再加入苯酚溶液,保持65-72℃搅拌25-35min,离心,收集第一上清液;
(2)将步骤(1)中收集的第一上清液用乙醚萃取去除苯酚,再去除残留的乙醚,收集水相溶液;
(3)在步骤(2)中收集到的水相溶液中加入无水乙醇至乙醇的终浓度为75-85v/v%,醇沉,离心,收集第二沉淀物;
(4)取所述第二沉淀物,加水配制成混悬液,再调节ph为6.5-7.5,离心,收集第二上清液,透析除盐,冷冻干燥,即得所述脆弱拟杆菌提取物。
在其中一些实施例中,步骤(1)中在所述第一沉淀物中加入的水、所述苯酚溶液以及所述第一沉淀物的配比为3-5ml:3-5ml:1g;所述苯酚溶液的质量浓度为70-80%。
在其中一些实施例中,步骤(3)所述醇沉为在0-8℃的温度下醇沉8-16小时。
在其中一些实施例中,步骤(4)包括:取所述第二沉淀物,加水配制成质量浓度为8-12%的混悬液,再加入质量浓度为8-12%的冰乙酸水溶液,加热至沸,搅拌反应1.5-2.5小时,调节ph为6.5-7.5,离心,收集第二上清液,透析除盐,冷冻干燥,即得所述脆弱拟杆菌提取物。
在其中一些实施例中,所述脆弱拟杆菌提取物的制备方法还包括降解的步骤:将步骤(4)中得到的脆弱拟杆菌提取物通过超声的方法进行降解,所述超声的条件为:180-210khz,15-25℃。
在其中一些实施例中,所述药物的剂型包括丸剂、片剂、颗粒剂、胶囊、口服液或管饲制剂。所述药物包括人用药或动物用药,可用于人或动物。所述食品包括奶粉、干酪、凝乳、酸奶酪、冰激凌或发酵谷类食品。所述食品还可以是动物食品,比如饲料等。所述食品还可以为婴儿食品或宠物食品。
本发明还提供了一种防治炎症性肠病的脆弱拟杆菌提取物或者药物或者食品。具体技术方案如下:
一种防治炎症性肠病的脆弱拟杆菌提取物或者药物或者食品,所述药物或食品中含有脆弱拟杆菌提取物,所述脆弱拟杆菌提取物中含有脆弱拟杆菌荚膜多糖a。
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖a的分子量为5~75kd。
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖a的分子量为15kd~65kd;
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖a的分子量为25kd~55kd。
在其中一些实施例中,所述脆弱拟杆菌荚膜多糖a的分子量为35kd~45kd。
在其中一些实施例中,所述脆弱拟杆菌提取物中脆弱拟杆菌荚膜多糖a的含量为60-75wt%。
在其中一些实施例中,所述脆弱拟杆菌为保藏编号为cgmccno.10685的脆弱拟杆菌zy-312。
在其中一些实施例中,所述脆弱拟杆菌提取物的制备方法包括以下步骤:
(1)将发酵培养后的脆弱拟杆菌菌液离心沉淀,收集第一沉淀物,取所述第一沉淀物加入65-72℃的水,溶解后再加入苯酚溶液,保持65-72℃搅拌25-35min,离心,收集第一上清液;
(2)将步骤(1)中收集的第一上清液用乙醚萃取去除苯酚,再去除残留的乙醚,收集水相溶液;
(3)在步骤(2)中收集到的水相溶液中加入无水乙醇至乙醇的终浓度为75-85v/v%,醇沉,离心,收集第二沉淀物;
(4)取所述第二沉淀物,加水配制成混悬液,再调节ph为6.5-7.5,离心,收集第二上清液,透析除盐,冷冻干燥,即得所述脆弱拟杆菌提取物。
在其中一些实施例中,步骤(1)中在所述第一沉淀物中加入的水、所述苯酚溶液以及所述第一沉淀物的配比为3-5ml:3-5ml:1g;所述苯酚溶液的质量浓度为70-80%。
在其中一些实施例中,步骤(3)所述醇沉为在0-8℃的温度下醇沉8-16小时。
在其中一些实施例中,步骤(4)包括:取所述第二沉淀物,加水配制成质量浓度为8-12%的混悬液,再加入质量浓度为8-12%的冰乙酸水溶液,加热至沸,搅拌反应1.5-2.5小时,调节ph为6.5-7.5,离心,收集第二上清液,透析除盐,冷冻干燥,即得所述脆弱拟杆菌提取物。
在其中一些实施例中,所述脆弱拟杆菌提取物的制备方法还包括降解的步骤:将步骤(4)中得到的脆弱拟杆菌提取物通过超声的方法进行降解,所述超声的条件为:180-210khz,15-25℃。
在其中一些实施例中,所述药物的剂型包括丸剂、片剂、颗粒剂、胶囊、口服液或管饲制剂。所述药物包括人用药或动物用药,可用于人或动物。所述脆弱拟杆菌提取物还可以与其他药物联合使用,所述的其他药物包含但不限于:柳氮磺胺吡啶水杨酸制剂(如艾迪莎,美沙拉嗪)、皮质类固醇(如强的松,地塞米松)和/或免疫抑制剂(如硫唑嘌呤)。所述食品包括奶粉、干酪、凝乳、酸奶酪、冰激凌或发酵谷类食品。所述食品还可以是动物食品,比如饲料等。所述食品还可以为婴儿食品或宠物食品。
本发明的脆弱拟杆菌zy-312,已于2015年4月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),其保藏编号为cgmccno.10685,保藏地址为北京市朝阳区北辰西路1号院3号。
本发明的发明人经过长期经验积累以及大量创造性实验研究,以本发明的制备方法意外的制备得到了分子量为70kd的脆弱拟杆菌荚膜多糖a,并且发现该脆弱拟杆菌荚膜多糖a具有防治炎症性肠病的效果,且其效果好于从脆弱拟杆菌nctc9343中提取得到的分子量为110kd的荚膜多糖a。进一步地,发明人通过对分子量为70kd的脆弱拟杆菌荚膜多糖a进行降解,获得了分子量为5~40kd的脆弱拟杆菌荚膜多糖a,并且意外地发现分子量为5~40kd的荚膜多糖a具有比从脆弱拟杆菌nctc9343中提取得到的分子量为110kd的荚膜多糖a更好的防治炎症性肠病的效果。本发明提供的脆弱拟杆菌荚膜多糖a对炎症性肠病的防治效果好且对机体没有副作用,同时还可以与其他预防/治疗炎症性肠病的药物联合使用。本发明提供的脆弱拟杆菌荚膜多糖a具有很好的食用和药用前景,为临床提供了一种适合人体服食的预防/治疗炎症性肠病的良品。
附图说明
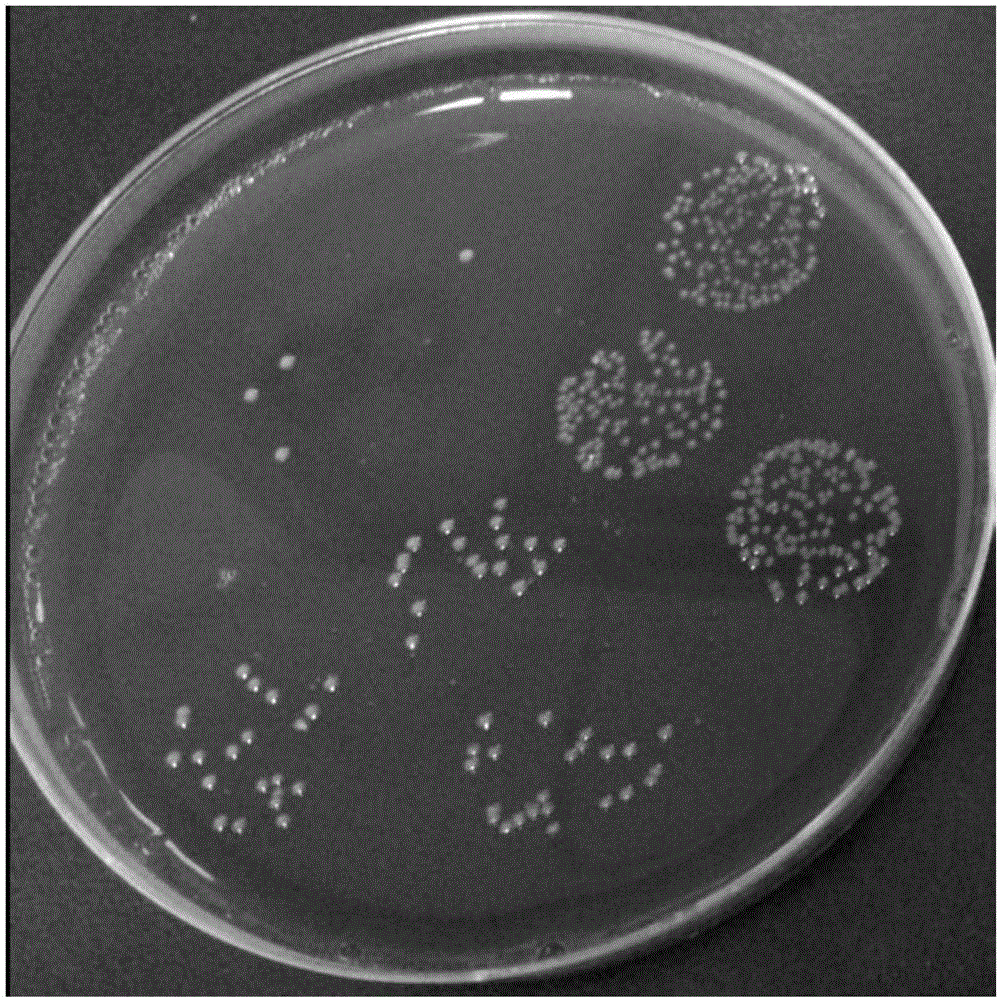
图1为实施例1的脆弱拟杆菌zy-312的菌落特征图;
图2为实施例1的脆弱拟杆菌zy-312进行革兰氏染色后的显微镜观察图;
图3为实施例1的荚膜多糖a核磁共振波谱仪分析的1h谱;
图4为实施例1的荚膜多糖a核磁共振波谱仪分析的13c谱;
图5为实施例1的荚膜多糖a核磁共振波谱仪分析的cosy谱;
图6为实施例1的荚膜多糖a核磁共振波谱仪分析的hsqc谱;
图7为实施例1的荚膜多糖a核磁共振波谱仪分析的hmbc谱图;
图8为实施例1制备得到的脆弱拟杆菌荚膜多糖a的化学结构式;
图9为实施例2的日常疾病指数(dai)结果图;
图10为实施例3中各组实验的结肠he染色图;
图11为实施例3中屏障相关蛋白zo-1,occludin,b-catenin和claudin-1的表达情况图。
具体实施方式
下面通过具体实施例对本发明做进一步详细说明,这些实施例仅用来说明本发明,并不限制本发明的范围。
以下实施例中所用的脆弱拟杆菌为脆弱拟杆菌zy-312(bacteroidesfragiliszy-312),于2015年4月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),其保藏编号为cgmccno.10685,保藏地址为北京市朝阳区北辰西路1号院3号。
实施例1脆弱拟杆菌提取物的制备
(1)脆弱拟杆菌的发酵培养
将菌种划线接种于血平皿,厌氧培养48h。观察菌落形态特征、染色特性、大小、球杆状和分布情况等。
菌落特征:脆弱拟杆菌zy-312在血平皿上培养48h后,呈现圆形微凸、半透明、白色、表面光滑、不溶血,菌落直径在1-3mm之间,参见图1。
显微镜下形态:脆弱拟杆菌zy-312进行革兰氏染色镜检,为革兰阴性细菌,呈现典型的杆状,两端钝圆而浓染,菌体中间不着色部分形如空泡,参见图2。
选取单个菌落接种于胰蛋白胨肉汤中进行发酵培养8小时(温度为37℃),所得菌液离心沉淀,转速3000r/min,离心15min,去上清,收集沉淀物。
(2)脆弱拟杆菌提取物的制备
1)取脆弱拟杆菌菌泥(上述步骤(1)获得的沉淀物)200g,加入68℃超纯水750ml,溶解后,再加入体积分数为75%苯酚溶液750ml,混合均匀,保持68℃搅拌萃取30min,15000g离心20min,取上层清液。
2)上层清液用等体积乙醚(1.5l)萃取去除苯酚,收集上层清液,重复萃取至无苯酚残留。水浴加热去除乙醚,收集水相。
3)水相15000g离心20min后测定体积,加入无水乙醇,至乙醇终浓度为80%(体积分数),4℃醇沉过夜(12小时),15000g离心20min,取沉淀。
4)称量步骤3)中的沉淀的质量,加入一定体积的去离子水将沉淀配制成质量浓度为10%的混悬液,搅拌混合均匀,加入质量浓度为10%的冰乙酸水溶液,加热至沸,持续搅拌反应2h后,调节ph至7.0,15000g离心20min,收集上清液。将所得上清液透析除盐(10kd透析袋),冷冻干燥,得到脆弱拟杆菌提取物。
5)称量30mg步骤4)所述的脆弱拟杆菌提取物,溶于0.5mld2o,加入1μl丙酮(1h,2.22;13c,30.89)定标。采用500mhzbruker核磁共振波谱仪分析1h、13c、cosy、hsqc、hmbc谱(图3-图7),确证步骤4)收集的脆弱拟杆菌提取物为荚膜多糖a,纯度约为70%。通过gpc(凝胶渗透色谱)分析,结果显示上述荚膜多糖a的重复单元分子量为781,单元重复数目n值为89,分子量约为70kd,分子式为-[c31n3o20h47]91-,化学结构见图8。
(3)不同分子量大小荚膜多糖a的制备
本实施例通过对(2)中制备的荚膜多糖a进行降解,所述的降解方法包括但不限于化学降解法、物理降解法和生物降解法。本实施例采用超声的方法,所述超声方法为将荚膜多糖a于195khz,20℃的条件分别处理3小时、2小时、0.5小时和0小时,分别收集得到分子量大小为2kd、5kd、40kd、70kd的荚膜多糖a。使用(2)的方法从脆弱拟杆菌nctc9343(购自美国atcc)中提取得到分子量为110kd的荚膜多糖a。
实施例2不同剂量脆弱拟杆菌荚膜多糖a对dss诱导的小鼠炎症性肠病的疗效
一、实验设计
本实施例通过dss(葡聚糖硫酸钠)诱导c57bl/6小鼠肠炎,然后使用实施例1制备得到的脆弱拟杆菌提取物(主要成分为荚膜多糖a)对诱导的c57bl/6小鼠肠炎进行治疗,检测其治疗效果。本实施例以分子量为40kd的荚膜多糖a为例。
小鼠肠炎诱导方法:本实施例60只雌性c57bl/6小鼠,每只实验用小鼠均分配有一个唯一编号。在对动物进行分组之前,应在鼠笼的标签上标注项目编号、种属/品系、性别、笼号及动物号。使用biobook软件根据小鼠的初始体重随机分成6组,每组10只。
第0天开始,除第1组饮用正常用水外,第2组到第6组小鼠饮用含dss的水溶液,连续饮用6天,之后小鼠自由饮用正常用水4天(从第6天下午17:30到第9天)。将开始造模当天计为0天。dss水溶液用锡箔纸包裹,保证避光。每2天更换一次dss水溶液。为了保证实验的可靠性,本实施例根据动物的平均体重和动物状态调整dss的使用浓度。大致原则如下:
1.5%dss:平均体重<17.5g
1.7%dss:17.5g<平均体重<18g
1.9%dss:18g<平均体重<18.5g
2.0%dss:18.5g<平均体重<20g;
具体实验分组及给药方案如表1所示:
表1实验分组及给药方案
二、观察指标及判定
1、小鼠体重
每天测量记录动物的体重,并对动物的日常活动进行观察,记录异常情况。
2、日常疾病指数(dai)按照以下标准评等级:
体重损失(0,≤0%;1,1-3%;2,3-6%;3,6-9%;4,>9%);
血便(0,阴性;2,带血粪便;4,流体样血便);
粪便评分(0,正常;2,稀便;4,腹泻)
三部分的分数相加得到日常疾病指数值。
3、血清采集,肠的重量、长度和溃疡面积
第9天,所有小鼠接受3%-5%的异氟烷吸入麻醉后经眼眶取血,分离血清。采血后小鼠接受过量co2后脱颈处死。剪开腹腔,取小鼠结直肠,去除结肠周围的组织,测量从回盲瓣到肛门的纵向长度。剖开结直肠,对内容粪便进行评分,清洗肠内物,对结肠整体拍照,称重,收集结肠以备用。
4、统计与分析
分别计算各组小鼠的体重损失、血便、粪便评分的平均值,三部分的分数相加得到日常疾病指数值(dai)。体重,结肠长度以均值±标准误统计。使用graphpadprism,spss或sigmaplot软件进行统计分析。具体的数据以图表的形式呈现。p<0.05被认为具有统计学差异。
三、结果及分析
使用均值±标准误(mean±s.e.m)统计动物的体重、肠子的长度、重量以及溃疡面积。肠相关变量用anova结合dunnett’s进行多重分析。动物体重相关数据使用anova进行多重比较。当p<0.05时,则认为在统计学上有差异。
表2dai评分
表3结直肠宏观评价
在本实施例中,阳性药cyclosporinea(环胞素a、csa)降低了dss诱导的小鼠肠炎的临床症状,包括体重下降,腹泻和血便三个指标。cyclosporinea也改善了结直肠内存留的粪便的性状,且与模型组相比,均具有统计学差异。
实施例1提供的分子量为40kd的脆弱拟杆菌荚膜多糖a高剂量组表现出了显著的抑制dss诱导的小鼠肠炎的药效,表现在其显著地降低了肠炎导致的结直肠重量的增加,改善了肠内容物的性状,详见表3。与模型组相比,以上指标均具有统计学差异。
在本实施例中,通过比较6组实验的日常疾病指数(dai)可以发现,本发明提供的低、中、高剂量的脆弱拟杆菌荚膜多糖a均能有效降低日常疾病指数(dai)(详见表2、图9)。
可见,本发明提供的脆弱拟杆菌荚膜多糖a对dss诱导小鼠急性肠炎具有很好的治疗作用,而且未表现出任何毒副作用。
实施例3、肠道通透性检测
炎症性肠病严重破坏肠黏膜通透性。肠黏膜通透性处于正常水平可以有效阻挡外来微生物和毒素的侵袭,有利于机体的内环境稳定,是机体健康的保证。本实施例对实施例1提供的分子量为70kd的脆弱拟杆菌荚膜多糖a对肠道通透性的作用进行检测,本实施例选择实施例2中收集的day9病变最明显的结肠段检测以下项目:
1)组织病理变化:he染色观察组织变化,炎症浸润情况;透射电镜观察病变超微结构变化,观察上皮细胞形态、上皮间紧密连接,上皮通透性变化。本实施例选用实施例2中6组于day9收集的结肠,按照常规技术进行he染色观察,结果如图10。
显微镜下可以观察到,模型组小鼠的肠粘膜上皮层完整性受到破坏,伴有炎性细胞浸润,隐窝扭曲变形及黏膜下水肿。而正常组对照组、环孢素a(csa)以及脆弱拟杆菌荚膜多糖a低、中、高剂量组的小鼠结肠组织未见明显的病理改变。
2)肠道通透性:使用外翻肠囊法,将制备的肠囊置于添加了乳果糖和甘露醇的hbss缓冲液(ph7.4),收集培养后的肠囊内培养液,经高效液相色谱仪测定。
具体步骤:
(1)外翻肠囊的制备:分别取实施例2中正常组对照组、模型组、环孢素a(csa)组、脆弱拟杆菌荚膜多糖a(低剂量)、脆弱拟杆菌荚膜多糖a(中剂量)、脆弱拟杆菌荚膜多糖a(高剂量)组中day9病变最明显的结肠段,去掉肠系膜,用生理盐水(或缓冲液)冲洗干净,外翻使肠粘膜向外,结扎一端形成肠囊状,灌注hbss缓冲液(ph7.4)后结扎另一端,并做好标记。
(2)将步骤(1)制备的外翻肠囊置于添加了乳果糖和甘露醇的培养液中,通入95%氧气和5%二氧化碳的混合气体,培养2h。
(3)用注射器分别抽取肠囊中的培养液进行高效液相色谱仪测定。
结果:正常组对照组、模型组、环孢素a(csa)组、脆弱拟杆菌荚膜多糖a(低剂量)组、脆弱拟杆菌荚膜多糖a(中剂量)组、脆弱拟杆菌荚膜多糖a(高剂量)组肠囊中乳果糖和甘露醇含量的比值分别为0.021±0.006、0.83±0.41、0.029±0.013、0.025±0.009、0.023±0.007和0.020±0.008,从检测结果发现正常组对照组、环孢素a(csa)组、脆弱拟杆菌荚膜多糖a(低剂量)组、脆弱拟杆菌荚膜多糖a(中剂量)组、脆弱拟杆菌荚膜多糖a(高剂量)组中乳果糖和甘露醇含量的比值比模型组中的明显降低,差异显著(p<0.05),具有统计学意义。而正常组对照组、环孢素a(csa)组、脆弱拟杆菌荚膜多糖a(低剂量)组、脆弱拟杆菌荚膜多糖a(中剂量)组、脆弱拟杆菌荚膜多糖a(高剂量)组中乳果糖和甘露醇含量的比值相近,差异不显著(p>0.05)。可见,经过dss处理后,小鼠结肠段肠粘膜屏障的通透性明显增加,而经cyclosporinea和脆弱拟杆菌荚膜多糖a治疗后均可明显降低小鼠结肠段肠粘膜屏障的通透性。
3)肠壁炎症:肠组织匀浆后,检测tnf-α,ifn-γ,il-13,il-17。
具体步骤如下:
tnf-α,ifn-γ,il-13,il-17水平测定分别按试剂盒要求切取肠段,去除脂肪系膜组织,加冰生理盐水制备10%匀浆,-20℃贮存待测。
除空白孔外,分别将样品或不同浓度的标准品(100μl/孔)加入相应孔中,用封板胶纸封住反应孔,37℃恒温箱孵育90min。
甩去酶标版内液体,洗板4次,每次5分钟。
除空白孔外,加入生物素抗体工作液(100μl/孔),用封板胶纸封住反应孔,37℃恒温箱孵育60min。
用0.01mpbs洗板4次,每次5分钟。
除空白孔外,加入亲和素-过氧化物复合物(abc)工作液(100μl/孔)用封板胶纸封住反应孔,37℃恒温箱孵育30min。
用0.01mpbs洗板4次,每次5分钟。
加入显色剂(100μl/孔),避光37℃恒温箱孵育10~15min。
加入终止剂(100μl/孔),混匀后即刻在450nm处测量od值。
每个样本od值减去零孔的od值后,建立标准曲线,根据标准曲线计算各样品中的tnf-α,ifn-γ,il-13,il-17含量。
结果如表4所示:与正常组对照组小鼠相比,模型组小鼠结肠匀浆中tnf-a、ifn-γ的含量明显增高(p<0.01),提示小鼠肠粘膜中免疫失衡,促炎细胞因子水平明显增高。与模型组小鼠相比,经过cyclosporinea和实施例1制备的脆弱拟杆菌荚膜多糖a(低剂量、中剂量和高剂量)治疗后,小鼠结肠匀浆中tnf-a、ifn-γ的含量明显降低(p<0.01),说明本发明提供的脆弱拟杆菌荚膜多糖a能有效地改善小鼠肠粘膜中免疫平衡。
表4结肠匀浆中tnf-α,ifn-γ,ifn-13,il-17含量
注:*表示与模型组相比p<0.05,差异显著。
4)屏障相关蛋白主要有zo-1,occludin,b-catenin和claudin-1,本实施例使用免疫组化、westernblot法检测实施例2day9中正常对照组、模型组、环孢素a(csa)组和脆弱拟杆菌荚膜多糖a(高剂量)的屏障相关蛋白zo-1,occludin,b-catenin和claudin-1的差异。
结果:模型组中zo-1,occludin,b-catenin和claudin-1屏障相关蛋白的表达明显低于脆弱拟杆菌荚膜多糖a(高剂量)和环孢素a(csa)组,说明经实施例1制备的脆弱拟杆菌荚膜多糖a治疗后,屏障相关蛋白zo-1,occludin,b-catenin和claudin-1的表达量明显增加,与正常对照组中的表达量相当,详见图11。说明,本发明提供的脆弱拟杆菌荚膜多糖a可明显提高屏障相关蛋白的表达量,可有效地调节肠粘膜屏障。
实施例4不同分子量的脆弱拟杆菌荚膜多糖a对炎症性肠病的疗效
本实施例通过dss(葡聚糖硫酸钠右旋糖酐硫酸酯钠)诱导c57bl/6小鼠肠炎,然后分别使用本发明实施例1制备得到的2kd、5kd、40kd和70kd的脆弱拟杆菌荚膜多糖a对dss诱导的c57bl/6小鼠肠炎的进行预防/治疗,检测不同分子量的脆弱拟杆菌荚膜多糖a对炎症性肠病的治疗效果。本实施例以高剂量的2kd、5kd、40kd和70kd的脆弱拟杆菌荚膜多糖a为例。
参照实施例2的实验组分组方法,将小鼠分为正常对照组、模型组、2kd组、5kd组、40kd组、70kd组以及110kd组。
给药方案参照实施例2。
具体实验分组及给药方案如下表:
表5实验分组及给药方案
(1)参考实施例2的方法进行结直肠宏观评价,具体结果如下:
表6结直肠宏观评价
从上表可以看出本发明提供的分子量为5kd、40kd、70kd的脆弱拟杆菌荚膜多糖a表现出了显著的抑制dss诱导的小鼠肠炎急性肠炎的药效,具体表现在其显著地降低了炎症性肠病导致的结直肠重量的增加,改善了肠内容物的性状,详见表6。与2kd组和110kd组相比,5kd、40kd、70kd在降低炎症性肠病导致的结直肠重量和粪便分数表现出更好的活性,p<0.05,统计学差异显著。
(2)参考实施例3的方法检测肠道通透性,正常组对照组、模型组、2kd、5kd组、40kd组、70kd组、110kd组中乳果糖和甘露醇含量的比值分别为0.023±0.007、0.84±0.52、0.76±0.42、0.025±0.014、0.023±0.004、0.024±0.008和0.120±0.014。从检测结果发现正常组对照组、5kd组、40kd组、70kd组、110kd组中乳果糖和甘露醇含量的比值比2kd组、模型组中的明显降低,差异极显著(p<0.01),具有统计学意义。另外,与110kd组相比,5kd组、40kd组和70kd组中乳果糖和甘露醇含量的比值明显降低,差异显著(p<0.05),具有统计学意义。
通过本实施例可以看出,本发明通过对脆弱拟杆菌荚膜多糖a进行降解,降低其分子量和黏度,可以增强其生物活性,特别是在分子量为5kd–70kd区间内,对炎症性肠病具有更好的疗效。
实施例5不同菌株脆弱拟杆菌荚膜多糖a对炎症性肠病的疗效
本实施例使用实施例1记载的超声方法对分子量为110kd的荚膜多糖a进行降解(超声条件:195khz,25℃,0.5小时),并收集分子量为70kd的荚膜多糖a,记为nctc9343-70kd组,并与从zy-312中提取得到的分子量为70kd的荚膜多糖a(记为zy-312-70kd组)进行对比,评价其对炎症性肠病的疗效。本实施例参考实施例4记载的方法,分别检测结直肠宏观评价和肠道通透性,具体结果如下:
表7结直肠宏观评价
zy-312-70kd组、nctc9343-70kd组中乳果糖和甘露醇含量的比值分别为0.023±0.007、0.025±0.014。
从上述结果可以看出,将从nctc9343菌株中提取得到分子量为110kd的荚膜多糖a进行降解,可以实现与从zy-312菌株提取的荚膜多糖a对炎症性肠病相近的治疗效果。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!