一种鱼类口服疫苗佐剂及其制剂方法与流程
本发明涉及鱼类用疫苗制剂技术领域,尤其涉及一种鱼类口服疫苗佐剂及其制剂方法。
背景技术:
鱼类黏膜免疫系统具有一定的自主性。鱼类的黏膜组织(鳃、皮肤、肠道)有丰富的非特异性防御因子和各种免疫细胞,它不仅是抵挡病原入侵的第一道屏障,而且具有独立完成局部免疫应答的功能,为黏膜免疫接种提供了重要的理论依据。随着鱼类系统免疫研究的逐步深入,黏膜免疫的研究也受到重视。研究表明,鱼类的后肠存在呈递抗原的上皮细胞和巨噬细胞,能够摄取可溶性和颗粒性的抗原,因此鱼类肠道是进行黏膜免疫接种的一个有效部位。
鱼类虽然是低级脊椎动物,但它仍有较为完善的免疫系统。早在20世纪30年代就有报道鱼类具有免疫反应,随之出现了“鱼疫苗”,后来抗生素的应用一时间成为预防疾病的主要措施,直至70年代由于化学治疗抗药性,如抗生素使用后细菌耐药性问题的显现,鱼疫苗又再度兴起,近年已成为疫苗学的一个重要分支。鱼用疫苗的发展相当迅速,几十年来,疫苗的种类日益增多,分类方式也多种多样,按免疫方式分为注射疫苗、浸泡疫苗和口服疫苗;按疫苗抗原成分类型分为菌体疫苗、亚单位疫苗、重组疫苗和dna疫苗等,按照抗原制备方式分为灭活疫苗、减毒疫苗、基因缺失疫苗等。以上这些疫苗按照发展阶段和应用技术可以通分为传统疫苗和新型疫苗两大类。
鱼用疫苗因鱼类的自身特点,其接种方法主要有三种:一是注射,二是浸泡,三是口服。这三种方法在实际应用中均有各自的优缺点:
1)注射免疫剂量准确,诱导免疫应答比其它几种方法都强,若辅以佐剂更可提高和延长免疫应答反应。但注射免疫费时费力,鱼的应激反应也大,对鱼苗和较小的鱼类并不适用。
2)浸泡免疫省时方便,是仅次于注射法的有效给药途径,并且可适用于难以实施注射的鱼苗。但其吸收效果受到多种因素的影响,且疫苗进入体内的机理并不十分清楚。另外,在dna疫苗的研究中,试验所用的浸泡液中dna疫苗含量很高,而且需脂质体包埋,因而成本较高,应用受到限制。
3)口服免疫对鱼体无损伤,操作方便,不受时间、地点、鱼体大小的限制。但由于鱼类的肠道在吸收疫苗前,胃内的消化酶已将疫苗分解,导致疫苗降解或失活,其吸收效率和生物利用度大大降低,到达目标接种部位的抗原浓度不足,而难以引发有效的免疫应答反应。因此,口服疫苗的应用需要提供疫苗抗原的保护方法及有效的免疫佐剂才能达到预期免疫效果。
迄今为止,在渔业生产上甚少有可应用的口服疫苗出现。在水产养殖中,joosten等(1997)制备的微囊弧菌疫苗,通过对草鱼和鳟鱼的口服免疫试验,证实了微囊疫苗确实可以提高鱼体对抗原的吸收。肖鹏等(2007)也通过鳗弧菌口服乳化疫苗对大菱鲆的免疫效果试验得到了同样的结论。这些发现为口服疫苗的研制与开发提供了帮助。目前研究的热点主要集中在微粒、微胶囊、包裹微球方面。
但现有口服疫苗存在以下问题:
1)疫苗的制粒及包裹工艺方面普遍存在制粒或是包裹工艺复杂的问题,且制粒后的高温干燥过程易使菌体蛋白变性而丧失部分免疫活性,以致免疫效果差,保护率低;
2)包裹层数过多,包裹材质在胃肠道内不容易被消化,不利于疫苗在肠道内的释放;
3)包裹载体对疫苗的活性存在影响,如包裹材料多用的是高分子材料或是蛋白载体,高分子材料的溶剂可能用到有机溶剂,有机溶剂的存在可能会破坏疫苗的免疫原性,而蛋白类载体容易产生非特异性抗体,影响免疫效果。
综上所述,筛选一种非蛋白类包裹材料和一个可以保护口服疫苗抗原免受胃肠道破坏,加快疫苗抗原完整吸收从而诱导理想的免疫反应的佐剂配方,制定一套简单易操作的口服疫苗制备工艺十分必要。
技术实现要素:
为了克服现有技术的不足,本发明的目的之一在于提供一种可较好地被鱼类吸收的鱼类口服疫苗佐剂。
本发明的目的之二在于提供上述鱼类口服疫苗的制剂方法。
本发明的目的之一采用如下技术方案实现:
一种鱼类口服疫苗佐剂,包括以下组分:抗胃酸组分、胃消化酶抑制组分、促肠道吸收组分和多糖包裹组分;
所述抗胃酸组分用于将疫苗在胃肠道局部的ph值调节为6.5-7.5;所述促肠道吸收组分用于协助运载疫苗扩散到黏膜细胞,包括表面活性剂、油酸类或增稠剂;所述多糖包裹组分为非蛋白类多糖。
进一步地,鱼类口服疫苗佐剂包括按重量份的以下组分:3-6份抗胃酸组分、2-5份胃消化酶抑制组分、2-5份促肠道吸收组分和2-6份多糖包裹组分。
进一步地,所述抗胃酸组分为bronsted碱。
进一步地,所述抗胃酸组分为碳酸氢钠、碳酸钠、柠檬酸钠、磷酸钙、碳酸钙、碳酸镁、氢氧化镁、磷酸镁、氧化镁和带有负电荷的多聚体透明质酸中的一种或两种以上。
进一步地,所述胃消化酶抑制组分为植物源性胃蛋白酶抑制剂、血红蛋白、卵清蛋白、蛋白酶体或edta中的一种或两种以上。
进一步地,所述促肠道吸收组分包括皂角苷、水杨酸钠、十二醇硫酸钠、油酸、亚油酸、胆汁盐类、油酸甘油酯、卡波姆、卵磷脂、溶血卵磷脂、山梨糖醇酐和磷脂类中的一种或两种以上。
进一步地,所述多糖包裹组分包括多聚赖氨酸、多聚鸟氨酸、壳聚糖、海藻酸、胶原蛋白、琼脂糖和硫酸纤维中的一种或两种以上。
本发明的目的之二采用如下技术方案实现:
一种鱼类口服疫苗的制剂方法,以疫苗抗原、抗胃酸组分、胃消化酶抑制组分、促肠道吸收组分和多糖包裹组分为原料,包括以下步骤:
1)将抗胃酸组分、胃消化酶抑制组分和促肠道吸收组分混合,加食用植物油搅拌均匀;
2)将步骤1)得到的物料缓慢加至鱼类饲料中,混合;
3)将多糖包裹组分加水搅拌至粘稠状,加入疫苗抗原,混均;
4)将步骤3)得到的物料与步骤2)得到的物料进行混合,搅拌均匀;
5)将步骤4)得到的物料进行干燥。
进一步地,所述抗胃酸组分用于将疫苗在胃肠道局部的ph值范围调节为6.5-7.5;所述促肠道吸收组分用于协助运载疫苗扩散到黏膜细胞,包括表面活性剂、油酸类或增稠剂;所述多糖包裹组分为非蛋白类多糖。
进一步地,所述疫苗抗原的菌种类型为无乳链球菌、海豚链球菌、嗜水气单胞菌、副溶血弧菌、爱德华氏菌、点状假单胞菌、荧光假单胞菌、柱状纤维菌、草鱼出血热病毒、锦鲤疱疹病毒中的任意一种或两种以上;所述疫苗抗原的状态为灭活抗原、亚单位抗原或减毒活疫苗抗原中的一种或两种以上。
进一步地,步骤5),在通风处充分晾晒干燥。
相比现有技术,本发明的有益效果在于:
1)本发明提供的鱼类口服疫苗佐剂,除了采用致敏性低的多糖包裹组分将疫苗抗原包裹于其内,有效延长了疫苗抗原的释放时间;采用疫苗形成保护氛层的抗胃酸组分和胃消化酶抑制组分,避免了疫苗抗原在胃肠道内的变性;再辅以促肠道吸收组分以促进疫苗抗原在鱼肠道内的吸收和利用,提高肠道黏膜对疫苗抗原的渗透能力,以提高疫苗抗原的利用率和单位效力;
2)本发明提供的制剂方法,通过先将抗胃酸组分、胃消化酶抑制组分和促肠道吸收组分用食用植物油进行均质后再与饲料进行混合,采用多糖包裹组分加水调稠后将疫苗抗原进行包裹,使疫苗抗原在自内至外的多层保护下进入鱼类消化道,使鱼类对疫苗抗原的吸收性更佳。
附图说明
图1为检测例1的试验结果图;
图2为检测例2的双抗夹心elisa方法标准曲线;
图3为检测例2的试验结果图,其中,曲线自上至下依次为高剂量组、中剂量组、低剂量组、空白疫苗免疫组和绝对空白对照组。
图4为检测例4的试验结果图。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
本发明提供一种鱼类口服疫苗佐剂,其特征在于,包括以下组分:抗胃酸组分、胃消化酶抑制组分、促肠道吸收组分和多糖包裹组分;
所述抗胃酸组分用于将疫苗在胃肠道局部的ph值调节为6.5-7.5;所述促肠道吸收组分用于协助运载疫苗扩散到黏膜细胞,包括表面活性剂、油酸类或增稠剂;所述多糖包裹组分为非蛋白类多糖。
本发明同时提供一种鱼类口服疫苗的制剂方法,以疫苗抗原、抗胃酸组分、胃消化酶抑制组分、促肠道吸收组分和多糖包裹组分为原料,包括以下步骤:
1)将抗胃酸组分、胃消化酶抑制组分和促肠道吸收组分混合,加食用植物油搅拌均匀;
该步骤中,利用食用植物油将抗胃酸组分、胃消化酶抑制组分和促肠道吸收组分分散均匀,以形成保护氛围;
2)将步骤1)得到的物料缓慢加至鱼类饲料中,混合;
该步骤中,步骤1)得到的物料与鱼类饲料的重量比优选的为6-10:100;该配比范围内,一方面能有效保证保护氛围的稳定性,另一方面可以保证鱼类饲料的利用率,不会造成消化障碍;
3)将多糖包裹组分加水搅拌至粘稠状,加入疫苗抗原,混均;
该步骤是以疫苗抗原为核,形成单位的疫苗包裹颗粒,即形成集中作用点;
4)将步骤3)得到的物料与步骤2)得到的物料进行混合,搅拌均匀;
该步骤将保护氛围与集中作用点相结合,得到的既对疫苗抗原保护性好、又不妨碍饲料消化吸收的疫苗饲料;
5)将步骤4)得到的物料进行干燥。
作为进一步的方案,进一步地,所述鱼类口服疫苗佐剂包括按重量份的以下组分:3-6份抗胃酸组分、2-5份胃消化酶抑制组分、2-5份促肠道吸收组分和2-6份多糖包裹组分。
在本发明中,抗胃酸组分为bronsted碱,其主要作用是在疫苗表面形成保护氛围,使疫苗抗原所在局部的胃肠道ph值为6.5-7.5,以减少疫苗抗原受消化液的影响而失活;优选的,所述抗胃酸组分选自但不限定于碳酸氢钠、碳酸钠、柠檬酸钠、磷酸钙、碳酸钙、碳酸镁、氢氧化镁、磷酸镁、氧化镁和带有负电荷的多聚体透明质酸中的一种或两种以上。
在本发明中,所述胃消化酶抑制组分即胃消化酶抑制剂,其中消化酶抑制剂按照结构包括蛋白类和非蛋白类。消化酶抑制剂具有专一性,可以选择只有效的抑制某种真菌胞子的萌发和菌丝的生长;且在鱼类服用后不残留,对人体无伤害。优选地,本发明所采用的胃消化酶抑制组分具体可以选自但不限于植物源性胃蛋白酶抑制剂、血红蛋白、卵清蛋白、蛋白酶体或edta中的一种或两种以上。
在本发明中,促肠道吸收组分可促进疫苗抗原在鱼肠道内的吸收和利用,使疫苗抗原在鱼的中后肠部位引起有效的免疫反应;优选地,所述促肠道吸收组分选自但不限定于皂角苷、水杨酸钠、十二醇硫酸钠、油酸、亚油酸、胆汁盐类、油酸甘油酯、卡波姆、卵磷脂、溶血卵磷脂、山梨糖醇酐和磷脂类中的一种或两种以上。
在本发明中,所述多糖包裹组分包裹疫苗抗原后具有缓释功能,包裹结构在鱼胃部酸性环境中不会被破坏,而在鱼肠道的碱性环境中逐渐释放,形成集中作用点,利于疫苗抗原的吸收和利用;多糖包裹组分为天然材料,不会在体内产生过敏反应,而且会在体内逐渐降解,利用多糖包裹组分将疫苗包裹于饲料颗粒表面,保证鱼类在摄食的同时摄入疫苗,提高了疫苗的利用率,同时也不会影响鱼类对饲料的消化吸收。优选地,所述多糖包裹组分选自但不限定于多聚赖氨酸、多聚鸟氨酸、壳聚糖、海藻酸、胶原蛋白、琼脂糖和硫酸纤维中的一种或两种以上。
在本发明中,包含抗胃酸组分、胃消化酶抑制组分、促肠道吸收组分和多糖包裹组分,各组分之间相互协同作用,四位一体,缺一不可,同时作为疫苗运送载体的饲料颗粒,既可以诱导鱼进食,又利于疫苗抗原的包裹附着。包裹好的疫苗饲料进入鱼的消化道胃部后在抗胃酸组分、胃消化酶抑制组分和多糖包裹组分的协同作用下改变了疫苗所在鱼胃局部的酸性环境,保证了疫苗抗原的完整性,到达鱼体肠道部位后多糖组分在肠道的ph条件下开始释放疫苗抗原,同时借助促肠道吸收组分的作用使大部分的疫苗抗原顺利通过肠道表皮粘膜系统,进入鱼体血液循环,从而诱导免疫反应。
实施例1
一种鱼类疫苗口服疫苗佐剂,由下列原材料以质量份组成:3份抗胃酸组分;2份胃消化酶抑制组分;2份促肠道吸收组分;2份多糖包裹组分。
其中抗胃酸组分包含柠檬酸钠1份、无水碳酸钙2份;所述胃消化酶抑制组分包含卵清蛋白1.5份、edta0.5份;所述促肠道吸收组分包含亚油酸1份,卡波姆1份;所述多糖包裹组分为海藻酸1份、多聚赖氨酸1份。
一种鱼类口服免疫佐剂的制剂方法为:佐剂胃消化酶抑制组分、促肠道吸收组分使用前需与抗胃酸组分用食用植物油2份充分搅拌混匀,混匀后再与常规饲料进行搅拌,使之充分与饲料混匀。多糖包裹组分使用前需单独加水搅拌溶解,需缓慢加入,溶解至均质粘稠状为佳,多糖包裹组分的加入量控制为使其最终体积比浓度为0.01%,配制好后再与疫苗抗原混匀包裹到上述饲料表面。
实施例2
一种鱼类疫苗口服疫苗佐剂,由下列原材料以质量份组成:3份抗胃酸组分;3份胃消化酶抑制组分;2份促肠道吸收组分;3份多糖包裹组分。
其中,抗胃酸组分包含柠檬酸钠1份、无水碳酸钙1份、无水氯化钙1份;所述胃消化酶抑制组分包含卵清蛋白2份、edta1份;所述促肠道吸收组分包含水杨酸钠1份,胆汁盐类1份;所述多糖包裹组分为海藻酸2份、多聚赖氨酸1份。
该鱼类口服疫苗的制剂方法包括以下步骤:将佐剂胃消化酶抑制组分、促肠道吸收组分使用前需与抗胃酸组分用食用植物油3份充分搅拌混匀,混匀后再与常规饲料进行搅拌,使之充分与饲料混匀。多糖包裹组分使用前需单独加水搅拌溶解,需缓慢加入,溶解至均质粘稠状为佳,多糖包裹组分的加入量控制为使其最终体积比浓度为0.05%,配制好后再与疫苗抗原混匀包裹到上述饲料表面。
实施例3
一种可用于鱼类疫苗口服免疫的佐剂配方,由下列原材料以质量份组成:4份抗胃酸组分;3份胃消化酶抑制组分;3份促肠道吸收组分;5份多糖包裹组分。
其中抗胃酸组分包含碳酸钙3份、碳酸氢钠1份;所述胃消化酶抑制组分包含豆粉2份、蛋白酶体1份;所述促肠道吸收组分包含水杨酸钠1份,胆汁盐类2份;所述多糖包裹组分为壳聚糖3份、多聚鸟氨酸2份。
一种鱼类口服免疫佐剂的制剂方法为:佐剂胃消化酶抑制组分、促肠道吸收组分使用前需与抗胃酸组分用食用植物油4份充分搅拌混匀,混匀后再与常规饲料进行搅拌,使之充分与饲料混匀。多糖包裹组分使用前需单独加水搅拌溶解,需缓慢加入,溶解至均质粘稠状为佳,多糖包裹组分的加入量控制为使其最终体积比浓度为0.1%,配制好后再与疫苗抗原混匀包裹到上述饲料表面。
实施例4
一种可用于鱼类疫苗口服免疫的佐剂配方,由下列原材料以质量份组成:5份抗胃酸组分;4份胃消化酶抑制组分;5份促肠道吸收组分;6份多糖包裹组分。
其中抗胃酸组分包含碳酸氢钠2份、多聚体透明质酸3份;所述胃消化酶抑制组分包含豆粉2份、蛋白酶体2份;所述促肠道吸收组分包含皂角苷2份、胆汁盐3份;所述多糖包裹组分为壳聚糖3份、硫酸纤维3份。
一种鱼类口服免疫佐剂的制剂方法为:佐剂胃消化酶抑制组分、促肠道吸收组分使用前需与抗胃酸组分用食用植物油4份充分搅拌混匀,混匀后再与常规饲料进行搅拌,使之充分与饲料混匀。多糖包裹组分使用前需单独加水搅拌溶解,需缓慢加入,溶解至均质粘稠状为佳,多糖包裹组分的加入量控制为使其最终体积比浓度为0.5%,配制好后再与疫苗抗原混匀包裹到上述饲料表面。
实施例5
一种可用于鱼类疫苗口服免疫的佐剂配方,由下列原材料以质量份组成:6份抗胃酸组分;5份胃消化酶抑制组分;5份促肠道吸收组分;6份多糖包裹组分。
其中抗胃酸组分包含碳酸氢钠4份、碳酸钙2份;所述胃消化酶抑制组分包含卵清蛋白1份、豆粉4份;所述促肠道吸收组分包含胆汁盐类3份、十二醇硫酸钠2份;所述多糖包裹组分为海藻酸3份、琼脂糖3份。
一种鱼类口服免疫佐剂的制剂方法为:佐剂胃消化酶抑制组分、促肠道吸收组分使用前需与抗胃酸组分用食用植物油5份充分搅拌混匀,混匀后再与常规饲料进行搅拌,使之充分与饲料混匀。多糖包裹组分使用前需单独加水搅拌溶解,需缓慢加入,溶解至均质粘稠状为佳,多糖包裹组分的加入量控制为使其最终体积比浓度为0.02%,配制好后再与疫苗抗原混匀包裹到上述饲料表面。
性能检测与效果评价
检测例1.罗非鱼饲喂疫苗饲料与空白饲料后胃部ph值对比
本检测例的目的是比较验证疫苗佐剂配方是否会改变鱼胃部的ph值,从而起到保护疫苗抗原的作用。
试验采用体重20g左右健康罗非鱼,每组5尾,共分为2组,一组饲喂空白市售膨化罗非鱼饲料作为空白饲料,一组饲喂实施例1得到的鱼类口服疫苗饲料,投喂量按体重的3%-5%计算,饲喂完成后0.5h、1.5h、2.5h、5.5h、6.5h,每组各取两条罗非鱼,解剖,测定胃溶液的ph值,对比两个试验组胃部ph值的差别。
采用空白饲料和疫苗饲料饲喂后,不同时间内的罗非鱼胃部的ph值变化如图1所示,其ph值变化较大,饲喂后0.5h左右,两个组的ph均为5.5,随着时间的延长,饲料逐渐被消化,空白饲料组在0.5-2.5h内ph变化不大,但之后迅速下降,到5.5h时ph已降至3,6.5h时ph降至2,这说明是胃部已排空,饲料进入肠道内。而疫苗饲料组在0.5-2.5h内ph呈上升趋势,由5.5升至7,之后又趋于下降,但是由于疫苗中所有佐剂成分的调节作用,ph没有剧烈下降,到6.5h时ph仍在6左右。
检测例2.胃消化酶抑制组分保护链球菌亚单位疫苗抗原的抑制试验
本试验选取体重为30±5g的健康罗非鱼100尾,随机分为5组,每组20尾鱼,以链球菌亚单位为疫苗抗原,以实施例1得到的鱼类口服疫苗作为中剂量组,即口服佐剂的量为3份抗胃酸组分;2份胃消化酶抑制组分;2份促肠道吸收组分;2份多糖包裹组分;其中抗胃酸组分包含柠檬酸钠1份、无水碳酸钙1份;所述胃消化酶抑制组分包含卵清蛋白1.5份、edta0.5份;所述促肠道吸收组分包含亚油酸1份,卡波姆1份;所述多糖包裹组分为海藻酸1份、多聚赖氨酸1份,以胃消化酶抑制组分的使用量减半作为低剂量组,以胃消化酶抑制组分的使用量翻倍作为高剂量组。其中,链球菌亚单位疫苗抗原采用原核表达纯化的sip蛋白,具体组别见下表。
表1胃消化酶抑制组分的抑制试验分组处理
其中,绝对空白对照组灌服等体积蒸馏水,空白疫苗免疫组灌服不含胃消化酶抑制组分的sip蛋白抗原。
将各剂量胃消化酶抑制组分与其他固定量佐剂组分和sip蛋白包裹后,制作成流体饵料,各组根据以上分组灌喂,1.0ml/尾,每组20尾均灌服,灌服1次,绝对空白组给予等体积蒸馏水。分别在灌服后1h、2h、3h、4h、5h、6h,每个时间点取3尾鱼,将罗非鱼处死解剖,剪取前中后肠,沿肠管剪开,用一次性药用无菌木片刮取肠壁粘液至ep管中,每管中加入0.5ml灭菌生理盐水后用3500rpm/min的转速于4℃离心10min,将上层肠液收集起来,-20℃保存,准备测定链球菌sip蛋白含量。
采用夹心elisa方法来检测在罗非鱼胃肠道内胃消化酶抑制组分保护包裹链球菌抗原的状况。本方法使用sip蛋白抗原序列(434aa)的一段多肽(氨基酸序列351-370)免疫新西兰大白兔而生产的抗体作为捕获抗体,用小鼠抗sip蛋白的抗体作为检测抗体,羊抗鼠hrp作为酶标系统,进而建立夹心elisa检测方法:
1)方法用抗原的制备
sip蛋白抗原:大肠杆菌表达lrrg-sip蛋白,来源于中国水产科学院珠江水产研究所(卢迈新/可小丽),抗原浓度为0.37mg/ml(20mmtrishcl,100mmnacl,ph=8)。
多肽抗原:上海强耀生物科技有限公司合成(20mg,纯度>95%),多肽分别与钥孔血蓝蛋白(klh),卵清蛋白(ova),甲状腺蛋白(trd)偶联,制备成多肽偶联抗原,经透析带(molecularweightcutof10000)透析24h后,紫外分光光度仪280nm鉴定浓度为0.5mg/ml(pbs,ph=7.2)。
2)方法用抗体的制备
捕获抗体制备:试验动物为健康新西兰大白兔3只(其中1只为空白对照),体重1.4-1.5kg,购自南方医科大实验动物中心,免疫前检测其血清为阴性。初次免疫时,取偶联好的多肽200μl加灭菌生理盐水稀释至1ml,然后与弗氏完全佐剂以1:1的比例混合,用微量乳化器充分混匀乳化(乳化效果以滴于冷水中5min不扩散为宜)。加强免疫时,偶联多肽稀释方法同上,然与弗氏不完全佐剂以1:1的比例进行乳化,乳化效果同上。首次免疫,皮下注射乳化好的多肽抗原于颈背部(臀部)皮下分4个位点注射,空白对照组注射等量弗氏佐剂与生理盐水的乳化物;间隔2周后第二次免疫,弗氏不完全佐剂乳化;再间隔2周第三次免疫,剂量、剂型、注射方法同二免。分别于免疫前、三免后7d、14d、21d于耳部静脉采血1-2ml分离血清,用琼脂扩散试验检测效价。当血清抗体效价达到212时,对免疫后的兔行颈动脉放血术,无菌采血,兔血在室温下放置2h,待其凝固后,4℃冰箱内放4h,以3000rpm/min离心10min,分离血清,-20℃保存备用。
检测抗体制备:洁净级昆明小白鼠雌鼠5只,购自南方医科大学实验动物中心,12周龄,体重20±1g。试验前饲养观察一周,每只小鼠先用100μl塑料枪头进行眼角血窦取血(150μl)置于1.5mlep管内,静置于室温2h,3000rpm/min离心10min,收集血清,-20℃保存。小鼠取血第二天,先进行腹腔注射,初免弗氏完全佐剂乳化的lrrg-sip蛋白(50μg/只),两周后进行腹腔二免疫弗氏不完全佐剂乳化的lrrg-sip蛋白(50μg/只),三周后再进行腹腔免疫弗氏不完全佐剂乳化的lrrg-sip蛋白(50μg/只),四周后小白鼠眼角血窦取血,分离血清,使用间接elisa检测抗体滴度。
3)双抗体夹心elisa方法的建立
用猪抗兔免疫球蛋白(美国kpl,0.5mg冻干品,去离子水溶解(1mg/ml),按照5μg/ml浓度进行包被,4℃过夜,然后用1%bsa/pbs封闭,37℃封闭1h,洗涤3次后备用。按多肽兔源多抗(30min)→lrrg-sip标准蛋白/或待检罗非鱼肠道内容物上清液(30min)→鼠抗lrrg-sip多抗(30min)→兔抗鼠二抗(hrp)(30min)→底物显色(10min)→终止显色的实验程序,采用方阵法测定lrrg-sip多肽抗体最适反应浓度和lrrg-sip多抗最适工作浓度,根据上述指标测定,确定最终反应程序。
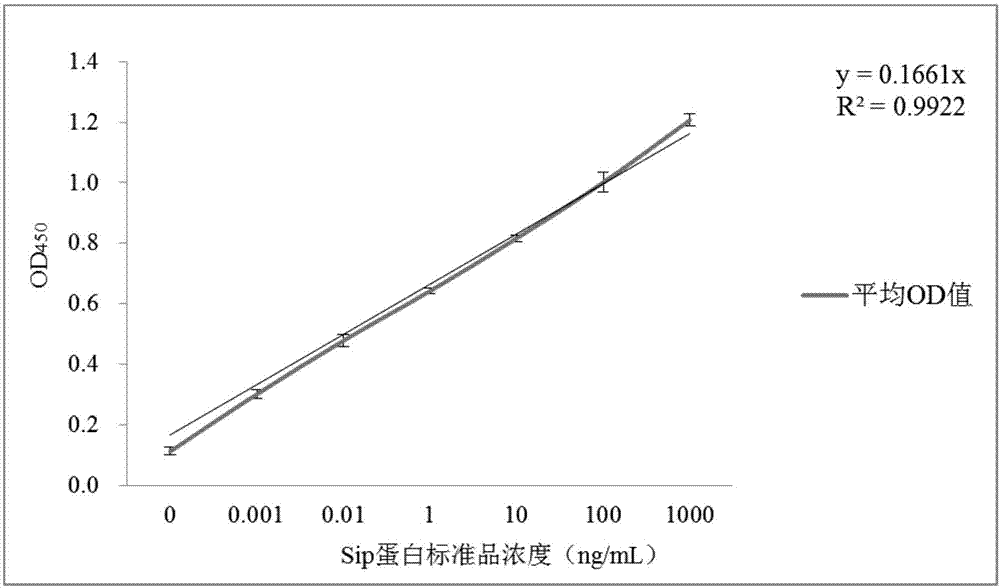
根据方阵滴定法最终确定兔源多抗的稀释倍数为1:2000,待检样品按1:50、1:100、1:200、1:400四个稀释,鼠抗sip蛋白抗体1:5000稀释,兔抗鼠hrp1:4000稀释。按照上述步骤检测2.3.1中不同时间点收集的肠道粘液样品,同时sip蛋白标准品设置1000ng/ml、100ng/ml、10ng/ml、1ng/ml、0.1ng/ml、0.01ng/ml、0ng/ml七个浓度梯度。根据sip蛋白检测结果绘制标准曲线,得出方程式,计算样品中sip蛋白的含量。
根据sip蛋白不同浓度标准品绘制标准曲线,见图2。得出线性方程式y=0.1661x(r2=0.9922),样品中的sip蛋白含量=y/0.1661×稀释倍数(ng/ml)。
取线性范围落在标准曲线内的肠粘液样品稀释倍数1:200为最佳样品稀释倍数。以此倍数稀释样品,以胃消化酶抑制组分中剂量组为例,检测结果具体见下表。
表2不同时间采样点罗非鱼肠道内sip蛋白含量测定
由表2结果可见,灌服后的1-5h内肠道内测得的sip蛋白含量逐渐升高,说明经胃部到达肠道内的sip蛋白的量也逐渐升高,这说明sip蛋白在罗非鱼胃部没有被胃蛋白酶消化破坏,即证明胃消化酶抑制组分可有效的抑制胃蛋白酶发挥作用。
不同试验组灌服后sip蛋白含量测定如图3所示,不同剂量的胃消化酶抑制组分对胃蛋白酶的抑制作用不同,空白疫苗免疫组因不含胃消化酶抑制组分致使sip蛋白在胃部大部分被降解,因此在肠部测得的含量较低。胃消化酶抑制组分高剂量组与中剂量组相比对胃蛋白酶的抑制作用没有显著的差别。
检测例3.促肠道吸收组分对促抗原吸收的效果试验
试验分为两组,选用体重50g左右的健康罗非鱼,每组10尾。以空白市售常规罗非鱼膨化饲料饲喂为基本饲料,试验组一为以实施例1得到的含1×108cfu/g的疫苗抗原和生物素(biotin)标记的hrp(4.0ng/5ml、5ml/尾)的鱼类口服疫苗饲料进行饲喂,试验组二为试验对照组,饲喂与实施例1差别在于不含促肠道吸收组分的对比疫苗饲料,疫苗饲料中含有生物素(biotin)标记的hrp(4.0ng/5ml、5ml/尾)。以含有疫苗抗原(1×108cfu/g)和生物素标记的hrp(4.0ng/5ml/尾)的包裹流体饵料为空白疫苗免疫组;两组鱼使用注射器和灌服针头进行灌服,分别灌服上述两种饲料,在灌服后30min、60min、90min、120min进行采血,静置分离血清,使用elisa方法检测hrp酶的活性。elisa具体操作步骤如下:
1)酶标板的包被:用包被液稀释链霉亲和素至5μg/ml包被酶标板,100μl/孔,37℃孵育1h后,4℃包被过夜,用1*洗涤液洗涤包被板,250μl/孔,洗涤5次,甩干;
2)酶标板的封闭:150μl/孔封闭液,37℃封闭60min,用1*洗涤液洗涤250μl/孔,洗涤5次,甩干,4℃保存备用;
3)检测:将不同时间采集的血清按1:50、1:100、1:200倍稀释,100μl/孔加样,每个样品重复检测2孔,室温孵育30min后洗涤,用1*洗涤液洗涤包被板,250μl/孔,洗涤5次,甩干,然后加入底物tmb显色,100μl/孔,避光显色10min,加入终止液终止反应,50μl/孔。od450nm读数。
根据od450读数结果,计算每个样品的平均酶活性,由下表结果可见。试验对照组的免疫组疫苗抗原在肠道内的吸收很少,灌服后30min测得的od450值仅为0.351(血清1:50倍稀释时),试验组一的免疫组疫苗抗原在肠道内的吸收相当显著,灌服后30min测得的od450值可达1.220(血清1:50倍稀释时),随着时间的延长检测值逐渐降低,说明抗原进入体内后逐步被吸收利用,两组对比结果可见,促肠道吸收组分可以有效地促进疫苗抗原在肠部的吸收利用。
表3促肠道吸收组分的促抗原吸收效果比较
检测例4.口服疫苗各组分单独应用对疫苗免疫抗体产生的影响
本试验选取体重为20±5g的健康罗非鱼250尾,随机分为5组,每组50尾鱼,每组饲喂含不同口服佐剂组分的疫苗饲料,投喂量按鱼体重的3%-5%计算,每天饲喂两次,连续饲喂7天。疫苗饲料结束后饲喂常规空白饲料。口服免疫结束后7d、14d、21d、28d、35d、42d分别采血,分离血清,每次采5尾鱼。然后用elisa方法检测不同试验组的抗体产生情况。
试验组5以实施例1得到的鱼类口服疫苗饲料进行饲喂,即包含3份抗胃酸组分;2份胃消化酶抑制组分;2份促肠道吸收组分;2份多糖包裹组分。其中抗胃酸组分包含柠檬酸钠1份、无水碳酸钙2份;所述胃消化酶抑制组分包含卵清蛋白1.5份、edta0.5份;所述促肠道吸收组分包含亚油酸1份,卡波姆1份;所述多糖包裹组分为海藻酸1份、多聚赖氨酸1份。试验所用包裹抗原为链球菌灭活疫苗抗原,饲料中疫苗抗原浓度为1×108cfu/g。
其他各组口服疫苗饲料的制备不同之处在于:试验组1仅用3份抗胃酸组分和疫苗抗原与饲料进行搅拌混匀;试验组2仅用2份胃消化酶抑制组分和疫苗抗原与饲料进行搅拌混匀;试验组3仅用2份促肠道吸收组分和疫苗抗原与饲料进行搅拌混匀;试验组4为用3份抗胃酸组分、2份胃消化酶抑制组分、2份促肠道吸收组分和疫苗抗原与饲料进行搅拌混匀。
抗体水平检测elisa具体操作步骤如下:
1)酶标板的包被与封闭:用包被液稀释sip蛋白至1μg/ml包被酶标板,100μl/孔,37℃孵育1h后,4℃包被过夜,用1*洗涤液洗涤包被板,250μl/孔,洗涤5次,甩干;然后加封闭液150μl/孔,37℃封闭60min,用1*洗涤液洗涤250μl/孔,洗涤5次,甩干,4℃保存备用。
2)检测:将不同时间采集的血清按1:50倍稀释,100μl/孔,室温孵育30min,用1*洗涤液洗涤包被板,250μl/孔,洗涤5次甩干。然后加入1:1000倍稀释的兔抗鱼igm抗体,100μl/孔,室温孵育30min,用1*洗涤液洗涤包被板,250μl/孔,洗涤5次,甩干。再加入1:2000倍稀释的羊抗兔hrp,室温孵育30min,用1*洗涤液洗涤包被板,250μl/孔,洗涤5次,甩干。然后加入底物tmb显色,100μl/孔,避光显色10min,加入终止液终止反应,50μl/孔。od450nm读数。
用试验组1-4制备的疫苗饲料免疫罗非鱼,即分别用只含有单独组分或是个别佐剂组分有缺失的疫苗饲料饲喂罗非鱼苗后,各试验组抗体水平有明显差异。由图4结果可见,试验组1-3基本无有效抗体产生,说明缺少抗胃酸组分、胃消化酶抑制组分、促肠道吸收组分的疫苗抗原进入鱼体胃肠道后很容易被胃肠道环境所破坏而不能产生有效的免疫反应。试验组4虽然不缺少上述几种组分,可以起到部分保护疫苗抗原的作用,但由于缺少多糖成分的包裹,进入鱼肠道内的抗原量十分有限,因此免疫抗体虽有产生,但水平较低,且持续时间短。试验组5包含口服疫苗的所有佐剂组分和疫苗抗原,疫苗抗原可以在各组分的协同作用下顺利进入罗非鱼的中后肠,从而引起有效地免疫反应,产生相应的免疫抗体。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 还没有人留言评论。精彩留言会获得点赞!