一种医用凝胶及其制备方法与应用与流程
本发明属于凝胶领域,尤其涉及医用凝胶及其制备方法与应用。
背景技术:
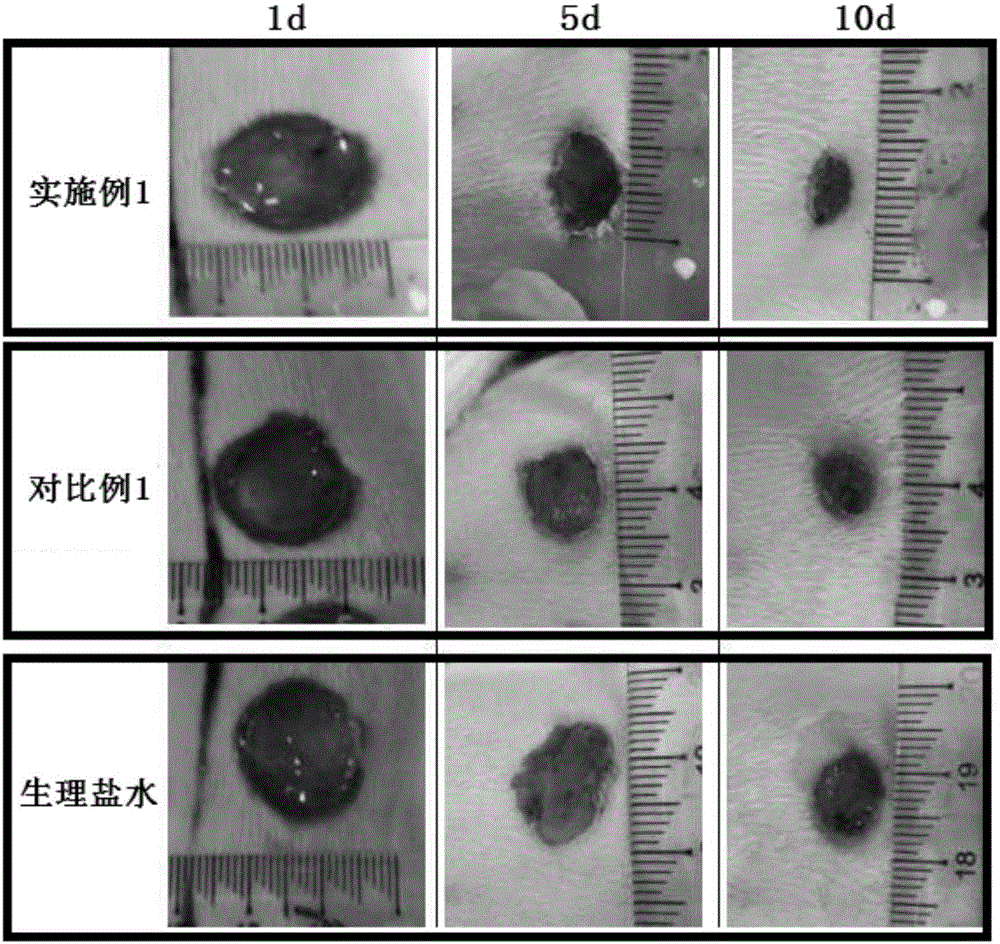
:创面愈合指的是因为外伤或其他伤病的病变造成组织缺损后,局部组织通过再生、修复、重建而进行修补的一系列病理生理过程。其是一个动态、复杂的过程,其涉及到细胞外基质、激酶、各类细胞和许多其他因素等。由于创面愈合过程中病理和生理过程的复杂性,因此,彻底实现组织再生是极其困难的。技术实现要素:为了克服上述问题,本发明人进行了锐意研究,将高分子量透明质酸锌和低分子量透明质酸锌进行复合使用,同时采用羟乙基纤维素和聚乙烯醇仿生构建创面修复微环境以促进创面的愈合,从而完成本发明。本发明的一方面在于提供一种医用凝胶,具体体现在以下几个方面:(1)一种医用凝胶,其中,基于1000重量份凝胶,其由包括以下重量配比的原料成分制成:其中,所述低分子量透明质酸锌是指分子量在10000da以下的透明质酸锌,尤其是1000~10000da;所述高分子量透明质酸锌是指分子量在10000da以上的透明质酸锌。(2)根据上述(1)所述的凝胶,其中,基于1000重量份凝胶,所述凝胶由包括以下重量配比的原料成分制成:(3)根据上述(1)或(2)所述的凝胶,其中,所述高分子量透明质酸锌与所述低分子量透明质酸锌的重量比为(0.2~8):1,优选为(0.5~6):1,更优选为4:1;和/或所述高分子量透明质酸锌或低分子量透明质酸锌如下获得:步骤a、将高分子量透明质酸钠或低分子量透明质酸钠加入水中,任选搅拌,得到溶液a;步骤b、配制无机锌盐水溶液,并将其加入溶液a中,搅拌,得到溶液b;步骤c、采用透析袋或超滤技术对溶液b进行过滤,优选采用透析袋,然后冷冻干燥,得到高分子量透明质酸锌或低分子量透明质酸锌;其中,当制备高分子量透明质酸锌时,采用高分子量透明质酸钠为原料,当制备低分子量透明质酸锌时,采用低分子量透明质酸钠为原料。(4)根据上述(3)所述的凝胶,其中,在步骤a中,得到的溶液a的质量浓度为0.05~1%,优选为0.05~0.5%,更优选为0.08~0.1.5%,例如0.1%;和/或在步骤b中,无机锌盐水溶液的浓度为0.1~5mol/l,优选为0.5~2mol/l,更优选为1mol/l;和/或在步骤a和步骤b中,透明质酸钠与无机锌盐的用量比为1(5~25),优选为1:(8~20),更优选为1:(10~15),例如1:10;和/或在步骤b中,搅拌2~40h,优选搅拌10~30h,更优选搅拌15~25h;和/或在步骤b中,所述无机锌盐包括氯化锌、硝酸锌和硫酸锌,例如氯化锌。(5)根据上述(1)至(4)之一所述的凝胶,其中,在所述凝胶中任选地还包括海藻酸钠;优选地:基于1000重量份凝胶,所述海藻酸钠的用量为1~10重量份,优选为2~5重量份,例如4重量份。(6)根据上述(1)至(5)之一所述的凝胶,其中,在所述凝胶中任选地还包括芦荟提取液;优选地:基于1000重量份凝胶,所述芦荟提取液的用量为1~10重量份,优选为2~8重量份,例如4~6重量份。本发明另一方面还提供了一种本发明第一方面所述医用凝胶的制备方法,具体体现在以下方面:(7)一种制备上述(1)至(6)之一所述医用凝胶的方法,其中,所述方法包括以下步骤:步骤1、将尼泊金甲酯加入水中,得到抑菌剂水溶液;步骤2、将高分子量透明质酸锌和低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;步骤3、再加入羟乙基纤维素、聚乙烯醇和甘油,搅拌,进行灭菌处理,得到所述凝胶。(8)根据上述(7)所述的方法,其中,所述高分子量透明质酸锌或低分子量透明质酸锌如下获得:步骤a、将高分子量透明质酸钠或低分子量透明质酸钠加入水中,任选搅拌,得到溶液a;步骤b、配制无机锌盐水溶液,并将其加入溶液a中,搅拌,得到溶液b;步骤c、采用透析袋或超滤技术对溶液b进行过滤,优选采用透析袋,然后冷冻干燥,得到高分子量透明质酸锌或低分子量透明质酸锌;其中,当制备高分子量透明质酸锌时,采用高分子量透明质酸钠为原料,当制备低分子量透明质酸锌时,采用低分子量透明质酸钠为原料。(9)根据上述(7)或(8)所述的方法,其中,在步骤3中,任选地加入海藻酸钠和芦荟提取液;和/或在步骤3中,所述灭菌处理为g60灭菌或高温高压灭菌,优选g60灭菌;优选地,所述灭菌处理如下进行:在10kgy剂量的g60辐射处理或者121℃高温高压下10~20分钟。(10)上述(1)至(6)之一所述医用凝胶或上述(7)至(9)之一所述方法得到的医用凝胶用于创面修复的应用。附图说明图1示出分别采用实施例1得到的凝胶、对比例1得到的凝胶以及生理盐水对大鼠创面进行修复的实验结果;图2示出分别采用实施例1得到的凝胶、对比例1得到的凝胶以及生理盐水对大鼠创面进行修复时,创面修复面积与修复时间的关系结果图。具体实施方式下面通过实施例和实验例对本发明进一步详细说明。通过这些说明,本发明的特点和优点将变得更为清楚明确。本发明一方面提供了一种医用凝胶,其中,基于1000重量份凝胶,其由包括以下重量配比的原料成分制成:其中,透明质酸锌是透明质酸与锌的结合而成,透明质酸是d-葡萄糖醛酸及n-乙酰葡萄糖胺组成的双糖单位,其具有较高临床价值。而透明质酸锌不仅具有透明质酸的优异性能,还具有利用锌离子调节细胞生长的功能,具体地,锌可以调整内皮细胞与血管生成相关的功能,同时可以刺激内皮细胞增殖,促进受伤的单层细胞修复。所述羟乙基纤维素具有增稠、保护水分的作用,所述尼泊金甲酯具有杀菌作用,所述甘油具有保湿的作用。在本发明中,采用高分子量透明质酸锌和低分子量透明质酸锌进行复配,协同作用。具体地,低分子量透明质酸锌可以调整内皮细胞与血管生成相关的功能;而高分子量透明质酸锌一方面在皮肤表面形成一层透气的薄膜,阻隔外来细菌侵入,保持创面湿度,另一方面,在创面处可被创面处的透明质酸酶缓慢降解为低分子量透明质酸锌,从而实现透明质酸锌的长效作用。在本发明中,引入的聚乙烯醇作为分散剂,可以防止高分子量透明质酸锌快速降低而实现在创面处缓慢降解,改善透明质酸锌的弱凝胶性和不易成型性。其中,所述低分子量透明质酸锌是指分子量在10000da以下的透明质酸锌,尤其是1000~10000da;所述高分子量透明质酸锌是指分子量在10000da以上的透明质酸锌。根据本发明一种优选的实施方式,基于1000重量份凝胶,所述凝胶由包括以下重量配比的原料成分制成:在进一步优选的实施方式中,基于1000重量份凝胶,所述凝胶由包括以下重量配比的原料成分制成:根据本发明一种优选的实施方式,所述高分子量透明质酸锌与所述低分子量透明质酸锌的重量比为(0.2~8):1。在进一步优选的实施方式中,所述高分子量透明质酸锌与所述低分子量透明质酸锌的重量比为(0.5~6):1。在更进一步优选的实施方式中,所述高分子量透明质酸锌与所述低分子量透明质酸锌的重量比为4:1。其中,高分子量透明质酸锌与低分子量透明质酸锌是协同作用,两者各自的用量均不能过多或过少,发明人经过大量实验后发现,最优选的方式是两者的重量比为4:1。根据本发明一种优选的实施方式,通过采用高分子量透明质酸钠和低分子量透明质酸钠分别与无机锌盐进行离子置换分别制备得到高分子量透明质酸锌和低分子量透明质酸锌。在进一步优选的实施方式中,高分子量透明质酸锌和低分子量透明质酸锌如下获得:步骤a、将高分子量透明质酸钠或低分子量透明质酸钠加入水中,任选搅拌,得到溶液a;步骤b、配制无机锌盐水溶液,并将其加入溶液a中,搅拌,得到溶液b;步骤c、采用透析袋或超滤技术对溶液b进行过滤,优选采用透析袋,然后冷冻干燥,得到高分子量透明质酸锌或低分子量透明质酸锌。其中,当制备高分子量透明质酸锌时,采用高分子量透明质酸钠为原料,当制备低分子量透明质酸锌时,采用低分子量透明质酸钠为原料。在本发明,将透明质酸钠的溶液与无机锌盐溶液混合,使钠离子与锌离子之间发生置换,得到透明质酸锌与无机钠盐,然后采用透析袋或超滤技术进行大分子物质与小分子物质的分离,这样,小分子无机钠盐几乎被100%过滤掉。而在现有技术中,采用在有机溶剂例如乙醇中过滤的方式进行大分子物质与小分子物质的分离,但是,这样处理效果非常差,产物中具有很高的无机钠盐残留。而残留的无机钠盐在后期凝胶制备中会破坏凝胶的形成,尤其是氯化钠。因此,当透明质酸锌用于凝胶时,必须采用高纯度透明质酸锌,否则,副产物无机钠盐(尤其氯化钠)会严重影响凝胶的形成。因此,发明人经过大量实验得到透明质酸锌的上述制备方法,已得到品质优良的透明质酸锌,应用于凝胶制备。根据本发明一种优选的实施方式,在步骤a中,得到的溶液a的质量浓度为0.05~1%,优选为0.05~0.5%,更优选为0.08~0.1.5%,例如0.1%。根据本发明一种优选的实施方式,在步骤b中,无机锌盐水溶液的浓度为0.1~5mol/l,优选为0.5~2mol/l,更优选为1mol/l。根据本发明一种优选的实施方式,在步骤a和步骤b中,透明质酸钠与无机锌盐的用量比为1:(5~25),优选为1:(8~20),更优选为1:(10~15),例如1:10。其中,在离子置换过程中,一个锌离子置换两个钠离子,在透明质酸锌制备时,使无机锌盐过量,尽量最大程度地进行离子置换,得到透明质酸锌。根据本发明一种优选的实施方式,在步骤b中,搅拌2~40h,优选搅拌10~30h,更优选搅拌15~25h。其中,在步骤b中,搅拌有利于促进离子置换,并且,搅拌时间较长时离子置换较优。根据本发明一种优选的实施方式,在步骤b中,所述无机锌盐包括氯化锌、硝酸锌和硫酸锌,例如氯化锌。根据本发明一种优选的实施方式,在步骤c中,采用分子量为1000的透析袋,即其可以截留住分子量1000以上的物质,而过滤掉分子量1000以下的物质。根据本发明一种优选的实施方式,在所述凝胶中任选地还包括海藻酸钠。其中,海藻酸钠为天然纤维素,并且,凝胶中透明质酸锌的锌离子会使海藻酸钠发生交联,提高凝胶的含水率,同时,进一步改善透明质酸锌的弱凝胶性,促进凝胶形成。因此,在本申请中,不仅利用了透明质酸锌中锌离子的调整内皮细胞与血管生成相关的功能,还利用其与海藻酸钠形成部分交联,促进凝胶形成。根据本发明一种优选的实施方式,基于1000重量份凝胶,所述海藻酸钠的用量为1~10重量份。在进一步优选的实施方式中,基于1000重量份凝胶,所述海藻酸钠的用量为2~5重量份,例如4重量份。其中,在本发明中,海藻酸钠的用量不宜太多,因为本申请所述凝胶为在创面处涂覆的凝胶,如果海藻酸钠加入量过多,形成的交联程度较大,这样,得到的凝胶强度过高,构架过于牢固,不易涂抹。因此,应该严格控制海藻酸钠的用量。发明人在经过大量实验后发现,海藻酸钠的用量优选2~5重量份。根据本发明一种优选的实施方式,在所述凝胶中任选地还包括芦荟提取液。在进一步优选的实施方式中,基于1000重量份凝胶,所述芦荟提取液的用量为1~10重量份。在更进一步优选的实施方式中,基于1000重量份凝胶,所述芦荟提取液的用量为2~8重量份,例如4~6重量份。其中,所述芦荟提取液中含有芦荟素a、创伤激素和聚糖肽甘露等具有抗病毒感染的成分,可以促进伤口愈合复原,并且可以减少疤痕残留。根据本发明一种优选的实施方式,在所述凝胶中任选地还包括尼泊金丙酯。在进一步优选的实施方式中,基于1000重量份凝胶,所述尼泊金丙酯的用量为0.02~0.8重量份。在更进一步优选的实施方式中,基于1000重量份凝胶,所述尼泊金丙酯的用量为0.05~0.4重量份,例如0.1~0.3。其中,所述尼泊金甲酯和尼泊金丙酯均为良好的抑菌剂,同时,两者之间具有复配作用,具体地,在两者的共同作用下,可杀铜绿色单假胞菌,而所述铜绿色单假胞菌容易引发伤口感染、脓肿,严重情况下,在烧伤后感染可引发死亡。因此,在本发明中,采用尼泊金甲酯和尼泊金丙酯作为复合抑菌剂。但是,由于尼泊金丙酯的水溶性稍微差一点,因此,在配方中加入甘油,可以促进尼泊金丙酯在水中的溶解。根据本发明一种优选的实施方式,在所述凝胶中任选地还包括生长因子,例如人碱性成纤维生长因子、人酸性成纤维生长因子和/或人血管内表皮生长因子。其中,人碱性成纤维生长因子可参与多种组织的创伤修复过程,是重要的创伤愈合因子之一,对烧伤、外伤及各种慢性难愈合创面具有显著的促修复作用,并且安全、有效、无不良反应;人酸性成纤维生长因子对深二度烧伤及削痂术后应用具有良好的促愈合作用;人血管内皮生长因子是已被证实是唯一对血管形成具有特异性的生长因子,其能促进血管内皮细胞的增值、迁移而调节、促进新生血管的形成,而创面新生血管的生长对于创伤的愈合、减少瘢痕组织的产生和减少感染的发生尤为重要,因此,在本发明中,还可以在凝胶中加入上述生长因子中的一种,或者是加入多种形成复合生长因子,用以促进创面愈合。在进一步优选的实施方式中,基于1000重量份凝胶,生长因子的总用量为0.03重量份。其中,生长因子总浓度应控制在30μg/g,与临床生长因子用药浓度接近,避免高浓度生长因子潜在的致癌性。根据本发明一种优选的实施方式,在所述凝胶中任选地还包括肝素钠和甘露醇。其中,所述肝素钠和甘露醇作为蛋白保护剂,用于保护生长因子的活性。甘露醇是生长因子稳定剂,而肝素钠是可以与生长因子结合的物质,其可以维持生长因子的生物活性、延缓生长因子的释放,实现控制缓释,防止生长因子从凝胶内快速释放。在进一步优选的实施方式中,基于1000重量份的凝胶,所述肝素钠的用量为0.02~0.2重量份,甘露醇的用量为5~20重量份。在更进一步优选的实施方式中,基于1000重量份的凝胶,所述肝素钠的用量为0.05~0.15重量份,例如0.1重量份,甘露醇的用量为5~15重量份,例如5重量份。其中,肝素钠和甘露醇作为蛋白保护剂,其用量不宜太少,太少不起作用,也不宜太多,太多可能会引起负效应,尤其是肝素钠,尤其其抗凝血性,因此,需要严重控制器剂量,防止副作用的产生。在本发明中,肝素钠可以分别与人碱性成纤维生长因子和人酸性成纤维生长因子形成稳定复合物,保持生长因子的生物活性,同时可以减缓生长因子的释放。具体地,肝素钠能够增强生长因子的有丝分裂促进活性,也能防止生长因子因酸或热而引起的失活,以及蛋白酶引起的降解,有效地保护生长因子的活性,稳定分子构象。在本发明中,人碱性成纤维生长因子和人酸性成纤维生长因子的总用量与肝素钠的用量比为(3~5):1,甘露醇浓度为0.5%~2%,在比例下生长因子有较好的稳定性。根据本发明一种优选的实施方式,所述凝胶于2~6℃保存。在进一步优选的实施方式中,所述凝胶于4℃保存。本发明另一方面提供了一种本发明第一方面所述凝胶的制备方法,所述方法如下进行:步骤1、将尼泊金甲酯加入水中,得到抑菌剂水溶液;步骤2、将高分子量透明质酸锌和低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;步骤3、再加入羟乙基纤维素、聚乙烯醇和甘油,搅拌,进行灭菌处理,得到所述凝胶。根据本发明一种优选的实施方式,在步骤1中,采用加热使尼泊金甲酯完全溶解。根据本发明一种优选的实施方式,在步骤1中,任选地加入尼泊金丙酯。在进一步优选的实施方式中,基于1000重量份凝胶,所述尼泊金丙酯的用量为0.02~0.8重量份。在更进一步优选的实施方式中,基于1000重量份凝胶,所述尼泊金丙酯的用量为0.05~0.4重量份,例如0.1~0.3。根据本发明一种优选的实施方式,在步骤2中,所述高分子量透明质酸锌和低分子量透明质酸锌分别通过高分子量透明质酸钠以及低分子量透明质酸锌与无机锌盐进行离子置换制备得到。在进一步优选的实施方式中,在离子置换之后采用透析袋或超滤技术对溶液b进行过滤得到。其中,当需要高分子量透明质酸锌时采用高分子量透明质酸钠为原料与无机锌盐进行离子置换,当需要低分子量透明质酸锌时采用低分子量透明质酸钠为原料与无机锌盐进行离子置换。这样,采用上述方法得到的高分子量透明质酸锌和低分子量透明质酸锌中均不含有小分子盐类残留,这样,不会对凝胶造成破坏。根据本发明一种优选的实施方式,在步骤3中,任选地加入海藻酸钠和芦荟提取液。根据本发明一种优选的实施方式,在步骤3中,所述灭菌处理为g60灭菌或高温高压灭菌,优选g60灭菌。在进一步优选的实施方式中,在步骤3中,所述灭菌处理如下进行:在10kgy剂量的g60辐射处理或者121℃高温高压下10~20分钟。其中,g60辐射灭菌或者高温高压灭菌后凝胶黏度均有一定程度下降,加入甘油对胶体还有一定的保护作用。根据本发明一种优选的实施方式,在步骤3之后,任选地进行步骤4和步骤5:步骤4、任选地将生长因子、肝素钠和甘露醇加入水中,然后过滤除菌,得到活性成分;步骤5、将步骤3得到的凝胶与步骤4得到的活性成分混合,搅拌。根据本发明一种优选的实施方式,在步骤5中,于无菌条件下进行。在进一步优选的实施方式中,在步骤5中,在搅拌后分装铝管,封口处理。在本发明中,若在所述凝胶中加入生长因子,则在制备时:先将生长因子与肝素钠和甘露醇混合,然后再于凝胶混合,这样的目的是先形成肝素钠/甘露醇-生长因子复合物。本发明第三方面提供了本发明第一方面所述凝胶或本发明第二方面所述制备方法得到的凝胶用于创面修复的应用。其中,所述凝胶可以用于创面修复,在短时间内实现创面愈合。本发明所具有的有益效果包括:(1)本发明所述凝胶采用低分子量透明质酸锌,利用了锌离子调节细胞生长的功能,同时采用高分子量透明质酸锌,利用创面处的透明质酸酶对其进行降解,缓慢降解为低分子量透明质酸锌,从而实现透明质酸锌的长效作用;(2)本发明所述凝胶中的高分子量透明质酸锌和低分子量透明质酸锌采用特殊方法制备,这样,其中不含有小分子盐类,不会对凝胶的形成造成任何影响;(3)本发明所述凝胶中含有海藻酸钠,不仅利用了海藻酸钠自身的特性,还巧妙地利用透明质酸锌的锌离子会使海藻酸钠发生交联的特性,进而提高凝胶的含水率,同时,进一步改善透明质酸锌的弱凝胶性,促进凝胶形成;(4)本发明所述凝胶中采用芦荟提取液,其中的芦荟素a、创伤激素和聚糖肽甘露等具有抗病毒感染的成分,可以促进伤口愈合复原,并且可以减少疤痕残留;(5)同时,本发明所述凝胶中任选地还包括生长因子,进一步促进创面愈合;(6)同时,本发明所述凝胶中任选地还含有肝素钠和甘露醇,可以保持生长因子的活性,并控制生长因子进行缓释;(7)本发明所述方法简单,易于实现。实施例以下通过具体实施例进一步描述本发明。不过这些实施例仅仅是范例性的,并不对本发明的保护范围构成任何限制。其中,在实施例中,所述人碱性成纤维生长因子、人酸性成纤维生长因子和人血管内表皮生长因子购于西格玛(sigma)。实施例1高分子量透明质酸锌的制备将1g分子量为70万da的透明质酸钠加入1000g水中,搅拌至溶解;将13.63g氯化锌加入水中定容至100ml,配制浓度为1mol/l的氯化锌水溶液,并将其加入透明质酸钠溶液中,搅拌24h;采用分子量为1000的透析袋进行过滤,然后冷冻干燥得到高分子量透明质酸锌。实施例2低分子量透明质酸锌的制备将1g分子量为5000da的透明质酸钠加入1000g水中,搅拌至溶解;将10g氯化锌加入水中定容至100ml,配制浓度为1mol/l的氯化锌水溶液,并将其加入透明质酸钠溶液中,搅拌24h;采用分子量为1000的透析袋进行过滤,然后冷冻干燥得到高分子量透明质酸锌。实施例3将1g尼泊金甲酯加入930g水中,得到抑菌剂水溶液;将20g高分子量透明质酸锌和5g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入5g羟乙基纤维素、5g聚乙烯醇和50g甘油,搅拌,然后进行10kgy辐射灭菌,得到所述凝胶。其中,凝胶外观无分层,涂感良好。实施例4将1.5g尼泊金甲酯加入920g水中,得到抑菌剂水溶液;将15g高分子量透明质酸锌和8g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入8g羟乙基纤维素、4g聚乙烯醇和60g甘油,搅拌,然后进行10kgy辐射灭菌,得到所述凝胶。其中,凝胶外观无分层,涂感良好。实施例5将0.5g尼泊金甲酯加入930g水中,得到抑菌剂水溶液;将10g高分子量透明质酸锌和10g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入4g羟乙基纤维素、8g聚乙烯醇和40g甘油,搅拌,然后进行10kgy辐射灭菌,得到所述凝胶。其中,凝胶外观无分层,涂感良好。实施例6将1g尼泊金甲酯和0.1g尼泊金丙酯加入950g水中,得到抑菌剂水溶液;将15g高分子量透明质酸锌和5g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入5g羟乙基纤维素、5g聚乙烯醇、4g海藻酸钠、6g芦荟提取液、20g甘油,搅拌,然后进行10kgy辐射灭菌,得到凝胶。其中,凝胶外观无分层,涂感优良,即该实施例得到的凝胶的涂感不仅良好,而且优于实施例3~5得到的凝胶的涂感。实施例7将1.5g尼泊金甲酯和0.2g尼泊金丙酯加入900g水中,得到抑菌剂水溶液;将8g高分子量透明质酸锌和8g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入4g羟乙基纤维素、4g聚乙烯醇、2g海藻酸钠、4g芦荟提取液、60g甘油,搅拌,然后进行10kgy辐射灭菌,得到凝胶。其中,凝胶外观无分层,涂感优良。实施例8将0.5g尼泊金甲酯和0.1g尼泊金丙酯加入920g水中,得到抑菌剂水溶液;将4g高分子量透明质酸锌和4g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入8g羟乙基纤维素、8g聚乙烯醇、5g海藻酸钠、8g芦荟提取液、40g甘油,搅拌,然后进行10kgy辐射灭菌,得到凝胶。其中,凝胶外观无分层,涂感优良。实施例9将1g尼泊金甲酯加入830g水中,得到抑菌剂水溶液;将5g高分子量透明质酸锌和5g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入5g羟乙基纤维素、5g聚乙烯醇和50g甘油,搅拌,然后进行10kgy辐射灭菌,得到所述凝胶;将15mg人碱性成纤维生长因子、15mg人血管内表皮生长因子、0.1g肝素钠和5g甘露醇加入100g水中溶解,然后过滤除菌,得到活性成分;于无菌条件下,将得到的凝胶与活性成分混合,搅拌均匀,分装铝管,封口,得到复合有生长因子的凝胶。其中,凝胶外观无分层,涂感良好。实施例10将1g尼泊金甲酯和0.2g尼泊金丙酯加入850g水中,得到抑菌剂水溶液;将5g高分子量透明质酸锌和5g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入5g羟乙基纤维素、5g聚乙烯醇、4g海藻酸钠、6g芦荟提取液、20g甘油,搅拌,然后进行10kgy辐射灭菌,得到凝胶;将15mg人碱性成纤维生长因子、15mg人酸性成纤维生长因子、0.15g肝素钠和15g甘露醇加入100g水中溶解,然后过滤除菌,得到活性成分;于无菌条件下,将得到的凝胶与活性成分混合,搅拌均匀,分装铝管,封口,得到复合有生长因子的凝胶。其中,凝胶外观无分层,涂感优良。实施例11将1.5g尼泊金甲酯和0.3g尼泊金丙酯加入800g水中,得到抑菌剂水溶液;将8g高分子量透明质酸锌和8g低分子量透明质酸锌加入步骤1得到的抑菌剂水溶液中,搅拌,得到凝胶前体;再加入4g羟乙基纤维素、4g聚乙烯醇、2g海藻酸钠、4g芦荟提取液、60g甘油,搅拌,然后进行10kgy辐射灭菌,得到凝胶;将10mg人碱性成纤维生长因子、10mg人酸性成纤维生长因子、10mg人血管内表皮生长因子、0.05g肝素钠和5g甘露醇加入100g水中溶解,然后过滤除菌,得到活性成分;于无菌条件下,将得到的凝胶与活性成分混合,搅拌均匀,分装铝管,封口,得到复合有生长因子的凝胶。其中,凝胶外观无分层,涂感优良。对比例对比例1重复实施例1过程,区别在于:采用等量的高分子量透明质酸钠替代高分子量透明质酸锌,等量的低分子量海藻酸钠替代低分子量透明质酸锌。对比例2重复实施例6的过程,区别在于:海藻酸钠的用量为20g。发现得到的凝胶强度增大,但是不宜涂抹于创面上。分析原因在于,海藻酸钠用量过多时,凝胶中的锌离子与其形成交联程度过大,导致不宜涂抹。对比例3重复实施例1过程,区别在于:采用等量的卡波姆替换羟乙基纤维素,得到凝胶。实验例实施例1凝胶稳定性检测将实施例1和对比例3制得的凝胶分别装于试管内,密封后放置4℃下,分别于1周、2周、4周、6周和8周检测凝胶的外观、ph值、黏度、涂感。其中,实施例1得到的凝胶检测结果如表1所示,对比例3得到的凝胶检测结果如表2所示。表1:凝胶外观ph值是否分层涂感黏度一周澄清透明5.9否良好32153mp.s二周澄清透明5.9否良好31969mp.s四周澄清透明5.9否良好30215mp.s六周澄清透明5.9否良好29135mp.s表2:凝胶外观ph值是否分层涂感黏度一周澄清透明6.2否良好30321mp.s二周澄清透明6.2否良好29635mp.s四周澄清透明6.2否良好25319mp.s六周有杂质6.0否较稀20135mp.s由上表可以看出,相较于对比例3得到的凝胶,本发明所述凝胶具有更好的稳定性。实验例2大鼠创面修复实验将大鼠背部皮肤剃毛,先用记号笔画圈,然后用剪刀剪皮肤,形成直径约12mm的圆形创面,采用暴露疗法,每天进行创面消毒和分别采用实施例1得到的凝胶、对比例1得到的凝胶以及生理盐水处理,观察大鼠皮肤愈合情况。每组10只重复。创面修复情况分别如图1和图2所示。其中,在图1和图2很明显可以看出,在三组实验中,采用本发明实施例1得到的凝胶对创面修复最有效:(1)采用对比例1得到的凝胶对创面的修复由于采用生理盐水对创面的修复;(2)而采用本发明实施例1得到的凝胶对创面的修复又明显优于对比例1得到的凝胶对创面的修复。分析原因在于:实施例1采用的是高分子量透明质酸锌与低分子量透明质酸锌复合使用;而对比例1采用的是高分子量透明质酸钠与低分子量透明质酸钠复合使用,其虽然也是采用高分子量与低分子量复合使用,但是,透明质酸锌的效果明显高于透明质酸钠。以上结合优选实施方式和范例性实例对本发明进行了详细说明。不过需要声明的是,这些具体实施方式仅是对本发明的阐述性解释,并不对本发明的保护范围构成任何限制。在不超出本发明精神和保护范围的情况下,可以对本发明技术内容及其实施方式进行各种改进、等价替换或修饰,这些均落入本发明的保护范围内。本发明的保护范围以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1