一种艾塞那肽口服纳米颗粒的制作方法
本发明涉及药物制剂领域,具体涉及含有艾塞那肽的口服纳米粒及其制备方法。
背景技术:
糖尿病是一种以慢性高血糖为特征的全身代谢性疾病,表现为胰岛素分泌缺陷或胰岛素生物作用出现障碍。据统计,目前全球范围内约有1.4亿糖尿病患者,而由于人口老龄化,肥胖发病率增加等因素,估计在2025年全球糖尿病患者将达到3亿。i型糖尿病,其特征是胰岛素分泌能力降低或彻底丧失,临床治疗需每天皮下注射胰岛素;ii型糖尿病,其特征是人体无法有效利用胰岛素,糖尿病患者中有90%是ii型糖尿病。
艾塞那肽是一种全新类型的ii型糖尿病治疗药物,是目前唯一可以帮助ii型糖尿病患者同时控制血糖和体重的治疗药物。艾塞那肽作为多肽类药物,目前临床上常用的给药方式为皮下注射给药,艾塞那肽注射液(百泌达
口服途径是目前应用最广、更加方便的给药方式,但是口服给药经过胃肠道吸收,胃肠道不仅起着吸收水分、营养物质和电解的作用,同时还是机体抵抗外源异物的第一道有效屏障。因此蛋白多肽类药物的口服给药研究十分具有挑战性。艾塞那肽等蛋白多肽类药物经口服给通常会在胃肠道中被降解破坏,同时小肠上皮会阻碍药物的吸收。由于以上原因,使得蛋白多肽类药物口服生物利用度低,大多数蛋白质多肽类药物很少或不能经胃肠道吸收,限制了其临床应用。如果艾塞那肽可以口服给药,可以极大地提高患者顺应性,而且生产过程无菌要求较低,可以降低生产成本。因此,为了扩大艾塞那肽制剂的临床应用,急需开发一种给药更加方便的艾塞那肽口服制剂。
技术实现要素:
本发明提供了一种艾塞那肽口服纳米粒,纳米粒由聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物包裹艾塞那肽再和fc抗体片段(-sh)结合。fc抗体片段(-sh)与高分子聚合物发生迈克尔加成反应修饰纳米粒,从而提高纳米粒在小肠部位的吸收效率,提高艾塞那肽的口服生物利用度。
本发明提供的一种艾塞那肽纳米粒,所述纳米粒中艾塞那肽包裹在聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物中形成纳米粒,艾塞那肽与聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物,重量比为1:50~1:1,优选1:16.7。
本发明所述的纳米粒,可以是艾塞那肽的聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物形成的纳米粒与fc抗体片段结合形成,艾塞那肽的聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物纳米粒与fc抗体片段的摩尔比比为100:1~30:1,优选60:1。
本发明所述艾塞那肽口服纳米粒采用下述方法制备:称取艾塞那肽和聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物,用有机溶剂溶解聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物,得到的油相加入到艾塞那肽粉末中,超声得到初乳,将初乳加入到pva溶液中,超声得到复乳,将复乳加入pva溶液中搅拌,挥发有机溶剂,获得纳米粒,将制备的纳米粒浓缩,将浓缩的纳米粒与fc抗体片段在氮气下以反应,使用葡聚糖g50柱分离靶纳米颗粒和游离的lmwp,获得fc抗体片段结合的艾塞那肽peg-plga纳米粒。
所述制备方法中,有机溶剂为丙酮和二氯甲烷的混合溶液,优选丙酮:二氯甲烷1:1混合溶液,优选所述艾塞那肽与聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物的重量比为1:16.7,优选艾塞那肽的聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物纳米粒与fc抗体片段的摩尔比为60:1。优选所述聚乳酸-羟基乙酸共聚物(plga)或其改构的高分子聚合物为mpeg-plga:peg-plga-mal,优选聚合物的比例为9:1。
所述艾塞那肽口服纳米粒以口服制剂形式存在,所述口服制剂可以采用药学常规方法制备得到,优选肠溶胶囊。
附图说明
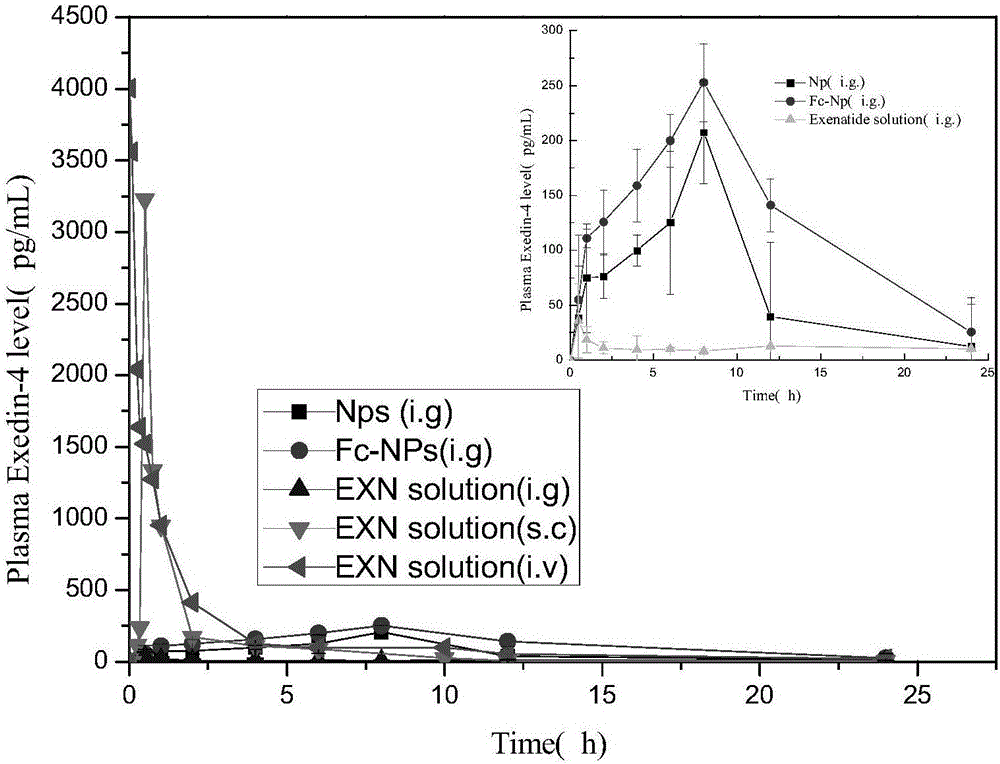
图1:5种制剂的体内生物利用度比较图
图2:5种制剂的降血糖结果比较图
具体实施方式
下面通过实施例对本发明加以进一步的说明,但不以任何形式限制本发明。
实施例1油相为二氯甲烷制备的艾塞那肽口服纳米粒
取30.06mg的plga-mpeg和3.34mg的plga-peg-mal(分子量为20000)溶于二氯甲烷(2ml),作为油相。取800ul2.5mg·ml-1的艾塞那肽水溶液,加入油相超声形成初乳,超声功率为300w,超声时间为100s。再加入4ml3%pva外水相超声形成复乳。最后在冰水浴、500rpm的转速下,滴加到40ml0.5%pva的超纯水中。挥发有机溶剂约5h。纳米粒过0.45um水膜,测得粒径为220nm,测得包封率67%。
实施例2油相为丙酮制备的艾塞那肽口服纳米粒
取30.06mg的plga-mpeg和3.34mg的plga-peg-mal(分子量为20000)溶于丙酮(2ml),作为油相。取800ul2.5mg·ml-1的艾塞那肽水溶液,加入油相超声形成初乳,超声功率为300w,超声时间为100s。再加入4ml3%pva外水相超声形成复乳。最后在冰水浴、500rpm的转速下,滴加到40ml0.5%pva的超纯水中。挥发有机溶剂约5h。纳米粒过0.45um水膜,测得粒径为150nm,测得包封率54%。
实施例3油相为丙酮和二氯甲烷(3:1)制备的艾塞那肽口服纳米粒
取30.06mg的plga-mpeg和3.34mg的plga-peg-mal(分子量为20000)溶于丙酮(1.5ml)和二氯甲烷(0.5ml)的混合溶剂,作为油相。取800ul2.5mg·ml-1的艾塞那肽水溶液,加入油相超声形成初乳,超声功率为300w,超声时间为100s。再加入4ml3%pva外水相超声形成复乳。最后在冰水浴、500rpm的转速下,滴加到40ml0.5%pva的超纯水中。挥发有机溶剂约5h。纳米粒过0.45um水膜,测得粒径为170nm,测得包封率52%。
实施例4油相为丙酮和二氯甲烷(1:1)制备的艾塞那肽口服纳米粒
取30.06mg的plga-mpeg和3.34mg的plga-peg-mal(分子量为20000)溶于丙酮(1.0ml)和二氯甲烷(1.0ml)的混合溶剂,作为油相。取800ul2.5mg·ml-1的艾塞那肽水溶液,加入油相超声形成初乳,超声功率为300w,超声时间为100s。再加入4ml3%pva外水相超声形成复乳。最后在冰水浴、500rpm的转速下,滴加到40ml0.5%pva的超纯水中。挥发有机溶剂约5h。纳米粒过0.45um水膜,测得粒径为139nm,测得包封率88%。
实施例5制备艾塞那肽peg-plga纳米粒
称取mpeg-plga(5,000–20,000da,50:50la:ga,w/w):peg-plga-mal(5,000–20,000da,50:50la:ga,w/w)比例为9:1共16.7mg高分子聚合物,用丙酮:二氯甲烷1:1(各0.5ml)溶解,得到油相,加入400ul艾塞那肽2.5mg/ml中,300w超声30s得到w/o初乳,将初乳加入到1%的pva溶液中,冰水浴中300w超声100s得到w/o/w复乳,将复乳加入1%pva溶液中磁力搅拌,挥发有机溶剂丙酮和二氯甲烷。测定纳米粒的包封率为85.07%。
实施例6制备艾塞那肽peg-plga纳米粒
称取mpeg-plga(5,000–20,000da,50:50la:ga,w/w):peg-plga-mal(5,000–20,000da,50:50la:ga,w/w)比例为9:1共16.7mg高分子聚合物,用丙酮:二氯甲烷1:1(各0.5ml)溶解,得到油相,加入800ul艾塞那肽2.5mg/ml中,300w超声30s得到w/o初乳,将初乳加入到1%的pva溶液中,冰水浴中300w超声100s得到w/o/w复乳,将复乳加入1%的pva溶液中磁力搅拌,挥发有机溶剂丙酮和二氯甲烷,测定纳米粒的包封率为67.70%.
实施例7制备艾塞那肽纳米粒
称取mpeg-plga(5,000–20,000da,50:50la:ga,w/w):peg-plga-mal(5,000–20,000da,50:50la:ga,w/w)比例为9:1共16.7mg高分子聚合物,用丙酮:二氯甲烷1:1(各0.5ml)溶解,得到油相,加入200ul艾塞那肽2.5mg/ml中,300w超声30s得到w/o初乳,将初乳加入到1%的pva溶液中,冰水浴中300w超声100s得到w/o/w复乳,将复乳加入1%的pva溶液中磁力搅拌,挥发有机溶剂丙酮和二氯甲烷,测定纳米粒的包封率为57.90%.
实施例8艾塞那肽单克隆抗体fc修饰的口服纳米粒
单克隆抗体fc巯基化:取1ml的1.5mg/ml的fc与41.85ul的1mg/ml的traut’s试剂反应,过g-25葡聚糖凝胶色谱柱,使用bca蛋白浓度检测试剂盒检测分离出游离的fc,得到巯基化的fc单克隆抗体。
浓缩前述实施例制备的纳米粒约1ml,然后以摩尔比plga-peg-mal:fc=60:1的比例与166ug的巯基化fc在避光、充氮气、冰水浴的条件下反应1h。然后使用100k超滤管浓缩、洗涤纳米粒三次,去除游离的巯基化fc单克隆抗体,得到fc单克隆抗体修饰的艾塞那肽纳米粒。
试验例1:体内生物利用度研究试验
实验动物:六周龄的db/db小鼠30只,随机分为5组,每组6只,雌雄各半,体重40-45g。单次给药:
(1)100μg/kg给予制备口服exenatide溶液组,口服给药组;
(2)100μg/kg给予实施例8制备的exenatide-fc靶向纳米粒,口服给药组;
(3)100μg/kg给予实施例5制备的exenatide纳米粒组,口服给药组;
(4)100μg/kg给予制备的exenatide溶液:静脉给药组;
(5)100μg/kg给予制备的exenatide溶液:皮下给药组;
分别在给药后0min,1min,5min,15min,20min,30min,45min,1h,2h,4h,6h,8h,12h,24h,取血,测试。
表1:不同制剂生物利用度研究结果
结果分析:艾塞那肽不同制剂的药释曲线和药物动力学参数见图1和表1,艾塞那肽(口服)组检出的艾塞那肽一直很低,艾塞那肽(sc)组在0.5h达到最大血浆浓度。给药4小时后,艾塞那肽在血浆中检测到含量已很低,而fc-exenatide-np可以延长艾塞那肽的体内半衰期,尽管最大血浆浓度较低,但在纳米颗粒施用8小时后达到最大血浆浓度,并且在12小时仍然检测到较高含量的艾塞那肽。与艾塞那肽(口服)组相比,艾塞那肽纳米粒显着增加了艾塞那肽在胃肠道中的血浆浓度,从而提高了口服艾塞那肽的相对生物利用度。
试验例2:降低血糖试验
实验动物:六周龄的db/db小鼠30只,随机分为5组,每组6只,雌雄各半,体重40-45g。单次给药:
(1)100μg/kg给予实施例5制备的exenatide纳米粒组:,口服给药组;
(2)100μg/kg给予实施例8制备的exenatide-fc靶向纳米粒,口服给药组;
(3)100μg/kg给予口服exenatide溶液,口服给药组;
(4)等体积的生理盐水口服给药组。
(5)10ug/kgexenatide皮下注射组:
分别在给药后0min,1h,2h,4h,6h,8h,10h,12h,24h,48h从尾部收集血液,用血糖计(roche血糖仪,上海)测定血糖值。
表2:单次给药后测定的血糖值
结果分析:艾塞那肽不同制剂的降低血糖结果见图2和表2,(1)纳米粒组相比生理盐水组、口服艾塞那肽组都有降血糖优势;(2)皮下注射给药组血糖水平有一个明显的下降再回升的过程,1h最低,约10h恢复给药前水平;(3)fc靶向组相比普通纳米粒有更明显降血糖优势,24h内都平稳降低血糖,(4)fc靶向组相比其他纳米粒组降血糖效果明显。
- 还没有人留言评论。精彩留言会获得点赞!