可用于过敏反应治疗的细菌菌株的选择的制作方法
本实施方案一般地涉及细菌菌株的选择,具体地涉及可用于预防、抑制和/或治疗过敏反应的细菌菌株的选择,及其用途。
背景
过敏反应,也称为过敏性的反应或疾病,为免疫系统对环境中的某物的超敏性引起的许多病况。过敏反应包括,例如,过敏性鼻炎(也称为花粉热)、食物过敏反应、特应性皮炎(也称为特应性湿疹)、过敏性哮喘和过敏性反应(anaphylaxis)。症状一般根据过敏反应的类型而不同。例如,食物过敏反应,其为对食物的异常免疫应答,可引起范围从轻微到严重瘙痒、舌肿胀、呕吐、腹泻、荨麻疹、呼吸困难或低血压的体征和症状。这通常在暴露数分钟到数小时内发生。当症状严重时其称为过敏性反应。
常见的过敏原,即,产生异常剧烈的免疫应答(其中免疫系统对抗察觉到的威胁,所述威胁否则将会对身体有害)的抗原,尤其包括花粉和食物。潜在的机制涉及免疫球蛋白e抗体(ige)结合过敏原,然后结合在肥大细胞或嗜碱粒细胞上的受体,在该处其触发炎性化学物质(例如组胺)的释放。
当前用于过敏反应的治疗包括避免已知的过敏原和使用药物,例如抗组胺。抗组胺为对抗体内组胺受体的活性的药剂。抗组胺根据其作用的组胺受体进行亚分类。两个最大类的抗组胺为h1-抗组胺和h2-抗组胺。靶向组胺h1-受体(h1r)的抗组胺主要用于治疗过敏性的反应。靶向组胺-h2受体(h2r)的抗组胺用于治疗胃肠系统的病况。
一些较老的抗组胺药物类型受副作用,例如嗜睡和协调性降低困扰。同样,较新的抗组胺药物类型可能具有不想要的副作用,例如口干和头痛。因此,存在进一步改进新方法以治疗和预防过敏反应的空间。
人和其它哺乳动物的身体的各种位置居住许多不同种类的细菌,包括许多不同种类的乳酸细菌。这样的细菌常常与其宿主共存,给予各种类型的协同有益效果,现今也已知为多样化的并且取决于实际的细菌菌株。根据美国粮食和农业组织(fao)和世界卫生组织(who)当前采用的定义,益生菌为“当以足够的量给予时赋予宿主健康益处的活微生物”。现今,许多不同的细菌用作益生菌,例如产乳酸细菌,例如乳杆菌属(lactobacillus)和双歧杆菌属(bifidobacteria)的菌株。
已知的乳酸细菌的一个实例为罗伊氏乳杆菌(lactobacillusreuteri),其为共生的肠内厚壁菌门,以及各种鸟类和哺乳动物物种的胃肠道内广泛流行的益生菌。该生物被认为是公认安全(gras)的和有益的微生物,并且已经在全球用作益生菌近乎20年。罗伊氏乳杆菌已经报道在不同的啮齿类模型中抑制肠上皮细胞、单核细胞和肠炎症中的促炎细胞因子。
lee等人(2004)公开了通过促进th1细胞的细胞因子例如il-2同时抑制th2细胞的细胞因子例如il-4和il-5,乳酸细菌可用作口服的过敏反应治疗方式。
概述
一般目标为选择可用于预防、抑制和/或治疗过敏反应的细菌菌株。
实施方案的一个方面涉及一种用于选择用于在哺乳动物中预防、抑制和/或治疗过敏反应的细菌菌株的方法。所述方法包括筛选细菌菌株产生二酰甘油激酶(dagk)的能力。所述方法还包括选择能够产生dagk的细菌菌株,用于在哺乳动物中预防、抑制和/或治疗过敏反应。
实施方案的另一个方面涉及能够产生dagk的细菌菌株,用于在哺乳动物中预防、抑制和/或治疗过敏反应,附带条件为所述细菌菌株不选自罗伊氏乳杆菌菌株atccpta-6475和罗伊氏乳杆菌菌株atccpta-4659。
实施方案的进一步的方面涉及一种在哺乳动物中预防、抑制和/或治疗过敏反应的方法。所述方法包括给予患有或有风险发展过敏反应的哺乳动物能够产生dagk的细菌菌株,附带条件为所述细菌菌株不选自罗伊氏乳杆菌菌株atccpta-6475和罗伊氏乳杆菌菌株atccpta-4659。
实施方案的额外的方面包括用于在哺乳动物中预防、抑制和/或治疗过敏反应的罗伊氏乳杆菌dsm32273、用于在哺乳动物中预防、抑制和/或治疗食物过敏反应的罗伊氏乳杆菌atccpta-6475、用于在哺乳动物中预防、抑制和/或治疗食物过敏反应的罗伊氏乳杆菌atccpta-4659和用于在哺乳动物中预防、抑制和/或治疗过敏反应的发酵乳杆菌(l.fermentum)atcc14931。
实施方案的另一个方面涉及包含能够产生dagk的细菌菌株和h1-抗组胺的抗过敏反应组合物。
进一步的方面涉及上述抗过敏反应组合物,其用作药剂和用于在哺乳动物中预防、抑制和/或治疗过敏反应。
实施方案的产生dagk的细菌菌株能够终止h1r信号传导途径中的二酰甘油(dag)信号传导。因此,过敏性反应中释放的组胺被抑制经由h1r信号传导途径诱导其促炎作用,但仍能够经由h2r信号传导途径诱导其抗炎作用。
附图简述
实施方案,连同其进一步的目标和优点,可通过参考下列描述连同附图,得到最好理解,在附图中:
图1为说明根据一个实施方案用于选择用于在哺乳动物中预防、抑制和/或治疗过敏反应的细菌菌株的方法的流程图。
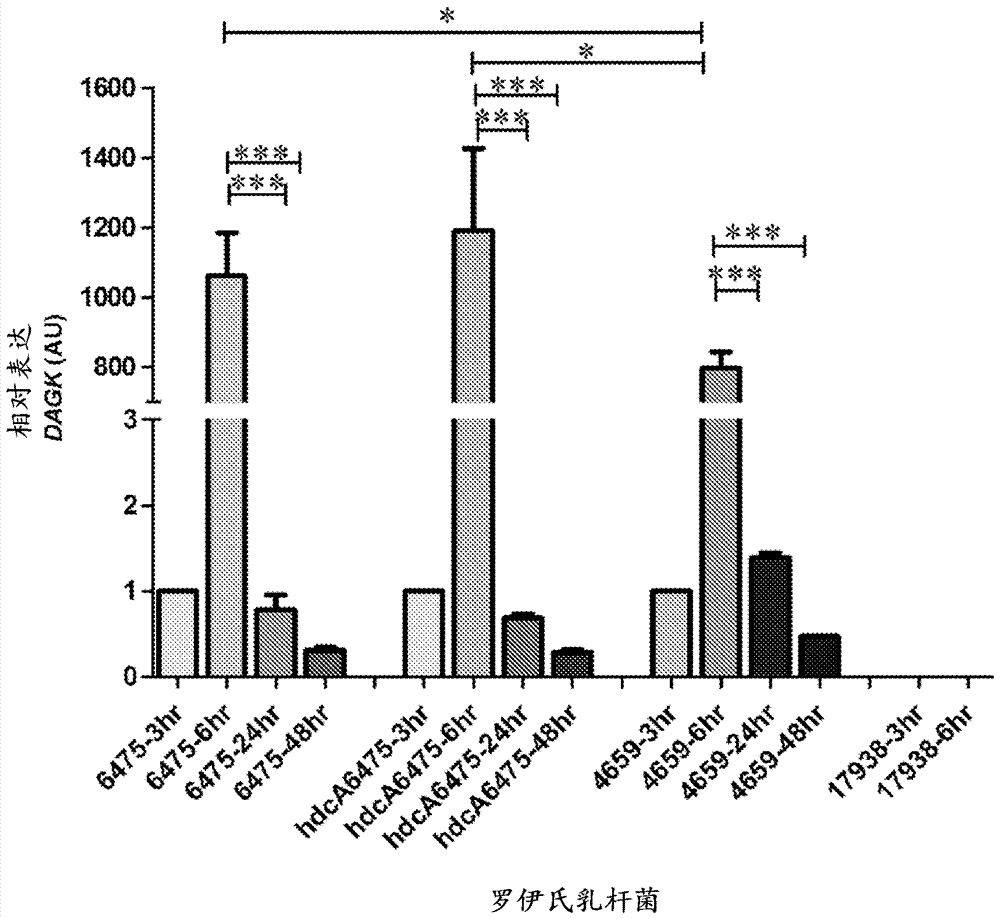
图2说明罗伊氏乳杆菌野生型(wt)和hdca突变体atccpta-6475和atccpta-4659产生dagk。对管家基因rpob归一化的相对mrna靶基因表达水平从每一细菌的3、6、24和48小时培养物提供。将从每一细菌的3小时培养物获得的mrna设置为1.0并用作校准器来鉴定相对的mrna倍数差异。
图3说明罗伊氏乳杆菌dagk氨基酸序列(seqidno:13)。罗伊氏乳杆菌dagk的氨基酸序列与胰蛋白酶切割位点(垂直线)一起显示。粗体氨基酸表示在这样的胰蛋白酶处理之后获得的肽序列。黑色条指示lc-ms/ms实验中发现的肽序列。
图4说明罗伊氏乳杆菌dagk氨基酸序列(seqidno:13)。粗体氨基酸指示获得的肽序列。黑色条指示lc-ms/ms实验中发现的肽序列。
图5说明市售可得的dagk抑制剂(dgkinhi)在小鼠肠类器官(enteroids)中阻止罗伊氏乳杆菌衍生的dagk介导的蛋白激酶c(pkc)磷酸化。(a)说明蛋白质印迹分析,其显示从用仅培养基对照(ldm-4)、wtlr(ldm4中生长的wtlr)、dagk抑制剂和dagk抑制剂连同wtlr处理45min的10周龄无菌(gf)雄性小鼠的小鼠回肠肠类器官分离的蛋白,其靶向哺乳动物磷酸化的pkc(ppkc)。将10µg蛋白上样到sds凝胶的每一孔。ppkc合成率通过image-j分析获得,其中将dagk抑制剂处理的组的ppkc设置为1并用作基线。(b)n=3的平均值,显示ppkc蛋白浓度(上样10µg)并通过密度测定使用image-j定量。将gf对照组设置为1。*p<0.05,**p<0.01,***p<0.001。n=10只小鼠/组。单向方差分析,并伴随bonferroni校正。
详述
本实施方案一般地涉及细菌菌株的选择,具体地涉及可用于预防、抑制和/或治疗过敏反应的细菌菌株的选择,及其用途。
与传统的抗组胺方法相比,本实施方案采取在过敏反应预防和治疗领域中根本不同的方法。与现有技术形成鲜明对比,本实施方案基于选择和使用在预防、抑制和/或治疗过敏反应中有益的细菌菌株。根据本实施方案选择和使用的细菌菌株能够产生二酰甘油激酶(dagk)。
dagk为利用腺苷三磷酸(atp)作为磷酸源催化二酰甘油(dag)转化为磷脂酸(pa)的酶。在非刺激的细胞中,dagk活性低,允许dag用于甘油磷脂生物合成。然而,在磷酸肌醇途径的受体活化时,dagk活性增加,驱动dag向pa转化。dag向pa的转化耗尽dag,后者否则可活化蛋白激酶c(pkc)。
组胺h1-受体(h1r)下游信号传导通过抑制信号传导中涉及的脂质dag,被dagk合成中断。因此,如本文所公开的产dagk细菌菌株抑制所释放的组胺的促炎作用。这继而仅允许由于过敏性反应产生的组胺活化组胺h2-受体(h2r)。这种h2r活化促进抗炎症状。
因此,能够产生dagk的细菌菌株引起h1r下游信号传导的抑制,但另一方面,过敏性反应释放的组胺诱导h2r活化,这组合抑制组胺的促炎作用和促进抗炎和抗过敏症状。
在细菌中,酶dagk由基因dagk表达。
图1为说明用于选择用于在哺乳动物中预防、抑制和/或治疗过敏反应的细菌菌株的方法的流程图。所述方法包括在步骤s1中,筛选细菌菌株产生dagk的能力。所述方法还包括在步骤s2中,选择能够产生dagk的细菌菌株,用于在哺乳动物中预防、抑制和/或治疗过敏反应。
图1中所示的方法因此可用于鉴定和选择可用于在哺乳动物中预防、抑制和/或治疗过敏反应的细菌菌株。选择标准为产生酶dagk的能力,如上文所提及的,该酶抑制由于过敏性反应释放的组胺的促炎作用和促进所释放的组胺的抗炎作用。
在一个实施方案中,图1中的步骤s2包括选择能够产生dagk和能够胞外释放dagk的细菌菌株。因此,在该实施方案中,步骤s2中选择的细菌菌株不仅能够产生dagk,而且制造可溶性dagk,其也可在胞外,即所选择的细菌菌株的细胞外部获得。这意指细菌菌株能够分泌或以其它方式胞外释放dagk。
在一个实施方案中,筛选细菌菌株产生dagk的能力通过检测细菌菌株中(在其基因组中或在表达盒例如质粒中)编码二酰甘油激酶的基因,例如dagk基因的存在情况评估。在这样的实施方案中,图1的步骤s1包括筛选细菌菌株编码dagk的基因例如dagk基因的存在情况。在该实施方案中,步骤s2包括选择包含编码dagk的基因例如dagk基因的细菌菌株。
在一个具体的实施方案中,细菌菌株包含编码dagk的活性基因。关于基因的活性意味着编码dagk的基因受细菌菌株中的组成型启动子或受细菌菌株中的诱导型启动子(即在细菌菌株中可被活化或诱导的启动子)控制。
多种技术可用于检测编码dagk的基因的存在情况。非限制性,但说明性的技术包括聚合酶链反应(pcr),其使用与编码dagk的基因的部分互补或与编码dagk的基因的启动子互补的引物,以扩增和检测编码dagk的基因、其部分、基因的启动子或其部分所对应的扩增的脱氧核糖核酸(dna)序列的存在情况。具体地,定量聚合酶链反应(qpcr)可用于检测编码dagk的基因的存在情况。其它技术涉及各种dna测序技术。
在另一个实施方案中,筛选细菌菌株产生dagk的能力通过检测,例如在细菌细胞的胞质溶胶中,或如果细菌菌株额外地能够分泌或胞外释放dagk,则在培养细菌菌株的培养基中dagk酶的存在情况评估。在该实施方案中,图1的步骤s1包括筛选细菌菌株dagk在细菌菌株的胞质溶胶中的存在情况和/或dagk在培养细菌菌株的各自的培养基中的存在情况。在该实施方案中,步骤s2包括选择i)在其胞质溶胶中包含dagk的细菌菌株,和/或ii)在培养细菌菌株的培养基中包含dagk的细菌菌株。
存在多种技术可用于检测细菌细胞的胞质溶胶和/或培养基中dagk的存在情况。非限制性,但说明性的技术包括使用抗dagk抗体,例如在酶联免疫吸附测定(elisa)中;蛋白质谱,例如肽质量指纹法,其通过基质辅助激光解吸/电离(maldi)飞行时间(tof)和电喷射离子化(esi)tof补充串联质谱(ms/ms)分析进行;免疫电泳等。
在一个实施方案中,在图1的方法中筛选和选择的细菌菌株为公认安全(gras)的细菌菌株。因此,当给予哺乳动物以预防、抑制和/或治疗过敏反应时,细菌菌株应优选不引起任何疾病或有害病况。因此,根据图1的方法选择的细菌菌株优选为非致病的细菌菌株。这样的gras细菌菌株因此优选为所谓的有益微生物。gras的细菌菌株的具体实例为益生菌细菌,例如非致病的益生菌细菌。因此,在一个实施方案中,图1中的步骤s1包括筛选益生菌细菌菌株产生dagk的能力并且步骤s2包括选择能够产生dagk的益生菌细菌菌株。
在一个实施方案中,细菌菌株为乳酸细菌菌株。在这样的实施方案中,步骤s1包括筛选乳酸细菌菌株产生dagk的能力。相应地,步骤s2包括选择能够产生dagk的乳酸细菌菌株。
乳酸细菌,也称为乳杆菌目(lactobacillales),为革兰氏阳性、低gc、酸耐受、一般不产生孢子、不呼吸的杆形或球形细菌的一个进化枝,其享有共同的代谢和生理特征。这些细菌产生乳酸作为碳水化合物发酵的主要代谢终产物。包含乳酸细菌的属包括乳杆菌属(lactobacillus)、明串珠菌属(leuconostoc)、片球菌属(pediococcus)、乳球菌属(lactococcus)和链球菌属(streptococcus)。乳酸细菌也可存在于其它属中,例如,气球菌属(aerococcus)、肉杆菌属(carnobacterium)、肠球菌属(enterococcus)、酒球菌属(oenococcus)、芽孢乳杆菌属(sporolactobacillus)、四联球菌属(tetragenococcus)、漫游球菌属(vagococcus)和魏斯氏菌属(weissella)。
链球菌属中特别优选的细菌物种包括唾液链球菌(streptococcussalivarius)和嗜热链球菌(streptococcustermophilus)。
在一个具体的实施方案中,所述细菌菌株为唾液链球菌或嗜热链球菌菌株。在该实施方案中,图1的步骤s1包括筛选唾液链球菌或嗜热链球菌菌株产生dagk的能力,和相应地,步骤s2包括选择能够产生dagk的唾液链球菌或嗜热链球菌菌株。
在一个具体的实施方案中,步骤s2包括选择能够产生dagk的唾液链球菌或嗜热链球菌菌株,用于在哺乳动物中预防、抑制和/或治疗花粉过敏反应。
当前优选的属为乳杆菌属。
乳杆菌属包括若干物种,包括耐酸乳杆菌(l.acetotolerans)、l.acidifarinae、l.acidipiscis、嗜酸乳杆菌(l.acidophilus)、敏捷乳杆菌(l.agilis)、l.algidus、消化乳杆菌(l.alimentarius)、解淀粉乳杆菌(l.amylolyticus)、嗜淀粉乳杆菌(l.amylophilus)、l.amylotrophicus、食淀粉乳杆菌(l.amylovorus)、动物乳杆菌(l.animalis)、l.antri、l.apodemi、鸟乳杆菌(l.aviaries)、双发酵乳杆菌(l.bifermentans)、短乳杆菌(l.brevis)、布赫内氏乳杆菌(l.buchneri)、l.camelliae、干酪乳杆菌(l.casei)、链状乳杆菌(l.catenaformis)、l.ceti、l.coleohominis、丘状菌落乳杆菌(l.collinoides)、l.composti、l.concavus、棒状乳杆菌(l.coryniformis)、卷曲乳杆菌(l.crispatus)、l.crustorum、弯曲乳杆菌(l.curvatus)、德氏乳杆菌保加利亚亚种(l.delbrueckiisubsp.bulgaricus)、德氏乳杆菌德氏亚种(l.delbrueckiisubsp.elbrueckii)、德氏乳杆菌乳亚种(l.delbrueckiisubsp.lactis)、糊精乳杆菌(l.dextrinicus)、l.diolivorans、l.equi、l.equigenerosi、l.farraginis、香肠乳杆菌(l.farciminis)、发酵乳杆菌、l.fornicalis、食果糖乳杆菌(l.fructivorans)、l.frumenti、l.fuchuensis、鸡乳杆菌(l.gallinarum)、加氏乳杆菌(l.gasseri)、l.gastricus、l.ghanensis、草乳杆菌(l.graminis)、l.hammesii、哈氏乳杆菌(l.hamster)、l.harbinensis、l.hayakitensis、瑞士乳杆菌(l.helveticus)、希氏乳杆菌(l.hilgardii)、同型腐酒乳杆菌(l.homohiochii)、l.iners、l.ingluviei、肠乳杆菌(l.intestinalis)、詹氏乳杆菌(l.jensenii)、约翰逊乳杆菌(l.johnsonii)、l.kalixensis、马乳酒样乳杆菌(l.kefiranofaciens)、高加索酸奶乳杆菌(l.kefiri)、l.kimchi、l.kitasatonis、l.kunkeei、l.leichmannii、林氏乳杆菌(l.lindneri)、坏发酵乳杆菌(l.malefermentans)、马里乳杆菌(l.mali)、l.manihotivorans、l.mindensis、粘膜乳杆菌(l.mucosae)、鼠乳杆菌(l.murinus)、l.nagelii、l.namurensis、l.nantensis、l.oligofermentans、口乳杆菌(l.oris)、面包乳杆菌(l.panis)、l.pantheris、类短乳杆菌(l.parabrevis)、类布氏乳杆菌(l.parabuchneri)、类干酪乳杆菌(l.paracasei)、类丘状菌落乳杆菌(l.paracollinoides)、l.parafarraginis、类高加索酸奶乳杆菌(l.parakefiri)、l.paralimentarius、类植物乳杆菌(l.paraplantarum)、戊糖乳杆菌(l.pentosus)、l.perolens、植物乳杆菌(l.plantarum)、桥乳杆菌(l.pontis)、l.protectus、l.psittaci、l.rennini、罗伊氏乳杆菌(l.reuteri)、鼠李糖乳杆菌(l.rhamnosus)、裂乳杆菌(l.rimae)、罗氏乳杆菌(l.rogosae)、l.rossiae、瘤胃乳杆菌(l.ruminis)、l.saerimneri、清酒乳杆菌(l.sakei)、唾液乳杆菌(l.salivarius)、旧金山乳杆菌(l.sanfranciscensis)、l.satsumensis、l.secaliphilus、沙氏乳杆菌(l.sharpeae)、l.siliginis、l.spicheri、猪双臼乳杆菌(l.suebicus)、l.thailandensis、l.ultunensis、牛痘乳杆菌(l.vaccinostercus)、阴道乳杆菌(l.vaginalis)、l.versmoldensis、l.vini、犊乳杆菌(l.vitulinus)、玉米乳杆菌(l.zeae)和l.zymae。在一个实施方案中,所述细菌菌株为具有gras状态、非致病性并从上文呈现的乳杆菌属物种组中选择的乳酸细菌菌株。
在一个具体的实施方案中,所述细菌菌株为罗伊氏乳杆菌菌株。在该实施方案中,图1中的步骤s1包括筛选罗伊氏乳杆菌菌株产生dagk的能力,和相应地,步骤s2包括选择能够产生dagk的罗伊氏乳杆菌菌株。
在一个具体的实施方案中,步骤s2包括选择能够产生dagk的罗伊氏乳杆菌菌株,用于在哺乳动物中预防、抑制和/或治疗食物过敏反应。
在另一个具体的实施方案中,所述细菌菌株为发酵乳杆菌菌株。在该实施方案中,图1中的步骤s1包括筛选发酵乳杆菌菌株产生dagk的能力,和相应地,步骤s2包括选择能够产生dagk的发酵乳杆菌菌株。
在一个具体的实施方案中,步骤s2包括选择能够产生dagk的发酵乳杆菌菌株,用于在哺乳动物中预防、抑制和/或治疗花粉过敏反应。
在一个实施方案中,细菌菌株在dag的存在下生长以获得在冷冻干燥或冻干细菌前已经表达dagk的预活化的细菌菌株。因此,在该实施方案中,所述方法进一步包括在dag的存在下培养细菌菌株。
实施方案的另一个方面涉及能够产生dagk的细菌菌株,用于在哺乳动物中预防、抑制和/或治疗过敏反应,附带条件为细菌菌株不选自罗伊氏乳杆菌菌株atccpta-6475和罗伊氏乳杆菌菌株atccpta-4659。
在一个实施方案中,过敏反应选自食物过敏反应和花粉过敏反应。在一个具体的实施方案中,过敏反应为食物过敏反应,并且优选地食物过敏反应选自花生过敏反应、乳(乳糖或乳蛋白)过敏反应、蛋过敏反应、树坚果过敏反应、鱼过敏反应、贝类过敏反应、大豆过敏反应和小麦(谷蛋白)过敏反应。
花粉过敏反应的非限制性实例包括对来自松树(松属(pinus))、桦树(桦木属(betula))、桤木(桤木属(alnus))、雪松、榛树(榛属(corylus))、鹅耳枥(鹅耳枥属(carpinus))、七叶树(七叶树属(aesculus))、柳树(柳属(salix))、杨树(杨属(populus))、悬铃木(悬铃木属(platanus))、椴树/酸橙树(椴树属(tilia))、橄榄树(洋橄榄属(olea))、杉(日本柳杉(cryptomeriajaponica))、日本扁柏(chamaecyparisobtusa)、黑麦草(loliumsp.)、梯牧草(phleumpratense)、豚草(豚草属(ambrosia))、车前草(车前草属(plantago))、荨麻/墙草属(荨麻科(urticaceae))、艾蒿(artemisiavulgaris)、白花藜(藜属(chenopodium))和酸模(sorrel/dock)(酸模属(rumex))的花粉的过敏反应。
实施方案的产dagk细菌菌株可用于在哺乳动物中治疗过敏反应。如本文所使用的治疗不一定意味着给予哺乳动物实施方案的细菌菌株后哺乳动物变得100%无症状。治疗也包括减少哺乳动物中过敏反应的症状。因此,实施方案的细菌菌株可用于在哺乳动物中抑制或遏制过敏反应。
实施方案的细菌菌株可也,或备选地,用于预防哺乳动物发展过敏反应,即防止哺乳动物发展过敏反应或至少减少哺乳动物发展过敏反应的风险。哺乳动物可,例如,具有对过敏反应的倾向,例如对过敏反应的基因或遗传倾向。实施方案的细菌菌株然后可给予这样的哺乳动物,以防止哺乳动物患过敏反应或发展过敏性反应,或至少减少哺乳动物患过敏反应或发展过敏性反应的风险。
在一个具体的实施方案中,可给予实施方案的细菌菌株的哺乳动物优选为人。实施方案的细菌菌株也可用于兽医应用,即,给予非人哺乳动物。这样的非人哺乳动物的非限制性的实例包括狗、猫、马和奶牛。
在一个实施方案中,所述细菌菌株为能够产生dagk并且能够胞外释放,例如分泌dagk的细菌菌株。
在一个实施方案中,所述细菌菌株为能够产生dagk的乳酸细菌菌株。在一个具体的实施方案中,乳酸细菌菌株为能够产生dagk的乳酸细菌菌株,其选自乳杆菌属、明串珠菌属、片球菌属、乳球菌属、链球菌属、气球菌属、肉杆菌属、肠球菌属、酒球菌属、芽孢乳杆菌属、四联球菌属、漫游球菌属和魏斯氏菌属。在一个实施方案中,能够产生dagk的乳酸细菌菌株选自乳杆菌属、明串珠菌属、片球菌属、乳球菌属和链球菌属。
在一个实施方案中,所述细菌菌株为能够产生dagk的罗伊氏乳杆菌菌株。在一个具体的实施方案中,能够产生dagk的罗伊氏乳杆菌菌株用于在哺乳动物中预防、抑制和/或治疗食物过敏反应。
在另一个实施方案中,所述细菌菌株为能够产生dagk的发酵乳杆菌菌株。在一个具体的实施方案中,能够产生dagk的发酵乳杆菌菌株用于在哺乳动物中预防、抑制和/或治疗花粉过敏反应。
在又一个实施方案中,细菌菌株为能够产生dagk的唾液链球菌或嗜热链球菌菌株。在一个具体的实施方案中,能够产生dagk的唾液链球菌或嗜热链球菌菌株用于在哺乳动物中预防、抑制和/或治疗花粉过敏反应。
实施方案的又一个方面涉及能够产生dagk的细菌菌株在制造用于在哺乳动物中预防、抑制和/或治疗过敏反应的药剂中的用途,附带条件为细菌菌株不选自罗伊氏乳杆菌菌株atccpta-6475和罗伊氏乳杆菌菌株atccpta-4659。
实施方案的进一步的方面涉及在哺乳动物中预防、抑制和/或治疗过敏反应的方法。所述方法包括给予患有或有风险发展过敏反应的哺乳动物能够产生dagk的细菌菌株,附带条件为细菌菌株不选自罗伊氏乳杆菌菌株atccpta-6475和罗伊氏乳杆菌菌株atccpta-4659。
细菌菌株的适当给予模式和制剂根据期需局部产生dagk的位点选择。优选的给予模式为口服。其它给予模式包括经鼻、眼内、局部或至皮肤、直肠、鼻、眼、阴道或齿龈的一些其它形式的局部给予,或静脉内、皮下或肌内注射。
口服给予实施方案的细菌菌株可特别优选,以在哺乳动物中预防、抑制和/或治疗食物过敏反应。在这样的情况下,由于给予模式,细菌菌株将接近肠上皮,由此可通过由细菌菌株产生dagk来改变脂质信号传导,以引起对炎性或过敏性反应具有局部影响的免疫生物标志的变化。
经鼻给予实施方案的细菌菌株可特别优选以在哺乳动物中预防、抑制和/或治疗花粉过敏反应。在这样的情况下,由于给予模式,细菌菌株将接近呼吸上皮,由此可通过由细菌菌株产生dagk来改变脂质信号传导,以引起对炎性或过敏性反应具有局部影响的免疫生物标志的变化。
适当剂量的如本文所定义的菌株可容易地根据待治疗的过敏反应、给予模式和关注的制剂进行选择。例如,选择剂量和给予方案以致于根据本发明给予受试者的细菌可导致期需的治疗效果、预防效果或健康益处。因此,优选地剂量为治疗或预防有效的剂量,其适于哺乳动物的类型和待治疗的过敏反应。例如,可使用每日剂量为104-1010,例如105-109或106-108或108-1010总cfu的细菌。优选的每日剂量为约108总cfu,例如,107-109或108-109。
过敏反应一般与增加的组胺释放伴随促炎症状相关。因此,实施方案的产dagk细菌菌株可为极好的治疗途径,其以更天然的方式抑制由过敏性反应期间释放的组胺引起的炎症。这意味着实施方案的能够产生dagk的细菌菌株可避免由抗组胺药物引起的副作用。
预防性或治疗性抗过敏反应效果可通过仅实施方案的细菌菌株,即,作为唯一的抗过敏反应活性剂取得。然而,实施方案的细菌菌株可组合其它抗过敏药物,例如抗组胺,以形成包含细菌菌株和至少一种抗组胺,任选连同药学上可接受的载体、稀释剂、赋形剂或溶剂的组合物。组合治疗也可通过分开给予患有或有风险患过敏反应的哺乳动物实施方案的细菌菌株和至少一种抗组胺取得。
其中产dagk细菌菌株与至少一种抗组胺组合的组合治疗的优点为与单独给予至少一种抗组胺相比,所需的至少一种抗组胺的剂量可减少。抗组胺剂量的这一减少因此可避免或至少最小化与至少一种抗组胺相关的副作用,同时仍取得足够的抗过敏反应效果。
因此,在一个实施方案中,与包含至少一种抗组胺作为唯一的抗过敏反应剂(即缺乏实施方案的任何细菌菌株)的组合物中至少一种抗组胺的量相比,组合物中至少一种抗组胺的量优选小于90%,例如以重量计。在各个实施方案中,与包含至少一种抗组胺作为唯一的抗过敏反应剂(即缺乏实施方案的任何细菌菌株)的组合物中至少一种抗组胺的量相比,组合物中至少一种抗组胺的量优选小于80%、小于70%、小于60%、小于50%、小于40%、小于30%、小于20%或小于10%,例如以重量计。
可在组合治疗中与产dagk细菌菌株一起使用的抗组胺的非限制性,但说明性的实例包括h1-抗组胺,例如h1r拮抗剂和/或h1r反激动剂。
h1r拮抗剂的说明性实例包括阿伐斯汀(acrivastine)、氮卓斯汀(azelastine)、比拉斯汀(bilastine)、溴苯海拉明(bromodiphenhydramine)、溴苯那敏(brompheniramine)、布克力嗪(buclizine)、卡比沙明(carbinoxamine)、西替利嗪(cetirizine,例如在名字zyrlex®、vialerg®、acura®下销售)、氯苯海拉明(chlorodiphenhydramine)、氯苯那敏(chlorphenamine)、氯丙嗪(chlorpromazine)、氯马斯汀(clemastine)、赛克力嗪(cyclizine)、赛庚啶(cyproheptadine)、右溴苯那敏(dexbrompheniramine)、右氯苯那敏(dexchlorpheniramine)、茶苯海明(dimenhydrinate)、二甲茚定(dimetindene)、苯海拉明(diphenhydramine)、多西拉敏(doxylamine)、依巴斯汀(ebastine,例如在名字kestine®下出售)、恩布拉敏(embramine)、非索非那定(fexofenadine,例如在名字allegra®、altifex®下出售)、羟嗪(hydroxyzine)、氯雷他定(loratadine,例如在名字clarityn®下出售)、美克洛嗪(meclizine)、米氮平(mirtazapine)、奥洛他定(olopatadine)、奥芬那君(orphenadrine)、苯茚胺(phenindamine)、非尼拉敏(pheniramine)、苯托沙敏(phenyltoloxamine)、异丙嗪(promethazine)、喹硫平(quetiapine)、卢帕他定(rupatadine)、曲吡那敏(tripelennamine)和曲普利啶(triprolidine)。
h1r反激动剂的说明性实例包括西替利嗪、左西替利嗪、地氯雷他定(例如在名字flynise®下出售)和吡拉明(pyrilamine)。
因此,实施方案的一个方面涉及包含能够产生dagk的细菌菌株和h1-抗组胺的抗过敏反应组合物。
在一个实施方案中,h1-抗组胺选自西替利嗪、依巴斯汀、非索非那定、氯雷他定和地氯雷他定。
在一个实施方案中,细菌菌株不选自罗伊氏乳杆菌菌株atccpta-6475和罗伊氏乳杆菌菌株atccpta-4659。
实施方案的进一步的方面涉及用作药剂和用于在哺乳动物中预防、抑制和/或治疗过敏反应的抗过敏反应组合物。
组合治疗中如本文所定义的菌株的适当剂量可容易地根据待治疗的过敏反应、给予模式、关注的制剂和组合治疗中使用的至少一种抗组胺选择。例如,选择剂量和给予方案以致于根据本发明给予受试者的细菌和抗组胺可导致期需的治疗效果、预防效果或健康益处。因此,优选地剂量为治疗或预防有效的剂量,其适于哺乳动物的类型和待治疗的过敏反应。前文中提及的细菌的每日剂量可用于组合治疗中。对于组合治疗还可能使用更低的每日剂量,因为细菌与至少一种抗组胺组合。
细菌菌株也可在用于治疗食物过敏反应例如花生过敏反应的口服免疫疗法中用作佐剂。
如本文所呈现的实验数据显示罗伊氏乳杆菌dsm32273(于2016年3月8日在dsmz-deutschesammlungvonmikroorganismenundzellkulturengmbh(inhoffenstrasse7b,d-38124braunschweig,germany)在budapesttreaty下保藏)、罗伊氏乳杆菌atccpta-6475(于2004年12月21日在americantypeculturecollection(10801universityblvd,manassas,va20110-2209,u.s.)在budapesttreaty下保藏)和罗伊氏乳杆菌atccpta-4659(于2002年9月11日在americantypeculturecollection(10801universityblvd,manassas,va20110-2209,u.s.)在budapesttreaty下保藏)为能够产生dagk的罗伊氏乳杆菌菌株。因此,这些罗伊氏乳杆菌菌株可如本文所公开的,用于在哺乳动物中预防、抑制和/或治疗过敏反应。在一个具体的实施方案中,过敏反应为食物过敏反应。
因此,实施方案的一个方面涉及用于在哺乳动物中预防、抑制和/或治疗过敏反应的罗伊氏乳杆菌菌株dsm32273。在一个具体的实施方案中,过敏反应为食物过敏反应。
实施方案的其它方面涉及用于在哺乳动物中预防、抑制和/或治疗食物过敏反应的罗伊氏乳杆菌菌株atccpta-6475和/或罗伊氏乳杆菌菌株atccpta-4659。
罗伊氏乳杆菌菌株dsm32273、atccpta-6475和atccpta-4659可单独使用,或作为至少两种罗伊氏乳杆菌菌株的组合物,例如罗伊氏乳杆菌dsm32273和atccpta-6475;罗伊氏乳杆菌dsm32273和atccpta-4659;罗伊氏乳杆菌atccpta-4659和atccpta-6475;或者罗伊氏乳杆菌dsm32273、atccpta-6475和atccpta-4659使用。
在一个实施方案中,发酵乳杆菌atcc14931为能够产生dagk的发酵乳杆菌菌株。因此,发酵乳杆菌atcc14931可如本文所公开的,用于在哺乳动物中预防、抑制和/或治疗过敏反应。在一个具体的实施方案中,过敏反应为花粉过敏反应。
发酵乳杆菌菌株atcc14931可单独使用,或作为至少一种上文列出的产dagk罗伊氏乳杆菌菌株的组合物使用。然后,这样的组合物可包括发酵乳杆菌atcc14931和罗伊氏乳杆菌dsm32273;发酵乳杆菌atcc14931和罗伊氏乳杆菌atccpta-6475;发酵乳杆菌atcc14931和罗伊氏乳杆菌atccpta-4659;发酵乳杆菌atcc14931、罗伊氏乳杆菌dsm32273和atccpta-6475;发酵乳杆菌atcc14931、罗伊氏乳杆菌dsm32273和atccpta-4659;发酵乳杆菌atcc14931、罗伊氏乳杆菌atccpta-4659和atccpta-6475;或者发酵乳杆菌atcc14931、罗伊氏乳杆菌dsm32273、atccpta-6475和atccpta-4659。
在一个具体的实施方案中,图1的方法包括筛选除罗伊氏乳杆菌dsm32273、atccpta-4659和atccpta-6475以及发酵乳杆菌atcc14931之外的细菌菌株产生dagk的能力。所述方法还包括选择除罗伊氏乳杆菌dsm32273、atccpta-4659和atccpta-6475以及发酵乳杆菌atcc14931之外能够产生dagk的细菌菌株,用于在哺乳动物中预防、抑制和/或治疗过敏反应。
实施例
实施例1
通过qrt-pcr定量dagkmrna基因表达
野生型(wt)罗伊氏乳杆菌atccpta-6475、罗伊氏乳杆菌atccpta-6475的hdca突变体(先前在thomas等人,2012中描述)、wt罗伊氏乳杆菌atccpta-4659和wt罗伊氏乳杆菌dsm17938(于2006年1月30日在dsmz-deutschesammlungvonmikroorganismenundzellkulturengmbh(mascheroderweg1b,d-38124braunschweig,germany)在budapesttreaty下保藏)在mrs培养基中在37℃生长过夜,并在严格缺氧条件(n2/co2(80/20;v/v)作为气相)下培养。将100µl新鲜培养物接种入10ml乳杆菌属确定成分培养基4(ldm4)。将培养物在小型生物反应器中在37℃在严格缺氧条件下维持。样品在3小时、6小时、24小时和48小时收集。细菌沉淀通过在4℃在6000×g处理培养物10min获得。随后将沉淀用rnase处理。来自细菌细胞的mrna用trizol分离试剂盒提取。来自每一组的500ngmrna用于将mrna转换为cdna。将处理的cdna1:2稀释,并用于运行qrt-pcr。stratagenemx3000p(agilenttechnologiesgmbh,usa)qrt-pcr用于扩增和荧光数据收集。主混合物由12.5µlpowersybrgreen2000(abisystems,usa)、0.5µl每一引物(dagk-l.r–f:gcgtgagtccataaccgtct(seqidno:9)和dagk-l.r-r:atggctgctgaaattcctgt(seqidno:10),10µm)、1µl样品组成,并用水调整至每孔25µl的终体积。pcr扩增后,引物的特异性通过检查熔解曲线和通过琼脂糖凝胶电泳(1%)测定扩增子的大小进行检查。相对mrna靶基因表达水平(比率=[(e靶)dcp靶(对照-样品)]/[(eref.)dcpref.(对照-样品)])对管家基因rpob归一化并用作参考。随后,将从每一细菌的3小时培养物获得的mrna设置为1.0,并用作校准器以鉴定罗伊氏乳杆菌atccpta-6475、atccpta-4659和dsm17938的同一细菌菌株在不同时间点如6小时、24小时和48小时的相对mrna倍数差异。
图2说明dagk基因表达实验的结果。该图显示wt和hdca突变体罗伊氏乳杆菌atccpta-6475二者连同罗伊氏乳杆菌atccpta-4659增加的dagk表达。然而,罗伊氏乳杆菌dsm17938缺乏dagk表达,即,不能够产生dagk。引人注意地,dagkmrna表达在细菌的伸长阶段期间非常高地表达。从重复实验选择12小时孵育时间点,因为其显示与6小时相似的表达。
实施例2
用于检测细菌培养上清液中dagk蛋白的lc-ms/ms
根据文献,认为dagk在革兰氏阳性细菌中具有可溶性同工型。我们假设dagk从罗伊氏乳杆菌atccpta-6475释放并且其与宿主肠上皮脂质信号传导相互作用并抑制由于过敏性反应释放的组胺的促炎作用,并且还促进抗炎行为。当我们突变罗伊氏乳杆菌atccpta-6475中的dagk基因(突变体通过如vanpijkeren和britton(2012)中所描述,并且适应于使用靶向dagk的寡聚体突变dagk基因的rect介导的单链重组工程创建)并将我们的无菌(gf)小鼠用dagk突变体罗伊氏乳杆菌atccpta-6475定殖时,我们未看到如我们在用野生型罗伊氏乳杆菌atccpta-6475定殖的无菌小鼠中所观察到的il-6和il-1α抑制。基础促炎细胞因子水平受到显著抑制。由于过敏性反应释放的组胺可活化h1r和h2r。然而,h1r下游信号传导被罗伊氏乳杆菌中的dagk合成通过抑制信号传导中涉及的脂质dag中断,因此抑制组胺的促炎作用。这仅允许h2r活化,其已知促进抗炎症状。
为了dagk对宿主免疫应答显示任何正面作用,宿主dag脂质应被表达。为了dag活化,h1r信号传导必须被活化。这就是当我们突变罗伊氏乳杆菌中的dagk并定殖小鼠时我们未看到促炎细胞因子抑制的原因。这额外用pkc和pka活化证实。
为了进一步显示dagk同工型是否从罗伊氏乳杆菌分泌,我们进行细菌细胞培养实验。将100µl过夜mrs生长的罗伊氏乳杆菌atccpta-6475在37℃在缺氧条件下加入存在或不存在dag的10mlldm4培养基中,并在缺氧条件下置于37℃12小时。细菌细胞通过在4℃在6000×g离心10min移除。将1:1比率的蛋白酶和蛋白激酶抑制剂加入上清液中。上清液通过0.22µm滤器过滤以移除痕量细菌。由于dagk为10-13kda的蛋白,减少背景是必需的。因此,将上清液用50kda滤器处理。将流穿液加入3kda滤器并在5000×g离心30min。上相的浓缩物用于在胰蛋白酶消化后运行lc-ms/ms。图3说明来自罗伊氏乳杆菌atccpta-6475的dagk蛋白的氨基酸序列,连同胰蛋白酶消化或切割位点(tryps)。图4说明当dag存在于细胞培养基中时来自罗伊氏乳杆菌atccpta-6475的dagk蛋白的氨基酸序列。
lc-ms/ms实验的结果在表1和2以及图3和4中呈现。匹配罗伊氏乳杆菌dagk蛋白的序列在上清液中存在。因此,罗伊氏乳杆菌atccpta-6475能够产生和分泌dagk蛋白。引人注意地,与dag不存在时相比,罗伊氏乳杆菌在细胞培养基中存在dag时分泌更高水平的dagk。然而,我们可在存在和不存在dag时检出dagk,但其浓度不同。培养基对照保持阴性。
表1.来自罗伊氏乳杆菌atccpta-6475的上清液的胰蛋白酶处理的lc-ms/ms结果
表1中的肽a-f:
表2.当dag存在于细胞培养基中时,来自罗伊氏乳杆菌atccpta-6475的上清液的胰蛋白酶处理的lc-ms/ms结果
表2中的肽g-h:
实施例3
能够产生dagk的菌株的鉴定
细菌在厌氧气氛中在mrs平板上在37℃培养16h。细菌菌落用无菌塑料环收集并悬浮在100µl无菌水(pcr质量)中。或者,dna可使用任何合适的方法从细菌培养物制备,参见例如实施例1。
dagk基因的存在情况通过pcr,例如通过使用puretaqreadytogopcr珠(gehealthcare)和引物对dagk_lrf(tggactcacgcgataaacatca,seqidno:11)和dagk_lrr(acaatcaaatctgtaacagcttcg,seqidno:12)(各自0.4mm)检查。将细菌悬液或dna制备物(0.5µl)加入pcr混合物中,pcr反应通过运行程序95°c,5min;30×(95°c,30s;58°c,30s;72°c,30s);72°,10min进行。pcr产物通过使用标准琼脂糖凝胶电泳分离和可视化,序列使用用于pcr的正向引物(dagk_lrf)通过标准sanger测序测定。
实施例4
能够产生dagk的罗伊氏乳杆菌dsm32273的分析
罗伊氏乳杆菌dsm32273细菌在mrs肉汤中在37℃生长过夜。将细菌悬液在3500rpm离心5min,将1µl沉淀悬浮在100µlpbs中。
罗伊氏乳杆菌dsm32273中dagk基因的pcr分析如实施例3中所描述的进行。
结果显示罗伊氏乳杆菌dsm32273对编码组氨酸脱羧酶的基因和dagk基因阳性,参见表3。细菌菌株罗伊氏乳杆菌atccpta-6475和dsm17938作为对照包括在内。
表3.pcr分析的结果,显示所检验的细菌的物种、菌株和宿主源
实施例5
制造用于花粉过敏反应的益生菌产品
在该实施例中,制造用于花粉过敏反应的益生菌产品。菌株发酵乳杆菌atcc14931基于其产生dagk的能力选择,如从公布的基因组序列分析的。发酵乳杆菌菌株使用工业上用于生长乳杆菌属的标准方法生长和冻干。产品为对于良好稳定性和贮藏寿命而制备的基于油的制剂。生产过程的特性为干燥油的步骤,通过将其置于真空下以移除油中的大部分水和增加制剂的稳定性进行。本发明中使用的油为纯食用植物油,优选向日葵油和中链甘油三酯。
成分的混合
1.在bolz混合器/罐(alfredbolzapparatebaugmbh,wangenimallgäu,germany)中混合中链甘油三酯,例如,akomedr(karlshamnsab,karlshamnsweden)和向日葵油,例如,akosun(karlshamnsab,karlshamnsweden)与二氧化硅,cab-o-silm5p,m5p,cabot)。
2.均质化。将sine泵和dispax(sinepump,arvada,colorado)连接bolz混合器,并将混合物均质化。
3.真空干燥。将混合物在bolz罐中在10mbar真空下干燥12小时。
4.加入发酵乳杆菌。将约20kg干燥的油混合物移至50升不锈钢容器。加入发酵乳杆菌粉末,优选冷冻干燥的;使用的发酵乳杆菌的量根据油中想要的量而不同,但一个实例为加入0.2kg具有1011cfu/g的培养物。将其缓慢混合直至均质。
5.混合。将具有发酵乳杆菌的预混合物放回bolz混合器。
6.排出。将悬浮液排出至200升玻璃容器,并用氮气覆盖。
将悬浮液维持在容器中直至装入喷雾瓶中,其用于经鼻给予人,以预防或治疗花粉过敏反应。
实施例6
制造用于食物过敏反应的益生菌产品
在该实施例中,罗伊氏乳杆菌dsm32273基于其产生dagk的能力选择,以将该菌株加入用于在人中预防、抑制和/或治疗食物过敏反应的片剂中。罗伊氏乳杆菌菌株使用工业上用于生长乳杆菌属的标准方法生长和冻干。
下列步骤说明用于包含所选择的细菌菌株的片剂(包括葡萄糖包囊)的制造过程的实例。应理解如本领域所已知的片剂产品的赋形剂、填充剂、矫味剂、包囊剂、润滑剂、抗结块剂、甜味剂和其它组分可在不影响产品的功效下使用。
1.熔化。在容器中熔化softisan™154(sasolgmbh,badhomburg,germany),将其加热至70℃以确保完全破坏晶体结构。然后将其冷却至52–55℃(刚刚高于其硬化点)。
2.制粒。将罗伊氏乳杆菌冷冻干燥粉末转移至diosna高剪切混合器/制粒机或等效物中。在大约1分钟期间将熔化的softisan™154缓慢加入至罗伊氏乳杆菌粉末。在加入期间使用切碎机。
3.湿筛。紧接制粒之后,使用tornado碾磨机将颗粒通过1-mm筛网。将过筛的颗粒装入pvc-涂覆的铝箔制成的alupouches中,用热封机封口以形成小袋,连同干燥剂小袋一起,并冷藏,直至混合。制粒批次分为两个片剂批次。
4.加入包囊的d-葡萄糖(g8270,>99.5%葡萄糖,sigma),使用本领域已知的标准微型包囊方法包囊。糖的量取决于加入的干燥罗伊氏乳杆菌粉末的总cfu,标准水平可为每108的总cfu的细菌1克糖,但这也可改变,下至0.1克或0.01克,上至10克甚至上至100克糖。
5.混合。在混合器中混合所有成分,至均质掺合物。
6.压制。将最终的掺合物转移至旋转式压片机的漏斗中并在kilian压缩机中以总重量765mg压制片剂。
7.批量包装。将片剂连同分子筛的干燥小袋一起包装入alu袋中。将alu小袋放在塑料桶中并在凉爽处保存至少一周,然后最终包装。softisan™(一种氢化棕榈油)的使用使得乳杆菌属细胞能够包裹在脂肪中和在环境上受保护。
如上文所说明的,实施方案的产品可为片剂以外的形式,并且如本领域所已知的制备潜在产品的标准方法有利地用于制备包含所选择的罗伊氏乳杆菌培养物的本发明产品。
实施例7
研究哺乳动物肠上皮dag和ppkc信号传导的小鼠肠类器官实验
小鼠肠类器官(仅包含肠上皮层)自10周龄无菌(gf)balb/c小鼠获得。肠类器官生长以形成单层并用ldm4培养基(对照)、野生型罗伊氏乳杆菌pta-6475条件培养基(50-3kda截断)、仅二酰甘油激酶(dgk)抑制剂(2µm)或dgk抑制剂(2µm)与野生型罗伊氏乳杆菌pta-6475条件培养基(cm;50-3kda截断)诱导。dgk抑制剂(r59-022;6-[2-(4-[(4-氟苯基)苯基亚甲基]-1-哌啶基)乙基]-7-甲基-5h-噻唑并-[3,2-a]嘧啶-5-酮)在加入条件培养基之前2小时加入至肠类器官以防止哺乳动物dgk活化,并且2小时后,将肠类器官洗涤并分别用条件培养基或者仅ldm4培养基处理(含或不含dgk抑制剂)。蛋白在孵育45min后收集以进行蛋白质印迹。
在野生型(wt)罗伊氏乳杆菌pta-6475条件培养基存在下,用dgk抑制剂处理的肠类器官产生增加的pkc磷酸化,而在野生型罗伊氏乳杆菌pta-6475条件培养基存在下缺乏dgk抑制剂的肠类器官不产生增加的pkc磷酸化的证据,参见图5a和5b。
上文所描述的实施方案应理解为本发明的几个说明性实例。本领域技术人员将理解,在不脱离本发明的范围的情况下,可对实施方案进行各种修饰、组合和改变。特别地,在技术上可能的情况下,不同实施方案中的不同部分解决方案可以以其它配置组合。然而,本发明的范围通过所附的权利要求定义。
参考
thomas等人(2012).histaminederivedfromprobioticlactobacillusreuterisuppressestnfviamodulationofpkaanderksignaling(从益生菌罗伊氏乳杆菌衍生的组胺经由调节pka和erk信号传导抑制tnf).plosone7(2):e31951.
vanpijkeren和britton.(2012).highefficiencyrecombineeringinlacticacidbacteria(乳酸细菌中的高效重组工程).nucleicacidsresearch40(10):e76.
lee等人(2004).dietaryintakeofvariouslacticacidbacteriasuppressestype2helpertcellproductioninantigen-primedmicesplenocyte(膳食摄入各种乳酸细菌抑制抗原引发的小鼠脾细胞中的2型辅助t细胞产生).j.microbiol.biotechnol.14(1):167-170.
- 还没有人留言评论。精彩留言会获得点赞!