通过调节性T细胞刺激治疗性血管生成的制作方法
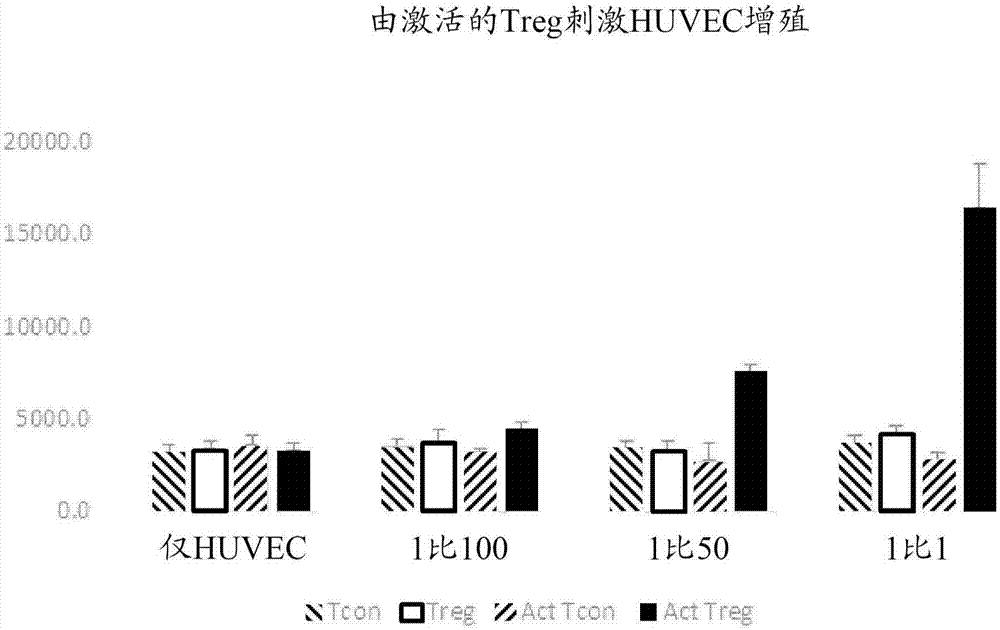
本发明涉及免疫学领域,更具体地,本发明涉及使用调节性t细胞(通常被称为免疫细胞)以刺激血管生成。本发明涉及利用细胞以刺激血管生成,更具体地,本发明涉及利用免疫细胞以刺激血管生成,更具体地,本发明涉及利用调节性t细胞以刺激治疗性血管生成,以及在刺激血管生成时调节性t细胞和干细胞之间的协同效应。背景调节性t(treg)细胞是免疫系统的必要组分,其保护身体免受自身免疫攻击。这由早期的研究阐明,其中新生地切除胸腺的小鼠遭受系统性自身免疫,其通过cd4细胞的转移被拯救。随后的研究将treg表型鉴定为具有il-2受体cd25,鉴于该受体也在激活的t细胞上发现,这多少是有问题的。外周血含有表达调节性t表型(例如对cd4和cd25抗原两者呈阳性)的t细胞淋巴细胞的小群体。存在若干个treg细胞子集。调节细胞的一个子集在胸腺中发育。胸腺源性treg细胞通过细胞因子非依赖性机制(其涉及细胞与细胞接触)起作用。它们对于诱导和维持自身耐受性以及预防自身免疫性是必需的(shevach,2000annu.rev.immunol.18:423-449)。这些调节细胞防止已经逃脱胸腺删除的自身反应性t细胞的激活和增殖,或识别胸腺外抗原,因此它们对于内稳态和免疫调节以及保护宿主免受自身免疫性的发展是至关重要的。因此,免疫调节性cd4+cd25+t细胞通常被称为“专业抑制剂细胞”。自然产生的cd4+cd25+treg细胞是在胸腺中高亲和力配体上被阳性选择并且已经被显示在建立和维持对自身抗原的免疫耐受性中起重要作用的细胞的独特细胞群。这些细胞的发育和/或功能中的缺陷与人类和各种动物先天性或诱导的自身免疫性模型中的严重自身免疫性相关。treg细胞直接经由细胞与细胞接触或间接经由可溶性因子显示出它们的致耐受性作用。尽管这些细胞的抑制机制仍有待完全阐明,但阻断效应t细胞(teff)中的il-2表达、物理消除teff细胞、经由ctla-4/b7轴诱导致耐受性树突细胞(dc),以及经由tgf-β和il-10抑制teff细胞是迄今为止所涉及的一些机制。还显示了通过ctla-4/cd80进入到teff细胞中的反向信号传导在通过treg细胞的它们的抑制中起重要作用。类似地,treg细胞上的ctla-4与dc上的cd80之间的相互作用可导致反向信号传导和吲哚胺双加氧酶的上调,所述吲哚胺双加氧酶经由调节色氨酸代谢参与耐受性。还可以通过激活成熟的外周cd4+t细胞产生treg细胞。研究表明,外周源性treg细胞通过产生免疫抑制性细胞因子(诸如转化生长因子-β(tgf-β)和il-10)介导它们的抑制活性(kingsley等人,2002j.immunol.168:1080;nakamura等人,2001j.exp.med.194:629-644)。treg细胞在文献中被描述为体外低增殖性的(sakaguchi,2004ann.rev.immunol.22:531)。trenado等人在疾病的体内小鼠模型中提供了离体激活的和扩增的cd4+cd25+调节细胞的治疗功效的首次评价(trenado等人,2002j.clin.invest.112(11):1688-1696)。迄今为止,treg细胞的所有已知活性都与免疫调节有关。概述已知treg细胞抑制免疫响应,在保护免受自身免疫和促进肿瘤性免疫逃避中起关键作用。尚未评价treg细胞对血管生成的直接刺激。因此,本文提供了用于treg细胞刺激血管生成的方法和系统。在一些实施方案中,将体外人脐静脉内皮细胞(huvec)模型用于刺激血管生成。在一些实施方案中,同种异体脐带血cd4+cd25+treg细胞的共培养导致刺激huvec增殖的刺激。在一些实施方案中,huvec增殖的刺激与血管内皮生长因子(vegf)的产生相关。在一些实施方案中,通过添加抗ctla4抗体阻断vegf产生。在一些实施方案中,提供了使用抗cd3抗cd28珠和il-2扩增treg细胞的方法。在一些实施方案中,treg的扩增还包括间充质干细胞(msc)的添加,其导致内皮细胞刺激性能的维持。在一些实施方案中,与没有msc的扩增相比,有msc的treg扩增提供了更大的扩增。在一些实施方案中,提供了严重肢体缺血的免疫感受态模型(immunecompetentmodel)的体内治疗。在一些实施方案中,施用体外扩增的treg导致体内模型中的保肢,而用对照t细胞或人成纤维细胞治疗不会导致保肢。因此,本文提供的一些实施方案涉及作为解决缺血性疾病的手段的基于treg的血管生成的方法。本文公开的一些实施方案涉及刺激血管生成的方法。在一些实施方案中,该方法包括获得细胞群。在一些实施方案中,细胞群包括调节性t细胞。在一些实施方案中,含有调节性t细胞的细胞群包括以下中的一种或多种:外周血单个核细胞、脐带血、月经血或脂肪源性基质血管部分细胞。在一些实施方案中,该方法包括从细胞群中选择调节性t细胞。在一些实施方案中,该方法包括激活调节性t细胞以增强调节性t细胞的血管生成活性。在一些实施方案中,激活调节性t细胞包括将调节性t细胞暴露于以下中的一种或多种:血管活性肠肽、il-10、tgf-β、间充质干细胞条件化培养基、间充质干细胞源性外泌体、脑源性神经营养因子(bdnf)、人绒毛膜促性腺激素、血管内皮生长因子(vegf)、cd3和cd28抗体、缺氧条件、血管生成素或雷帕霉素。在一些实施方案中,通过与间充质干细胞一起培养激活调节性t细胞。在一些实施方案中,间充质干细胞获自以下中的一种或多种:脂肪组织、骨髓、牙髓、毛囊、子宫内膜、月经血、外周血、网膜、皮肤、脐带血、华顿氏胶、胎盘或输卵管。在一些实施方案中,间充质干细胞经扩增的纯化的间充质干细胞,其表达cd44、cd90、cd105、cd73、vegfr2或tem-1中的一种或多种。在一些实施方案中,该方法包括向需要治疗的患者施用调节性t细胞。在一些实施方案中,需要治疗的患者具有缺血性组织。在一些实施方案中,缺血性组织是患有以下疾病中的一种或多种的患者的肢体:外周动脉疾病、严重肢体缺血、冠状动脉疾病或心脏病。在一些实施方案中,需要治疗的患者患有新生血管病变。如本文所述,病变是器官或组织中通过损伤或疾病遭受损害的区域。新生血管病变是与新血管形成相关的病变。新生血管病变在视网膜脉络膜中很常见,包括中心凹下新生血管病变。因此,在一些实施方案中,本文提供了修复脉络膜新生血管病变的方法。还可以使用本文提供的方法修复其它新生血管病变。在一些实施方案中,以约2×106个细胞的量施用调节性t细胞。在一些实施方案中,调节性t细胞抑制用激活增殖的信号刺激的幼稚t细胞的增殖。在一些实施方案中,激活增殖的信号包括以下中的一种或多种:抗cd3珠、抗cd28珠、伴刀豆球蛋白a、植物血凝素(pha)或用同种异体反应性抗原呈递细胞的刺激。在一些实施方案中,调节性t细胞表达以下中的一种或多种:糖皮质激素诱导的tnfr相关的(gitr)配体、神经纤毛蛋白-1、ctla-4、cd25、cd105、膜结合的tgf-β、foxp3、cd39、cd73、cd127、糖蛋白a重复序列为主的蛋白(garp,glycoproteinarepetitionspredominant)。本文公开的一些实施方案涉及刺激血管生成的方法。在一些实施方案中,该方法包括将调节性t细胞施用至缺血组织中。在一些实施方案中,缺血性组织是患有以下疾病中的一种或多种的患者的肢体:外周动脉疾病、严重肢体缺血、冠状动脉疾病或心脏病。在一些实施方案中,调节性t细胞表达标志物cd25或ctla4。在一些实施方案中,以1个调节性t细胞比1个激活的t细胞的比率,调节性t细胞对激活的t细胞的增殖抑制大于25%。在一些实施方案中,调节性t细胞来源于脐带血、外周血、月经血或经动员的外周血。在一些实施方案中,通过以下中的一种或多种实现所述调节性t细胞的激活:il-2、雷帕霉素、抗cd3抗体或抗cd28抗体。在一些实施方案中,将调节性t细胞与间充质干细胞一起培养。本文公开的一些实施方案涉及扩增调节性t细胞的方法。在一些实施方案中,该方法包括培养包含调节性t细胞的细胞群。在一些实施方案中,该方法包括富集cd25+细胞。在一些实施方案中,含有调节性t细胞的细胞群包括以下中的一种或多种:外周血单个核细胞、脐带血、月经血或脂肪源性基质血管部分细胞。在一些实施方案中,该方法还包括用间充质干细胞饲养层培养所述细胞群。附图简述当结合附图阅读时,从以下详细描述中理解本文的描述。需要强调的是,根据惯例,附图的各种特征不是按比例的。相反,为了清楚起见,各种特征的尺寸被任意扩大或缩小。附图中包括以下图。图1说明了在本文所述的实施方案中通过激活的调节性t(treg)细胞刺激人脐静脉内皮细胞(huvec)增殖的结果。图2说明了在本文所述的实施方案中通过激活的treg细胞刺激血管内皮生长因子(vegf)产生的结果。图3说明了在本文所述的实施方案中treg细胞诱导的对vegf刺激的增殖的超敏性的结果。图4说明了在本文所述的实施方案中ctla-4抑制treg刺激huvec增殖的结果。图5说明了在本文所述的实施方案中通过与间充质干细胞(msc)饲养层共培养而增强的脐带源性treg的扩增的结果。图6说明了如本文实施方案中所述,当与msc饲养层组合时,用培养扩增的treg刺激huvec细胞增殖的能力增强。图7描绘了本文所述的实施方案中脐带血扩增的treg细胞保护免受肢体损失的结果。详述除非另外定义,否则本文使用的所有技术和科学术语具有与本领域普通技术人员通常理解的含义相同的含义。除非另有说明,否则本文引用的所有专利、申请、公布的申请和其它出版物均通过引用将它们整体明确地并入本文。如果本文的术语存在多个定义,除非另有说明,否则以本节中的那些定义为准。如本文所用的,“正常、健康的个体”或“正常、健康的对象”是指未患有正测试的特定疾病、病症或病况的对象。如本文所用的,“有此需要的对象”是指易患指定疾病、病症或病况,有指定疾病、病症或病况风险或出现指定疾病、病症或病况的对象。如本文所用的,“易感的”和“有风险”是指对某种疾病、病症或病况几乎没有抵抗力,包括是有疾病、病症或病况遗传倾向的,具有疾病、病症或病况的家族史和/或具有疾病、病症或病况的症状。如本文所用的,“预防(prevent/preventing/prevention)”及其语法变型是指部分或完全延迟或阻止病症或病况的发作或复发和/或其伴随症状的一种或多种或阻拦动物获得或重新获得病症或病况或降低动物获得或重新获得病症或病况或其伴随症状的一种或多种的风险的方法。如本文所用的,术语“减少”就特定性状、特性、特征、生物过程或现象而言,指的是特定性状、特性、特征、生物过程或现象的减少。性状、特性、特征、生物过程或现象可以减少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或大于100%。如本文所用的,术语“治疗(treat/treating/treatment)”及其语法变型包括部分或完全延迟、减轻、缓解或降低病症或病况的一种或多种伴随症状的强度,和/或减轻、缓解或阻止病症或病况的一种或多种原因。可以预防性地、防止性地、逐步地或补救性地应用根据本公开的治疗。如本文所用的,“对象”是指作为治疗、观察或实验的目标的动物。“动物”包括冷血和温血的脊椎动物和无脊椎动物,诸如鱼、贝类、爬行动物和特别地,哺乳动物。“哺乳动物”包括但不限于小鼠、大鼠、兔、豚鼠、狗、猫、绵羊、山羊、牛、马、灵长类动物(诸如猴、黑猩猩和猿,以及特别地,人类)。在一些替代方案中,对象是人。如本文所用的,“有此需要的对象”是指易患指定疾病、病症或病况,有指定疾病、病症或病况风险或出现指定疾病、病症或病况的对象。本发明用于兽医和医学应用以及研究中。适合的对象包括禽类和哺乳动物。如本文所用的的术语“禽类”包括但不限于鸡、鸭、鹅、鹌鹑、火鸡和野鸡。如本文所用的的术语“哺乳动物”包括但不限于人类、牛科动物、绵羊类动物、山羊类动物、马科动物、猫科动物、犬科动物、兔类动物等。人类对象包括新生儿、婴儿、青少年和成人。在其它实施方案中,对象是缺血的动物模型。在某些实施方案中,对象患有糖尿病(例如,i型或ii型糖尿病)或有患糖尿病(例如,i型或ii型糖尿病)的风险。在其它实施方案中,对象患有心血管疾病或经历了缺血或中风。在另外的其它实施方案中,对象有缺血的风险。在另外的实施方案中,对象需要增加血管生成和/或动脉生成。如本文所用的,术语“缺血”是指导致细胞、组织或器官接收不足的氧气供应的事件。如本文所用的,术语“血管生成”是指当前血管的扩张或新血管的产生。“生理性血管生成”由复杂的分子和细胞机制协调,并且是最佳血管内皮健康所必需的。如本文所用的“活跃的血管生成”是指当前血管的扩张或新血管的产生超过正常/有规律的血管修复;即在没有血管生成的对象中的血管修复。如本文所用的,“调节性t细胞”或“treg细胞”是t细胞亚群,并且是指可以下调免疫系统的一种t细胞类型。此外,可以将调节性t细胞与treg细胞、cd4+cd25+细胞或cd4+cd25+foxp3+细胞互换使用。treg细胞包括自然或组成型调节性t细胞以及适应型或可诱导型调节性t细胞两者。如本文所用的,“效应t细胞”或“teff细胞”是指执行免疫响应功能的t细胞(t淋巴细胞)。在一个实施方案中,teff细胞是cd3+和cd4+或cd8+。teff细胞可以分泌、含有或表达效应标志物,诸如ifn-γ、颗粒酶b和icos(但本领域技术人员将理解,teff细胞不完全限于这些表型)。treg细胞是免疫系统的基本组分,具有识别和抑制对自身抗原响应的能力(bluestone,j.a.等人,jclininvest,2015.125(6):第2250-60页)。具体地,当形成免疫系统时,在被称为阴性选择的过程中,在胸腺中删除识别自身抗原的teff细胞。有时识别自身抗原的teff细胞“漏过”或逃脱阴性选择过程,因此具有通过攻击自身抗原来诱导自身免疫病况的能力。自身免疫病况的实例包括1型糖尿病(其中teff细胞攻击胰腺胰岛素促进细胞中的gad65抗原)、多发性硬化(其中teff细胞攻击髓鞘碱性蛋白)、或者类风湿性关节炎(其中teff细胞攻击ii型胶原蛋白)。为了保护身体免受系统性自身免疫,在胸腺中产生treg细胞,然而,当它们识别胸腺中的自身抗原时,不是被删除,而是一经识别自身抗原它们就被给予“存活信号”(aschenbrenner,k.等人,natimmunol,2007.8(4):第351-8页)。以这种方式,如果识别自身抗原的teff细胞逃脱胸腺,则针对自身免疫的备份是treg细胞,其特异性阻断teff细胞介导它们的作用。癌症领域的研究表明,treg细胞可能具有免疫调节之外的其它功能的可能性。在一方面,证明增加数量的treg细胞与增强的肿瘤血管生成相关(zhan,h.l.等人,asianpacjcancerprev,2012.13(3):第867-72页;giatromanolaki,a.等人,gynecoloncol,2008.110(2):第216-21页;pucino,v.等人,chemimmunolallergy,2014.99:第155-69页)。另一个研究领域表明,癌症中treg细胞的耗竭减少了肿瘤血管生成(facciabene,a.等人,nature,2011.475(7355):第226-30页)。treg细胞和肿瘤之间的相互作用是众所周知的,并且被认为依赖于各种肿瘤特异性因子,包括引起选择性归巢至肿瘤的treg吸引地址素的表达(nummer,d.等人,jnatlcancerinst,2007.99(15):第1188-99页)。虽然有人建议treg可以刺激血管生成,但treg部分通过ip-10产生来抑制th1细胞(作为血管生成的有效抑制剂)的可能性(nummer,d.等人,jnatlcancerinst,2007.99(15):第1188-99页)也可以解释先前的联想研究。例如,由th1细胞产生的细胞因子(诸如干扰素γ)可以抑制m2巨噬细胞的产生(dungan,l.s.等人,eurjimmunol,2014.44(10):第2903-17页;spence,s.等人,immunity,2013.38(1):第66-78页),所述m2巨噬细胞是促血管生成的(barbay,v.,等人,angiogenesis,2015.18(2):第191-200页),并支持m1巨噬细胞的产生(mills,c.d.等人,jimmunol,2000.164(12):第6166-73页),所述m1巨噬细胞是抗血管生成的(xing,y.等人,genescells,2016;sun,t.等人,oncolres,2014.21(5):第227-35页)。在一些实施方案中,treg细胞展现出改善的生物分布,因为它们小于间充质干细胞。由于改善的生物分布,treg细胞能够有助于抑制并且展现出改善的选择性归巢至炎症的能力。在非肿瘤性病况中,已经显示treg细胞与对多种缺血性病况的治疗效果相关,诸如:a)心肌梗塞(weirather,j.等人,circres,2014.115(1):第55-67页;tang,t.t.等人,basicrescardiol,2012.107(1):第232页;matsumoto,k.等人,intheartj,2011.52(6):第382-7页);b)中风(stubbe,t.等人,jcerebbloodflowmetab,2013.33(1):第37-47页;brea,d.等人,jcellmolmed,2014.18(8):第1571-9页;na,s.y.等人,stroke,2015.46(1):第212-20页);和c)主动脉瘤(yodoi,k.等人,hypertension,2015.65(4):第889-95页;zhou,y.等人,cardiovascres,2015.107(1):第98-107页)。有趣地是,虽然在癌症的情况下treg细胞与增强的血管生成相关(facciabene,a.,g.t.motz和g.coukos,cancerres,2012.72(9):第2162-71页),但在非癌症病况中,似乎treg通过抑制炎症、mmp活性和实际抑制血管生成而具有治疗活性(zhou,y.等人,cardiovascres,2015.107(1):第98-107页;saxena,a.等人,amjphysiolheartcircphysiol,2014.307(8):第h1233-42页)。因此,一些实施方案涉及刺激血管生成的方法。在一些实施方案中,该方法包括获得包含调节性t细胞的细胞群。获得treg细胞群包括获得包含从脐带血、月经血获得的外周血单个核细胞或是脂肪源性基质血管部分细胞的细胞群。在一些实施方案中,可以直接从对象获得所述细胞,或者可以从培养物获得所述细胞。直接从对象获得细胞包括直接从对象获得脐带血、月经血、人脐静脉内皮细胞或脂肪源性基质血管部分细胞。从培养物中获得细胞包括使用已建立的huvec细胞、单个核细胞或从对象获得或可商购的其它细胞的细胞培养物。在一些实施方案中,获得细胞群包括从细胞培养物分离细胞,所述细胞表达以下中的一种或多种:糖皮质激素诱导的tnfr-相关的(gitr)配体、神经纤毛蛋白-1、ctla-4、cd25、cd105、膜结合的tgf-β、foxp3、cd39、cd73、cd127、糖蛋白a重复序列为主的蛋白(garp)。在一些实施方案中,获得treg细胞群可以包括活组织检查。在一些实施方案中,该方法还包括从所述细胞群中选择调节性t细胞以获得经分离的treg细胞群。选择treg细胞包括分离表达特定标志物的那些细胞。在一些实施方案中,该标志物包括以下中的一种或多种:糖皮质激素诱导的tnfr相关的(gitr)配体、神经纤毛蛋白-1、ctla-4、cd25、cd105、膜结合的tgf-β、foxp3、cd39、cd73、cd127、糖蛋白a重复序列为主的蛋白(garp)。可以通过标准细胞检测技术完成分离表达标志物的细胞,包括例如流式细胞术、细胞分选、免疫细胞化学、荧光激活的细胞分选、磁性激活的细胞分选、使用显微镜检查细胞形态,或通过使用技术(诸如pcr或基因表达谱)测量基因表达中的变化。如本文所用的,“分离”细胞意指去除至少20%、30%、40%、50%、60%、70%、80%、90%、95%或99%的细胞,所述细胞与细胞通常相关。来自对象的细胞当存在于细胞群中时是“分离的”,所述细胞群包含少于50%的与所述细胞通常相关的细胞。如本文所用的,术语“分离的细胞群”意指基本上与所述细胞群所来源的组织或组织培养物的其它细胞分开的细胞群。如果在分离该细胞期间,与细胞群一起的细胞或细胞群所来源的细胞的至少50%、60%、70%、80%、90%、95%或至少99%从该细胞中去除,则该细胞是“分离的”。在一些实施方案中,该方法还包括激活所述调节性t细胞以增强所述调节性t细胞的血管生成活性。如本文所用的,“激活treg细胞”包括刺激treg细胞的血管生成活性,诱导treg细胞的血管生成活性,或增加treg细胞的血管生成活性。如本文所用的,“激活的treg细胞”是引起血管生成响应的treg细胞。在一些实施方案中,激活treg细胞包括将treg细胞暴露于刺激treg细胞的血管生成活性的激活剂或培养条件。如本文所用的,“激活剂”或“激活条件”包括血管活性肠肽、il-10、tgf-β、间充质干细胞条件化培养基、间充质干细胞源性外泌体、脑源性神经营养因子(bdnf)、人绒毛膜促性腺激素、血管内皮生长因子(vegf)、cd3和cd28抗体、缺氧条件、血管生成素、雷帕霉素或间充质干细胞。因此,在一些实施方案中,激活treg细胞包括将treg细胞暴露于以下中的一种或多种:血管活性肠肽、il-10、tgf-β、间充质干细胞条件化培养基、间充质干细胞源性外泌体、脑源性神经营养因子(bdnf)、人绒毛膜促性腺激素、血管内皮生长因子(vegf)、cd3和cd28抗体、缺氧条件、血管生成素或雷帕霉素。在一些实施方案中,将treg细胞暴露于间充质干细胞。在一些实施方案中,该方法还包括在需要疗法或治疗的患者中施用所述调节性t细胞。如本文所用的,“有需要的患者”或“有需要的对象”是指被确定为需要疗法或治疗的对象,并且是指易患指定疾病、病症或病况,有指定疾病、病症或病况风险或出现指定疾病、病症或病况的对象。在一些实施方案中,有需要的对象是易患缺血,有缺血风险或出现缺血的对象。在一些实施方案中,缺血是缺血性事件或缺血性损伤的结果。如本文所用的,“缺血性事件”或“缺血性损伤”是指导致或可能导致组织血液不足供应的任何情况,并且可以包括,例如,低血糖、心动过速、动脉粥样硬化、低血压、高血压、血管瘤、体温过低、局部极度寒冷、血栓栓塞、血管受压、血管破裂、神经受压、栓塞、镰状细胞病、炎症过程、出血、心力衰竭、心脏骤停、休克或贫血。在某些实施方案中,对象是需要增加的血管生成和/或动脉生成的对象。例如,对象可以是经历了缺血、目前正在经历缺血或者患有可能导致缺血性事件(诸如组织中的梗塞或慢性缺血)的病症或病况的对象。例如,缺血可能在在如糖尿病的疾病中更易患缺血的身体的一部分中,诸如肢体,例如下肢,例如,脚和/或脚趾。在某些实施方案中,对象有缺血的风险,例如,患有使对象倾向于发生缺血的疾病的对象。在一个实施方案中,对象患有糖尿病(例如,i型或ii型)或前驱糖尿病病况。对象可能患有由于糖尿病引起的一种或多种并发症(诸如肾病、视网膜病、冠状动脉疾病、外周血管疾病和相关的溃疡、坏疽和/或疼痛,和/或自主神经功能障碍)或具有由于糖尿病引起的一种或多种并发症(诸如肾病、视网膜病、冠状动脉疾病、外周血管疾病和相关的溃疡、坏疽和/或疼痛,和/或自主神经功能障碍)的风险。在其它实施方案中,对象未患有糖尿病(例如,i型或ii型)。在其它实施方案中,对象患有心血管或脑血管疾病或经历了缺血或中风。在其它实施方案中,对象有移植物(例如,皮肤移植物)或其它移植的组织、吻合术、伤口、溃疡、灼伤、男性型秃发、动脉粥样硬化、缺血性心脏组织、缺血性外周组织(例如,肢体或肠系膜缺血)、心肌梗塞或脑梗塞,或血管闭塞或狭窄。在一些实施方案中,有需要的对象患有新生血管病变。如本文所述的,病变是器官或组织中通过损伤或疾病已经遭受损害的区域。新生血管病变是与新血管形成相关的病变。新生血管病变在视网膜脉络膜中很常见,包括中心凹下新生血管病变。因此,在一些实施方案中,本文提供了修复脉络膜新生血管病变的方法。还可以使用本文提供的方法修复其它新生血管病变。施用分离的treg细胞群的途径包括但不限于静脉内、肌内、皮下注射、关节内、经口、局部、皮内、经皮、皮下、肠胃外、经直肠、脊柱或表皮施用。在一些实施方案中,施用treg细胞包括肌内、皮下注射或静脉内施用。在一些实施方案中,将treg细胞与适合于施用模式的药学上可接受的载体组合施用。在一些实施方案中,将treg细胞以每次施用约1×104、1×105、2×105、3×105、4×105、5×105、6×105、7×105、8×105、9×105、1×106、2×106、3×106、4×106、5×106、6×106、7×106、8×106、9×106、1×107、2×107、3×107、4×107、5×107、6×107、7×107、8×107或9×107个细胞的量,或者以由上述值的任何两个限定的范围内的量施用。在一些实施方案中,将treg以单次注射施用。在一些实施方案中,在整个治疗期间以多剂量施用treg。在一些实施方案中,将分离的treg细胞群以每日数次、每日两次、每日一次、每周一次、每月一次、每季度一次或每年一次,或以任何上述周期之间的频率施用。如本文所用的,“治疗期”是在其期间期望治疗的时间长度。治疗期可以包括含有以下时间的时间量:1、2、3、4、5、6或7天,或1、2、3、4、5、6、7或8周,或1、2、3、4、5、6、7、8、9、10、11或12个月,或1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20年,或可以包括在由上述时间量的任何两个限定的范围内的时间周期。在一些实施方案中,用于注射的药学上可接受的载体可包括但不限于用于注射的无菌水和生理盐水。药学上可接受的载体可以含有生理上可接受的化合物,其起作用以例如稳定或增加或降低本发明的药物组合物的吸收率或清除率。生理上可接受的化合物可以包括,例如碳水化合物(诸如葡萄糖、蔗糖或右旋糖酐)、抗氧化剂(诸如抗坏血酸或谷胱甘肽)、螯合剂、低分子量蛋白质、去污剂、脂质体载体、或赋形剂或其它稳定剂和/或缓冲剂。其它生理上可接受的化合物包括润湿剂、乳化剂、分散剂或防腐剂。参见第21版的remington’spharmaceuticalscience,mackpublishingcompany,easton,pa.(“remington’s”)。本发明的药物组合物还可以包括辅助物质,诸如药理学试剂、细胞因子或其它生物响应调节剂。如本文所用的“治疗(treatment/treat/treating)”或“疗法”涵盖对哺乳动物(特别是人)的疾病或病况的任何治疗,并且包括:(a)预防疾病或病况在可能倾向于患该疾病或病况但尚未被诊断为患有该疾病或病况的对象中发生;(b)抑制疾病或病况,例如,阻止其发展;(c)减轻或改善疾病或病况,例如导致疾病或病况消退;或(d)治愈疾病或病况,例如,停止它的发展或进展。通过本发明的方法治疗的对象群体包括患有不良病况或疾病的对象,以及具有发展该病况或疾病风险的对象。与外周血细胞来源相比,脐带血是具有增强的再生能力的细胞来源。先前的研究已经证明了脐带血treg细胞可扩增性以及以同种异体方式使用的能力的概念的临床验证(brunstein,c.g.等人,blood,2011.117(3):第1061-70页)。因此,脐带血treg细胞刺激血管生成的可能性提供了同时刺激各种治疗性活性的潜在手段。因此,在一些实施方案中,本文提供了使用能够刺激血管细胞在体外和体内增殖的针对cd4和cd25表达而纯化的脐带血细胞的方法和系统。本文还提供了在treg细胞上包括ctla-4以在内皮细胞上赋予增殖活性的方法和系统。本发明提供了利用调节性t细胞刺激缺血性组织中血管生成的方法。使用treg细胞进行刺激血管生成与传统教导相悖,因为treg细胞刺激tgf-β,已知所述tgf-β抑制血管生成。然而,在一些实施方案中,描述了使用treg细胞刺激血管生成的方法和系统。在一个实施方案中,本发明教导了非匹配的脐带血源性调节性t细胞来治疗缺血性病况的用途。本发明包括扩增用于刺激血管生成的调节性t细胞(treg)、自然调节性t细胞(ntreg)的组合物和方法。更优选地,经扩增的细胞在扩增后保留ntreg或treg表型和血管生成活性。本发明提供了用于扩增treg(优选ntreg),而不随后将ntreg逆转为效应t细胞的组合物和方法。因此,此类扩增方法允许建立用于刺激血管生成的细胞库。在本发明的一方面,可以通过从期望的细胞来源分离ntreg并随后在主要信号和共刺激信号存在下培养扩增细胞来进行ntreg扩增。如本文所述,可以将用于在treg上刺激主要信号和共刺激信号的试剂以可溶形式使用、连接至细胞表面,或固定在表面上。在优选的实施方案中,将主要试剂和共刺激剂共同固定在表面(例如珠或经工程化的细胞)上。在一个实施方案中,将提供主要激活信号的分子(诸如cd3配体)和共刺激分子(诸如cd28配体)偶联或加载在相同表面(例如颗粒或经工程化的细胞)上。可以单独施用或与血管生成细胞一起施用所述细胞以治疗缺血性病症。在另一个实施方案中,本发明提供了使用重复刺激程序将treg(优选ntreg)扩增到前所未有的数量的方法。在一个实施方案中,扩增ntreg的方法包括基于细胞大小的再刺激ntreg。优选地,选择展现出约为静止ntreg大小的细胞大小的ntreg用于再刺激。在一些情况下,静止ntreg的大小为约8.5μm。即,本发明基于以下发现:细胞大小是有助于成功扩增ntreg而不丧失ntreg表型和抑制剂活性的参数。在另一个实施方案中,扩增ntreg的方法包括在雷帕霉素存在下再刺激ntreg。优选地,在雷帕霉素存在下再刺激从外周血分离的ntreg。即,本发明基于以下发现:雷帕霉素有助于成功扩增从外周血分离的ntreg,而不丧失ntreg表型和抑制剂活性。优选地,本发明的扩增细胞保持指示ntreg的foxp3谱。在一个实施方案中,扩增的ntreg群体表达特异性自然treg标志物(诸如foxp3和潜伏相关肽(latencyassociatedpeptide,lap)),在foxp3基因中展现treg特异性脱甲基化,并且含有极少的il-2、ifnγ、il-17分泌细胞。本发明的扩增细胞还能够抑制严重肢体缺血的异种模型中的肢体损失。在其它实施方案中,储存至少一部分的活性细胞群用于随后移植/输注。可以将群体分成大于一个等分试样或单元,使得保留ntreg群体的一部分用于随后的应用,同时将部分立即应用于患者。在细胞库中中等至长期储存的全部或部分细胞也在本发明的范围内。出于本发明的目的,treg和ntreg可以是可互换的。实施例在以下实施例中进一步详细公开了另外的替代方案,其不以任何方式旨在限制权利要求的范围。一般程序和方法脐带血treg细胞在再生医学研究所机构审查委员会(regenerativemedicineinstituteinstitutionalreviewboard,irb)批准的方案下提供冷冻保存的脐带血单元。将冷冻保存的人cb单元解冻并在含有0.5%hsa(baxterhealthcare,westlakevillage,ca)的clinimacs缓冲液(miltenyibiotec,bergishgladbach,德国)中洗涤以得到cb单个核细胞(mnc)。然后根据制造商的说明书(miltenyibiotec,bergishgladbach,德国),使用磁性激活的细胞分选(macs)对cbmnc进行cd25细胞富集。以指定的比率将阳性选择的细胞与cd3/28共表达的(clinexvivotmcd3/cd28,invitrogendynalas,oslo,挪威)共培养,并以1×106个细胞/ml重悬在补充有10%人ab血清(geminibio-products,sacramento,ca)、2mml-谷氨酰胺(sigma,st.louis)的xvivo15培养基(cambrexbioscience,walkersville,md)中。共培养测定人脐静脉内皮细胞(huvec)购自cambrex(sandiego,calif.),并保持在含有90μg/ml肝素、30μg/ml内皮细胞生长补充剂(bdbiosciences,bedford,mass.)、20%fbs、50μg/ml庆大霉素和50μg/ml两性霉素的培养基199(mediatech,inc,herndon,va.)中。在37℃下于湿润的培养箱(95%空气,5%co2)中维持培养物。将在6孔板(每孔1×106个细胞)上生长至90%汇合的huvec用pbs洗涤3次,并在无血清培养基中培养24小时,以根据先前描述的方法进行同步化(he,s.等人,arteriosclerthrombvascbiol,2010.30(12):第2621-30页)。去除非粘附细胞并更换培养基。对于共培养实验,用200iu/mlil-2以指定的比率,在抗cd3/抗cd28dynabeads存在下,在没有t细胞、有treg(cd25+)或有cd4+cd25-t细胞(cd25-)的情况下,将huvec培养48小时。使用抗ctla4、抗pd1和抗vegf抗体进行阻断实验。通过去除t细胞(非粘附的)、洗涤细胞、使用cd3t细胞柱(r&dsystems)纯化t细胞、计数并随后在1uc/孔氚化胸苷的存在下重新铺板来评估增殖。通过闪烁计数评估增殖,并表示为每分钟计数(cpm)。treg扩增测定用人华顿氏胶msc覆盖t-175细颈瓶表面并允许其增殖直至75%汇合,此时将treg或tcon加入培养物中。在一些培养物中,利用了用于扩增上述treg的相同混合物。每周传代细胞,并随后收获细胞。下肢缺血测定根据nih推荐的程序和预防措施进行涉及小鼠的所有程序。将小鼠在标准室条件下饲养,随意饮食和水。尽一切努力使动物的痛苦最小化。在先前公布的模型中通过股动脉结扎和局部神经损伤处理balb/c小鼠(meng等人,2007,j.trans.med.5:57)。实施例1:用脐带血激活huvec先前的研究已经证明外周血源性treg细胞抑制来自huvec细胞的炎症标志物表达,然而,据我们所知,尚未评估treg细胞对huvec细胞增殖的影响。因此,我们检查了与不同浓度的脐带血treg细胞一起培养的huvec细胞的增殖。此外,为了评估treg细胞的激活状态是否影响huvec刺激活性,评估了新鲜分离的和il-2、cd3/cd28dynabead的huvec刺激活性。如图1所示,在与激活的treg共培养但未与幼稚treg共培养后,以剂量依赖性方式观察到huvec增殖的上调。此外,幼稚cd4+foxp3-t细胞(tcon)和激活的tcon都不能刺激huvec细胞增殖。为了确保增殖由t细胞介导,在用氚化胸苷脉冲之前将t细胞从huvec洗掉以评估增殖。vegf是一种众所周知的血管生成标志物,其在最终形成新血管的不同的细胞活动中发挥着基本性作用(gianni-barrera,r.等人,biochemsoctrans,2014.42(6):第1637-42页)。为了评估huvec增殖是否与血管生成活性相关,响应于与treg一起培养,测量通过huvec的vegf产生的评估。虽然vegf通常被认为是huvec增殖的刺激物,但是已经在huvec细胞中显示自分泌vegf,其被认为在它们的结构完整性中起作用。此外,已经证明huvec的激活诱导vegf产生的上调(gianni-barrera,r.等人,biochemsoctrans,2014.42(6):第1637-42页)。如图2所示,通过用激活的脐带血treg而不是对照细胞处理huvec观察到刺激vegf产生。此外,通过与激活的脐带血treg而不是与对照细胞共培养刺激vegf诱导的huvec增殖(图3)。为了评估与t细胞生物活性相关的分子信号是否影响treg刺激huvec增殖,在1:1的treg比huvec的培养物中进行针对ctla-4、pd-1和vegf的抗体添加。有趣地是,只有抗ctla4抗体能够剂量依赖性地抑制huvec细胞的自发和vegf刺激的增殖(图4)。该实施例证明了在一些实施方案中,调节性t细胞诱导血管生成。在一些实施方案中,处于激活状态的treg细胞能够刺激huvec增殖、vegf产生和对vegf的响应性。实施例2:分离基质血管部分细胞以下实施例证明了分离基质血管部分细胞的一个实例。使用无菌技术和局部麻醉,用有1:200,000肾上腺素的0.5%的利多卡因渗入脐下区。在止血10分钟后,使用连接至60cctoomey注射器的4mm套管以环切割辐射技术(circumcisionalradiatingtechnique)吸出500cc的脂肪组织。当9个注射器中的每一个被充满时,将注射器从套管中移出,加盖,并在无菌区内以无菌方式更换为新注射器。使用无菌实验室技术,将充满注射器的脂肪抽吸物置于两个无菌500ml离心容器中,并用无菌杜尔贝科氏磷酸盐缓冲盐水洗涤三次以去除红细胞。使用1:1的体积比将clyzyme/pbs(7ml/500ml)添加至经洗涤的脂肪抽吸物。将离心容器密封并置于37℃振荡水浴中1小时,然后在300rcf下离心5min。离心后,将基质细胞重悬在单独的无菌50ml离心管内的异溶剂(isolyte)中。将管在300rcf下离心5min,并去除异溶剂,留下细胞团块。将团块重悬于40ml异溶剂中,在300rcf下再次离心5min。再次去除上清液,并将细胞团块合并以及通过100μm细胞过滤器过滤到无菌50ml离心管中,并在300rcf下离心5min和去除上清液,留下成团块的脂肪基质细胞。实施例3:调节性t细胞的培养和扩增将冷冻保存的脐带血袋(1个单位袋)解冻并在含有0.5%hsa(baxterhealthcare,westlakevillage,ca)的clinimacs缓冲液(miltenyibiotec,bergishgladbach,德国)中洗涤,以纯化单个核细胞。随后,根据制造商的说明书(miltenyibiotec,bergishgladbach,德国),通过使用磁性激活的细胞分选(macs)的阳性选择进行细胞cd25+细胞富集。检查细胞的存活力,并随后通过与cd3/28共表达的(clinexvivotmcd3/cd28,invitrogendynalas,oslo,挪威)以1:3的细胞比珠比率共培养被刺激,以及以1×106个细胞/ml被重悬于补充有10%人ab血清(geminibio-products,sacramento,ca)、2mml-谷氨酰胺(sigma,st.louis,mo)、1%青霉素-链霉素(gibco/invitrogen,grandisland,ny)]和200iu/ml白介素(il)-2(chironcorporation,emeryville,ca)的x-vivo15培养基(cambrexbioscience,walkersville,md)中。将cd25+细胞和珠粒在37℃,5%co2空气气氛中,于组织培养瓶中进行离体共培养。通过每48-72小时添加新鲜培养基和il-2(维持200iu/ml)将cb源性cd25+富集的t细胞维持在1×106个细胞/ml。在一些培养物中进行华顿氏胶msc的添加。如上所述,在添加脐带血细胞之前,将所述msc以50%汇合度进行预铺板。实施例4:与msc饲养层共培养的增强的treg细胞扩增先前的研究已经证明间充质干细胞(msc)能够产生与细胞增殖相关的生长因子,诸如fgf(lai,w.t.,v.krishnappa,和d.g.phinney,stemcells,2011.29(7):第1102-11页;coutu,d.l.,m.francois,和j.galipeau,blood,2011.117(25):第6801-12页)、vegf(kinnaird,t.等人,circulation,2004.109(12):第1543-9页;kinnaird,t.等人,circres,2004.94(5):第678-85页;kwon,h.m.等人,vasculpharmacol,2014.63(1):第19-28页)、igf-1(montes,r.等人,cellres,2009.19(6):第698-709页)和hgf(shen,c.等人,molmedrep,2015.12(1):第20-30页)。事实上,msc饲养层先前已被用于扩增造血干细胞(walenda,t.等人,exphematol,2011.39(6):第617-28页;fong,c.y.等人,jcellbiochem,2012.113(2):第658-68页),和多能干细胞(zou,q.等人,plosone,2016.11(2):第e0149023页;silvadossantos,d.等人,cellmed,2014.7(1):第25-35页),同时将这些细胞维持在未分化状态。此外,已经证明msc在体外(cahill,e.f.等人,stemcellresther,2015.6:第19页;wang,z.x.等人,molcellbiochem,2015.400(1-2):第163-72页;kwon,m.s.等人,jneurochem,2014.131(2):第206-18页;luz-crawford,p.等人,stemcellresther,2013.4(3):第65页;erkers,t.等人,stemcelldev,2013.22(19):第2596-605页;engela,a.u.等人,clinexpimmunol,2013.173(2):第343-54页)和在体内(bai,l.等人,natneurosci,2012.15(6):第862-70页;lee,e.s.等人,plosone,2015.10(9):第e0138846页;treacy,o.等人,amjtransplant,2014.14(9):第2023-36页)促进treg细胞产生。当将经纯化的cd4+cd25+添加至具有il-2补充的标准cd3cd28珠中时,组织培养物中增加的细胞数在输入时为50,000个细胞,并且培养20天后为5000万个细胞。相比之下,在相同的培养期后,华顿氏胶饲养细胞上的培养导致从输入时的50,000个细胞产生500万个细胞(图5)。当使用混合物和msc饲养细胞的组合时,用培养扩增的treg显著增加了刺激huvec细胞增殖的能力(图6)。实施例5:在体外刺激血管生成将如实施例3中产生的treg细胞以指定浓度添加至huvec细胞,并在培养48小时后通过氚化胸苷评估增殖。实施例6:通过施用脐带血扩增的treg细胞保护免受肢体损失先前的研究已经证明骨髓间充质干细胞(msc)能够通过诱导侧支血管的形成,在肌内施用细胞后恢复下肢缺血模型的循环(hoffmann,j.等人,thoraccardiovascsurg,2010.58(3):第136-42页;iwase,t.等人,cardiovascres,2005.66(3):第543-51页)。因此,我们寻求确定扩增的treg细胞是否具有诱导相似治疗性血管生成的能力。鉴于脐带血扩增的treg细胞是人类来源的,利用对照人成纤维细胞。另外,将同源小鼠骨髓用作阳性对照。如图7所示,随着扩增,肢体损失得到了显著减少。实施例7:在体内刺激血管生成在先前公布的模型中通过股动脉结扎和局部神经损伤处理balb/c小鼠(meng等人,2007,j.trans.med.5:57)。将如实施例3中产生的treg在损伤后第3天肌内以2百万个细胞的浓度注射。与对照处理的小鼠相比,肢体损失显著更少。下面的两个表代表独立的实验。表1:表2:小鼠编号第7天第14天第21天第28天第35天对照1肢体损失对照2肢体损失对照3肢体损失对照4肢体损失对照5肢体损失对照6肢体损失对照7肢体损失处理8处理9处理10处理11处理12处理13处理14这些实施例证明,在一些实施方案中,体内激活的treg细胞刺激血管生成。在一些实施方案中,ctla-4的阻断诱导增殖的剂量依赖性抑制。先前已经显示ctla-4诱导抗原呈递细胞的改变,诸如经由cd80/cd86“外向内”信号传导诱导吲哚胺2,3脱氧酶产生(onodera,t.等人,jimmunol,2009.183(9):第5608-14页;fallarino,f.等人,natimmunol,2003.4(12):第1206-12页)。实施例8:在人中刺激血管生成可以将本文所述的激活的treg细胞用于增强和刺激人对象中的血管生成。选择被鉴定为患有缺血的人对象参与该研究。通过任何适合的递送方法将如实施例3中产生的激活的treg细胞移植到人对象。例如,通过注射在适合的载体或稀释剂中的细胞,或通过手术递送至内部或外部靶位点,或通过导管到血管可到达的位点,将细胞直接施用于靶位点(诸如肢体、心肌或脑)。一些注射模式包括肌内注射。为了精确放置,可以使用立体定向注射技术将细胞精确地递送至位点中。例如通过增强血管生成,将细胞以有效量(即以能够在受治疗的对象中产生期望的结果的量)施用至对象。可以凭经验确定此类治疗有效量。该范围可以基于对象的年龄或体型以及基于病况的严重程度而显著变化。通常,可以以范围为每次施用约104-107个细胞(包括1×104、1×105、2×105、3×105、4×105、5×105、6×105、7×105、8×105、9×105、1×106、2×106、3×106、4×106、5×106、6×106、7×106、8×106、9×106、1×107、2×107、3×107、4×107、5×107、6×107、7×107、8×107或9×107个细胞)的量或由上述值的任何两个限定的范围内的量施用细胞。在一些实施方案中,以单次注射施用treg。在一些实施方案中,在整个治疗期间以多剂量施用treg。在一些实施方案中,将分离的treg细胞群以每日数次、每日一次、每周一次、每月一次、每季度一次或每年一次施用,或以任何上述周期之间的频率施用。可以以任何适合的制剂或组合物将细胞施用至对象。可以基于施用模式和途径所选择的方式,将组合物或制剂单独或与药学上可接受的载体组合施用给至对象。在remington’spharmaceuticalsciences中可以找到示例性药学上可接受的载体和稀释剂,以及药物制剂的描述。可以将其它物质添加至组合物以稳定和/或保存组合物。一经施用组合物,可以评估对象以确定组合物的功效,以确定提供另外剂量的适当性。改善或增强血管生成的指标包括心跳的程度(measure)和起搏、新血管生长的程度、改善的至某一区域或组织的血流量的程度、或组织健康和外观的程度。实施例9:修复新生血管病变可以将本文公开的激活的treg细胞用于修复新生血管病变。在一些有需要的患者中,视网膜色素上皮(rpe)细胞围绕着与新生血管年龄相关的黄斑变性(amd)相关的新生血管病变,并且与水肿减少、脉络膜新生血管化(cnv)减少和cnv病变生长减少相关。由rpe细胞介导的这种伤口愈合过程封闭了新生血管病变,以重整将视网膜与入侵脉络膜血管分开的完整rpe层。一旦rpe重整了完整的层,就会稳定新生血管病变。因此,向这些患者施用激活的treg细胞可以促进新生血管病变位点处的rpe层,并从而促进伤口愈合,以更有效地封闭新生血管病变并减少对抗新生血管治疗的需要。虽然不旨在受任何特定理论或作用机制的束缚,但据信用激活的treg细胞治疗可以导致产生更大比例的rpe细胞(其于新生血管病变中发生的炎性损伤中存活),增强迁移到位点以封闭病变的正常rpe表型;稳定rpe表型,并抑制rpe分化成不期望的细胞类型(诸如成纤维细胞)。可以通过眼内注射(包括例如,玻璃体内、视网膜下、前房内、巩膜内)或眼周(包括例如局部施加至角膜、结膜下、眼球筋膜下(subtenon)或经巩膜)来施用激活的treg细胞。可以以范围为每次施用约104-107个细胞(包括1×104、1×105、2×105、3×105、4×105、5×105、6×105、7×105、8×105、9×105、1×106、2×106、3×106、4×106、5×106、6×106、7×106、8×106、9×106、1×107、2×107、3×107、4×107、5×107、6×107、7×107、8×107或9×107个细胞)的量或由上述值的任何两个限定的范围内的量施用细胞。在一些实施方案中,以单次注射施用treg。在一些实施方案中,在整个治疗期间以多剂量施用treg。在一些实施方案中,将分离的treg细胞群以每日数次、每日一次、每周一次、每月一次、每季度一次或每年一次施用,或以任何上述周期之间的频率施用。可以根据施用的模式和途径,用适当的药学上可接受的载体和稀释剂来配制组合物。也可以通过以类似方式施用激活的treg细胞来修复与视网膜无关的其它形式的新生血管病变,其中将激活的treg细胞施用至新生血管病变的位点。可以将激活的treg细胞通过任何可接受的途径施用,包括肌内注射或直接手术移植至病变位点。可以以范围为每次施用约104-107个细胞(包括1×104、1×105、2×105、3×105、4×105、5×105、6×105、7×105、8×105、9×105、1×106、2×106、3×106、4×106、5×106、6×106、7×106、8×106、9×106、1×107、2×107、3×107、4×107、5×107、6×107、7×107、8×107或9×107个细胞)的量或由上述任何值的两个限定的范围内的量施用激活的treg细胞。在一些实施方案中,以单次注射施用treg。在一些实施方案中,在整个治疗期间以多剂量施用treg。在一些实施方案中,将分离的treg细胞群以每日数次、每日一次、每周一次、每月一次、每季度一次或每年一次施用,或以任何上述周期之间的频率施用。实施例10:严重肢体缺血招募了5名患有严重肢体缺血的患者。患者符合以下纳入标准:a)将由未参与该研究的血管外科医生确定不可重建的动脉疾病。通过四肢动脉树内的动脉闭塞性病变限定不可重建的动脉疾病,其由于程度或形态不适合手术旁路或ptca和支架术;b)严重外周动脉疾病的客观证据将包括踝臂指数(abi)小于0.55,和/或静息趾臂指数(tbi)小于40;c)患者必须有能力同意;和d)除非非黑色素瘤皮肤癌没有恶性疾病史,胸部x-射线、乳房x线摄影(35岁以上的女性)、巴氏涂片(papanicolaousmear)(40岁以上的女性)、正常的粪便潜血(50岁以上)和正常的前列腺特异性抗原(45岁以上的男性)无可疑发现。向患者注射如上述实施例中所述产生的10(8)个脐带血扩增的调节性t细胞。每次注射使用1000万个细胞进行注射,其中在腓肠肌中的10cmx10cm区域内灌注失败的区域处局部注射10次。通过比较踝压和臂压来测量踝臂指数。没有患者在研究期间报告截肢。实施方案本文描述的一些方面还涉及以下编号的实施方案。1.刺激血管生成的方法,其包括以下步骤:a)获得含有调节性t细胞的细胞群;b)从所述细胞群选择所述调节性t细胞;c)激活所述调节性t细胞以增强所述调节性t细胞的血管生成活性;和d)向需要治疗的患者施用所述调节性t细胞。2.如实施方案1所述的方法,其中所述含有调节性t细胞的细胞群是外周血单个核细胞。3.如实施方案1所述的方法,其中所述含有调节性t细胞的细胞群是经动员的外周血单个核细胞。4.如实施方案3所述的方法,其中通过施用g-csf实现所述动员。5.如实施方案3所述的方法,其中通过施用flt-3配体实现所述动员。6.如实施方案3所述的方法,其中通过施用促血小板生成素实现所述动员。7.如实施方案3所述的方法,其中通过施用普乐沙福(mozobil)实现所述动员。8.如实施方案1所述的方法,其中所述含有调节性t细胞的细胞群是脐带血。9.如实施方案1所述的方法,其中所述含有调节性t细胞的细胞群是月经血。10.如实施方案1所述的方法,其中所述含有调节性t细胞的细胞群是脂肪源性基质血管部分细胞。11.如实施方案1所述的方法,其中所述调节性t细胞具有抑制用激活增殖的信号刺激的幼稚t细胞的增殖的能力。12.如实施方案11所述的方法,其中所述激活增殖的信号选自:a)抗cd3和抗cd28珠;b)伴刀豆球蛋白a;c)pha;和d)用同种异体反应性抗原呈递细胞刺激。13.如实施方案1所述的方法,其中所述调节性t细胞能够抑制树突细胞成熟。14.如实施方案13所述的方法,其中所述树突细胞成熟是选自以下的分子的上调:cd80;cd40;cd86;和hlaii。15.如实施方案1所述的方法,其中所述调节性t细胞具有gitr配体的表达。16.如实施方案1所述的方法,其中所述调节性t细胞表达神经纤毛蛋白-1。17.如实施方案1所述的方法,其中所述调节性t细胞表达ctla-4。18.如实施方案1所述的方法,其中所述调节性t细胞表达cd25。19.如实施方案1所述的方法,其中所述调节性t细胞表达cd105。20.如实施方案1所述的方法,其中所述调节性t细胞表达膜结合的tgf-β。21.如实施方案1所述的方法,其中所述调节性t细胞产生il-10。22.如实施方案1所述的方法,其中通过暴露于血管活性肠肽来激活所述调节性t细胞。23.如实施方案1所述的方法,其中通过暴露于il-10来激活所述调节性t细胞。24.如实施方案1所述的方法,其中通过暴露于tgf-β来激活所述调节性t细胞。25.如实施方案1所述的方法,其中通过暴露于间充质干细胞条件化培养基来激活所述调节性t细胞。26.如实施方案1所述的方法,其中通过暴露于间充质干细胞源性外来体来激活所述调节性t细胞。27.如实施方案1所述的方法,其中通过暴露于bdnf来激活所述调节性t细胞。28.如实施方案1所述的方法,其中通过暴露于人绒毛膜促性腺激素来激活所述调节性t细胞。29.如实施方案1所述的方法,其中通过暴露于vegf来激活所述调节性t细胞。30.如实施方案1所述的方法,其中通过暴露于cd3和cd28抗体来激活所述调节性t细胞。31.如实施方案1所述的方法,其中所述调节性t细胞是无能性t细胞。32.如实施方案1所述的方法,其中通过暴露于缺氧条件来激活所述调节性t细胞。33.如实施方案1所述的方法,其中通过暴露于血管生成素来激活所述调节性t细胞。34.如实施方案1所述的方法,其中所述调节性t细胞表达foxp3。35.如实施方案1所述的方法,其中所述调节性t细胞表达cd39。36.如实施方案1所述的方法,其中所述调节性t细胞表达cd73。37.如实施方案1所述的方法,其中所述调节性t细胞表达cd127。38.如实施方案1所述的方法,其中所述调节性t细胞表达garp。39.如实施方案1所述的方法,其中通过暴露于雷帕霉素来激活所述调节性t细胞。40.如实施方案1所述的方法,其中通过与间充质干细胞一起培养来激活所述调节性t细胞。41.如实施方案40所述的方法,其中从以下获得所述间充质干细胞:a)脂肪;b)骨髓;c)牙髓;d)毛囊;e)子宫内膜;f)月经血;g)外周血;h)网膜;i)皮肤;j)脐带血;k)华顿氏胶;l)胎盘;和m)输卵管。42.如实施方案41所述的方法,其中所述脂肪源性间充质干细胞是具有以下标志物的经扩增纯化的间充质干细胞:a)cd90;b)cd105和c)cd73。43.如实施方案41所述的方法,其中所述脂肪源性间充质干细胞是基质血管部分细胞。44.如实施方案43所述的方法,其中通过以下步骤分离所述基质血管部分细胞:使用无菌技术和局部麻醉,用有1:200,000肾上腺素的0.5%的利多卡因渗入脐下区;在允许止血10分钟后,使用连接至60cctoomey注射器的4mm套管以环切割辐射技术吸出500cc的脂肪组织;当9个注射器中的每一个被充满时,将所述注射器从套管中移出,加盖,并在无菌区内以无菌方式更换为新注射器;使用无菌实验室技术,将充满注射器的脂肪抽吸物置于两个无菌500ml离心容器中,并用无菌杜尔贝科氏磷酸盐缓冲盐水洗涤三次以去除红细胞;使用1:1的体积比将clyzyme/pbs(7ml/500ml)添加至经洗涤的脂肪抽吸物;将所述离心容器密封并置于37℃振荡水浴中1小时,然后在300rcf下离心5min;离心后,将基质细胞重悬在单独的无菌50ml离心管内的异溶剂中;将所述管在300rcf下离心5min,并去除异溶剂,留下细胞团块;将所述团块重悬于40ml异溶剂中,在300rcf下再次离心5min;再次去除所述上清液;将所述细胞团块合并并通过100μm细胞过滤器过滤到无菌50ml离心管中,并在300rcf下离心5min和去除所述上清液,留下成团块的脂肪基质细胞。45.如实施方案41所述的方法,其中,其中针对选自以下标志物阳性选择所述脂肪源性细胞:a)cd105;b)cd73;c)cd44;d)cd90;e)vegfr2;和f)tem-1。46.如实施方案45所述的方法,其中针对选自以下的标志物阴性选择所述脂肪源性细胞:a)hla-dr;b)cd45;和c)cd14。47.如实施方案41所述的方法,其中针对标志物stro-1的表达选择所述骨髓间充质干细胞。48.如实施方案41所述的方法,其中针对标志物cd73的表达选择所述骨髓间充质干细胞。49.如实施方案41所述的方法,其中针对标志物醛脱氢酶的表达选择所述骨髓间充质干细胞。50.如实施方案41所述的方法,其中针对抑制混合的淋巴细胞反应的能力选择所述骨髓间充质干细胞。51.如实施方案41所述的方法,其中所述骨髓间充质干细胞表达标志物ngf受体p75。52.如实施方案41所述的方法,其中所述子宫内膜源性间充质干细胞是子宫内膜再生细胞。53.刺激血管生成的方法,其包括施用调节性t细胞至缺血性组织中。54.如实施方案53所述的方法,其中所述缺血性组织是患有外周动脉疾病的患者的肢体。55.如实施方案53所述的方法,其中所述缺血性组织是患有严重肢体缺血的患者的肢体。56.如实施方案53所述的方法,其中所述缺血性组织是患有冠状动脉疾病的患者的心肌。57.如实施方案53所述的方法,其中所述缺血性组织是患有心脏病的患者的心肌。58.如实施方案53所述的方法,其中所述调节性t细胞表达标志物cd25。59.如实施方案53所述的方法,其中所述调节性t细胞表达标志物ctla4。60.如实施方案53所述的方法,其中所述调节性t细胞具有以下的能力:以1个调节性t细胞比1个激活的t细胞的比率,对激活的t细胞的增殖抑制大于25%。61.如实施方案53所述的方法,其中所述调节性t细胞具有抑制树突细胞成熟的能力。62.如实施方案61所述的方法,其中所述树突细胞成熟被限定为cd80的上调。63.如实施方案61所述的方法,其中所述树突细胞成熟被限定为cd86的上调。64.如实施方案61所述的方法,其中所述树突细胞成熟被限定为cd40的上调。65.如实施方案53所述的方法,其中所述调节性t细胞来源于脐带血。66.如实施方案53所述的方法,其中所述调节性t细胞来源于外周血。67.如实施方案53所述的方法,其中所述调节性t细胞来源于月经血。68.如实施方案53所述的方法,其中所述调节性t细胞来源于经动员的外周血。69.如实施方案68所述的方法,其中通过施用g-csf实现所述动员。70.如实施方案68所述的方法,其中通过施用普乐沙福实现所述动员。71.如实施方案53所述的方法,其中由诱导cd3细胞内信号传导的试剂激活所述调节性t细胞。72.如实施方案53所述的方法,其中通过雷帕霉素处理来激活所述调节性t细胞。73.如实施方案53所述的方法,其中通过用抗cd3和抗cd28抗体培养来激活所述调节性t细胞。74.如实施方案73所述的方法,其中将所述抗cd3和抗cd28抗体结合至表面。75.如实施方案74所述的方法,其中所述表面是珠。76.如实施方案53所述的方法,其中所述调节性t细胞的所述激活通过在来自以下的一种或多种试剂组成的组合中培养而被实现:a)il-2;b)雷帕霉素;c)抗cd3抗体;和d)抗cd28抗体。77.如实施方案76所述的方法,其中将间充质干细胞添加至所述培养物。78.刺激血管生成的方法,其通过施用同种异体调节性t细胞连同血管生成细胞群来进行。79.如实施方案78所述的方法,其中所述血管生成细胞群是内皮祖细胞。80.如实施方案78所述的方法,其中所述血管生成细胞群是间充质干细胞。81.如实施方案78所述的方法,其中所述血管生成细胞群是间充质祖细胞。82.如实施方案78所述的方法,其中所述血管生成细胞群是外周血单个核细胞。83.如实施方案78所述的方法,其中所述血管生成细胞群是骨髓单个核细胞。84.如实施方案78所述的方法,其中所述血管生成细胞群是cd34阳性细胞。85.如实施方案78所述的方法,其中所述血管生成细胞群是cd133阳性细胞。虽然本发明易于进行各种修改和替代形式,但是已经在附图中显示并在本文中详细描述其具体实施例。然而,应当理解,本发明不限于所公开的特定形式或方法,相反,本发明将涵盖落入所述的各种实施方案和所附权利要求的精神和范围内的所有修改、等同物和替代物。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1