脂肪及其医疗用途的制作方法
本发明涉及微片段脂肪组织或包含微片段脂肪组织的组合物,其用于治疗全身性疾病,优选与脓毒病相关或由脓毒病引起。此外,微片段脂肪组织或包含微片段脂肪组织的组合物用于治疗全身性,炎性,免疫性或慢性疾病,所述疾病是脓毒性疾病的结果。优选地,微片段脂肪组织可用于治疗脓毒病的急性(早期)和晚期。
背景技术:
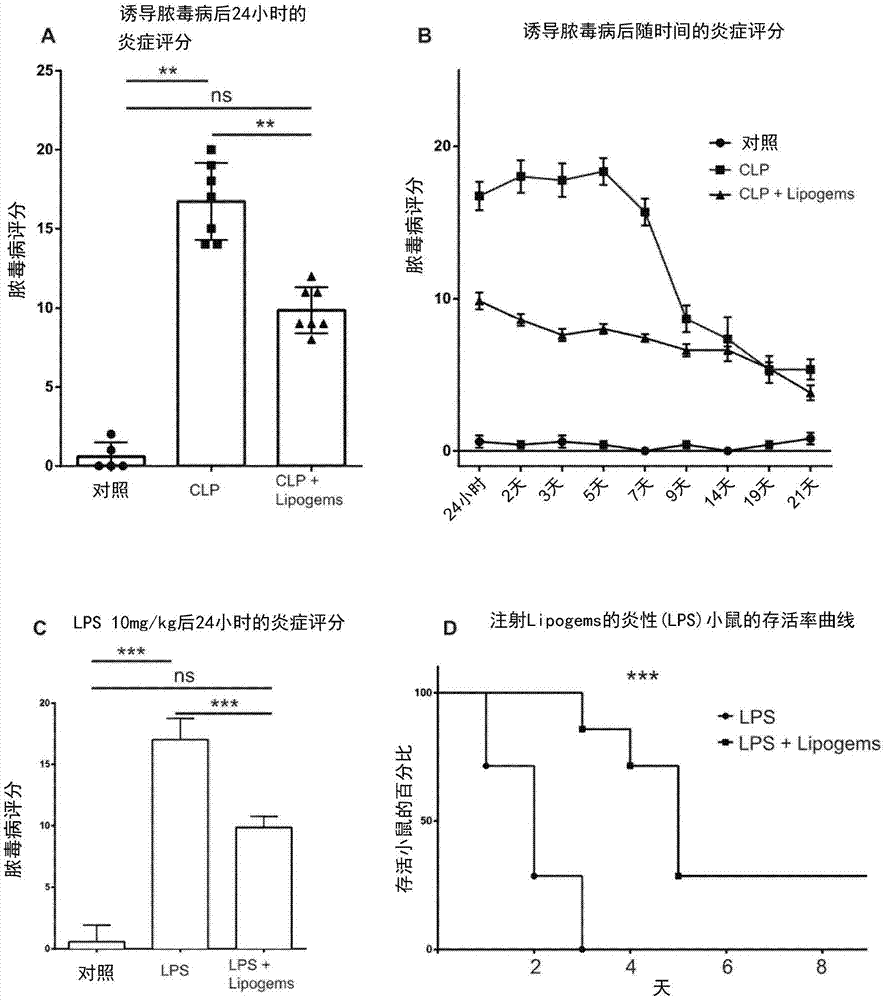
:脓毒病或全身炎症响应综合征被定义为由感染诱导的生理,病理和生化异常的综合征,导致全身性不受控制的炎症响应,引起血管渗漏,组织损伤,多器官衰竭。目前,由于可用的治疗不是很有效,脓毒病在30%至40%的病例中会导致死亡。据报道,脓毒病每年在美国造成20多万人死亡。因此,脓毒病显著增加了医疗保健的总体成本。如今,尽管脓毒病患者的管理越来越好,但脓毒病相关的发病率正在增加。例如,在一半的病例中,存活的患者的状态因后天性神经病变而复杂化,并且患者可能由于肌肉无力和消瘦,能量功能障碍和蛋白水解而面临长期残疾。与脓毒病相关的有害作用部分是由于损害组织和器官的不受控制的细胞因子风暴。此外,炎症通路的广泛激活进展为多器官功能障碍,循环系统崩溃并最终死亡。鉴于上述所有考虑因素,仍然强烈需要开发治疗这些全身性疾病,特别是脓毒病的新的/替代治疗方法。技术实现要素:本发明通过使用/施用微片段脂肪组织,优选通过腹膜内途径,解决了上述需要。实际上,申请人惊奇地发现,例如,用微片段脂肪组织治疗的脓毒病个体显示出与脓毒病相关或由脓毒病引起的大多数有害作用的减少。更有趣的是,微片段脂肪组织的使用/施用恢复了脓毒病急性期和晚期典型的损伤。微片段脂肪组织的使用/施用在挽救与脓毒病相关的长期作用(例如器官功能障碍和/或损伤,肌肉无力或认知障碍)方面特别有效。实际上,申请人已经观察到用微片段脂肪组织治疗的小鼠的存活率的提高和脓毒病评分的持续降低。此外,经处理的小鼠显示出体温和生物学参数的正常化,促炎细胞因子水平的降低和抗炎细胞因子水平的增加。此外,经处理的小鼠还显示肝脏和肺中免疫细胞的浸润减少。最后,给予微片段脂肪组织能够恢复与脓毒病晚期相关的神经肌病和肌肉无力/消瘦。附图的简要说明图1显示注射lipogems(微片段脂肪组织)或盐水的clp小鼠的脓毒病评分(a-b),以及注射或未注射lipogems(微片段脂肪组织)的lps处理小鼠的脓毒病评分和存活率(c-d)。图2显示了注射盐水或lipogems(微片段脂肪组织)的clp小鼠的存活率(a)和体温(b)。图3显示丙氨酸氨基转移酶(alt),天冬氨酸氨基转移酶(ast),碱性磷酸酶(ap),肌酸激酶(ck)和乳酸脱氢酶(ldh)的血浆水平(a);用盐水或lipogems(微片段脂肪组织)注射的clp冰中的白细胞计数(b-c)。图4显示了注射或不注射lipogems(微片段脂肪组织)的clp小鼠中的促炎细胞因子水平。图5显示注射或不注射lipogems(微片段脂肪组织)的clp小鼠肝脏和肾脏中f4/80+,b220+和cd3+细胞的数量。图6显示注射lipogems,lipogems+吲哚美辛,lipogems+sc-560和lipogems+ls-398(lipogems=微片段脂肪组织)的clp小鼠的炎症评分(a),存活率(b),白细胞计数(c)和促炎细胞因子水平(d)。本发明优选实施方式详述本发明的第一方面涉及微片段脂肪组织或包含微片段脂肪组织的组合物,其用于治疗全身性疾病或全身性病症,优选与脓毒病相关或由脓毒病引起的全身性疾病或全身性病症。换句话说,根据本发明,微片段脂肪组织可用于改善(恢复和/或挽救)与全身性疾病或全身性疾病相关的有害健康影响,优选与脓毒病相关或由脓毒病引起,优选与脓毒病相关或由脓毒病引起的长期影响。因此,本发明的第一方面涉及治疗全身性病症或全身性疾病的方法,优选与脓毒病相关或由脓毒病引起的疾病/病症,所述方法包括至少一个步骤的给予有需要的个体有效量的微片段脂肪组织或包含微片段脂肪组织的组合物。所述疾病或病症优选是全身性,炎性,免疫或慢性疾病/病症,所述疾病/病症是由脓毒病疾病/病症引起的。根据优选的实施方案,疾病或病症与前列腺素合成和/或非cox靶标有关。因此,病症或疾病是非cox靶标介导的。换句话说,它不涉及cox,优选cox-2途径。实际上,这些酶的抑制剂不会损害本发明的治疗效果。在本文中,全身性病症或全身性疾病被定义为影响许多器官和组织或者甚至整个身体的病症或疾病。在本文中,脓毒病也意味着全身性炎症反应综合征。在本文中,脓毒病或全身性炎症反应综合征是指导致全身不受控制的炎症反应的感染,它引起血管渗漏,组织损伤和/或多器官衰竭。特别是,在脓毒病的晚期阶段,这些影响可导致神经肌肉病,肌肉无力,能量功能障碍,蛋白水解,肌肉萎缩,最终甚至导致脓毒病个体死亡。在本文中,与脓毒病相关的有害健康影响优选选自:神经肌病,能量功能障碍,蛋白水解,肌肉萎缩,急性肾和肝损伤,多器官功能障碍和可能的死亡。优选地,急性期损伤影响选自:体温变化,细胞因子风暴(巨大和快速增加)和pct(降钙素)增加。晚期有害作用(或脓毒病的长期作用)优选选自:器官功能障碍和/或损伤,急性肺损伤,休克,肾衰竭,肌肉损失和/或虚弱,认知障碍(失眠,恶梦,生动幻觉和恐慌发作,极度疲劳,注意力不集中,精神功能下降,自尊和自信心丧失),以及多器官功能障碍综合征(mods)。优选地,微片段脂肪组织是非酶促微片段脂肪组织。换句话说,本发明中使用/施用的脂肪已经微片段化而没有任何酶处理。根据本发明的另一个优选实施方案,微片段脂肪组织,优选脂肪抽吸物,通过使用装置获得,更优选根据专利申请wo2011/145075中完全公开的方法获得。优选地,将分离的脂肪引入装置中,并在溶液(优选盐水溶液)的存在下通过温和的机械力以小的组织簇逐渐减小(片段化)。优选地,微片段脂肪包含尺寸为50至5000μm,优选100至3000μm,更优选200至2500μm,更优选300至1500μm,更优选400至900μm的脂肪簇。更优选地,这些脂肪簇包括间充质干细胞(msc)和/或周细胞,优选周细胞相关的msc和/或脂肪干细胞和/或内皮细胞和/或成纤维细胞和/或脂肪细胞。这些细胞进入脂肪簇维持其生态环境,这意味着细胞保持其天然/完整的基质血管生态环境。因此,有利地,这些细胞在营养和/或信号传导方面由基质支持。此外,它们在移植过程中受到保护,不受侵蚀性环境和任何物理和化学外部侵害(如机械,氧等)的影响。根据本发明的优选实施方案,与没有经过本申请所述的微片段化过程以及专利申请wo2011/145075中所述的非微片段组织(即脂肪组织,优选脂肪抽吸物)相比,微片段脂肪组织,优选微片段脂肪抽吸物具有较高的微血管含量,优选较高的cd31+细胞含量,更优选5-10倍的较高的cd31+细胞。根据本发明的另一个优选实施方案,与没有经过本申请所述所述的微片段化过程以及专利申请wo2011/145075中的非微片段组织(即脂肪组织,优选脂肪抽吸物)相比,微片段脂肪组织,优选微片段脂肪抽吸物具有较高含量的更大血管和/或周细胞数量,即ng2阳性细胞。因此,本发明的微片段脂肪组织,优选微片段脂肪抽吸物优选包含:-大小为50至5000μm的组织簇;和/或-间充质干细胞(msc)和/或周细胞,优选周细胞相关的msc和/或脂肪干细胞和/或内皮细胞和/或成纤维细胞和/或脂肪细胞;和/或-优选不含血液残留物和促炎油性物质。这些细胞(优选脂肪间充质干细胞)表达至少一种选自以下的标记物(优选所有标记物):cd44,cd73,cd90,cd105,cd146和cd166,优选还有至少一种选自以下的标记物(更优选全部):oct4,sox2,nanog,b-微管蛋白iiinestin,neurod1,musashi1,pax6和sox3。更优选地,这些细胞共表达巢蛋白,b-微管蛋白iii,gfap和o4。通过使用包含在装置中的一种或多种片段化/分散机构实现受控的脂肪片段化。优选地,该机构是金属机构,更优选金属珠,其中所述珠的尺寸优选为0.1-30毫米,优选1-20毫米,更优选5-10毫米,更优选7.5-8.5毫米。该装置的受控摇动使得整个脂肪组织中的片段化/分散机构的轻微移动,因此进行温和的脂肪片段化/分散。优选地,片段化/分散在流动的盐水缓冲液,更优选连续流动的盐水缓冲液中进行,允许去除油和血液残余物。脂肪片段化/分散步骤优选需要15-20分钟。因此,通过使用温和,无酶,无菌,术内和快速操作获得本发明的微片段脂肪组织。本发明的脂肪组织优选为人来源。根据优选的实施方案,脂肪组织是人脂肪组织,更优选来自个体的下腹部和/或外侧腹部区域的人脂肪组织,更优选分离/脂肪抽吸物。然而,所述脂肪组织可以从任何有用的身体区域分离。优选地,脂肪组织,优选微片段脂肪组织是自体的或异源的。根据本发明的优选实施方案,受脓毒病影响的个体是人。根据本发明的另一个优选实施方案,脓毒病是医院获得的或其与细菌、真菌或病毒感染有关。优选地,根据本发明的脓毒病病症/疾病涉及促炎分子的错误调节,所述分子优选地选自但不限于:il-1a,il-1b,il-2,il-5,il-6,il-12,il-17,gm-csf,ifn-g,mip-1a,mip-1b,rantes,降钙素原(pct)分子和肌酸激酶(ck)和tnf-a。优选地,根据本发明的脓毒病病症/疾病涉及抗炎分子的错误调节,所述分子优选地选自但不限于:il-4,il-10,il-13和g-csf。实际上,在脓毒病个体中微片段化脂肪施用后,抗炎分子被上调,而促炎分子被下调。因此,可以使用/施用微片段脂肪以减少促炎分子,优选地选自但不限于:il-1a,il-1b,il-2,il-5,il-6,il-12,il-17,gm-csf,ifn-g,mip-1a,mip-1b,rantes,和/或用于增加抗炎分子,优选选自:il-4,il-10,il-13和g-csf。根据本发明的优选实施方案,用于治疗全身性疾病或病症,优选脓毒病或与脓毒病相关(由脓毒病引起)的病症的微片段脂肪是用于腹膜内,肌肉内,肺泡,鼻,肺,鞘内,通过筛板(嵴板(laminacribra)),优选使用鼻腔途径或淋巴给予。最优选的给药途径是腹膜内途径。优选地,微片段脂肪组织或包含微片段脂肪组织的组合物本身或与其他分子,优选抗炎剂和/或抗生素剂组合施用。根据一个优选的实施方案,给药与其他治疗联合或在其他治疗后进行:-感染部位的手术;和/或-血液动力学的再平衡,优选通过注射电解质;和/或-强心剂和/或血管活性物质(如儿茶酚胺)分子给药;和/或-皮质疗法,优选低剂量;和/或-呼吸,最好通过通气帮助;和/或-血液透析和/或胰岛素治疗;和/或-输血-输血。优选地,根据当前的临床实践剂量,当脓毒病症状出现时,在最初的6小时内(称为医学界的黄金时段)进行使用/施用。或者,使用/施用在脓毒病症状出现后几天和/或数周发生。实施例小鼠和饲养条件所有协议均由主管当局巴斯德研究所(institutpasteur)审查,以遵守法国和欧洲动物福利法规和公共卫生服务建议。使用的小鼠是6至10周龄的c57b1/6rjrj雄性。如果在任何给定时间点的炎症评分大于21,或者如果归因于呼吸速率或质量的点增加超过3,则对小鼠实施安乐死22。除非另有说明,否则对于每个实验,非clp对照使用的动物总数为5,实验点clp为7,组为7。实验总是独立重复两次。对于lps激发,我们使用n=4只动物进行对照,n=8只动物用于lps,n=8只动物用于lps+lipogems组。将小鼠在无病原体设施中以12:12光/暗循环饲养,温度和湿度受控。随意提供食物和饮料。始终遵循arrive良好实践实验研究指南。盲肠结扎和穿刺(clp)和脂多糖(lps)注射我们在本研究中使用了两种脓毒病小鼠模型:1.盲肠结扎和穿刺20(clp)模型。其包括在雄性6至10周龄c57b1/6rjrj中由clp诱导腹膜炎作为炎症模型。clp模型包括盲肠穿孔,允许粪便物质释放到腹膜腔中以产生由多微生物感染诱导的恶化的免疫应答。液体复苏的clp的小鼠显示出第一(早期)高动力阶段,其在时间上进展到第二(晚期)低动力学阶段。在手术前用氯胺酮(imalgene1000100mg/kgmerial)和甲苯噻嗪(rompun2%20mg/kgbayer)腹腔注射麻醉动物。剖腹手术后,用4.0缝合线将盲肠在远端三分之一处结扎,并用21号针头将远端部分穿孔两次。将所有组小鼠水合并在手术后每天两次用镇痛药(丁丙诺啡axience0.3mg/kg)治疗4天。2.lps给予。腹膜内施用lps以达到10mg/kg,储存在0.9%nacl中的10mg/ml储备溶液根据小鼠体重校正。进行该组以确认仅对主要目标(炎症评分和存活率)的影响。在两种模型中,对照动物仅用氯胺酮(imalgene1000100mg/kgmerial)和甲苯噻嗪(rompun2%20mg/kgbayer)以相同剂量腹腔注射麻醉。所有外科手术均在早晨在无菌罩下进行。收获每位患者签署了无异议的知情同意书用于研究手术组织(否则将用于销毁)。患者的数据收集在法国国家个人数据保护局批准后建立的前瞻性数据库中(委员会国家信息和自由委员会:cnil.https://www.cnil.fr.registrationnumber1922081–02.02.2016)。-人体脂肪组织的收获使用源自传统手术吸脂术的技术,选择下腹部或外侧腹部区域作为用于脂肪组织采集的供体部位。沿着它分布有多个1×2mm的椭圆形孔的钝的13g套管用于脂肪组织收获。这种一次性套管与10cc注射器连接,可以快速无损伤地采集脂肪组织,只需很少的套管冲程。在所选区域用盐水和1:1000肾上腺素的肿胀浸润后10分钟收获脂肪组织。-使用装置处理脂肪组织收获的脂肪组织立即在封闭系统中处理。微片段化、洗涤和过滤的机械过程在完全浸没在生理溶液中的系统中进行,避免空气的存在,以便减少体积并最小化对细胞产品的任何创伤作用。得到的产物含有保留在完整的基质血管壁生态环境内的周细胞/msc,准备好在移植后与受体组织相互作用。将纯化的脂肪组织收集在60cc注射器中并定位以通过重力轻轻倾析以除去过量的盐水溶液。然后将产品转移到几个1cc注射器中,在受体小鼠中腹膜内再注射。环氧合酶抑制剂在递送时腹膜内注射的地方,对小鼠进行环加氧酶抑制剂的注射。用吲哚美辛(以10mg/kg使用的cox酶的非选择性抑制剂;西格玛-奥德里奇公司(sigma-aldrich),i7378,usa)或sc-560(cox1的选择性抑制剂,以6mg/kg使用;西格玛-奥德里奇公司,s2064,usa)或ns-398(以6mg/kg使用的cox2的选择性抑制剂;西格玛-奥德里奇公司,n194,usa)进行注射。每8小时进行注射持续24小时。所有注射均进行体重校正,从在0.9%nacl中注射前新鲜制备的10mg/ml溶液开始。对照组注射相同体积的0.9%nacl。对于这组实验,我们使用n=8只脓毒病clp小鼠,n=8只脓毒病小鼠和n=5只对照(非脓毒病非注射小鼠)。独立实验重复两次。(多重免疫分析)在肝素涂覆的eppendorf管和注射器中从心脏穿刺中收集血液。将血液以1500rpm在4℃旋转10分钟,收集上清液(血浆)并冷冻。将冷冻血浆解冻并加工用于多细胞因子和趋化因子分析(protm小鼠细胞因子标准23-plex,组i和标准9-plex,组ii)。炎性细胞因子的研究在对照,脓毒病(clp),注射的脓毒病小鼠上进行。对于这组实验,我们使用n=7只脓毒病clp小鼠,n=7只脓毒病小鼠和n=5只对照(非脓毒病非注射小鼠)。苏木精和伊红(h&e)染色和免疫组织化学对于h&e分析,将器官在4%甲醛中固定2天,并在60℃下包埋在石蜡中。然后将组织切成50μm并放置过夜干燥。将切片浸入苏木精中30秒。用醇酸和氨水洗涤后,将它们浸入曙红中15秒。每个步骤后,用蒸馏水冲洗切片。然后通过用浓度逐渐增加的醇(70%,80%,95%和100%)处理使切片脱水。最后,用二甲苯处理切片并用玻璃片覆盖。对于免疫染色,使用标准技术制备冷冻的连续10-μm切片。用多聚甲醛4%固定所有组织15分钟并用pbs洗涤。然后将组织与pbs中的0.5%tritonx100和3%bsa(牛血清白蛋白)一起温育30分钟。在充分洗涤后,将第一抗体在pbs中于37℃温育1小时。然后用pbs洗涤切片并暴露于二级抗体(histofine,在室温下针对正确宿主的简单染色maxpo过氧化物酶聚合物50分钟)。与所有免疫组织化学染色同时进行阴性对照(没有一级抗体的染色)。对于组织学计数,我们使用n=4对照,n=5脓毒病小鼠(clp)或计数在双盲中手动完成。使用的抗体列表如下:抗-cd3,dako#a0452;抗-cd4pharmigen#550280;抗-f4/80invitrogen#rm2600;抗-cd45r(b220)invitrogen#a14748;抗生物素化的jackson#712065150。测定。一级终点:一级终点是clp后24小时炎症评分的评估(表1)。为了比较和确认目的,在用10mg/kgiplps注射的小鼠中也在24小时计算该评分。二级终点:测量的二级终点包括直至炎症后第21天的存活和体温,天冬氨酸氨基转移酶(asat),丙氨酸氨基转移酶(alat),碱性磷酸酶(ap),乳酸脱氢酶(ldh)和肌酸激酶(ck)的血浆水平,在clp后24小时和直至第21天的白细胞计数以及促炎和抗炎细胞因子的血浆水平,clp后6小时肝脏和肾脏中f4/80+,b220+和cd3+细胞的数量。数据分析样本大小基于先前的实验和最小n值以获得显著结果。我们以前观察到在动物死亡后注射骨髓间充质干细胞后具有低变异性的重要差异。在诱导高级别clp后,我们有65%的死亡,并且在注射骨髓间充质干细胞后它降至5%。当α=5%且功率为90%时,我们最终得到n值=7。我们有证据(在实验室和基于文献的基础上,脂肪与骨髓来源的间充质干细胞观察到的细胞因子下降更多的实验),脂肪来源的间充质干细胞将比骨髓来源的间充质干细胞更有效。因此n=8就足够了。对于每种情况,数据表示为中值[iqr],除了体温,细胞因子的数量和白细胞计数,以平均值±sd显示。*p<0.05;**p<0.01;***p<0.001;ns,与各自的对照相比,在统计学上不显著。数据分析进行单盲(脓毒病评分,体温,luminex)或双盲(临床生物学,组织学)。使用graphpadprism软件使用适当的测试(除非指定的非参数mann-whitney)和显著性的最小95%置信区间进行统计分析;图中指示的p值<0.05(*),<0.01(**)和<0.001(***)。数字显示所测试的所有动物的中位数±置信区间或如其他实验所特别指出的。所有动物都包括在分析中。对脓毒病小鼠炎症反应的影响。一级终点:首先,我们观察了clp或腹腔注射lps后24小时的炎症评分。我们观察到注射的clp小鼠(9[8-12];p=0.006)与注射盐水的clp小鼠(17[14-20]图1a)相比,脓毒病评分显著降低。在注射盐水5天的clp小鼠中炎症评分保持很高(约16),在诱导脓毒病后第7天和第9天之间急剧下降。在注射盐水的脓毒病小鼠组中,在诱导脓毒病后第21天得分达到7[5-9](图1b)。诱导脓毒病后21天,注射的脓毒病组的炎症评分为3[2-5],低于未经治疗的对照组或注射盐水的脓毒病组5[3-6](p=0.03;图1b)。其次,我们研究了lps处理小鼠炎症后24小时的炎症评分。注射lps后24小时,炎症小鼠(仅注射lps)的炎症评分达到16[15-20],而注射的炎症小鼠的炎症评分为10[9-11](p=0.0006,图1c)。用lps激发的小鼠在2天内达到极限(定义为炎症评分为21)(中位存活)(图1c,d)。二级终点:与注射盐水的脓毒病小鼠相比,腹膜内注射的小鼠的存活率有统计学上显著的改善(65%对25%存活者,炎症诱导后60天p=0.03;图2a)。诱导炎症后24小时,注射的clp小鼠体温比注射盐水的脓毒病小鼠更高且体温下降更小(分别为36.3±0.6℃对34.9±0.98℃),p=0.004,图2b)。体温的差异持续到炎症后第14天。在炎症后第19天,两组的体温恢复到正常值(对照为37.2±0.3℃,clp和注射了的clp为36.9±0.38℃,p=0.34,图2b)。在炎症后48小时注射的小鼠的存活率为71%(7只动物中有5只,其中位存活时间为5[3-6]天(中位存活率)图1d),注射盐水的lps小鼠的中位存活率仅为2[1-3]天(p=0.009;图1d)。与对照非炎症组相比,clp小鼠炎症后24小时天冬氨酸氨基转移酶(asat),丙氨酸氨基转移酶(alat),碱性磷酸酶(ap),乳酸脱氢酶(ldh)和肌酸激酶(ck)的血浆水平统计学意义上更高(图3a)。当注射时,clp小鼠显示出接近对照的生物学参数(图3a)。我们观察到clp后24小时白细胞计数的初始下降,当clp小鼠注射时未观察到(图3b,p=0.0722)。在诱导clp后的任何测试条件下,在各组之间没有检测到白细胞计数的差异(图3c,p>0.05)。对细胞因子风暴和器官免疫浸润的影响。在脓毒病clp小鼠的血浆中,所有细胞因子水平在穿刺后24小时升高(图3,表i)。与未处理的clp小鼠相比,注射的clp小鼠中的下列促炎细胞因子水平显著降低:l-1a,il-1b,il-2,il-5,il-6il-12,il-17,gm-csf,ifn-g,mip-1a,mip-1b,rantes,tnf-a(图4,表i)。专注于促炎性il-6,我们观察到与未治疗的clp脓毒病小鼠相比,注射的脓毒病小鼠的水平降低(9139pg/μl±4307对比29628pg/μl±6166,p=0.0079,图4,表i)。相反,发现以下抗炎细胞因子增加:il-4,il-10,g-csf(图4,表i)。专注于抗炎性il-4,我们观察到与未治疗的clp小鼠相比,注射的clp小鼠的血浆水平显著升高(23.96pg/μl±3.6对比16.91pg/μl±1.6,p=0.008,图4,表i)。诱导脓毒病后21天,未经处理的脓毒病小鼠与注射的脓毒病小鼠之间没有差异。表i在诱导脓毒病后6天,我们还观察到与对照小鼠相比,炎性clp小鼠肝脏中f4/80+,b220+和cd3+细胞的数量增加。注射后,与未处理的clp小鼠相比,观察到f4/80(图5a,p=0.033);b220(图5b,p=0.024);cd3(图5c,p=0.035)数量显著减少。在注射后,肾也显示所有测试的免疫细胞类型的全面减少:f4/80(图5d,p=0.0014);b220(图5ep=0.05);cd3(图5f,p=0.03)。当将对照与炎性动物进行比较时,在炎症后未发现可检测的gr1阳性细胞,因此我们决定不在我们的分析中包括这些标记物。clp后24小时,环加氧酶抑制剂对作用的影响。为了理解效应是否通过cox途径介导,我们重复了先前的方案共同施用选择的cox抑制剂。详细地说,我们通过clp诱导炎症并在诱导脓毒病后2小时注射在clp后24小时处死小鼠。我们发现与脓毒病未处理小鼠相比,注射加吲哚美辛或加ns-398后24小时炎症评分没有改变(炎症评分=16.50[15-18];p=0.001和16.00[12-19]p=0.001)(图6a)。然而,与sc-560共同注射后,的作用没有受到影响(炎症评分:10[8-15]加sc-560,对比单独9[8-12]仅p=0.65,图6a)。当与吲哚美辛(中位生存率26[22-29]天;p=0.12)或ns-398(中位生存率21[18-24]天;p=0.09)共同注射时,观察到较低的存活率。当动物单独注射或加sc-560时,未检测到统计学差异(中位存活率为60[55-67]天;p=0.04,图6b)。与单独注射(每毫升6307±516个白细胞)相比,共同注射加吲哚美辛(3986±1172个白细胞/毫升;p=0.02)或ns-398(4068±551个白细胞/毫升,p=0.01)后,clp后3天白细胞计数下降(图6c)。当共同注射加sc-560时,未观察到白细胞计数的差异(每毫升6025±597个白细胞,p=0.095,图6c)。与单独的相比,注射加吲哚美辛的脓毒病(clp)小鼠的促炎细胞因子il-1,il-2,il-5,il-6,il-17,ifn-g,mip-1,tnf-α的血浆水平增加(图6d,表ii)。例如,注射的炎症小鼠血浆中il-6水平为9151pg/μl±897,而注射加吲哚美辛的炎症小鼠血浆中il-6水平为14225pg/μl±1078(p=0.028,图6d,表ii)。当使用特异性环加氧酶-1抑制剂sc-560时,与单独注射的clp小鼠相比,仅il-17血浆水平增加,而所有其他促炎细胞因子均未改变(表ii)。例如,il-6的浓度为8548pg/μl±971,与注射的炎性小鼠的9151pg/μl±897没有差异(p=0.48,表ii)。与clp后单独注射的组相比,注射和ns-398选择性环氧合酶-2抑制剂时得到类似结果:clp后24小时(h24)il-1,il-2,il-6,il-17,tnf-α血浆水平增加(图6d,表ii)。专注于il-6,clp后24小时我们观察到血浆浓度为12464pg/μl±2346,当小鼠共同注射和ns-398时,其高于单独注射的clp小鼠(9151pg/μl±897;p=0.028,图6f)。当炎性小鼠注射和吲哚美辛时,我们检测到clp后24小时(h24)il-4和il-10和il-13血浆水平的降低(图6d,表ii)。此外,当注射的clp小鼠同时注射吲哚美辛时,il-10血浆浓度为2364pg/μl±2100,低于仅用注射的clp观察到的浓度(8839pg/μl±1442;p=0.028,图6d,表ii)。注射sc-560并未改变抗炎细胞因子的水平(对于il-10,8120pg/μl±952.2,p=0.48,图6d,表ii),但注射ns-398降低了抗炎细胞因子il-4,il-10,il-13的血浆水平(对于il-10:2052pg/μl±1158,p=0.03,图6d,表ii)。表ii脓毒病h24+lipogems脓毒病h24+lipogems+吲哚美辛脓毒病h24+lipogems+sc-560脓毒病h24+lipogems+ns-398il-1a422,1±1886788±8234*475,8±193ns10495±3696*il-1b585,4±33616546±16711*332±199ns2845±1415*il-2492,4±2198535±7453*1737±621ns10598±2503*il-34164±9963658±21204178±971ns8049±1252nsil-427232±21684320±2038*19957±14525ns9299±2024*il-53477±10188083±875*3672±2466ns6519±1132nsil-69151±89714225±1078*8548±971ns12464±2346*il-108839±14422364±2100*8120±952ns2052±1158*il-121788±12435181±2683ns4308±1800ns3899±2280nsil-1315284±28474905±2538*11836±3373ns2711±1185*il-174562±214428917±15527ns4079±1741*14195±6154ns嗜酸性粒细胞趋化因子17223±201098321±4862ns9403±557ns7418±427nsg-csf10672±75503793±816ns5749±911ns2063±1221nsifn-g4528±183024465±7231*9345±3392ns13140±9227nsmcp-14034±162618650±11861ns5723±2317ns6785±2252nsmip1a2185±3415198±1512ns2189±1686ns3846±538nsmip1b263,7±259859,7±111*455,8±284ns569±75nsrantes3727±235914678±1006*3565±704ns10655±1498*tnfa4282±100716016±5019*5166±2422ns9437±1720*结论上面例举的数据表明,腹膜内给予微片段脂肪有效地减少了脓毒病的有害作用,特别是在急性期。实际上,数据表明用微片段脂肪治疗的脓毒病小鼠的存活率得到改善,并且脓毒病评分持续降低。此外,小鼠体温接近37℃,促炎细胞因子的水平降低,而抗炎细胞因子的水平增加。脓毒病小鼠的其他治疗,例如腹腔内施用脂肪抽吸物,没有显示出相同的结果。此外,上述数据表明,微片段脂肪通过前列腺素途径起作用。具体说,cox-2的酶活性对其抗炎作用至关重要。实际上,吲哚美辛(一种有效的前列腺素合成抑制剂)给药阻断了脓毒病小鼠中微片段脂肪给药的作用。因此,微片段脂肪影响前列腺素合成和非cox靶标。微片段脂肪组织注射到脓毒病小鼠的长期影响具有lipogems提取的微片段脂肪显示减少脓毒病急性期的炎症。脓毒病的长期影响之一可能是1)肌肉无力可持续5年和2)认知障碍。我们已经通过实验证明,当诱导脓毒病后几天将lipogems(微片段脂肪组织)注射到小鼠体内时,小神经胶质细胞-大脑的免疫细胞-受损较少。具体说,lipogems注射减少了脓毒病小鼠额叶皮层和海马中的小胶质细胞脱层,因此在脓毒病的慢性期注射lipogems可改善小胶质细胞的行为。总之,我们显示微片段脂肪注射预防或改善/减轻与脓毒病相关/由其引起的认知障碍。此外,我们测量了pax7+细胞的数量,并且我们发现在晚期施用lipogems后脓毒病小鼠中的卫星细胞减少。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1