含有弱酸性剂的微脂体组合物的制作方法
本发明涉及一种传输载体、套组或方法,其是应用于制备包覆治疗剂(特别是一弱酸性药物)的微脂体。
背景技术:
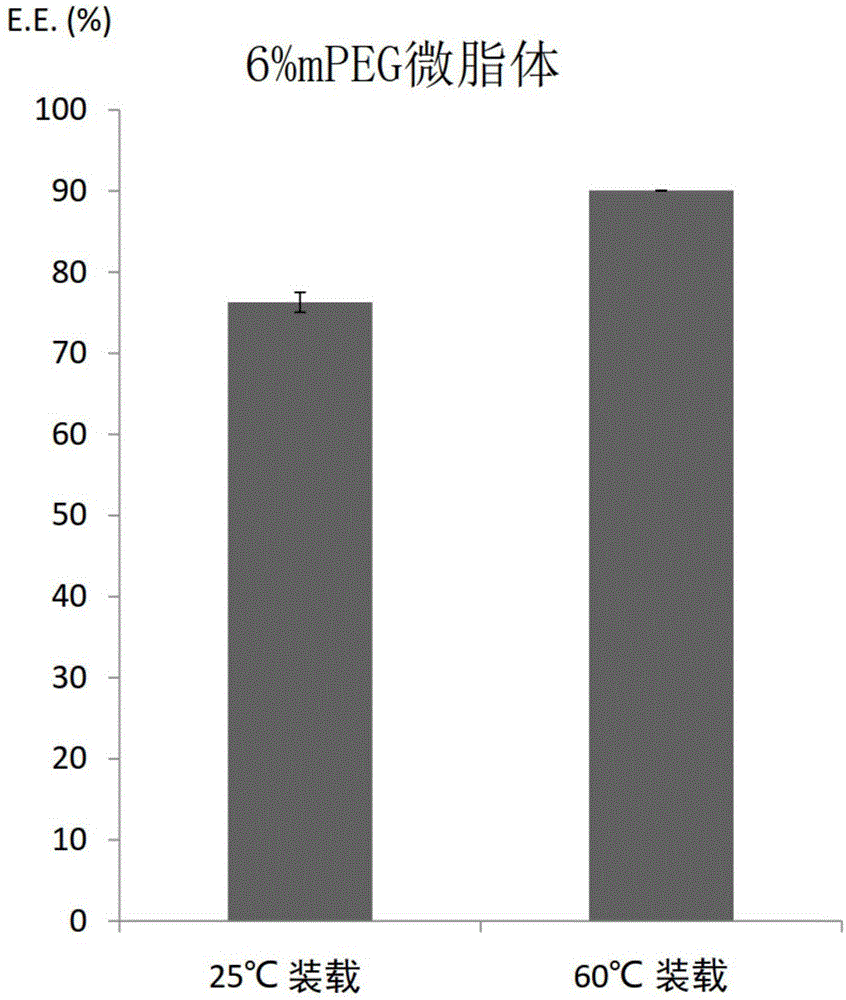
:现今已有许多方法可用于改善与弱酸性药物的稳定性或其他与治疗功能相关的性质。弱酸性药物,如前列腺素(prostaglandins,pgs),在医药应用上有其缺点。例如,是一种在α-环糊精包合复合物(α-cyclodextrininclusioncomplex)内的无菌无热原粉末,其亦被视为前列腺素e1(pge1-cd)的α-环糊精形式。这种药品易溶于水,且几乎不溶于乙醇、醋酸乙酯,及乙醚。于回溶(reconstitution)后,其活性成分,前列地尔(alprostadil),会立即从α-环糊精包合复合物中解离。然而,由于pge1的人体半衰期短(约30秒),且其用量过度时会产生严重的副作用,因此限制剂量的高频率给药对于pge1-cd疗法而言是必要的。其他医药制剂则为悬浮液的形式,其中pge1溶解于脂质微球体中,而为水包油型乳剂。然而,这种制剂的储放稳定性或在血浆内的稳定性都是不够的(us4,684,633)。一方面,为了改善一般弱酸性药物制剂在治疗上的不便,微脂体制剂被应用于传输弱酸性药物,例如pg。美国专利申请公开号us20020182248公开了透过使用特定的脂质、神经脂质(sphingolipid)的微脂体分散液。然而,这种现有的微脂体分散液是透过被动加载(passiveloading)而制备,而有pg包覆效率不定的情况。未经包覆的pg可能在施用于受试者时造成过量的问题。于另一方面,为了防止微脂体在血液中的聚集并避免被网状内皮系统(reticuloendothelialsystem,res)捕获,微脂体的表面是经聚(乙二醇)(poly(ethyleneglycol),peg)包覆。因为经长效型微脂体处理可使得肿瘤组织的药物浓度增加,包覆多柔比星的peg衍生的微脂体(peg衍生的微脂体已知为隐身微脂体(stealthliposome))在临床前研究中展现出增强的治疗功效(美国专利号5,013,556,美国专利号5,676,971)。然而,领域中似也未有证实peg衍生的微脂体可适用于在环境温度下以迅速的工艺装载或包覆弱酸性药物供临床使用。此外,领域中仍然需要能以高效率将弱酸性药物,特别是pg,装载至peg衍生的微脂体中的微脂体分散液,以避免因游离药物引起的过量药物问题或药物在水性分散体中降解的问题。于另一态样,为了以更高的效率将化学成分稳定地包覆在微脂体中,美国专利号us5,939,096利用质子穿梭机制(protonshuttlemechanism),其使用化学成分的盐类,从而产生内部较高/外部较低的ph梯度,以达成阳离子促进的沉淀作用或跨越低通透性(permeability)的微脂体跨膜屏障。然而,基于先前将弱酸性药物装载到微脂体或隐身微脂体中的技术,结合本发明申请人进行的实验数据(图1),显示隐身微脂体在环境温度(25℃)下的包覆效率很差,而需要加热步骤来增加前列腺素的穿透性。装载工艺需要将温度升高至高于微脂体的相转移温度(transitionaltemperature),通常高于60℃,其一般是高于环境温度。当暴露于水性环境时,升高的温度加速了不稳定的药物(例如前列腺素)的降解,从而阻碍组合物在长期储存时的稳定性。为了克服这些缺点,本发明提供了一种用于制备微脂体组合物的方法与套组。该微脂体组合物含有聚乙二醇衍生的微脂体,并适于取得在环境温度下较高的包覆效率及得以发挥持续释放弱酸性药物的有利药物动力学特性。此外,包覆较佳地,在货架存储时有提高的稳定性,以减轻或消除上述提及的问题。技术实现要素:本发明基于以下发现:在用于形成具有弱酸式盐梯度的微脂体的脂质混合物中,减少亲水性聚合物共轭脂质的含量,有助于在微脂体中装载及保留酸性化合物。据此,本发明提供用于传输对于诊断、预后、治疗或预防一受试者的不适、疾病、病症或症状有用的各种酸性化合物的方法、套组,或组合物。于本发明的一态样,提供了一种传输载体,该传输载体包含在一水性介质中的一微脂体,其中该微脂体具有一内部空间,且该内部空间:(1)为水性,(2)是由一脂质混合物组成的膜与该水性介质分隔,其中该脂质混合物含有一种或多种脂质以及基于该脂质混合物总量的小于3%的摩尔百分比的一亲水性聚合物共轭脂质;以及(3)含有一弱酸式盐。于本发明的另一态样,提供了一种制备一微脂体组合物的方法,其包含:在一水性介质中,使含一弱酸式盐的一微脂体与一弱酸性剂接触一足够的时间,从而使该弱酸性剂转而包覆在该微脂体内;该弱酸式盐包覆在一水性内部空间内,且该水性内部空间是由一脂质混合物组成的膜与该水性介质分隔;其中该弱酸式盐与该弱酸性剂具有一阳离子配对,且该脂质混合物含有一种或多种脂质以及基于该脂质混合物总量的小于3%的摩尔百分比的一亲水性聚合物共轭脂质。在一组具体实施例中,该亲水性聚合物共轭脂质为基于该脂质混合物总量的0.1%至3%的摩尔百分比的聚乙二醇衍生的脂质;较佳为0.5%至3%;更佳为0.5%至1%。在一组具体实施例中,该微脂体进一步包含一多质子酸。该多质子酸是包覆于该微脂体的水性内部空间中,从而,该多质子酸于该微脂体中提供了使经包载(entrapped)的前列腺素保留于该微脂体中的的优异效果。通常,该多质子酸为天然酸或合成的生物兼容性酸。较佳地,该多质子酸为有机三元酸。于一具体实施例中,该多质子酸是选自由柠檬酸、琥珀酸、酒石酸,或其组合所组成的群组。在一组具体实施例中,在一水性介质中,使微脂体与弱酸性剂的接触是在一环境温度下进行一段足以使该弱酸性剂弱酸性剂转而包覆在该微脂体内的时间。于本发明的另一方面,提供一种套组,其是用于制备含有一弱酸性剂的微脂体组合物,该套组包含:容纳一冻干饼(lyophilizedcake)的一容器,其中该冻干饼含有一弱酸性剂;以及容纳一微脂体溶液的另一容器,其中该微脂体溶液含有在一水性介质中的一微脂体,其中该微脂体包括一包覆在一水性内部空间的弱酸式盐,该水性内部空间由一脂质混合物组成的膜与该水性介质分隔,其中该脂质混合物含有一种或多种脂质以及基于该脂质混合物总量的小于3%的摩尔百分比的一亲水性聚合物共轭脂质。于一个一般的具体实施例中,该弱酸性剂是衍生自脂肪酸的生理活性脂质。特别是,该弱酸性剂为花生四烯酸代谢物,例如包括前列环素或凝血脂素的前列腺素(pg),其为参与许多身体功能的一种类激素物质,例如平滑肌的收缩与松弛、血管扩张与收缩、控制血压、抑制血小板聚集,以及调节发炎。前列腺素已被开发为用于治疗高血压、血栓形成、哮喘,以及胃及肠溃疡的药物或治疗化合物,用于怀孕的哺乳动物的分娩及流产的指示,以及用于预防动脉硬化。于一个一般的具体实施例中,该弱酸性剂为前列腺素a1(pga1)、前列腺素a2(pga2)、前列腺素e1(pge1)、前列腺素e2(pge2)、前列腺素f1α(pgf1α),或前列腺素f2α(pgf2α)。于一较佳具体实施例中,根据本发明的弱酸性剂为前列腺素e1(pge1)(也称为前列地尔)或其衍生物,例如,但不限于,6-酮前列腺素e1、15-酮前列腺素e1、13,14-二氢-15-酮前列腺素e1,或16,16-二甲基-6-酮前列腺素e1,其是适用于间歇性跛行患者的治疗。对于间歇性跛行患者,前列地尔可增加其末梢血流量及血管通透性,并抑制血小板聚集。pge1可以缓解患者因末梢循环血流不足所引起的疼痛。然而,使用pge1-cd(α-环糊精形式)的常规治疗对于bid疗程(每天两次)进行数周的患者而言并不方便。于另一态样,因为pge1的半衰期在人体内很短(约30秒至10分钟),且当过量(其降低血压)时,其副作用可能很严重,因此限制剂量的高频率给药对于pge1-cd疗法而言是必要的。为了改善常规前列腺素疗法的该些不便,本发明提供一种用于制备一含有前列腺素的微脂体组合物的传输载体、套组或方法,特别是一微脂体pge1制剂,其中pge1被包覆在微脂体内。微脂体制剂的益处之一是允许pge1在该微脂体组合物中自微脂体逐渐释放出来,从而对于目标疾病或症状进行较长间隔时间的治疗。此外,由于只有pge1的游离形式会引起副作用,而微脂体形式则不会引起,因此可以增加微脂体pge1的剂量,而不会产生严重的副作用问题。本发明的传输载体、套组及方法提供了更加友善且具控制力的产品以供患者使用。本发明的目的之一是建立一种即用型的两瓶套组形式的微脂体组合物,其含有如pge1的弱酸性剂。为了达到更好的临床应用,在环境温度下的短期间且远程装载(remoteloading)后的高包覆效率是必要的。较高的包覆效率降低了可能于过量时引起不欲副作用的游离形式的药剂。另一方面,在体外释放后有更多被保留的药剂也是必须的,其代表持续释放的性质。此外,为了本发明这样的目的,该套组在4℃下保存至少一年仍应是稳定且得于动物模型中表现出药效。根据这些需求,对该所述运输载体、套组及方法的参数进行调整,以满足该些需求。从以下结合附图的详细描述,本发明的其它目的、优点及新颖特征将变得更加明显。附图说明图1是比较在环境温度及升高的温度条件下,将前列腺素包覆至具有习知可使用量的聚乙二醇衍生脂质(6%)的微脂体的图;以及图2显示根据实施例7所获得的包覆效率与微脂体组合物中聚乙二醇衍生脂质的效价的关系图。具体实施方式i.定义如上述及本发明公开内容全文所用,除非另有说明,以下术语应理解为具有以下含义。如本发明所用,单数形式“一”、“一个”,与“该”包括多数含义,除非上下文另有明确指出。本发明中的所有数字可被理解为被以“约”修饰。微脂体如本发明所用的术语“微脂体”通常的特征在于具有透过形成囊泡的一或多个双层膜从外部介质隔离的水性内部空间。微脂体的双层膜通常由脂质形成,亦即包含空间分离的疏水及亲水结构域的合成或天然来源的两亲分子。较佳地,在本发明的实践中,微脂体包括小单层微脂体(suv)、大单层微脂体(luv),亦即直径大于50nm的单层微脂体,以及具有多于一个双层脂质的多层微脂体(mlvs)。通常,微脂体由包括一种或多种脂质的脂质混合物所组成。脂质的实例包括,但不限于,(i)中性脂质,例如,胆固醇、神经酰胺、二酰基甘油、酰基(聚醚),或烷基聚(醚);(ii)中性磷脂,例如,二酰基磷脂酰胆碱、鞘磷脂,以及二酰基磷脂酰乙醇胺,(iii)阴离子脂质,例如,二酰基磷脂酰丝胺酸、二酰基磷脂酰甘胺酸、二酰基磷脂酰胆碱、心磷脂、二酰基甘胺酰基肌醇、二酰基甘油硫代琥珀酸酯、二酰基甘油硫酸胆酸酯、以及其类似物;以及(v)阳离子脂质,例如,二甲基二十八烷基铵溴化物(ddab)、1,2-二酰基-3-三甲基铵丙烷(dotap),以及1,2-二酰基-sn-甘油-3-乙基磷酸胆碱。就亲水性聚合物衍生的微脂体的典型案例而论,微脂体是由至少一种磷脂与中性脂质的混合物,以及一亲水性聚合物共轭脂质所组成。用于本发明的磷脂的实例包括,但不限于,磷脂酰胆碱(pc)、磷脂酰甘油(pg)、磷脂酰乙醇胺(pe)、磷脂酰丝胺酸(ps)、磷脂酸(pa)、磷脂酰肌醇(pi)、卵磷脂酰胆碱(epc)、卵磷脂酰甘油(epg)、卵磷脂酰乙醇胺(epe)、卵磷脂酰丝胺酸(eps)、卵磷脂酸(epa)、卵磷脂酰肌醇(epi)、大豆磷脂酰胆碱(spc)、大豆磷脂酰甘油(spg)、大豆磷脂酰乙醇胺(spe)、大豆磷脂酰丝胺酸(sps)、大豆磷脂酸(spa)、大豆磷脂酰肌醇(spi)、二棕榈酰磷脂酰胆碱(dppc)、1,2-二油酰-sn-甘油-3-磷脂酰胆碱(dopc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、二棕榈酰磷脂酰甘油(dppg)、二油酰磷脂酰甘油(dopg)、二肉豆蔻酰磷脂酰甘油(dmpg)、十六烷基磷酸胆碱(hepc)、氢化大豆磷脂酰胆碱(hspc)、二硬脂酰磷脂酰胆碱(dspc)、二硬脂酰磷脂酰甘油(dspg)、二油酰磷脂酰乙醇胺(dope)、棕榈酰硬脂酰磷脂酰胆碱(pspc)、棕榈酰硬脂酰磷脂酰甘油(pspg)、单油酰磷脂酰乙醇胺(mope)、1-棕榈酰-2-油酰-sn-甘油-3-磷脂酰胆碱(popc)、二硬脂酰磷脂酰乙醇胺(dspe)、二棕榈酰磷脂酰丝胺酸(dpps)、1,2-二油酰-sn-甘油-3-磷脂酰丝胺酸(dops)、二肉荳蔻酰磷脂酰丝胺酸(dmps)、二硬脂酰磷脂酰丝胺酸(dsps)、二棕榈酰磷脂酸(dppa)、1,2-二油酰-sn-甘油-3-磷脂酸(dopa)、二肉荳蔻酰磷脂酸(dmpa)、二硬脂酰磷脂酸(dspa)、二棕榈酰磷脂酰肌醇(dppi)、1,2-二油酰-sn-甘油-3-磷脂酰肌醇(dopi)、二肉荳蔻酰磷脂酰肌醇(dmpi)、二硬脂酰磷脂酰肌醇(dspi),及其混合物。亲水性聚合物共轭脂质术语“亲水性聚合物共轭脂质”是指亲水性聚合物,其具有连接到脂质分子上的一长链的高度水合且挠性的中性聚合物。亲水性聚合物的实例包括,但不限于,分子量约2,000至约5,000道尔顿的聚乙二醇(peg)、甲氧基peg(mpeg)、神经节苷脂gm1、聚唾液酸、聚乙醇酸、聚乳酸聚乙醇酸(apolyacticpolyglycolicacid)、聚乙烯醇、聚乙烯吡咯烷酮、聚甲基恶唑啉、聚乙基恶唑啉、聚羟基乙基恶唑啉、聚羟基丙基恶唑啉、聚天冬酰胺、聚羟丙基甲基丙烯酰胺、聚甲基丙烯酰胺、聚二甲基丙烯酰胺、聚乙烯基甲基醚、聚羟基乙基丙烯酸酯、衍生化纤维素如羟甲基纤维素或羟乙基纤维素以及合成聚合物。脂质分子的实例包括,但不限于(i)中性脂质,例如,胆固醇、神经酰胺、二酰基甘油、酰基(聚醚),或烷基聚(醚);(ii)中性磷脂,例如,二酰基磷脂酰胆碱、鞘磷脂,以及二酰基磷脂酰乙醇胺,(iii)阴离子脂质,例如,二酰基磷脂酰丝胺酸、二酰基磷脂酰甘油、二酰基磷脂酸、心磷脂、二酰基磷脂酰肌醇、二酰基甘油硫代琥珀酸酯、二酰基甘油硫酸胆酸酯、及其类似物;以及(v)阳离子脂质,例如,二甲基二十八烷基铵溴化物(ddab)、1,2-二酰基-3-三甲基铵丙烷(dotap),以及1,2-二酰基-sn-甘油-3-乙基磷酸胆碱。于一组具体实施例中,亲水性聚合物共轭脂质为聚乙二醇衍生的脂质,其包括,但不限于:dspe-peg,其中peg的分子量为约2,000道尔顿(以下称为dspe-peg2000)。包覆术语“经包覆的(encapsulated)”或“经包载的(entrapped)”化合物、物质或治疗剂是指化合物、物质或治疗剂与微脂体相结合或至少部分地被隔离在微脂体的内部隔室中。术语“包覆效率”是指微脂体形式的药物含量相对于游离形式药物与微脂体形式的药物总和的比例。于一组具体实施例中,基于包覆在微脂体中的实体含量除以未包覆在微脂体中的实体含量与包覆在微脂体中的实体的总和,以计算包覆效率,其是使用各种本领域已知的方法来确定。弱酸式盐术语“弱酸式盐”是指该弱酸的共轭碱。如本发明所用,弱酸式盐是指该弱酸的共轭碱与任何伴随的相对离子(accompanyingcounterion)。较佳地,本发明中使用的弱酸式盐在高浓度下为水溶性的。该相对离子或阳离子实际上应该为脂膜不渗透的(具有渗透系数p小于10-12至10-11cm/s)。该相对离子可以是单价或多价的。用于本发明的示例性的弱酸包括:羧酸,如甲酸、醋酸、丙酸、丁酸、戊酸,及其取代的衍生物。用于本发明的示例性阳离子包括:钠、钾、铵及钙。较佳地,使用钙作为阳离子,而根据本发明选择前列腺素作为弱酸性剂。多质子酸术语“多质子酸”是指弱有机多元酸。用于本发明的示例性的多质子酸包括:柠檬酸、酒石酸、琥珀酸、己二酸,以及乌头酸,通常浓度为1至20mm。较佳地,用于本发明的多磷酸为浓度小于3mm的柠檬酸;更佳小于2.5mm;最佳小于2.3mm。于一特定具体实施例中,柠檬酸的浓度为1.5至2.5mm。弱酸性剂本发明所用的术语“弱酸性剂”是指用于加载到微脂体中并还含有至少一个羧基且为两亲性的化合物。该试剂的pka值通常小于约5。于一特定具体实施例中,该试剂的pka为约4.85。除了羧基官能团之外,该试剂还可以含有一个或多个官能团,尽管这种官能团的存在不应该显著地改变该试剂与其非官能化对应物的酸度。该试剂是指其质子化形式的化合物与其任何盐类形式。该试剂的盐类可以伴随任何医药上可接受的抗衡离子。术语“两亲性”在本发明中用于表示具有极性与非极性结构域的化合物,因此具有在合适条件下渗透通常无法渗透的膜的能力。术语“两亲性”在本发明中用于表示具有疏水(非极性)与亲水性(极性)基团的分子,且其特征在于以下任何一种:pka:其具有pka值高于3.0,较佳高于3.5,更佳在约3.5及约6.5之间的范围内;分配系数:在ph为7.0的正辛醇/缓冲液(水相)系统中,其具有logd在约-3及约2.5之间的范围内。冻干饼术语“冻干饼”是指含有弱酸性剂的冷冻干燥产品,其包括所需的特性,包括在回溶时维持原始剂型的特征,包括溶液性质;以及悬浮液的粒度分布;以及回溶时的等渗性。ii.用于装载的微脂体溶液的制备本发明提供了具有微脂体的微脂体溶液,其具有弱酸式盐的梯度,用于在整个梯度上装载一弱酸性剂。制备该微脂体溶液的一般方法描述如下。a.微脂体形成带有经包载于其水性内部空间的弱酸式盐且适用于形成本发明的微脂体溶液的微脂体,可透过技术制得。适用于制备本发明微脂体的方法的实例包括溶剂注射、反相蒸发、超音波处理、微流化、洗涤剂透析、醚注射,以及脱水/再水化。在典型的方法中,将脂质混合物溶解在乙醇中并注入含有弱酸式盐(如醋酸钠或醋酸钙)的水合缓冲液中。通常,微脂体的膜是由脂质混合物所组成,其中该脂质混合物包括磷脂或至少一种磷脂及中性脂质的混合物,以及亲水性聚合物共轭脂质。于一较佳具体实施例中,该脂质混合物是由一或多种磷脂及胆固醇与亲水性聚合物共轭脂质所组成,其中亲水性聚合物共轭脂质为dspe-mpeg,其基于该脂质混合物总量的摩尔百分比小于3%。于一组具体实施例中,胆固醇的基于该脂质混合物总量的摩尔百分比为10%至40%。于一组具体实施例中,该磷脂是选自dspc、dmpc、dppc,以及dopc。于另一组具体实施例中,磷脂、胆固醇,以及dspe-mpeg的含量的摩尔比为3:2:0.045。适用于本发明的水合缓冲液含有醋酸钠、醋酸钾或醋酸钙。于一组具体实施例中,该水合缓冲液含有醋酸钠,较佳浓度至少为100mm;通常在100mm至800mm之间;较佳在200mm至800mm之间;最佳在400mm至800mm之间。于另一组具体实施例中,该水合缓冲液含有浓度较佳在200mm至400mm之间的醋酸钙;更佳为250mm至350mm。通过在4.0至9.0之间,较佳为7.5至8.5之间,最佳为8.2的ph值下加入酸或碱以调整该水合缓冲液。于一替代的具体实施例中,当该水合缓冲液进一步含有多质子酸(如柠檬酸)时,较佳的ph值调整至6.5,且与未含多质子酸者相比,在体外释放测定后可相对保持更多其保留的pge1。对于弱酸性剂以及允许在内部及外部隔室之间分布的弱酸,作为一内部到外部的质子穿梭器,弱酸性剂的保留可能在微脂体的内部空间中的各种组分之间改变。为了调节弱酸性剂的保留,该水合缓冲液是经调整以含有多质子酸。然而,将多质子酸添加到该水合缓冲液中降低了微脂体的水性内部空间的ph值导致包覆效率被不期望地降低。于一较佳具体实施例中,该水合缓冲液含有浓度小于50mm、较佳小于10mm、更佳为0.01mm至5mm,更佳为0.1mm至3mm,最佳为在1.5mm至2.5mm之间的多质子酸。微脂体的大小可以透过控制用于低压挤出的膜的孔径,或在微流化中使用的通道的压力及数量,或任何其它合适的方法来控制。本发明的微脂体具有约30nm至约200nm的平均直径,更佳为约50nm至约150nm。b.建立弱酸式盐的梯度于调整微脂体的尺寸(sizing)后,微脂体的外部水合缓冲液是经处理以形成内部具较高浓度梯度的弱酸式盐(如醋酸钠)。这可以透过各种技术来完成,例如透过(a)水性介质的稀释,(b)对水性介质的透析,(c)分子筛色层分析,或(d)高速离心及在一水性介质中重新悬浮离心的微脂体,其中该水性介质适合于生理条件及医药施用。于一般情况下,该水性介质,或者作为外部缓冲液,含有用于保持所需渗透压的缓冲液及溶质,并将ph值调整在4至7之间,较佳为4至5之间,最佳为5.5。示例性的缓冲液为浓度在5至50mm,较佳为20mm的ph值4至7的组胺酸、mes等。示例性的溶质为强酸的盐类,以形成盐水,或单醣或二糖,如蔗糖、葡萄糖、甘露糖醇、乳糖或麦芽糖。iii.冻干饼的制备用于本发明的冻干饼可透过各种技术来制备。通常,冻干过程由三个阶段组成:冷冻、一次干燥,以及二次干燥。冻干制剂的设计取决于活性医药成分(activepharmaceuticalingredient,api),在本发明中是指弱酸性剂,以及预期给药途径的要求。于另一具体实施例中,含有弱酸性剂的储备溶液适用于本发明,由以下组成:一有机溶剂,如叔丁醇(tba);一冷冻保护剂;以及该弱酸性剂。对储备溶液进行冻干处理以获得该冻干饼。示例性的冻干饼含有1.2%至1.5%范围内的水含量,且该弱酸性剂与冷冻保护剂的重量比为0.0001:1.0至0.01:1.5,较佳为0.005:1.25,更佳为0.0526:125。于一特定的具体实施例中,该冷冻保护剂为麦芽糖。iv.制备含有一弱酸性剂的微脂体组合物的方法透过根据本发明的方法制备包覆该弱酸性剂的亲水性聚合物衍生的微脂体。于一典型的方法中,在一弱酸性剂可转而被包覆在本发明微脂体内的条件下,将该微脂体溶液与含有该弱酸性剂的冻干饼接触,以制备微脂体组合物;其中该条件包括在环境温度(通常为18℃至30℃)且时间短于20分钟的状况下进行。由此获得含有该弱酸性剂的微脂体,该弱酸性剂是被包覆于该水性内部空间内,而该水性内部空间是透过膜而与该水性介质分隔,且该微脂体是准备用于医药或其他应用。通常,该微脂体组合物是透过将该药物对脂质以一预定比例而使该微脂体溶液与该冻干饼接触而获得。该药物对脂质的比例是指冻干饼中弱酸性剂含量与微脂体溶液中脂质含量的比例。药物对脂质的示例性摩尔比为0.001:1至0.05:1。通常,pge1:脂质的比例范围为20μg:5μmol至10μg:20μmol。于一组具体实施例中,该条件包括,但不限于,在环境温度下足以将弱酸性剂转而包覆在微脂体内的时间,该时间至少为5分钟,例如,10分钟、60分钟或24小时;较佳至少10分钟。更佳地,该条件包括在环境温度,通常为18℃至30℃,下使该弱酸性剂转而被包覆在该微脂体内。所得的微脂体组合物的包覆效率至少为85%;且任选的至少为90%、95%,或97%;且较佳为95-99%。现在将参考以下具体的非限制性实施例更详细地描述本发明。实施例1制备冻干饼的方法将冷冻保护剂溶于热水(50-60℃)中,然后冷却至40℃以下以形成冷冻保护剂溶液。将前列腺素e1溶解在叔丁醇(tba)中(其在40℃下预热以使该溶剂液化),然后转移至冷冻保护剂溶液中并与其混合以形成前列腺素溶液。将该前列腺素溶液进行无菌过滤并装入6r小瓶中,然后冷冻干燥以形成含有pge1的冻干饼(此处亦表示为前列地尔(alprostadil)饼)。在具有如下表i中列出的参数的程序下使用搁板式冷冻干燥机进行冻干。表i前列地尔饼的冻干参数实施例2以各种成分制备前列地尔饼为了找到合适的制剂以形成本发明的前列地尔饼,提出了使用每小瓶52.6μg的pge1于前列地尔饼,以及使用125mg冷冻保护剂于本实施例的制剂。由于pge1在制剂中作为api,因此需要合适的溶剂来溶解不溶于水的pge1。pge1可溶于叔丁醇(tba)。选择tba溶解pge1以形成前列腺素溶液。pge1经脱水形成前列腺素a1。为了提高pge1的储存寿命,使用冻干法将水分含量降至非常低的含量以使降解减到最小。候选制剂的筛选是基于40℃加速稳定性试验的结果。由于如上所述,冷冻保护剂与pge1的含量是固定的,如表ii所述进一步调节其他冻干参数,如含水量、tba添加量等,并按下列实施例所述进行研究。表ii前列地尔饼的配方实施例2a前列腺素溶液中含水量的影响首先,按照tba的固定百分比,透过使用表iii中列出的配方形成前列地尔饼,以研究冷冻干燥前水所占百分比的影响。表iii具有不同含水量的前列腺素溶液的配方如表iv所示,所有制剂均满足在40℃下6周后剩余90%pge1的标准,该剩余含量随着前列腺素溶液中水的百分比而降低。显示透过增加空间间隔(透过增加水的百分比),减少api与水接触的机会,可以提高前列地尔饼的稳定性。此外,制剂pc029与pc030之间没有显著差异,证明随着空间增加到一定值,api与水之间将以足够大的空间分隔。为了使冻干时间最小化,具有最低含水量的配方是适合的候选物。选择制剂pc030而非制剂pc029。表iv制得的前列地尔饼在40℃下6周后的稳定性配方编码剩余pge1(%)pga1(%)含水量(%)pc02995.9±0.54.0±0.41.40±0.15pc03096.1±0.54.3±0.01.34±0.03pc03193.6±1.05.2±0.121.41±0.04实施例2b前列腺素溶液中溶剂含量的影响第二,透过使用表v中列出的配方来形成前列地尔饼,以研究tba在pge1溶液中含量的影响。表v具有不同tba浓度的前列腺素溶液的配方如表vi所示,tba含量的增加降低了pge1的降解。此暗示是由冷冻步骤中的结晶变化所引起;与tba含量较低的组别的类晶体相比,在高tba含量的组别中观察到饼的外观松散,这表示在具有不同tba含量的组别中结晶作用不同。结晶条件的变化影响pge1的稳定性,并导致观察到的结果。表vi制得的前列地尔饼在40℃下6周后的稳定性配方号码剩余pge1(%)pga1(%)含水量(%)pc03290.7±1.09.7±1.11.27±0.02pc03395.2±1.13.6±0.41.35±0.07pc03494.9±2.55.0±0.81.36±0.02实施例2c冷冻保护剂含量在前列腺素溶液中的影响最后,亦透过使用表vii中列出的配方形成该前列地尔饼,以研究如表vii中记载的不同冷冻保护剂的效果。表vii具有不同冷冻保护剂的前列腺素溶液的配方如表viii所示,以麦芽糖作为冷冻保护剂的前列地尔饼显示出最慢的降解速率(pc036)。另一方面,以蔗糖作为冷冻保护剂的前列地尔饼(pc035)是所有配方中最差的。这表示冷冻保护剂的种类可以调节前列地尔饼中pge1的稳定性,这是由于所有制剂于冻干过程中晶体结构的变化。表viii制得的前列地尔饼在40℃下6周后的稳定性配方编码剩余pge1(%)pga1(%)含水量(%)pc03290.7±1.0a9.7±1.1a1.27±0.02apc03587.7±0.9b10.4±0.8b1.17±0.05bpc03693.9±0.4b6.5±0.3b1.16±0.01b结果基于上述结果,选择较高的含水量,较高的tba含量与麦芽糖作为前列腺素溶液中的冷冻保护剂,以提高冻干饼的稳定性。基于40℃加速稳定性试验的结果进一步评估pc030的稳定性,在实验进行6周后仅观察到4%的降解。配方pc030被选用是因为其使用乳糖单水合物而pge1具有降解速率最低的pge1。在以下实施例中选择乳糖单水合物作为冷冻保护剂。据此,选择pc030作为前列地尔饼的合适配方。表ix前列地尔饼的候选配方实施例3制备微脂体溶液的一般方法微脂体与hspc、胆固醇,以及可选择的1,2-二硬脂酰-磷脂酰乙醇胺-甲基-聚乙二醇缀合物(dspe-mpeg)混合。为了形成微脂体颗粒,首先将脂质混合并溶解于乙醇中;然后注入一水合缓冲液,其中水合缓冲液含有ph值高于7的弱酸式盐,例如,醋酸钠。由于脂质分子的两亲性质,微脂体粒子自发形成并悬浮于该水合缓冲液中。在微脂体粒子形成后,透过挤出来操作粒径。所谓挤出,是使微脂体粒子受力通过聚碳酸酯膜,得到平均直径在80nm至180nm范围内的微脂体。多次通过后,微脂体粒径降至亚微米级;且该微脂体粒子比初始粒子更为稳定。透过正交流过滤(tangentflowfiltration,tff)的渗滤作用将微脂体悬浮于其中的外部水合缓冲液取代为一外部缓冲液,以形成悬浮该微脂体的水性介质;并且,在此过程中,微脂体内的一些醋酸分子也可穿透微脂体的双层结构而被移除。这可以在微脂体膜上产生醋酸盐类/ph梯度;且这种梯度对于pge1主动装载(亦即远程装载)是必需的。据此,制备pge1远程装载的微脂体溶液。设计以下实验来研究合适的配方参数、方法参数,以及pge1远程装载参数,以实现pge1的高包覆效率与持续释放。透过包含以下步骤的一般方法来确定包覆效率。通过自填充树脂管柱分离微脂体及游离形式的pge1:首先,制备在bio-rad管柱中填充toyopearlhw-55f树脂的管柱。将样品施加到该经调整(conditioned)的管柱中,以一般生理盐水冲提,并收集微脂体形式的pge1的各分段(fraction),然后以水冲提管柱,收集游离形式的pge1的分段。透过hplc分析微脂体与游离形式pge1的含量。以微脂体形式的pge1与游离形式的pge1的总和含量除以微脂体形式pge1的含量以计算包覆效率。透过包含以下步骤的一般方法进行体外释放测定。将装载pge1的微脂体与醋酸钠缓冲液或人类血浆(实施例6a)混合,以引发并促进pge1从该微脂体中释放。根据上述记载测定于释放试验后的包覆效率,即为所述经保留的pge1。实施例4微脂体溶液的制备微脂体溶液是根据实施例3所述的方法制备,包括脂质、水合缓冲液、水性介质,以及pge1装载过程中的其它参数的描述,例如使该微脂体溶液与如先前所述的冻干饼接触(例如,前列地尔饼),或溶液形式的前列地尔(例如pge1溶液);并形成微脂体组合物。包括装载持续时间、药物-脂质比以及最终获得的包覆效率的其它参数显示于表x中。表x微脂体溶液的配方实施例5在不同条件下制备微脂体溶液以改善包覆效率更高的包覆效率表示游离形式pge1的最小化。在pge1装载于最终获得的微脂体组合物后促进pge1的包覆效率是优先要务。透过改变水合缓冲液与水性介质来调整微脂体膜两侧的外部相及内部相,从而形成增强的驱动力以供本实施例的pge1装载。实施例5a水合缓冲液的ph值调整水合缓冲液的ph值决定微脂体的内部ph值。尽管在内部醋酸盐类穿透出的渗滤处理后,内部ph值可能升高,但水合缓冲液的ph值仍然主要地影响供pge1装载的微脂体跨膜的梯度。针对内部ph值(受含醋酸的水合缓冲液影响)对包埋效率的影响进行评估并摘要于表xi中。表xi在不同ph值下具有该水合缓冲液的配方在相同装载条件下,即药物与脂质之间的比例为20μg:10μmol,60℃反应5分钟,测定包覆效率。结果显示,较高的缓冲液ph值具有较好的包覆效率。该结果与远程装载理论相关:更大的ph梯度具有较佳的包覆效率。该水合缓冲液的ph值经决定为8.2。实施例5b水性介质的ph调整水性介质的ph值决定微脂体的外部ph值且透过影响微脂体膜跨膜的ph梯度来促进pge1装载。透过将ph调整至所列标准,含浓度20mm的组胺酸的水性介质的ph值的影响记录于表xii中。表xii水性介质的ph值优化在以下装载条件下测定包覆效率:药物与脂质之比为10μg:5μmol,20℃反应30分钟。由于该水性介质的ph值决定了该微脂体膜的跨膜ph值梯度,高于6.0的外部ph值导致包覆效率显著降低。该水性介质的ph值经决定为5.5。实施例5c水合缓冲液的浓度调整该水合缓冲液中弱酸式盐的浓度是可能影响包覆效率的另一个因素。对表xiii中所示的弱酸式盐的浓度对包覆效率(e.e.)的影响进行评估并摘要于表xiii中。表xiii水合缓冲液浓度在以下装载条件下测定包覆效率:药物与脂质之比为10μg:5μmol,于25℃下反应30分钟。当醋酸钠的浓度超过400mm时,e.e.达到高原期。较高的醋酸盐类浓度没有改变包覆效率。然而,由于低醋酸盐类浓度显示出较低的e.e,所以较高的醋酸盐类浓度对于形成供pge1装载的醋酸盐类梯度仍然是必需的。弱酸式盐的浓度经决定为400mm醋酸钠,因其产生足够的pge1装载梯度。结果根据实施例5a至5c,使用包覆方法测定水合缓冲液与水性介质的性质。含有ph8.2的400mm醋酸钠的水合缓冲液与ph5.5的含有20mm组胺酸的水性介质展现所欲包覆效率。实施例6在不同条件下制备微脂体溶液以改善持续释放特性根据本发明的目标微脂体组合物需要持续释放特性以控制人体内的药物释放。因此,透过不仅包覆效率而且透过体外释放测定以评估以下调整,以选择所需的配方。透过前述实施例中所述的方法测定经保留的pge百分比。实施例6a水合缓冲液中阳离子的调整pge1装载后,在水合缓冲液中弱酸式盐的阳离子与作为阴离子的pge1相互作用。这种相互作用可能会减缓pge1的释放。在水合缓冲液中使用不同的醋酸盐类作为弱酸式盐,并透过包覆效率测定及以人类血浆进行体外释放测定以进行评估。表xiv水合缓冲液中使用的不同阳离子在以下装载条件下测定包覆效率:药物与脂质的比例为20μg:10μmol,60℃下反应5分钟。透过将分析物与人类血浆以1:1的比例混合进行体外释放,然后在37℃下作用2小时。仅有醋酸钠与醋酸钾的微脂体在血浆释放后表现出高的包覆效率与经保留的pge1。进一步的研究集中在如表xv中所示的这二种选择的配方。表xv制剂pl112与pl117的体外释放结果在以下装载条件下测定包覆效率:药物与脂质的比例为20μg:10μmol,在60℃下反应5分钟。透过将分析物与人类血浆以1:1的比例混合进行体外释放,然后在37℃下作用1小时。虽然醋酸钾在血浆释放测定中显示出所需的释放曲线,但其初始包覆效率远小于以醋酸钠作为弱酸式盐的组别。因此,在该水合缓冲液中选择醋酸钠作为该弱酸式盐。实施例6b在水合缓冲液中加入柠檬酸根据实施例5,该水合缓冲液经决定为ph8.2的400mm醋酸钠。然而,高ph值可能导致脂质不稳定。为了避免脂质不稳定且为了建立较大的醋酸盐类梯度以供进行装载,评估如表xvi所示的不同浓度的额外添加的柠檬酸的影响。表xvi具有不同柠檬酸浓度的水合缓冲液在以下装载条件下测定包覆效率:药物与脂质的比例为10μg:5μmol,在20℃下反应30分钟。结果显示额外添加的柠檬酸降低了包覆效率。然而,e.e.的降低可能是由于ph值大幅度降低所引起的(其阻碍了pge1装载)。因此,透过包覆效率(e.e.)测定与体外释放(ivr)测定进一步评估如表xvii中所示的添加柠檬酸以维持ph值为6.5的效果。表xvii以额外添加的柠檬酸调整水合缓冲液于以下装载条件下测定包覆效率:药物与脂质的比例为10μg:5μmol,在20℃下反应30分钟。ivr以1:1的比例进行,与15mmnaac及8.1%ph5.5的蔗糖缓冲液混合,然后于25℃下作用30分钟。结果显示,在该水合缓冲液中额外添加的柠檬酸不仅提高了包覆效率,且在ivr后也保留了更多的pge1在微脂体内。据此,该水性介质因此决定为ph6.5的400mm醋酸钠,并具有浓度为1.5mm至2mm的柠檬酸。实施例6c透过调整药物与脂质的比例以制备微脂体组合物分别根据表x制备的微脂体溶液与含有pge1的冻干饼或pge1溶液以如下表xviii(a)所示的药物对脂质的比例接触,以形成相应的微脂体组合物。透过将pge1粉末溶解在适量的乙醇中制备pge1溶液,得到浓度为5mg/ml的pge1储备溶液。为了制备根据本发明的一微脂体组合物,将该微脂体溶液与pge1储备溶液在9%蔗糖溶液中稀释至一目标浓度;然后在指定条件下作用使pge1装载入微脂体中。表xviii(a)药物与脂质比的调整在初始配方中,药物与脂质的比例预先确定为10μg:5μmol。为了进一步提高微脂体的包覆效率与持续释放的特性,调整了装载pge1的药物与脂质的比例,且pl130、pl156以及pl157的e.e结果如表xviii(b)所示。表xviii(b)药物与脂质比例的调整配方药物与脂质比例包覆效率(%)pl13010μg:5μmol87.6pl15610μg:10μmol91.9pl15710μg:20μmol97.1±1.2(n=4)在以下装载条件下测定包覆效率:于25℃下反应30分钟。降低药物与脂质的比例提高了包覆效率。之后,进一步测试了在25℃反应10分钟的条件下,药物与脂质的比例为10μg:10μmol以及10μg:20μmol的微脂体。表xix较低的药物与脂质比例的微脂体配方药物与脂质比例包覆效率(%)(n=3)在ivr后的e.e.(%)(n=3)pl17710μg:10μmol92.9±1.736.62±1.35pl17810μg:20μmol95.6±1.748.83±3.02在以下装载条件下测定包覆效率:于25℃下反应10分钟。ivr以1:1的比例进行,与15mmnaac及8.1%ph5.5的蔗糖缓冲液混合,然后在25℃下作用15分钟。降低药物与脂质的比例在ivr后略有增加包覆效率。然而,10μg:20μmol的药物与脂质比例太低了。因此,决定药物与脂质的比例为10μg:10μmol。实施例7mpeg含量的调制磷酸胆碱与胆固醇的含量以3:2的摩尔比固定,因为这种类型的组合物具有最大的脂质凝聚排列。对于产生表面负电荷以避免人体微脂体排出或微脂体聚集的dspe-mpeg,如表xx所示,改变了pge1装载与ivr。表xxmpeg含量的调制配方mpeg含量(mol%)包覆效率(%)在ivr后的e.e.(%)pl196076.652.6pl1970.483.549.9pl1940.998.659.1pl198395.558.6pl199685.436.9pl2001086.740.9在以下装载条件下测定包覆效率:药物与脂质的比例为10μg:10μmol,在25℃下反应10分钟。对于ivr测定,在装载pge1(平衡装载)1小时后,所获得的微脂体溶液以9:1(v/v)的比例与75mm醋酸钠释放缓冲液混合,并在37℃下作用15分钟。如表xx及图2所示,dspe-mpeg摩尔比为0.9%至3%之间(亦即,hspc:胆固醇:dspe-mpeg=3:2:0.45至3:2:0.15),作用10分钟时显示出最高的包覆效率。此外,在ivr测定后,经保留的pge1的含量在这些配方中排名高。确定最终脂质组合物含有hspc:胆固醇:dspe-mpeg=3:2:0.45的比例的脂质。结果根据实施例6a至6c以及7,微脂体溶液的配方被调整为hspc:胆固醇:dspe-mpeg=3:2:0.045的脂质组合物;含有400mm醋酸钠与2mm柠檬酸的ph6.5的水合缓冲液;药物与脂质的比例为10μg:10μmol,如表xxi所示。表xxipl194配方的组合物在环境温度下,这种配方在短时间(10分钟)装载后展现高pge1包覆效率(约90%);且在ivr测定中保留了比其他配方更多的pge1。实施例8使用血流分析对pge1配方的功效进行体内评估将微脂体组合物pl157与pl194的功效透过如下所述的血流研究与经游离药物(peg1-cd)处理的动物进行比较。血流研究将wistar大鼠以异氟烷麻醉并在加热垫(36.5℃)上保持体温。当动物被深度麻醉时,在透过静脉施予3μg/kgpge1-cd或微脂体组合物之前5分钟,透过激光多普勒流量计(moorvmsldf1,moor仪器有限公司)记录右尾爪数字上的圆弧数字的皮肤微血管血流量,然后连续记录20分钟,以监测给予剂量后的反应。透过moorvns-pcv2.0软件记录通量值的原始数据,并导出到excel文件(microsoft软件)进行数据处理。对血流数据进行标准化,绘制曲线,计算参数bf0、bfmax,以及auc%,其中bf0表示基线的平均血流量;bfmax表示给予剂量后最大血流量;auc%表示与基线auc相比,血流量0至20分钟曲线下面积的百分比。结果如表xxii和表xxiii所示,与pge1-cd相比,pl194及pl157都引起较高的bfmax/bf0以及较大的auc比。与pl157相比,pl194引起的bfmax/bf0比值略低,auc比较小。表xxii研究1表xxiii研究2前列地尔饼与微脂体溶液的配方如上述进行了研究。反映于稳定性试验与动物研究,该配方展现了所需性能。对于前列地尔饼,配方pc030或pc036显示出优异的稳定性。对于微脂体溶液,配方pl194在环境温度条件下的短装载时间内显示出高度的包覆效率;还有,经保留的pge1比ivr研究中的其他配方多。如血流结果所示,与常规的前列腺素组合物相较,根据本发明的微脂体组合物确实获得了改善的功效。尽管在前面的描述中已经阐述了本发明的许多特征及优点,以及本发明的结构与特征的细节,但是本发明公开内容仅为说明性的。细节事项可经改变,特别是在本发明公开内容的原则至所附的权利要求书所表述的术语的广泛一般含义所指示的全部范围内,部分内容的形状、尺寸及布置的事项。本申请依美国法典35u.s.c.§119(e)主张于公元2016年8月8日申请的美国临时申请第62/372,096号申请及于2016年8月16日申请的美国临时申请第62/375,698号申请为优先权基础案,这些临时申请的全部内容亦并入本申请作为参考。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1