集成于一个环境中的复杂放射治疗剂量校准、重建和验证的自动化方法以及实施系统与流程
本发明的目的是提供一种集成在基于硅单片探测器技术的装置中的复杂放射治疗的自动剂量学校准、重建和验证方法。本发明对系统或它的实施的安装的影响相同。本发明属于医学物理和生物医学的技术领域。
技术背景
为了保证放射治疗的质量,来自不同机构的多个建议显示了如何对放射治疗中使用的加速器进行质量控制:“国际电工委员会”(iec977)、“医学物理与工程研究所”(ipem81)、“美国医学物理学家协会”(aapmtg40)。
这些建议表明需要测量的参数以及修订这些参数的规律性。传统上,这些修订是在水模型中使用剂量计进行的:剂量计移动到水模型的三个不同方向,以便根据不同机构的建议和协议,在不同的水深中采用剂量的准确测量。此外,iba剂量学还生产了如多管的几种商业化系统,它允许在不使用水模型的情况下,通过电离室的剂量测量来确定加速器光束的特性。
还有一些新的进展,如2015年10月的医学物理学中埃克豪斯t、阿尔哈拉克h、里特t所写的文章“自动化线性加速器质量保证”所述。此文还使用系统日志文件和电子接口成像设备或epid对性能进行了评估。
另一方面,已经开发出多种系统和方法来验证在给患者用药之前的治疗。在放射治疗(如vmat)中越来越复杂的这些技术,也需要以高精度和一致性来验证它们的确保质量的程序。为了确定外部光束放射治疗中的吸收剂量,国际原子能机构(iaea)和国际辐射单位和测量委员会(icru)编制了若干报告和实施规程。其中,我们发现icru第24号报告(“放射治疗程序中x或伽马射线照射患者吸收剂量的测定”),其中提到需要提供5%标准精度的吸收剂量。这是一个广为讨论的限值;事实上,自1976年以来,在低分级剖面的相对剂量测量中,有人建议限值为2%。对于剂量测量中的空间分辨率,没有同样的一致标准,在高剂量梯度的区域,2mm是最精确的标准。根据这些建议,有几个商业化的系统以及不同研究机构进行的新发展,其在对患者进行治疗前对治疗进行验证。目前存在的放射治疗验证方法和系统可分为:探测器、epid、基于线性加速器日志的软件系统和基于射线照相或辐射变色胶片的传统系统。
在商业化的系统中,我们发现了基于电离室和硅二极管的二维探测系统。太阳原子核制造的图谱检查系统和图谱检查2系统是基于n型二极管,而iba剂量测定组和octavius729(ptwfreiburggmbbh)创建的i'mrt矩阵则基于电离室。除了探测器技术外,这些系统在排列和它们之间的距离上有所不同。这些系统的空间分辨率取决于探测元件之间的距离。它们允许通过插值算法获得剂量图谱。基于二维阵列的商业化系统不仅可以对每个领域进行检查,还可以进行实时治疗验证。
电子接口成像设备是与加速器有关的另一种商业选择,其允许我们测量它的出口流量以及多焦准直器的位置。许多系统是基于几种技术开发的。空间分辨率优于二维阵列探测器,但仪器校准更为复杂。参考文献,如2015年5月8日的应用临床医学物理学杂志中迪福dl、瓦兹奎克诺la、玛沃芮迪斯p、帕帕尼古拉乌n所写的文章“使用epid或mlc日志文件的、基于解剖的、患者特定的vmatqa”,开始讨论系统和方法的使用,该系统和方法允许基于使用epid和加速器的日志文件验证复杂的治疗。
如果与传统的基于射线照相或辐射变色胶片探测的方法相比,所有这些系统都具有提供实时剂量的优势。但是,它们涉及厘米的空间分辨率更差。因为通道数量大它们需要一个复杂的电子系统,而且它们不能有效地获得满足icru要求的轴向剂量图谱。
为了解决二维商用系统存在的问题,基于分段半导体探测器的其他系统也开始开发:这种类型的探测器广泛应用于医学成像(如pet)和高能物理中。
为了提高空间分辨率,在欧洲项目框架maestro(放射肿瘤学模拟和治疗的方法和先进装备)内,开发了一种单片探测器,用于测量剂量图谱,并将其结果与图谱检查系统进行比较,结果是正向的。
在dosi中还开发了一种硅像素阵列,它的特性与电离室和金刚石探测器进行了比较,显示出良好的一致性。这两个系统中的任何一个都适合在轴向级别上测量剂量图谱,因为相关的读数系统太充足了。radia合作提供了专利es2409760,其主要创新是第一个原型系统,该系统允许使用硅单片探测器在轴向级别上测量剂量。它的空间分辨率比目前商业化系统的高。但是,它并不能解决实时获取和验证剂量图谱的问题。
通过这种方式,我们发现专利文件编号为2453944(“imrt验证的方法和设备”),该专利文件显示了一种方法和系统,该方法和系统验证从所采取的措施到来自垂直级别的加速器光束的实时3dimrt治疗。这种方法未考虑来自加速器日志的信息。
文献号为2303403(“用于外部放射治疗验证的方法和系统”)着重于纠正直接测量的多焦准直器误差,没有使用加速器日志文件。
专利号为es2309093t3(“用于辐射剂量测定的自动校准”)是关于通过射线照相胶片自动进行剂量校准的程序,没有获得实时响应。
还有其他的系统和方法,一些专利文件如:
韩国专利申请文献kr20130059668(“用于强度调制辐射治疗和立体定向身体辐射治疗质量保证的多维体模”)允许使用电离室测量尺寸上的剂量分布,但不允许重建或验证剂量m韩国专利申请文件kr20130059668(“用于强度调制辐射治疗和立体定向身体辐射治疗质量保证的多维体模”)允许使用电离室测量一维的剂量分布,但不允许重建或验证剂量图谱。
在西班牙专利es2409760(“放射治疗的验证系统和方法”)中,通过使用基于分段硅条探测器测量的算法(但仅在一个平面内)在轴向平面重建剂量图谱是相对允许的。它既不包括允许实时获取的程序,也不包括将其与规划系统计算的另一个治疗进行比较的重建治疗验证,也不包括允许表征加速器光束并将其与加速器日志文件进行对比的在前程序。
此外,欧洲专利ep2050395(“用于提高图像探测器图像质量的方法及其系统”)提出了一种通过放射治疗中使用的硅探测器中的偏移减法来提高图像质量的方法。但是,这种方法既不允许重建,也不允许验证放射治疗。
因此,目前还没有任何解决方案允许加速器光束的表征和放射治疗的验证,评估规划系统或tps的计算与加速器提供的剂量分布之间的一致性。这种验证不仅通过使用轴向平面系统的直接测量进行,而且还通过研究导致加速器日志的可能偏差以及同时在同一设置中设计者的整合来进行。
技术实现要素:
本发明的目的是解决在相同的设置中集成加速器光束的表征和放射治疗的验证的现有技术的缺陷,不仅在临床表现中有效果,而且在工作的组织中有效果,减少每个患者所需的时间。
在本发明的实际实施中,该系统和方法允许验证放射治疗,评估tps计算与加速器提供的剂量分布之间的一致性。规划剂量和测量之间的一致性是通过使用不同的参数获得的,例如而非限制性,二维伽马、三维伽马和剂量容积柱状图。该系统和方法允许当从轴向平面出来时加速器提供的剂量分布通过直接测量被评估,或通过研究分析中可能出现的偏差以及加速器日志中处理的信息来评估剂量分布。该系统和方法还允许集成到同一系统中,或设置通过tps(可以基于蒙特卡罗计算)规划剂量计算的结果。
为此目的,以更精确的方式,本发明涉及一种方法,该方法允许自动化用于获取系统信号的介质的远程控制,在参考条件下校准剂量响应模式,以及以自动化方式获得允许表征加速器光束的参数(非限制性的例子:等剂量分布、截面轮廓、输出深度和输出因子。)
该系统和方法还允许以自动化方式:
对用在放射治疗中的能量、场尺寸和源面距离的不同组合,在参考和非参考条件下对加速器光束进行表征。
从不确定度小于1%且空间分辨率大于2mm的轴向平面直接测量或从加速器信息日志或文件中,重建和三维可视化放射治疗。
通过一个由分段半导体探测器、一个采集系统和一个用户界面组成的系统,验证和可视化允许在放射治疗中验证的参数,如下所述。
为了实现这种方法,必须有一个探测器子系统参与的系统。带护环的分段探测器子系统位于平行平面上,它们之间的最小距离为3mm。它们之间的空间由一个材料层实现,该材料层允许维持电子平衡条件。
这种基于单片探测器的子系统的运行需要反向极化。在这些条件下,探测器的输出不仅是由于我们想要验证的剂量累积,而且还有一个因素,其来源来自于自己的暗电流探测器。必须检查该因素,以减少已获得的剂量图谱中存在的不确定性。本文所描述的方法不仅适用于不同类型的探测器,还适用于分段硅探测器。
类似地,一些人体模型通过将探测器子系统置于进行剂量测定所需的条件来参与系统。
准确地说,允许在参考条件下以及参考条件之外表征加速器光束的一个平面人体模型和一个验证放射治疗的圆柱形人体模型。
探测子系统由一个控制和数据采集系统补充,该系统具有多个通道,允许从探测子系统读取每个条带或像素。
控制子系统允许使用发动机旋转圆柱形人体模型,从而通过使用角度传感器子系统即时控制其角度位置。该子系统可以以与龙门加速器相同的角速度旋转,同时加速器传送如vmat的复杂治疗。
探测器信号由数据采集系统数字化。这种采集系统允许使用数模转换器进行数字化,数模转换器的位数和频率样本允许最小化剂量测量的不确定性。
数字化信息与源在加速器中的信息一起按照通信协议布置在采集系统中,作为执行的非限制性示例,如以太网。这些信息可以通过通信总线发送和存储在pc或过程和存储系统中,其也可以允许集成来自规划系统的数据。人机界面(以下简称hmi)不仅允许控制和数据采集系统的配置和管理,还允许光束特性参数、测量、重建和验证治疗的访问和可视化。
以二维重建图像为基础,得到了基于探测子系统的测量的放射治疗三维重建。
验证或评估这些参数将允许验证或检查可能的错误。换言之,如果他们不符合预先确定的标准,系统和方法将允许重复该过程,直到获得参数符合该标准才退出。
这样我们就得到了一种方法和系统,它集成在一个唯一的平台上,即优化工作流程和临床结果的介质。
附图说明
为了补充以下说明,并且更好地理解本发明的特征,根据实施例的优选示例,本说明书附有一组附图,其中具有说明性和非限制性的特征表示以下内容:
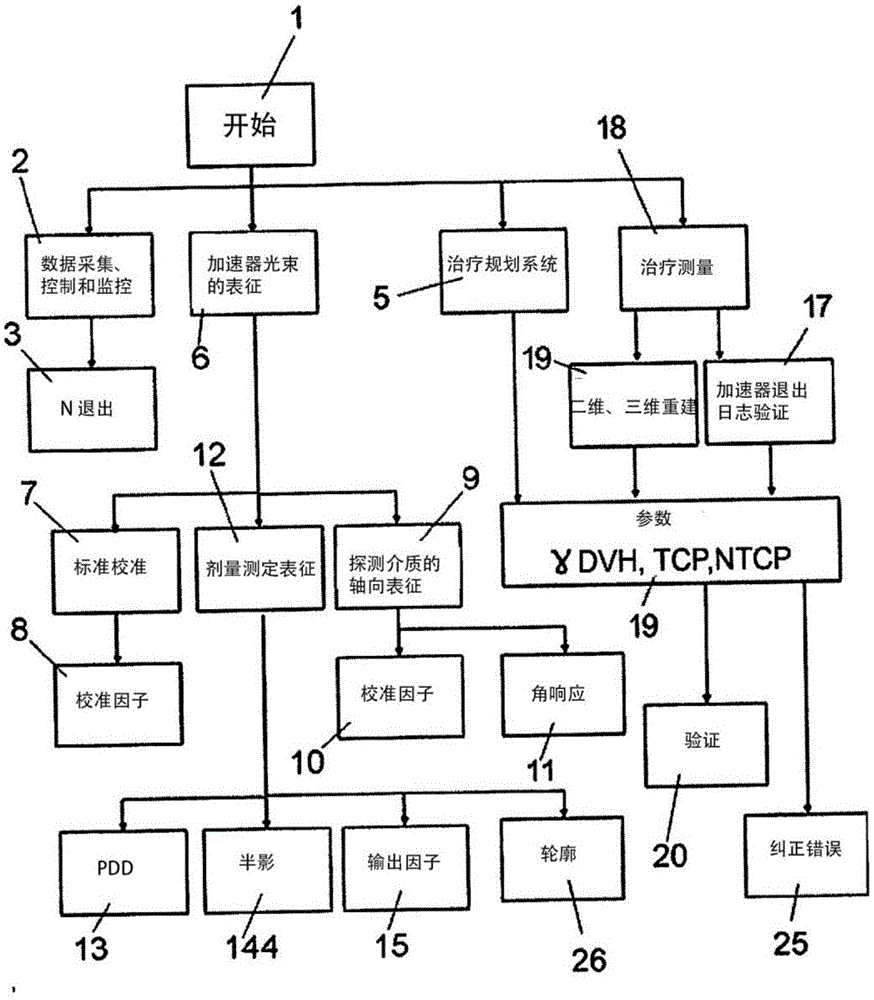
图1示出了实施本发明方法的应用架构的一般示意图。
图2说明了计算用户介质中深度剂量性能的分析。
图3示出了应用该方法的分段硅带探测器获得的半影的计算是如何可视化的。
图4示出了如何可视化输出因子的计算。
图5说明了分段条形探测器在轴向平面上的表征。
图6说明了使用不同入射角计算分段条形探测器校准因子的程序。
图7说明了应用轴向平面最终校准程序的结果。
图8示出了用于重建32条带探测器的剂量图谱的算法应用示例,用于半径为3a(其中a是条带宽度)的圆形剂量分布(圆形不在中间)。
图9示出了带有伽马因子计算结果的图谱。参考文件可以被选择,因为这通常是由规划者获得的,重建的剂量图谱文件可以检查结果的有效性。
图10示出了为实施上述方法而规划的安装或系统的示意图。
具体实施方式
在本发明方法和系统的实际实施中,将光束加速器的表征和放射治疗的验证集成在同一平台中,评估tps计算与加速器提供的剂量分布之间的一致性,该方法和系统允许加速器在放射治疗中提供的剂量分布,通过在轴向平面上的直接测量和研究加速器日志中可能的偏差、分析和处理信息来评估。该方法和系统允许在相同的范围内整合tps的规划剂量计算和提供的剂量。通过使用不同的参数获得了规划剂量和加速器提供剂量之间的一致性,实施的非限制性示例如二维伽马、三维伽马和剂量容积柱状图(dvh)、肿瘤控制概率(tcp)、正常组织并发症概率(ntcp)。
在更精确的方式中,定义了系统(2),以集成光束加速器(21)的表征和三维放射治疗(22)的验证,其不仅基于在这样的辐射光束的同一出口平面中获得的测量,而且还包括在加速器文件中包含的信息。该系统包括以下几个阶段:
a.在使用加速器(21)以不同所需条件辐照放置在与辐射束垂直的平面人体模型上的探测子系统(11)之后,读取系统的配置、控制、监控和自动化,不同所需条件由表征光束的不同机构的建议来定义。
b.校准放置在平面人体模型(12)上的探测器子系统(11)的读数,将所得值与来自用作标准参考的另一种探测介质(例如电离室)的值进行比较,包括在这种校准中,如果需要,校正在探测器子系统中的暗电流效应。
c.自动获取放置在垂直于辐射光束的平面人体模型(12)内的探测器子系统剂量测定响应(11):它允许获取表征加速器光束(21)的参数,作为非限制性示例:深度输出曲线(图2或111)、剂量轮廓(112)和不同场尺寸的输出因子(图4或113)。
d.放置在圆柱形人体模型(14)内的探测介质的轴向平面中的自动剂量校准,根据入射角(图5、6和7),因此包括第二剂量校准,作为参考在相同条件下从规划系统获取数据,如果需要,包括对由暗电流造成的效应的校正。
e.基于探测器子系统在使用氡变换的轴向平面上进行的测量,对探测器子系统(11)上应用的放射治疗(图8)的三维重建(114)。利用二维重建图像获得三维重建。
f.验证和自动可视化用探测器子系统(11)进行的测量重建的剂量图谱,剂量图谱使用不同参数通过tps和从用于治疗的加速器输出日志获得的响应来获得,不同参数的非限制性示例为:伽马指数(图9或115)和dvh柱状图(116)的计算,这些柱状图将每个器官接收的剂量与容积联系起来。
验证放射治疗的方法(1)依赖于系统的使用。该系统具有一个探测器子系统(11),该探测器子系统由一组半导体段带或像素探测器(最好是硅探测器)组成,这些探测器设置在平行平面上,可以放置在舱(31)上,定位在允许容纳探测器子系统(11)的平面人体模型(12)中,或者定位在允许在将探测器子系统(11)保持在与辐射光束平行的平面上的圆柱形或拟人人体模型(14)中。探测介质(11)允许获得大于2mm的空间分辨率。
该系统还具有用于探测器子系统输出的可读介质(13),该可读介质放置在舱(31)上。探测器子系统(11)的可读介质(13)基于数字化仪,其采样频率和位数之间的关系允许获得大约大于2%的测量。
同时,该系统在舱外有一些介质,用于控制可读介质和圆柱形人体模型子系统的旋转,具有角度传感器子系统(15)和通信系统,该角度传感器子系统不仅可以协调圆柱形人体模型相对于加速器头部的角度位置,而且还可以协调运动速度,通信系统在加速器(21)和可读介质(13)之间,位于舱外靠近控制系统(32)。控制可读介质(13)的介质还允许可视化所捕获的数据,并允许应用集成加速器辐射光束表征和三维放射治疗验证的方法;不仅基于利用探测介质(11)从该辐射光束的同一输出平面上获得的测量值,也基于包括加速器日志中的分析和信息处理。
该系统还具有位于舱(31)上的可读介质(13)和可读介质(13)的控制介质之间的通信子系统(15),优选为以太网。
更具体地说,根据图1,本发明的方法从初始状态(1)开始,允许用户在三种可能的状态中选择方法应用的开始:系统的数据采集、控制和监控(2);加速器光束的表征(6);以及对治疗的验证(18)。
加速器光束的表征允许选择在标准条件下校准程序的开始(7)、剂量测定表征(12)和探测介质的轴向表征(9)。从标准校准中,我们得到校准因子(8),而从轴向校准(9)中,我们得到校准因子(10)和角响应(11),在一条线上得到一个剂量学表征(12),从中获得pdd(13)、半影(图3或144)和输出因子(15);并且获得轮廓(26)。验证(18),在轴向系统中的治疗进行测量之前,允许在提供测量的治疗后访问基于该测量的三维重建(19)、tps计算(5)和加速器日志(17)的结果,允许访问验证(18)的参数(19)、验证或纠正错误(25),如果参数不符合既定的标准,认为治疗是安全的。
对于验证放射治疗的程序,该方法和系统允许为探测介质的每个角度位置和加速器日志中包含的信息收集自动数据,以便以后可视化剂量图谱的重建和允许其验证的参数计算,参数的非限制性示例如伽玛指数。
该方法为用户提供了根据加速器能量选择cgy/um关系的可能性。该方法允许在标准条件和参考条件下获得剂量校准因子、与可用剂量轮廓相关的表格、计算用户介质内的百分比深度-剂量;允许可视化使用半导体探测器介质获得的半影计算;允许应用该方法逻辑与输出因子计算。
该方法和系统允许用户通过探测器子系统可视化轴向表征。用户可以监控对不同等入射角响应之间的比较(图6),也可以可视化规划者的数据和探测器获得的数据(图5),并且可视化每个角度的校准因子,以及看见最终校准(图7)。
图9示出了用于32条带探测介质的剂量图谱重建的算法应用的非限制性示例,用于半径为3a(其中a是条带宽度)的圆形剂量分布(其圆形不在中间)。在左侧示出了y轴投影或剂量轮廓。在右侧示出了x,y平面上的剂量分布。
最后,图10示出了带有二维伽马因子计算结果的图谱。参考文件可以被选择,因为这通常是由规划者获得的,重建的剂量图谱文件来检查结果的有效性。
- 还没有人留言评论。精彩留言会获得点赞!