左旋多巴和卡比多巴肠凝胶以及使用方法与流程
本披露提供了(a)包含左旋多巴活性剂和卡比多巴活性剂的药物组合物;和(b)治疗帕金森氏病和相关病症的方法,所述方法包括将所述药物组合物给予至患有帕金森氏病的受试者。
背景技术:
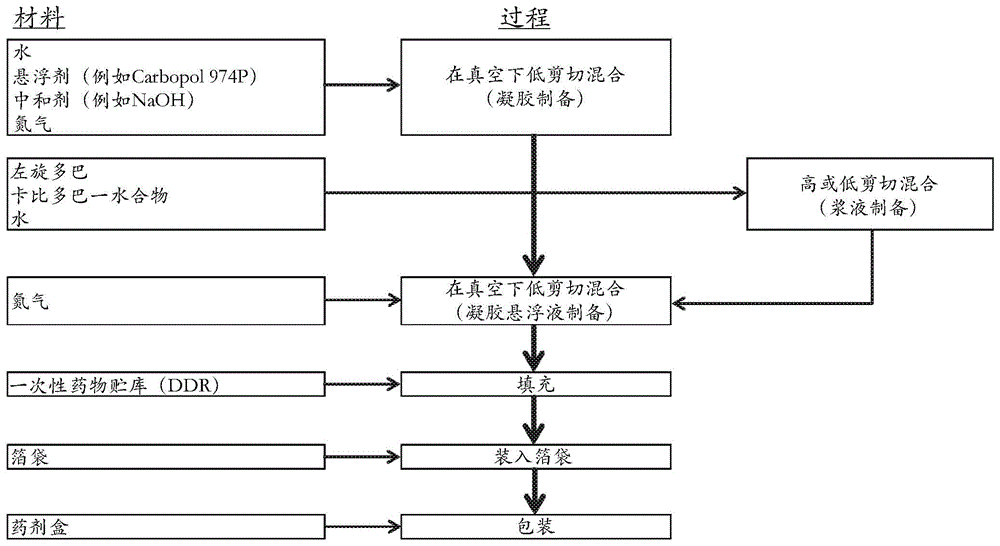
:帕金森氏病是一种慢性和进行性神经退行性病症,其特征在于脑中的神经递质多巴胺(即,3,4-二羟基苯乙胺)水平的降低。目前治疗帕金森氏病患者最有效的疗法是给药左旋多巴(或l-dopa)。不像多巴胺可以穿过血脑屏障,左旋多巴在脑中酶促地转化为多巴胺,导致多巴胺水平升高:左旋多巴转化为多巴胺是由芳香族l-氨基酸脱羧酶催化的,该脱羧酶是一种普遍存在的促进左旋多巴向多巴胺的中枢和外周代谢的酶。需要相对大剂量的左旋多巴以在脑中达到多巴胺的治疗有效水平。给药这样大剂量的左旋多巴导致外周多巴胺水平升高,这可以引起一些患者恶心。为了克服这些问题,左旋多巴通常与外周芳香族l-氨基酸脱羧酶抑制剂例如卡比多巴(即,(2s)-3-(3,4-二羟基-苯基)-2-肼基-2-甲基丙酸)共给予:卡比多巴与左旋多巴的共给药抑制左旋多巴外周代谢为多巴胺,这显著降低了治疗有效应答所需的左旋多巴剂量并减少了相关的副作用。然而,即使当左旋多巴和卡比多巴共给予时,由于左旋多巴在血浆中的半衰期相对较短,难以在脑中始终维持所希望的多巴胺水平。另外,许多患者对脑中多巴胺水平变化的耐受性随着疾病的进展而降低。已经有效降低多巴胺水平的变化的一种方法是以其商业名称为人所知的可调节剂量的左旋多巴/卡比多巴凝胶的连续肠递送。是左旋多巴/卡比多巴一水合物(左旋多巴与卡比多巴一水合物的比例为4∶1)在水性凝胶中的悬浮液。凝胶通过经皮内镜胃造口术的端口插入的空肠管递送到近端小肠。被包装在一次性药物贮库(“ddr”)中,并经由软件控制的便携式输注泵(ambulatoryinfusionpump)持续给予。尽管左旋多巴和卡比多巴已经共给予以治疗帕金森氏病几十年,但是适合于在室温储存的药物凝胶组合物目前尚不可商购。左旋多巴/卡比多巴肠凝胶的当前组合物是用于连续肠给药的凝胶。对于长期给药,该凝胶通过具有内置肠/空肠管的经皮内镜胃造口术的管用便携式泵直接给予到十二指肠或上空肠内。每1ml的含有20mg左旋多巴和5mg卡比多巴一水合物。尽管目前在商业上取得成功,但是该产品在产品制备方面受到限制,包括(1)储存和给药期间药物颗粒沉降的风险,(2)卡比多巴的化学不稳定性,这会导致肼形成。因此存在对改进的配制品和方法的持续需求,这些改进的配制品和方法可以在脑中提供持续且一致的多巴胺水平以有效治疗例如帕金森氏病等运动障碍。本披露提供了这样的改进的配制品和方法。技术实现要素:在一个方面,本披露提供了用于十二指肠内给药的包含左旋多巴活性剂和卡比多巴活性剂的药物组合物,其中该左旋多巴活性剂和卡比多巴活性剂悬浮在一种或多种基于聚合物的悬浮剂中,例如,卡波姆,并且该药物组合物具有至少约0.3帕斯卡(pa)的屈服值和≤15的验收值(acceptancevalue)。左旋多巴活性剂能以组合物的约4重量/重量百分比(w/w%)的量提供,并且卡比多巴活性剂(例如,卡比多巴一水合物)能以组合物的约1重量/重量百分比的量提供。本披露的药物组合物具有在一种或多种储存条件下,例如,在5℃,在室温(例如,约20℃至约25℃)和约60%的相对湿度(rh),或在约40℃和约75%的rh,提供至少约8周、至少约15周、至少约26周、或至少约60周的物理稳定性的屈服值。在另一个方面,本披露提供了用于十二指肠内给药的包含左旋多巴活性剂和卡比多巴活性剂的药物组合物,其中该左旋多巴活性剂和卡比多巴活性剂悬浮在一种或多种基于聚合物的悬浮剂中,并且该药物组合物具有至少约1.1帕斯卡(pa)的屈服值。左旋多巴活性剂能以组合物的约4重量/重量百分比(w/w%)的量提供,并且卡比多巴活性剂(例如,卡比多巴一水合物)能以组合物的约1重量/重量百分比的量提供。该药物组合物在室温(例如,约20℃至约25℃)具有适合于保持物理稳定性至少约15周的所希望的屈服值。在另一个方面,本披露提供了用于十二指肠内给药的包含左旋多巴活性剂和卡比多巴活性剂的药物组合物,其中该左旋多巴活性剂以组合物的约4重量/重量百分比(w/w%)的量提供,并且卡比多巴(例如,卡比多巴一水合物)以组合物的约1重量/重量百分比的量提供,其中该左旋多巴和卡比多巴悬浮于水性载体中,并且储存在单独的一次性药物贮库(“ddr”)中。含有药物组合物的ddr被充当完全隔氧层的材料覆盖,例如箔袋。该包装确保药物组合物在室温(例如,约20℃至约25℃)适合于保持化学稳定性至少约15周。在另一个方面,本披露提供了一种治疗有需要的患者的帕金森氏病的方法,其中所述方法包括向该患者给予用于十二指肠内给药的包含左旋多巴活性剂和卡比多巴活性剂的药物组合物,其中该左旋多巴活性剂和卡比多巴活性剂悬浮在一种或多种基于聚合物的悬浮剂中,并且该药物组合物具有至少约4pa的屈服值。左旋多巴剂能以组合物的约4重量/重量百分比(w/w%)的量提供,并且卡比多巴活性剂(例如,卡比多巴一水合物)能以组合物的约1重量/重量百分比的量提供。该药物组合物在室温(例如,约20℃至约25℃)具有适合于保持物理稳定性至少约15周的所希望的屈服值。在另一个方面,本披露涉及制造本披露的药物组合物,特别是例如下文实例1和图1中所披露的高浓度的药物组合物的方法。本文中进一步描述了本披露的这些和另外的实施例。通过阅读本专利申请,本披露的另外的益处对于本领域技术人员将是显而易见的。在下面的段落中描述的本披露的实施例旨在说明本发明,并且不应该被认为缩小了本发明的范围。附图说明图1是用于生产本披露的示例性药物配制品的制造过程流程图。图2显示本披露的示例性药物组合物与两种比较剂相比在小型猪中的左旋多巴血液水平时间-浓度特征曲线的线图,该示例性药物组合物和两种比较剂全部以推注加连续6小时输注给予。图3显示本披露的示例性药物组合物与两种比较剂相比在小型猪中的卡比多巴血液水平时间-浓度特征曲线的线图,该示例性药物组合物和两种比较剂全部以推注加连续6小时输注给予。图4a是显示对于用974p制备并在启动时间点和15周用箔袋包装的左旋多巴卡比多巴肠凝胶,在ph4.5介质中的左旋多巴的溶出速率的线性图。图4b是显示对于用974p制备并在启动时间点和15周用箔袋包装的左旋多巴卡比多巴肠凝胶,在ph4.5介质中的卡比多巴的溶出速率的线性图。图5是显示用971p制备的、填充有左旋多巴-卡比多巴肠凝胶的3个不同小瓶的插图。样品从左到右具有以下971p浓度:0.5%w/w、0.2%w/w、0.1%w/w(或w/w%)。图6是显示在各种条件下储存后包含左旋多巴和卡比多巴的药物组合物的低剪切(ls)粘度的线性图。图7是显示在各种条件下储存后包含左旋多巴和卡比多巴的药物组合物的高剪切(hs)粘度的线性图。图8是显示确定药物组合物的验收值的方法的图。图9是显示小型猪中配制品b(大左旋多巴粒度)和配制品c(小左旋多巴粒度)的药代动力学的线性图。具体实施方式本书面描述使用实例来披露本发明,包括最佳模式,并且还使得本领域任何技术人员能够实践本发明,包括制作和使用任何所披露的药物组合物、药剂盒、药物剂型、以及实施任何所披露的方法或过程。本发明的可取得专利权的范围由权利要求书定义,并且可以包括本领域技术人员想到的其他实例。如果这些其他实例具有与权利要求书的文字语言没有区别的元件,或者如果它们包括等同元件,则预期它们在权利要求书的范围内。i.定义如在本章节中所用的章节标题以及全部披露内容不旨在是限制性的。在列举数值范围的情况下,以相同的精确度明确地考虑了该范围内的每个居间数值(interveningnumber)。例如,对于范围6至9,除了6和9之外还考虑数值7和8,并且对于范围6.0至7.0,明确考虑数值6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9和7.0。以相同的方式,所有列举的比率还包括落在更宽比率内的所有子比率。单数形式“一个/一种”和“该/所述”包括复数个指示物,除非上下文中另外明确规定。本文中用于短语例如“a和/或b”中的术语“和/或”旨在包括:“a和b”、“a或b”、“a”以及“b”。术语“约”通常是指本领域的技术人员认为等同于所列举的值(即,具有相同功能或结果)的数字范围。在许多情况下,术语“约”可以包括四舍五入到最接近的有效数字的数值。在一些实施例中,术语“约”包括列举的数字±10%。因此,“约10”意指9至11。除非上下文另外要求,术语“包含(comprise、comprises和comprising)”是在它们将被解释为包含的而非排他的,并且申请人意指这些词语中的每一个都将在本专利申请(包括以下的权利要求书)中被如此解释的基础和清楚的理解使用的。术语“改进/改善”对于药学或医学科学领域的技术人员来说具有其朴素和一般性含义,并且具体包括缓解帕金森氏病的影响、或降低或减轻帕金森氏病的症状或副作用。术语“患者”包括哺乳动物和人类,尤其是人类。术语“药学上可接受的赋形剂”是指与药物给予相容的任何和所有溶剂、分散介质、防腐剂、抗氧化剂、等渗剂和吸收延迟剂等。分散介质可包括水不溶性赋形剂,例如微晶纤维素。术语“药学上可接受的盐”是指药学上可接受的并且拥有母体化合物的所希望的药理学活性的化合物的盐。这样的盐包括:(1)与无机酸例如盐酸、氢溴酸、硫酸、硝酸、磷酸等所形成的酸加成盐;或与有机酸例如乙酸、丙酸、己酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、3-(4-羟基苯甲酰)苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、1,2-乙二磺酸、2-羟基乙磺酸、苯磺酸、4-氯苯磺酸、2-萘磺酸、4-甲苯磺酸、樟脑磺酸、4-甲基-二环[2.2.2]-辛-2-烯-1-甲酸、葡糖庚酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、月桂基硫酸、葡糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸、粘康酸等所形成的酸加成盐;以及(2)当母体化合物中存在的酸性质子被金属离子(例如碱金属离子、碱土金属离子或铝离子)代替而形成的盐;或与有机碱(例如乙醇胺、二乙醇胺、三乙醇胺、n-甲基葡糖胺、二环己基胺等)配位所形成的盐。术语“减少(reduce和reducing)”对于药学或医学科学领域的技术人员来说具有其朴素和一般性含义,并且具体包括减弱或减少帕金森氏病症状或副作用(例如运动障碍或幻觉)的发生次数、持续时间或强度。术语“治疗有效量”意指当对患有或易感帕金森氏病或相关病症的患者单独给予或与其他疗法组合给予时,有效治疗帕金森氏病或相关病症的化合物的量。“治疗有效量”将取决于例如化合物、药物组合物或药物剂型、所治疗的病症及其严重程度、以及待治疗患者的年龄和体重而变化。术语“治疗(treat和treating)”对于药学或医学科学领域的技术人员来说具有其朴素和一般性含义,并且具体包括改善生活质量或减少帕金森氏病的症状或副作用。术语“一个/一种”可以指一个/一种或多于一个/多于多种。如本文使用的术语“左旋多巴活性剂”是指左旋多巴及其药学上可接受的盐或水合物。在一个实施例中,左旋多巴活性剂是左旋多巴的水合形式。在另一个实施例中,左旋多巴活性剂是左旋多巴一水合物。在另一个实施例中,左旋多巴活性剂是左旋多巴。左旋多巴也称为l-dopa。如本文使用的术语“卡比多巴活性剂”是指卡比多巴及其药学上可接受的盐或水合物。在一个实施例中,卡比多巴活性剂是卡比多巴的水合形式。在另一个实施例中,卡比多巴活性剂是卡比多巴一水合物。在另一个实施例中,卡比多巴活性剂是卡比多巴。术语“室温”通常是指在约20至约25摄氏度的温度下的环境条件。ii.药物组合物如上文所讨论的,用于十二指肠内给药的包含左旋多巴和卡比多巴悬浮液的药物组合物面临各种挑战,包括在储存和给药期间药物颗粒的沉降以及在储存期间缺乏化学稳定性。为了解决这些挑战,出乎意料地发现,当药物组合物具有合适的屈服值并且包装在箔袋或任何其他充当隔氧层的包装中时,可以克服这些挑战。屈服值与流体在压力下的初始流动阻力有关;因此,屈服值也可称为屈服应力。屈服值影响介质(例如运载体和/或悬浮剂)的悬浮能力。具体而言,如果介质的屈服值足以克服重力或浮力对这些颗粒的影响,则分散在介质中的颗粒可保持悬浮。屈服值独立于粘度。因此,本披露提供了用于十二指肠内给药的包含左旋多巴活性剂和卡比多巴活性剂的药物组合物,其中左旋多巴活性剂和卡比多巴活性剂以治疗有效量存在于一种或多种基于聚合物的悬浮剂中,并且其中药物组合物具有合适的屈服值。合适的屈服值的实例包括但不限于至少约1.1pa。在另一个实施例中,合适的屈服值的实例包括但不限于至少约0.3pa。如本文所理解的,使用来自ta仪器的discoveryhr-2流变计测量屈服值。流变计可以配备有同心圆柱体或其他合适的几何形状(例如圆锥形和板形)。首先将样品在25℃浸泡600秒,或直至达到平衡。如果需要,能以2001/s预剪切样品120秒。通过首先将预剪切的样品浸泡360秒,然后经300秒将剪切速率从0.0011/s增加到2501/s,或可以给出屈服值的良好分辨率的其他合适范围来使流动渐增。如果需要,样品能以2501/s保持另外的300秒。最后,经300秒从2501/s到0.0011/s,或可以给出屈服值的良好分辨率的其他合适范围来使流动渐降。将由此产生的流动渐降或渐增与herschel-bulkley模型拟合以获得屈服值。本文描述的具有以上描述的屈服值的药物组合物在室温(例如,约20℃至约25℃,例如约22℃)抗沉降至少约1周、至少约2周、至少约3周、至少约4周、至少约5周、至少约6周、至少约7周、至少约8周、至少约9周、至少约10周、至少约11周、至少约12周、至少约13周、至少约14周、或至少约15周。在另一个实施例中,本文描述的具有至少约0.3pa的屈服值的药物组合物是物理稳定的,并且当储存至少约8周、至少约10周、至少约15周、至少约20周、至少约26周、至少约30周、至少约40周、至少约50周、或至少约60周时在室温下抗沉降。在另一个实施例中,当包装在箔袋或其他适合作为隔氧层的包装中时,药物组合物在室温下(例如,约20℃至约25℃,例如约22℃)至少约15周是化学稳定的。另外,本文描述的药物组合物包装在箔袋,或充当隔氧层的其他合适的包装中,在室温下(例如,约20℃至约25℃,例如约22℃)稳定至少约15周、或者可替代地至少约1周、至少约2周、至少约3周、至少约4周、至少约5周、至少约6周、至少约7周、至少约8周、至少约9周、至少约10周、至少约11周、至少约12周、至少约13周、至少约14周、或至少约15周。在另一个实施例中,当包装在箔袋或其他适合充当隔氧层的包装中时,并且任选地,当药物组合物或箔袋包含除氧剂时,药物组合物在室温(例如,约20℃至约25℃,例如约22℃)下化学稳定至少约8周。在另一个实施例中,药物组合物在室温下化学稳定至少约9周、至少约10周、至少约11周、至少约12周、至少约13周、至少约14周、至少约15周、至少约26周、或至少约60周。除氧剂包括但不限于铁粉和氯化钠、活性炭、以及抗坏血酸的混合物。在各种方面,存在于药物组合物中的左旋多巴活性剂和卡比多巴活性剂(例如卡比多巴一水合物)的治疗有效量可以分别为组合物的约4.0和1.0重量/重量百分比。在一个实施例中,药物组合物包含占总组合物约4.0重量/重量百分比的量的左旋多巴活性剂;占总组合物约1.0重量/重量百分比的量的卡比多巴活性剂(例如,卡比多巴一水合物);至少一种悬浮剂(例如基于聚合物的);和液体运载体(例如水,聚乙二醇)。在各种实施例中,液体运载体可以占总组合物的从约0重量/重量百分比至约95重量/重量百分比,例如占总组合物的从约10重量/重量百分比至约70重量/重量百分比、或从约40重量/重量百分比至约60重量/重量百分比。在一个实施例中,左旋多巴活性剂是左旋多巴及其药学上可接受的盐或水合物,例如左旋多巴一水合物。在一个实施例中,存在于组合物中的左旋多巴以占总组合物的从约1.0至5.0重量/重量百分比的量存在。在一个实施例中,药物组合物包含约4.0重量/重量百分比的左旋多巴活性剂。在一个实施例中,例如如下文实例1中所述,左旋多巴活性剂可以被加工成微粒或微球等,以包含在本发明的药物组合物中。在一个实施例中,卡比多巴活性剂是卡比多巴及其药学上可接受的盐或水合物,例如卡比多巴一水合物。在一个实施例中,存在于组合物中的卡比多巴活性剂以占总组合物的从约0.25至1.25重量/重量百分比的量存在。在一个实施例中,药物组合物包含约1.0重量/重量百分比的卡比多巴活性剂。在一个实施例中,待给予的卡比多巴活性剂的形式是卡比多巴的水合形式。在一个实施例中,待给予的卡比多巴活性剂的形式是卡比多巴一水合物。在一个实施例中,例如如下文实例1所述,卡比多巴活性剂可以被加工成微粒或微球等,以包含在本发明的药物组合物中。左旋多巴活性剂和卡比多巴活性剂能以任何合适的比率存在于药物组合物中,例如在本发明的药物组合物中左旋多巴活性剂与卡比多巴活性剂(例如,卡比多巴一水合物)的比率可以为约4∶1。例如,药物组合物可以包含约4重量/重量百分比的左旋多巴活性剂和1重量/重量百分比的卡比多巴活性剂(例如,卡比多巴一水合物)。在一个实施例中,药物组合物包含每5.0ml体积含有约200mg左旋多巴和约50mg卡比多巴(例如,卡比多巴一水合物)的液体或粘性液体。在一个实施例中,例如如下文实例1中描述的,左旋多巴活性剂和卡比多巴活性剂可以被加工成微粒或微球等,以包含在本发明的药物组合物中。在另一个实施例中,合适的悬浮剂可以是任何基于聚合物的悬浮剂,其提供具有至少约0.3pa的屈服值的药物组合物。本披露的药物组合物可包含一种或多种悬浮剂。合适的基于聚合物的悬浮剂的实例包括但不限于丙烯酸基聚合物,例如主要由丙烯酸制成的聚合物(称为卡波姆(carbomer)),或者以商品名销售的丙烯酸基聚合物;以及水胶体聚合物,例如槐树豆胶、瓜耳胶、甲基纤维素、羧甲基纤维素钠和微晶纤维素,例如cl-611或rc591、黄原胶,例如vanzan,和黄蓍胶。卡波姆可以是与多元醇的烯醚交联的丙烯酸的高分子量聚合物。丙烯酸基聚合物可以是交联的,例如与聚链烯基醚或二乙烯乙二醇交联。具体而言,一种或多种悬浮剂可以是934p、971p或974p。934p可以由usp/nf药典专著药典名称卡波姆934p描述。971p可以由usp/nf药典专著药典名称卡波姆均聚物类型a描述。974p可以由usp/nf药典专著药典名称卡波姆均聚物类型b描述。基于聚合物的悬浮剂,例如971p和974p,是合成的,不像基于纤维素的试剂,它可以减少批次间的差异性。此外,基于聚合物的悬浮剂,例如971p和974p,基本上不溶解,从而减少与左旋多巴活性剂和卡比多巴活性剂的任何负相互作用。而且,基于聚合物的悬浮剂,例如971p和974p,不是基于纤维素的,这降低了生产这种基于纤维素的试剂的环境影响。一种或多种悬浮剂以药物组合物总重量的从约0.1至约6w/w%的量掺入组合物中。一种或多种悬浮剂能以该范围内的任何量使用,包括例如约0.1至约1w/w%,约0.1至约0.5w/w%,或约0.1至约0.2w/w%。在另一个实施例中,合适的悬浮剂可以是任何基于聚合物的悬浮剂,其提供具有至少约4pa的屈服值的药物组合物。合适的基于聚合物的悬浮剂的实例包括但不限于丙烯酸基聚合物,例如主要由丙烯酸制成的聚合物(称为卡波姆),或者以商品名销售的丙烯酸基聚合物;以及水胶体聚合物,例如槐树豆胶、瓜耳胶、甲基纤维素、羧甲基纤维素钠和微晶纤维素和黄蓍胶。基于丙烯酸的聚合物可以是交联的,例如与聚链烯基醚或二乙烯乙二醇交联。具体而言,一种或多种悬浮剂可以是971p和974p。基于聚合物的悬浮剂,例如971p和974p,是合成的,不像基于纤维素的试剂,它可以减少批次间的差异性。此外,基于聚合物的悬浮剂,例如971p和974p,基本上不溶解,从而减少与左旋多巴活性剂和卡比多巴活性剂的任何负相互作用。而且,基于聚合物的悬浮剂,例如971p和974p,不是基于纤维素的,这降低了生产这种基于纤维素的试剂的环境影响。悬浮剂以药物组合物总重量的从约0.1至约5w/w%的量掺入组合物中。悬浮剂能以该范围内的任何量使用,包括例如约0.1至约1w/w%,或约0.1至约0.5w/w%。在另一个实施例中,悬浮剂是丙烯酸基聚合物,例如卡波姆.例如971p或974p,并且该组合物包含总组合物的约0.1w/w%至约0.5w/w%的量的丙烯酸基聚合物,例如以总组合物的约0.1w/w%至约0.3w/w%的量、例如以总组合物的约0.1w/w%至约0.2w/w%的量的丙烯酸基聚合物。在另一个实施例中,组合物包含基于丙烯酸的聚合物,其量为总组合物的约0.10w/w%。在另一个实施例中,组合物包含基于丙烯酸的聚合物,其量为总组合物的约0.11w/w%、约0.12w/w%、约0.13w/w%、约0.14w/w%、约0.15w/w%、约0.16w/w%、约0.17w/w%、约0.18w/w%、约0.19w/w%、约0.20w/w%、或约0.20w/w%。在另一个实施例中,悬浮剂是水胶体聚合物,例如槐树豆胶、瓜耳胶、甲基纤维素、羧甲基纤维素钠和微晶纤维素、或黄蓍胶,并且组合物包括以总组合物的约1w/w%至约6w/w%的量的水胶体聚合物。在另一个实施例中,组合物包含总组合物的约1w/w%的量的水胶体聚合物。在另一个实施例中,组合物包含总组合物的约2w/w%、约3w/w%、约4w/w%、或约5w/w%的量的水胶体聚合物对于本发明的组合物,可以使用一种或多种悬浮剂来获得具有如上所述的所希望的屈服值的十二指肠内给药的悬浮液。然而,当使用表面活性剂时,可能最好在添加本文中教导的左旋多巴活性剂和卡比多巴活性剂和悬浮剂之后添加一种或多种表面活性剂。应当理解,本披露的组合物包含的每种组分必需是药学上可接受的并且对于旨在给予人受试者的配制品中的给药是安全的。可以添加抗微生物剂以通过抑制微生物生长来保存组合物。可以使用任何药学上可接受的抗微生物剂,例如像苯甲酸钠、丙酸钠、和山梨酸酯。在添加如本文教导的左旋多巴活性剂和卡比多巴活性剂和悬浮剂后,可以掺入一种或多种表面活性剂。当使用卡波姆,即971p或974p作为悬浮剂时,必需添加中和剂。中和剂的实例是,但不限于无机碱,例如,氢氧化钠和氢氧化钾,或胺,例如三乙醇胺和氨丁三醇。在一个实施例中,药物组合物是粘性液体组合物。在一个方面,药物组合物包含水并且适合于输注。在另一个实施例中,药物组合物具有至少约5mg/ml的左旋多巴活性剂浓度。在一个方面,左旋多巴活性剂浓度为至少约10mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约20mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约30mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约35mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约40mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约45mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约50mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约100mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约150mg/ml。在另一个方面,左旋多巴活性剂浓度为至少约200mg/ml。在另一个实施例中,药物组合物具有至少约5mg/ml的卡比多巴活性剂(例如卡比多巴一水合物)浓度。在一个方面,卡比多巴活性剂浓度为至少约10mg/ml。在另一个方面,卡比多巴活性剂浓度为至少约20mg/ml。在另一个方面,卡比多巴活性剂浓度为至少约30mg/ml。在另一个方面,卡比多巴活性剂浓度为至少约50mg/ml。在另一个方面,卡比多巴活性剂浓度为至少约100mg/ml。在另一个方面,卡比多巴活性剂浓度为至少约150mg/ml。在另一个方面,活性剂卡比多巴浓度为至少约200mg/ml。本披露的药物组合物任选地包含一种或多种另外的药学上可接受的赋形剂。术语“赋形剂”是指本身不是治疗剂、用作将治疗剂递送至受试者的载体或运载体或添加到药物组合物中以改进其处理或储存性能或允许或促进组合物的单位剂量形成的任何物质。赋形剂包括例如抗氧化剂、调节ph和渗透压的试剂、防腐剂、增稠剂、着色剂、缓冲剂、抑菌剂和稳定剂。给定的赋形剂(如果存在)通常将以按w/w%计约0.001%至约95%、约0.01%至约80%、约0.02%至约25%、或约0.3%至约10%的量存在。在一个实施例中,药物组合物任选地包含抗氧化剂。用于药物组合物中的合适的抗氧化剂包括例如丁羟甲苯、丁基羟基茴香醚、焦亚硫酸钾、半胱氨酸等。在一个实施例中,药物组合物任选地包含缓冲剂。缓冲剂包括减少ph变化的试剂。用于本披露的各种实施例中的适合的缓冲剂类型包括ia族金属的盐(包括例如ia族金属的碳酸氢盐、ia族金属的碳酸盐)、碱金属或碱土金属缓冲剂、铝缓冲剂、钙缓冲剂、钠缓冲剂或镁缓冲剂。合适的缓冲剂进一步包括任何前述的碳酸盐、磷酸盐、碳酸氢盐、柠檬酸盐、硼酸盐、乙酸盐、邻苯二甲酸盐、酒石酸盐、琥珀酸盐,例如磷酸钠或磷酸钾、柠檬酸钠或柠檬酸钾、硼酸钠或硼酸钾、乙酸钠或乙酸钾、碳酸氢钠或碳酸氢钾以及碳酸钠或盐酸钾。在一个实施例中,该组合物具有从约3.5至约8的ph。在一个方面,ph为从约3.5至约7.5。在另一个方面,ph为从约4.0至约7.5。在另一个方面,ph为从约5.0至约7.5。在另一个方面,ph为从约5.5至约7.5。在另一个方面,ph为从约6.0至约7.5。在各种实施例中,药物组合物可以存在于容器中。合适的容器包括不透氧的容器(例如袋)。可以将这些透氧性隔层并入主容器或二级外部容器中。合适容器的非限制性实例包括箔袋。在另一个实施例中,提供了一种药物剂型。药物剂型可以包含于ddr中的本文所述的药物组合物,在该ddr中具有配置于其中的不透氧外壳,其中该不透氧外壳用惰性气体(例如,n2)吹扫。也可以添加除氧剂(例如基于铁或非铁的罐或囊)。药物剂型可以适合于在能够以治疗有效的方式递送所述组合物的连续输注泵中使用。合适的不透氧外壳可包括例如箔袋。iii.制备药物组合物的方法本披露进一步提供了制备本文描述的药物组合物的方法。在各种方面,制备本文描述的药物组合物的方法可以包括提供适当的量的左旋多巴活性剂和卡比多巴活性剂,这样使得左旋多巴活性剂和卡比多巴活性剂以治疗有效量存在于药物组合物中。可以将左旋多巴活性剂和卡比多巴活性剂添加到水中以产生浆液。可以将浆液添加至如本文描述的一种或多种悬浮剂(例如971p或974p)、中和剂和水的混合物中以形成悬浮液。可以添加中和剂(例如氢氧化钠)使得ph在前文提及的范围内。悬浮液可以经受或不经受n2吹扫以降低氧气水平。具体地,悬浮液可以经受n2吹扫。任选地,可以使悬浮液脱气以从悬浮液中除去任何截留的氮气或空气。然后可以将悬浮液加载到如本文描述的不透氧的容器中。任选地,也可以向悬浮液中添加除氧剂。悬浮液经受n2吹扫和使用透氧性较低容器的组合可以通过减少组合物中存在的初始溶解的o2和储存期间进入组合物中的o2的量而有利地使药物组合物具有增加的化学稳定性。在各种方面,左旋多巴活性剂可以具有任何合适的粒度,用于制备具有适当药代动力学特性的药物组合物,并保持组合物的所希望的物理和化学稳定性。尽管可以使用范围广泛的粒度,但是左旋多巴活性剂(例如,在形成悬浮液之前)可以具有如下粒度分布,其中:(i)d50可以小于或等于约5μm、小于或等于约3μm、或小于或等于约1μm;(ii)d90可以小于或等于约11μm、小于或等于约9μm、小于或等于约7μm、小于或等于约5μm或小于或等于约3μm;以及(iii)d100可以小于等于约22μm、小于或等于约21μm、小于或等于约19μm、小于或等于约17μm、小于或等于至约15μm、小于或等于约13μm或小于或等于约11μm。在一个实施例中,左旋多巴活性剂具有如下的粒度分布:(i)小于或等于约5μm的d50;(ii)小于或等于11μm的d90;以及(iii)小于或等于22μm的d100。在另一个实施例中,左旋多巴活性剂(例如,在形成悬浮液之前)可以具有如下粒度分布,其中:(i)d10小于或等于约50μm、小于或等于约20μm、或小于或等于约10μm;(ii)d50小于或等于约100μm、小于或等于约50μm、或小于或等于约37μm;以及(iii)d90可以小于或等于约200μm、小于或等于约150μm、或小于或等于约120μm。在另一个实施例中,左旋多巴活性剂具有如下的粒度分布:(i)小于或等于约37.2μm的d50;(ii)小于或等于121.4μm的d90;以及(iii)小于或等于9.8μm的d10。卡比多巴活性剂也可以具有任何合适的粒度,用于制备具有适当药代动力学特性的本披露的药物组合物,并保持组合物的所希望的物理和化学稳定性。卡比多巴活性剂(例如,在形成悬浮液之前)可以具有如下粒度分布,其中:(i)d50可以小于或等于3μm;(ii)d90可以小于或等于7μm、或小于或等于5μm;以及(iii)d100可以小于或等于21μm、小于或等于19μm、小于或等于17μm、小于或等于15μm、小于或等于13μm、小于或等于至11μm、小于或等于9μm。在一个实施例中,卡比多巴活性剂,例如卡比多巴一水合物,可具有如下粒度分布:(i)小于或等于约3μm的d50;(ii)小于或等于7μm的d90;以及(iii)小于或等于21μm的d100。在另一个实施例中,卡比多巴活性剂具有如下的粒度分布:(i)小于或等于约9.4μm的d50;(ii)小于或等于34.5μm的d90;以及(iii)小于或等于3.1μm的d10。可以将左旋多巴活性剂和/或卡比多巴活性剂研磨或微粉化以获得这样的粒度分布。在另一个方面,卡比多巴活性剂(例如,在形成悬浮液之前)可以具有如下粒度分布,其中:(i)d10小于或等于约10μm、小于或等于约5μm、或小于或等于约3μm;(ii)d50小于或等于约20μm、小于或等于约15μm、或小于或等于约10μm;以及(iii)d90可以小于或等于约50μm、小于或等于约40μm、或小于或等于约35μm。在一个实施例中,本披露的药物组合物包含约4重量/重量百分比的左旋多巴活性剂和约1重量/重量百分比的卡比多巴活性剂(例如卡比多巴一水合物),其中以上描述的粒度分布保持物理稳定性至少约8周、至少约10周、至少约15周、至少约26周、或至少约60周,只要在将药物组合物暴露于约5℃的温度后测量,组合物的屈服值为至少约0.3pa。在另一个实施例中,本披露的药物组合物包含约4重量/重量百分比的左旋多巴活性剂和约1重量/重量百分比的卡比多巴活性剂(例如卡比多巴一水合物),其中以上描述的粒度分布保持物理稳定性至少约8周、至少约10周、至少约15周、至少约26周、或至少约60周,只要在将药物组合物暴露于约5℃的温度后测量,组合物的屈服值为至少约0.34pa、至少约0.4pa、至少约0.5pa、至少约0.6pa、至少约0.7pa、至少约0.8pa、至少约0.9pa、至少约1.0pa、至少约1.1pa、至少约1.2pa、至少约1.3pa、至少约1.4pa、至少约1.5pa、至少约1.6pa、至少约1.7pa、至少约1.8pa、至少约1.9pa、至少约2.0pa、至少约2.1pa、至少约2.2pa、至少约2.3pa、至少约2.4pa、至少约2.5pa、至少约2.6pa、至少约2.7pa、至少约2.8pa、至少约2.9pa、至少约3.0pa。在另一个实施例中,药物组合物包含约4重量/重量百分比的左旋多巴活性剂和约1重量/重量百分比的卡比多巴活性剂(例如卡比多巴一水合物),其中以上描述的粒度分布保持物理稳定性至少约8周、至少约10周、至少约15周、至少约26周、或至少约60周,只要在将药物组合物暴露于约25℃的温度和约60%的相对湿度(rh)后测量,组合物的屈服值为至少约0.3pa。在另一个实施例中,药物组合物包含约4重量/重量百分比的左旋多巴活性剂和约1重量/重量百分比的卡比多巴活性剂(例如卡比多巴一水合物),其中以上描述的粒度分布保持物理稳定性至少约8周、至少约10周、至少约15周、至少约26周、或至少约60周,只要在将药物组合物暴露于约25℃的温度和约60%的rh后测量,组合物的屈服值为至少约0.34pa、至少约0.4pa、至少约0.5pa、至少约0.6pa、至少约0.7pa、至少约0.8pa、至少约0.9pa、至少约1.0pa、至少约1.1pa、至少约1.2pa、至少约1.3pa、至少约1.4pa、至少约1.5pa、至少约1.6pa、至少约1.7pa、至少约1.8pa、至少约1.9pa、至少约2.0pa、至少约2.1pa、至少约2.2pa、至少约2.3pa、至少约2.4pa、至少约2.5pa、至少约2.6pa、至少约2.7pa、至少约2.8pa、至少约2.9pa、至少约3.0pa。在另一个实施例中,药物组合物包含约4重量/重量百分比的左旋多巴活性剂和约1重量/重量百分比的卡比多巴活性剂(例如卡比多巴一水合物),其中以上描述的粒度分布保持物理稳定性至少约8周、至少约10周、至少约15周、至少约26周、或至少约60周,只要在将药物组合物暴露于约40℃的温度和约75%的rh后测量,组合物的屈服值为至少约0.3pa。在另一个实施例中,药物组合物包含约4重量/重量百分比的左旋多巴活性剂和约1重量/重量百分比的卡比多巴活性剂(例如卡比多巴一水合物),其中以上描述的粒度分布保持物理稳定性至少约8周、至少约10周、至少约15周、至少约26周、或至少约60周,只要在将药物组合物暴露于约40℃的温度和约75%的rh后测量,组合物的屈服值为至少约0.34pa、至少约0.4pa、至少约0.5pa、至少约0.6pa、至少约0.7pa、至少约0.8pa、至少约0.9pa、至少约1.0pa、至少约1.1pa、至少约1.2pa、至少约1.3pa、至少约1.4pa、至少约1.5pa、至少约1.6pa、至少约1.7pa、至少约1.8pa、至少约1.9pa、至少约2.0pa、至少约2.1pa、至少约2.2pa、至少约2.3pa、至少约2.4pa、至少约2.5pa、至少约2.6pa、至少约2.7pa、至少约2.8pa、至少约2.9pa、至少约3.0pa。本披露的药物组合物的物理稳定性可以通过其验收值(av)来确定。如果由等式2定义的验收值(av)对于左旋多巴不超过15且对于卡比多巴不超过15,则药物组合物是物理稳定的。等式2.等式2中每个变量的定义都于表10示出。在一些实施例中,药物组合物中左旋多巴活性剂的av为约15。在另一个实施例中,药物组合物中左旋多巴活性剂的av为小于约15,例如约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3、约2、或约1。在一些实施例中,在将药物组合物储存在箔袋中至少约8周、至少约10周、至少约15周、至少约26周、或至少约60周后测量左旋多巴活性剂的av。在一些实施例中,药物组合物中卡比多巴活性剂的av为约15。在另一个实施例中,药物组合物中左旋多巴活性剂的av为小于约15,例如约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3、约2、或约1。在一些实施例中,在将药物组合物储存在箔袋中至少约8周、至少约10周、至少约15周、至少约26周、或至少约60周后测量卡比多巴活性剂的av。在另一个实施例中,具有上述粒度分布的左旋多巴活性剂和卡比多巴活性剂可以成功地形成悬浮液并且即使当左旋多巴活性剂和卡比多巴活性剂以更高的浓度存在于组合物时,只要组合物的屈服值至少为1.1pa,在整个药物组合物的保质期内也保持悬浮液的物理稳定性。例如,即使当药物组合物包含约4重量/重量百分比的左旋多巴活性剂和1重量/重量百分比的卡比多巴活性剂(例如,卡比多巴一水合物)时也可以保持物理稳定性。在另一个实施例中,组合物的屈服值为至少约0.3pa。在另一个实施例中,包含约4重量/重量百分比的左旋多巴活性剂和1重量/重量百分比的卡比多巴活性剂的药物组合物的屈服值为至少约2.0pa。在另一个实施例中,屈服值为至少约3.0pa。在另一个实施例中,屈服值为至少约4.0pa。在另一个实施例中,屈服值为至少约5.0pa。在另一个实施例中,屈服值为至少约6.0pa。在另一个实施例中,屈服值为至少约7.0pa。在另一个实施例中,屈服值为至少约8.0pa。在另一个实施例中,屈服值为至少约9.0pa。在另一个实施例中,屈服值为10.0pa或为至少约10.0pa。在另一个实施例中,提供了通过本文描述的方法制备的如本文描述的药物组合物。具体而言,能以适当的量提供左旋多巴活性剂和卡比多巴活性剂,这样使得左旋多巴活性剂和卡比多巴活性剂以治疗有效量存在于药物组合物中。提供的左旋多巴活性剂和卡比多巴活性剂具有以上描述的粒度分布。将左旋多巴活性剂和卡比多巴活性剂添加到水中以产生浆液。可将浆液添加至可能含有如本文描述的一种或多种悬浮剂(例如971p或974p)、中和剂、和水的混合物中悬浮液可以经受n2吹扫以降低氧气水平。可以将悬浮液加载到如本文描述的透氧性较低或不透氧的容器中。任选地,也可以向悬浮液中添加除氧剂。iv.治疗方法本披露进一步提供了治疗帕金森氏病和相关病症的方法,该方法包括向患者给予治疗有效量的包含高浓度的左旋多巴活性剂和卡比多巴活性剂的药物组合物。包含高浓度的左旋多巴活性剂和卡比多巴活性剂的药物组合物可以包含例如每5.0ml体积含有约200mg左旋多巴和约50mg卡比多巴一水合物的液体或粘性液体。在一个实施例中,本披露提供了治疗需要治疗的病症的方法,其中该方法包括向患者给予治疗有效量的本披露的药物组合物。在一个实施例中,通过给予该药物组合物治疗的病症是帕金森氏病。在另一个实施例中,通过给予该药物组合物治疗的病症是在帕金森氏病患者的运动性能受损(即,一种改进帕金森氏病患者的运动性能的方法)。在另一个实施例中,给予该药物组合物以治疗帕金森氏病患者的运动波动。在另一个实施例中,给予该药物组合物以治疗帕金森氏病患者的运动障碍。在另一个实施例中,本发明的药物组合物经由肠道给药给予。它们可以通过经皮内镜胃造口术插入的永久性管(例如具有外部经腹管和内部肠管)直接给予(或“输注”)到肠内,例如小肠(例如,十二指肠或空肠)内。在一个方面,第一化合物和第二化合物经由通过放射性胃空肠吻合术插入的管给予。在另一个方面,本发明的药物组合物经由插入患者中的临时经鼻十二指肠管给予,例如在插入永久性管之前首先确定患者是否对治疗方法有有利的反应。在一种或多种本发明的药物组合物经由肠道给药给予的实施例中,可以使用便携式泵(例如以商品名称cadd-legacy泵出售的泵)来进行给药。具体而言,可以将包含第一化合物和第二化合物的盒、小袋、小瓶或药筒附接至泵以产生递送系统。然后将递送系统连接到用于肠道给药的经鼻十二指肠管、经腹端口、十二指肠管或空肠管。在一个实施例中,该方法包括经至少约12小时的时段基本连续地向患者给予一种或多种本发明的药物组合物。在另外的方面,本发明的药物组合物可以经约16小时、约24小时、约36小时、约48小时、约3天、约4天、约5天、约6天、约一周或更长的时段基本上连续地给予。在一个实施例中,调整向患者给予的本发明的药物组合物的剂量以优化由患者实现的临床反应,这意味着例如通过最小化失能时间(off-time)发作(即,运动迟缓)的次数和持续时间和最小化伴随失能性运动障碍的非失能时间(on-time)来最大化白天的功能性非失能时间。在一个实施例中,根据本披露的方法向患者给予的左旋多巴活性剂的日剂量可以是例如每天约20至约5000mg、约20mg至约4000mg、约20mg至约3000mg、约20mg至约2000mg、或约20mg至约1000mg。在各种方面,例如,患者可以接受每天约:20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800、810、820、830、840、850、860、870、880、890、900、910、920、930、940、950、960、970、980、990、1000、1010、1020、1030、1040、1050、1060、1070、1080、1090、1100、1110、1120、1130、1140、1150、1160、1170、1180、1190、1200、1210、1220、1230、1240、1250、1260、1270、1280、1290、1300、1310、1320、1330、1340、1350、1360、1370、1380、1390、1400、1410、1420、1430、1440、1450、1460、1470、1480、1490、1500、1510、1520、1530、1540、1550、1560、1570、1580、1590、1600、1610、1620、1630、1640、1650、1660、1670、1680、1690、1700、1710、1720、1730、1740、1750、1760、1770、1780、1790、1800、1810、1820、1830、1840、1850、1860、1870、1880、1890、1900、1910、1920、1930、1940、1950、1960、1970、1980、1990、2000、2010、2020、2030、2040、2050、2060、2070、2080、2090、2100、2110、2120、2130、2140、2150、2160、2170、2180、2190、2200、2210、2220、2230、2240、2250、2260、2270、2280、2290、2300、2310、2320、2330、2340、2350、2360、2370、2380、2390、2400、2410、2420、2430、2440、2450、2460、2470、2480、2490、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、或5000mg的左旋多巴活性剂。在一个实施例中,根据本披露的方法向患者给予的卡比多巴活性剂的日剂量可以是例如每天0mg至约625mg、0mg至约500mg、0mg至约375mg、0mg至约250mg、或0mg至约125mg。在各种方面,例如,患者可以接受每天约:20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800、810、820、830、840、850、860、870、880、890、900、910、920、930、940、950、960、970、980、990、1000、1010、1020、1030、1040、1050、1060、1070、1080、1090、1100、1110、1120、1130、1140、1150、1160、1170、1180、1190、1200、1210、1220、1230、1240、或1250mg的卡比多巴活性剂。在一些实施例中,给予一定量的左旋多巴活性剂和卡比多巴活性剂,这样使得在组合中它们足以在患者体内达到至少约100ng/ml的左旋多巴血浆水平。在一个方面,左旋多巴血浆水平为至少约200ng/ml。在另一个方面,左旋多巴血浆水平为至少约200ng/ml。在另一个方面,左旋多巴血浆水平为至少约300ng/ml。在另一个方面,左旋多巴血浆水平为至少约400ng/ml。在另一个方面,左旋多巴血浆水平为至少约500ng/ml。在另一个方面,左旋多巴血浆水平为至少约600ng/ml。在另一个方面,左旋多巴血浆水平为至少约700ng/ml。在另一个方面,左旋多巴血浆水平为至少约800ng/ml。在另一个方面,左旋多巴血浆水平为至少约900ng/ml。在另一个方面,左旋多巴血浆水平为至少约1,000ng/ml。在另一个方面,左旋多巴血浆水平为至少约1,500ng/ml。在另一个方面,左旋多巴血浆水平为至少约2,000ng/ml。在另一个方面,左旋多巴血浆水平为至少约3,000ng/ml。在另一个方面,左旋多巴血浆水平为至少约4,000ng/ml。在另一个方面,左旋多巴血浆水平为至少约5,000ng/ml。在一些实施例中,给予一定量的左旋多巴活性剂和卡比多巴活性剂,这样使得在组合中它们足以达到从约10ng/ml至约8,000ng/ml的左旋多巴血浆水平。在一个方面,左旋多巴血浆水平为从约25ng/ml至约6,000ng/ml。在另一个方面,左旋多巴血浆水平为从约50ng/ml至约4,000ng/ml。在另一个方面,左旋多巴血浆水平为从约100ng/ml至约2,000ng/ml。在另一个方面,左旋多巴血浆水平为从约25ng/ml至约1,200ng/ml。在另一个方面,左旋多巴血浆水平为从约10ng/ml至约500ng/ml。在另一个方面,左旋多巴血浆水平为从约25ng/ml至约500ng/ml。在一些实施例中,维持上述左旋多巴浓度范围持续至少约:1小时间隔、2小时间隔、3小时间隔、4小时间隔、5小时间隔、6小时间隔、7小时间隔、8小时间隔、9小时间隔、10小时间隔、11小时间隔、12小时间隔、18小时间隔或24小时间隔。在一些实施例中,给予一定量的左旋多巴活性剂和卡比多巴活性剂,这样使得在组合中它们足以维持小于约500ng/ml的卡比多巴血浆水平。在一个方面,卡比多巴血浆水平小于约250ng/ml。在另一个方面,卡比多巴血浆水平小于约100ng/ml。在另一个方面,卡比多巴血浆水平小于约50ng/ml。在另一个方面,卡比多巴血浆水平小于约25ng/ml。在一些实施例中,给予一定量的左旋多巴活性剂和卡比多巴活性剂,这样使得在组合中它们足以维持从约1至约10ng/ml的卡比多巴血浆水平。在一个方面,卡比多巴血浆水平为从约1至约25ng/ml。在另一个方面,卡比多巴血浆水平为从约1至约50ng/ml。在另一个方面,卡比多巴血浆水平为从约1至约100ng/ml。在另一个方面,卡比多巴血浆水平为从约1至约250ng/ml。在另一个方面,卡比多巴血浆水平为从约5至约250ng/ml。在另一个方面,卡比多巴血浆水平为从约5至约100ng/ml。在另一个方面,卡比多巴血浆水平为从约10至约250ng/ml。在另一个方面,卡比多巴血浆水平为从约10至约100ng/ml。在另一个方面,卡比多巴血浆水平为从约25至约250ng/ml。在另一个方面,卡比多巴血浆水平为从约25至约100ng/ml。在一些实施例中,维持上述卡比多巴浓度范围持续至少约:1小时间隔、2小时间隔、3小时间隔、4小时间隔、5小时间隔、6小时间隔、7小时间隔、8小时间隔、9小时间隔、10小时间隔、11小时间隔、12小时间隔、18小时间隔或24小时间隔。在另外的实施例中,所给予的左旋多巴活性剂和卡比多巴活性剂可以具有如上描述的粒度分布。在各种实施例中,药物组合物可以如上描述存在于容器中,并且在给药至患者之前,凝胶悬浮液可以经受或不经受n2吹扫。当凝胶悬浮液经受n2吹扫并且容器具有低透氧性时,药物组合物在冷藏储存下不会经历以快于每周0.04w/w%的速度降解成dhpa。(该百分比为相对于卡比多巴的标称量。)另外地或可替代地,当容器经受n2吹扫时,药物组合物在冷藏储存条件下不会经历以快于每周0.04w/w%的速度降解成dhppa。(该百分比为相对于卡比多巴的标称量。)另外地或可替代地,当容器经受n2吹扫时,药物组合物在冷藏储存条件下不会以快于每周0.6μg/g的速度降解产生肼,其中μg/g表示每克凝胶悬浮液中肼的μg数。v.另外的治疗剂的共给药本披露的治疗方法任选地可以进一步包括除了给予左旋多巴活性剂和卡比多巴活性剂以外给予一种或多种用于治疗帕金森氏病的治疗剂。在一个实施例中,一种或多种另外的治疗剂选自下组,该组由以下组成:除了卡比多巴活性剂以外的脱羧酶抑制剂(例如,苄丝肼)、儿茶酚-o-甲基转移酶(“comt”)抑制剂(例如,恩他卡朋和托卡朋)、以及单胺氧化酶a(“mao-a”)或单胺氧化酶b(“mao-b”)抑制剂(例如吗氯贝胺、雷沙吉兰、司来吉兰和沙芬酰胺)。在一个方面,一种或多种另外的治疗剂选自下组,该组由以下组成:除卡比多巴活性剂以外的脱羧酶抑制剂。在另一个方面,一种或多种另外的治疗剂选自下组,该组由comt抑制剂组成。在另一个方面,一种或多种另外的治疗剂选自下组,该组由mao-a抑制剂组成。在另一个方面,一种或多种另外的治疗剂选自下组,该组由mao-b抑制剂组成。以类似的方式,本披露的药物组合物任选地可以进一步包含一种或多种用于治疗如上描述的帕金森氏病的另外的治疗剂。vi.药剂盒本披露还提供了包含一种或多种含有卡比多巴活性剂的药物剂型的药剂盒;包含一种或多种含有左旋多巴活性剂的药物剂型的药剂盒;以及包含一种或多种含有左旋多巴活性剂和卡比多巴活性剂两者的药物剂型的药剂盒。在药剂盒中,药物剂型可以单独或一起存在于较低o2渗透性袋中。药物剂型可以包含高浓度的左旋多巴活性剂和卡比多巴活性剂,例如处于总组合物的约4.0重量/重量百分比的量的左旋多巴活性剂;以及处于总组合物的约1.0重量/重量百分比的量的卡比多巴一水合物活性剂。药剂盒可以任选地包含一种或多种另外的治疗剂和/或说明书,例如使用药剂盒治疗患有帕金森氏病或相关病症的患者的说明书。vii.实例提供以下非限制性实例以进一步说明本披露。下面实例中使用的缩写包括以下:“cmax”意指最大观察血浆浓度。“tmax”意指最大观察血浆浓度的时间。“auc”意指血浆浓度-时间曲线下面积。“t1/2”意指生物半衰期:即通过正常生物学过程代谢或消除给予至活的生物体的药物或其他物质的一半量所需要的时间。viii.特定实施例本披露提供了作为特定实施例的实施例i-xx1。实施例i.用于十二指肠内给药的包含左旋多巴活性剂和卡比多巴活性剂的药物组合物,其中所述左旋多巴活性剂和卡比多巴活性剂悬浮在一种或多种基于聚合物的悬浮剂中,并且其中所述药物组合物具有至少约1.1pa的屈服值。实施例ii.根据实施例i所述的药物组合物,其中所述药物组合物包含:处于总组合物的约4.0重量/重量百分比的量的左旋多巴活性剂;处于总组合物的约1.0重量/重量百分比的量的卡比多巴一水合物活性剂;和液体运载体。实施例iii.根据实施例i或ii所述的药物组合物,其中基于聚合物的悬浮剂是基于丙烯酸的聚合物。实施例iv.根据实施例i或ii所述的药物组合物,其中基于聚合物的悬浮剂是水胶体聚合物。实施例v.根据实施例iii所述的药物组合物,其中基于聚合物的悬浮剂是卡波姆。实施例vi.根据实施例iii所述的药物组合物,其中基于聚合物的悬浮剂是以商品名971p或974p出售的羧基聚亚甲基和卡波姆聚合物。实施例vii.根据实施例iv所述的药物组合物,其中基于聚合物的悬浮剂选自下组,该组由以下组成:槐树豆胶、瓜耳胶、甲基纤维素、羧甲基纤维素钠和微晶纤维素、和黄蓍胶。实施例viii.根据实施例i-vii中所述的药物组合物,其中所述液体运载体的浓度处于总组合物的从约0百分比至约95重量/重量百分比的量。实施例ix.根据实施例viii所述的药物组合物,其中所述液体运载体选自下组,该组由以下组成:水或聚乙二醇。实施例x.根据实施例viii所述的药物组合物,其中所述液体运载体仅为水。实施例xi.根据实施例i-x中任一项所述的药物组合物,其中当维持在约20℃-25℃的温度至少15周的时间段时,该药物组合物中的杂质的量小于组合物的总重量的5.8w/w%。实施例xii.根据实施例i-xi中任一项所述的药物组合物,其中所述药物组合物存在于作为隔氧层的初级或二级容器中。实施例xiii.一种药物剂型,其包含在一次性药物贮库中的如实施例i-xii中任一项所述的药物组合物,所述一次性药物贮库具有配置于其中的不透氧外壳,其中用惰性气体吹扫所述不透氧外壳并且添加除氧剂。实施例xiv.根据实施例xiii所述的药物剂型,其中所述药物剂型适合于在能够以治疗有效的方式递送所述组合物的连续输注泵中使用。实施例xi.一种制备用于十二指肠内给药的药物组合物的方法,所述药物组合物包含左旋多巴活性剂和卡比多巴活性剂,其中所述方法包括:向水中添加一种或多种悬浮剂以分散聚合物;添加中和剂以使ph为约6.5,从而制成介质;向水中添加左旋多巴活性剂和卡比多巴活性剂以形成浆液;将所述浆液添加至所述介质中以形成悬浮液;以及任选地使所述悬浮液经受n2吹扫。实施例xvi.根据实施例xv所述的方法,其进一步包括将所述悬浮液加载到透氧性较低的容器中。实施例xvii.根据实施例xv所述的方法,其中悬浮剂是丙烯酸基聚合物。实施例xviii.根据实施例xv所述的方法,其中基于聚合物的悬浮剂是971p或974p。实施例xx.根据实施例xv所述的方法,其中所述中和剂是氢氧化钠。实施例xxi.一种治疗有需要的患者的帕金森氏病的方法,其中所述方法包括向该患者给予用于十二指肠内给药的包含左旋多巴活性剂和卡比多巴活性剂的药物组合物,其中所述左旋多巴活性剂和卡比多巴活性剂以治疗有效的方式提供给患者并悬浮在一种或多种基于聚合物的悬浮剂中,并且其中所述药物组合物具有至少约1.1pa的屈服值。本披露还提供了作为特定实施例的实施例1-50。实施例1.一种用于十二指肠内给药的药物组合物,其包含:(a)处于总组合物的约4.0w/w%的量的左旋多巴活性剂;(b)处于总组合物的约1.0w/w%的量的卡比多巴活性剂;(c)处于所述总组合物的约0.1w/w%至约5w/w%的量的基于聚合物的悬浮剂;以及(d)液体运载体,其中:(i)所述液体运载体是水、聚乙二醇、或水和聚乙二醇的混合物;(ii)所述药物组合物的验收值是相对于所述左旋多巴活性剂小于或等于15,和相对于所述卡比多巴活性剂小于或等于15;以及(iii)所述药物组合物的屈服值为至少约0.3pa,其中:在将所述药物组合物暴露于约25℃的温度和约60%的相对湿度至少约8周的时间段后测量所述验收值和屈服值。根据实施例1,“基于聚合物的悬浮剂”可以表示一种或多种基于聚合物的悬浮剂。当两种基于聚合物的悬浮剂包括在所述药物组合物中时,两者都可以是基于丙烯酸的聚合物,例如971p和974p,两者都可以是水胶体聚合物,例如cl-611和rc591,或其中一种可以是基于丙烯酸的聚合物并且另一种可以是水胶体聚合物,例如971p和cl-61。实施例2.根据实施例1所述的药物组合物,其中在将所述药物组合物暴露于约25℃的温度和约60%的相对湿度至少约15周的时间段后测量验收值和屈服值。实施例3.根据实施例1所述的药物组合物,其中在将所述药物组合物暴露于约25℃的温度和约60%的相对湿度至少约26周的时间段后测量验收值和屈服值。实施例4.根据实施例1所述的药物组合物,其中在将所述药物组合物暴露于约25℃的温度和约60%的相对湿度至少约60周的时间段后测量验收值和屈服值。实施例5.根据实施例1-4中任一项所述的药物组合物,其中所述基于聚合物的悬浮剂是丙烯酸基聚合物。实施例6.根据实施例1-5中任一项所述的药物组合物,其中所述基于聚合物的悬浮剂是卡波姆,例如934p、971p、或974p。实施例7.根据实施例1-6中任一项所述的药物组合物,其中所述基于聚合物的悬浮剂是971p或974p,或其组合。实施例8.根据实施例1-7中任一项所述的药物组合物,其中所述组合物包含基于聚合物的悬浮剂,所述悬浮剂的量为总组合物的约0.1w/w%至约0.3w/w%,例如总组合物的约0.11w/w%、约0.12w/w%、约0.13w/w%、约0.13w/w%、约0.14w/w%、约0.15w/w%、约0.16w/w%、约0.17w/w%、约0.18w/w%、约0.19w/w%、约0.20w/w%、约0.21w/w%、约0.22w/w%、约0.23w/w%、约0.24w/w%、约0.25w/w%、约0.26w/w%、约0.27w/w%、约0.28w/w%、或约0.29w/w%。实施例9.根据实施例1-4中任一项所述的药物组合物,其中所述基于聚合物的悬浮剂是水胶体聚合物。实施例10.根据实施例1或9所述的药物组合物,其中所述基于聚合物的悬浮剂选自下组,该组由以下组成:槐树豆胶、瓜耳胶、甲基纤维素、羧甲基纤维素钠和微晶纤维素、黄原胶、和黄蓍胶,或其组合。实施例11.根据实施例1、9或10中任一项所述的药物组合物,其中所述基于聚合物的悬浮剂选自下组,该组由以下组成:槐树豆胶、瓜耳胶、黄原胶、和黄蓍胶,或其组合。实施例12.根据实施例1、9或10中任一项所述的药物组合物,其中所述基于聚合物的悬浮剂选自下组,该组由以下组成:甲基纤维素、以及羧甲基纤维素钠和微晶纤维素,或其组合。实施例13.根据实施例1、9或10中任一项所述的药物组合物,其中所述基于聚合物的悬浮剂是羧甲基纤维素钠和微晶纤维素,例如cl-611或rc591。实施例14.根据实施例1或9-13中任一项所述的药物组合物,其中所述组合物包含所述基于聚合物的悬浮剂,其量为总组合物的约1w/w%至约5w/w%。实施例15.根据实施例1-14中任一项所述的药物组合物,其中所述液体运载体是水和聚乙二醇的混合物。实施例16.根据实施例1-14中任一项所述的药物组合物,其中所述液体运载体是水。实施例17.根据实施例1-5中任一项所述的药物组合物,其包含:(a)处于总组合物的约4.0w/w%的量的左旋多巴;(b)处于总组合物的约1.0w/w%的量的卡比多巴一水合物;(c)处于总组合物的约0.1w/w%至约0.2w/w%的量的971p或974p;以及(d)水。实施例18.根据实施例17所述的药物组合物,其基本上由以下组成:(a)处于总组合物的约4.0w/w%的量的左旋多巴;(b)处于总组合物的约1.0w/w%的量的卡比多巴一水合物;(c)处于总组合物的约0.1w/w%至约0.2w/w%的量的971p或974p;(d)中和剂;以及(e)水。实施例19.根据实施例18所述的药物组合物,其由以下组成:(a)处于总组合物的约4.0w/w%的量的左旋多巴;(b)处于总组合物的约1.0w/w%的量的卡比多巴一水合物;(c)处于总组合物的约0.1w/w%至约0.2w/w%的量的971p或974p;(d)处于约0.01w/w%至约0.3w/w%的量的氢氧化钠;以及(e)水。实施例20.根据实施例1-19中任一项所述的药物组合物,其中所述药物组合物具有至少约0.34pa的屈服值。实施例21.根据实施例20所述的药物组合物,其中所述药物组合物具有至少约0.6pa的屈服值。实施例22.根据实施例21所述的药物组合物,其中所述药物组合物具有至少约0.9pa的屈服值。实施例23.根据实施例22所述的药物组合物,其中所述药物组合物具有至少约1.1pa的屈服值。实施例24.根据实施例1-18或20-23中任一项所述的药物组合物,其进一步包含中和剂,其量为总组合物的约0.01w/w%至约0.5w/w%。实施例25.根据实施例24所述的药物组合物,其中所述中和剂是氢氧化钠。实施例26.根据实施例1-25中任一项所述的药物组合物,其中所述左旋多巴活性剂具有≤100μm的中值粒度分布(d50)。实施例27.根据实施例26所述的药物组合物,其中所述左旋多巴活性剂具有≤37μm的中值粒度分布(d50)。实施例28.根据实施例27所述的药物组合物,其中所述左旋多巴活性剂具有≤5μm的中值粒度分布(d50)。实施例29.根据实施例1-28中任一项所述的药物组合物,其中所述卡比多巴活性剂具有≤20μm的中值粒度分布(d50)。实施例30.根据实施例29所述的药物组合物,其中所述卡比多巴活性剂具有约≤10μm的中值粒度分布(d50)。实施例31.根据实施例30所述的药物组合物,其中所述卡比多巴活性剂具有≤3μm的中值粒度分布(d50)。实施例32.根据实施例1-31中任一项所述的药物组合物,其中当维持在约20℃-25℃的温度和约60%的相对湿度至少8周的时间段时,所述药物组合物中的杂质的量小于组合物的总重量的约5.8w/w%,例如小于约5w/w%、小于约4w/w%、小于约3w/w%、小于约2w/w%、或小于约1w/w%。实施例33.根据实施例1-31中任一项所述的药物组合物,其中当维持在约20℃-25℃的温度和约60%的相对湿度至少15周的时间段时,所述药物组合物中的杂质的量小于组合物的总重量的约5.8w/w%,例如小于约5w/w%、小于约4w/w%、小于约3w/w%、小于约2w/w%、或小于约1w/w%。实施例34.根据实施例1-31中任一项所述的药物组合物,其中当维持在约20℃-25℃的温度和约60%的相对湿度至少26周的时间段时,所述药物组合物中的杂质的量小于组合物的总重量的约5.8w/w%,例如小于约5w/w%、小于约4w/w%、小于约3w/w%、小于约2w/w%、或小于约1w/w%。实施例35.根据实施例1-31中任一项所述的药物组合物,其中当维持在约20℃-25℃的温度和约60%的相对湿度至少60周的时间段时,所述药物组合物中的杂质的量小于组合物的总重量的约5.8w/w%,例如小于约5w/w%、小于约4w/w%、小于约3w/w%、小于约2w/w%、或小于约1w/w%。实施例36.根据实施例1-35中任一项所述的药物组合物,其中所述药物组合物存在于作为隔氧层的初级或二级容器,例如箔袋中。实施例37.一种药物剂型,其包含在具有配置于其中的不透氧外壳的一次性药物贮库中的根据实施例1-35中任一项所述的药物组合物,其中用惰性气体吹扫所述不透氧外壳并且添加除氧剂。实施例38.根据实施例37所述的药物剂型,其中所述药物剂型适合于在能够以治疗有效的方式递送所述组合物的连续输注泵中使用。实施例39.一种制备用于十二指肠内给药的药物组合物的方法,所述药物组合物包含左旋多巴活性剂和卡比多巴活性剂,其中(i)所述药物组合物具有相对于所述左旋多巴活性剂小于或等于15和相对于所述卡比多巴活性剂小于或等于15的药物组合物验收值;以及(ii)所述药物组合物具有至少约0.3pa的屈服值,其中:在将所述药物组合物暴露于约25℃的温度和约60%的相对湿度至少约8周的时间段后测量所述验收值和屈服值,所述方法包括:将丙烯酸基聚合物悬浮剂添加至水中以形成分散体;将中和剂添加至所述分散体以使ph为约6.5,从而制成介质;向水中添加左旋多巴活性剂和卡比多巴活性剂以形成浆液;以及将所述浆液添加至所述介质中以形成所述药物组合物。实施例40.根据实施例39所述的方法,其中所述丙烯酸基聚合物悬浮剂是卡波姆。实施例41.根据实施例39所述的药物组合物,其中所述丙烯酸基聚合物悬浮剂是971p或974p。实施例42.根据实施例38-40中任一项所述的方法,其中所述中和剂是氢氧化钠。实施例43.一种制备用于十二指肠内给药的药物组合物的方法,所述药物组合物包含左旋多巴活性剂和卡比多巴活性剂,其中(i)所述药物组合物具有相对于所述左旋多巴活性剂小于或等于15和相对于所述卡比多巴活性剂小于或等于15的药物组合物验收值;以及(ii)所述药物组合物具有至少约0.3pa的屈服值,其中:在将所述药物组合物暴露于约25℃的温度和约60%的相对湿度至少约8周的时间段后测量所述验收值和屈服值,所述方法包括:将水胶体聚合物悬浮剂添加至水中以形成分散体;向水中添加左旋多巴活性剂和卡比多巴活性剂以形成浆液;以及将所述浆液添加至所述介质中以形成所述药物组合物。实施例44.根据实施例43所述的药物组合物,其中所述基于聚合物的悬浮剂选自下组,该组由以下组成:槐树豆胶、瓜耳胶、羧甲基纤维素钠和微晶纤维素、黄原胶、和黄蓍胶。实施例45.根据实施例39-44中任一项所述的方法,其进一步包括使所述药物组合物经受n2吹扫。实施例46.根据实施例39-45中任一项所述的方法,其进一步包括将所述药物组合物加载到透氧性较低的容器中。实施例47.一种治疗有需要的患者的帕金森氏病的方法,所述方法包括向该患者给予治疗有效量的根据实施例1-36中任一项所述的药物组合物。实施例48.根据实施例1-36中任一项所述的药物组合物,其中所述左旋多巴活性剂的验收值为小于或等于15,例如约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3、约2、或约1。实施例49.根据实施例1-36或48中任一项所述的药物组合物,其中所述卡比多巴活性剂的验收值为小于或等于15,例如约14、约13、约12、约11、约10、约9、约8、约7、约6、约5、约4、约3、约2、或约1。实施例50.根据实施例37或38所述的药物剂型,其包含约40mg/ml的所述左旋多巴活性剂和约10mg/ml的所述卡比多巴活性剂。实例1:药物组合物的制备如图1所示和如下描述的用974p制备左旋多巴活性剂/卡比多巴活性剂药物组合物:1.1浆液制备将左旋多巴和卡比多巴添加至容器里的水中,并使用高剪切混合器混合。可替代地,可以用低剪切混合器代替顶部叶轮。使用所述浆液来使api(药物活性物)润湿和结块。1.2凝胶-悬浮液制备将974p添加至第二容器里的水中,并使用低剪切混合器在真空下混合。将氢氧化钠添加至混合物中以中和聚合物。将浆液添加至混合物中并使用低剪切混合器进一步混合以完成凝胶-悬浮液制备。1.3填充和装袋将凝胶悬浮液填充至一次性药物贮库(ddr)中。通过天平以常规间隔检查填充重量。填充的ddr用箔袋覆盖。将袋用氮气吹扫并热密封。1.4包装将箔袋包装进容纳7个ddr的药剂盒中。然后将药剂盒在各种条件下(在5℃、25℃和约60%相对湿度(rh)、以及在40℃和75%rh下)储存。表1:药物组合物的配方表2:药物产品和api属性药物产品和api属性值在25℃的屈服值(pa)≥4左旋多巴粒度(μm)≤22卡比多巴一水合物粒度(μm)≤21氧气浓度≤环境ph3-8实例2:高浓度药物组合物稳定性2.1-配制品制备在中试设备上制造基于974p的配制品。整个制造过程与实例1中相同。将批次填充到ddr(一次性药物贮库)中然后将ddr样品包装在经氮气吹扫的箔袋中以防止任何氧气从环境中进入。在25℃的15周稳定性研究中,样品保持其化学和物理稳定性。用其他左旋多巴卡比多巴肠凝胶(例如市场上的duodopa)不能达到这个结果。表3:基于的配制品的药物产品和api材料属性药物产品和api属性值*在25℃的屈服值6.9pa左旋多巴粒度≤22μm卡比多巴一水合物粒度≤21μm氧气浓度环境ph6.5批次大小9kg*过程中测量的值2.2-化学稳定性数据2.1中描述的配制品在制造后立即置于5℃,并且在制造几周后将其置于25℃以启动稳定性测试。然后,将其在5℃解冻,之后将其置于25℃以启动稳定性测试。在将配制品置于25℃(定义为启动时间点)和15周之前评估化学稳定性。进行以下测试以评估化学稳定性:左旋多巴和卡比多巴的浓度(作为来自靶标(测定)的百分比)和关键杂质(dhpa和dhppa)。表4.在25℃经15周的稳定性测定和配制品的杂质2.3-关于稳定性,样品的物理稳定性使用含量分配均匀性(udc)方法来评估配制品的物理稳定性。udc方法获得在给药时凝胶中的api浓度。这模拟通过泵递送的每5g凝胶,患者将接受到的物质,并且确保患者在一个ddr的消耗期间将接受一致的药物量。在整个15周的稳定性研究中在每个时间点进行测试。用于研究的api的粒度分布在本文提及的粒度范围内。结果总结在下表5(左旋多巴)和表6(卡比多巴)中。表5:关于稳定性,左旋多巴样品的含量分配均匀性表6:关于稳定性,卡比多巴样品的含量分配均匀性实例3-药物组合物在小型猪中的治疗效果将使用羧甲基纤维素钠的高浓度(hc)左旋多巴/卡比多巴肠凝胶与低浓度(lc)左旋多巴/卡比多巴肠凝胶羧甲基纤维素钠、和使用974p的高浓度左旋多巴/卡比多巴肠凝胶进行比较,并且按以下方式进行测试:在交叉研究设计中,向4只小型猪一组的每一只小型猪给予lc左旋多巴/卡比多巴肠凝胶、hc左旋多巴/卡比多巴肠凝胶、或在974p载体中的左旋多巴/卡比多巴。四只小型猪中的每一只在一周的第一天给予一种配制品,随后在给予第二种配制品之前有一周的清除期。在另一周清除期后,将第三种配制品给予相同的小型猪。总剂量:11.07mg/kg左旋多巴剂量、经6.5小时;20mg/ml组别:lc;hc;974p推注剂量:2.53mg/kg、经30分钟推注剂量输注剂量:8.54mg/kg、经6小时。推注输注速率:lc=0.253ml/kg/hr(例如:10kg猪=2.53ml/hr泵速)hc=0.127ml/kg/hr(例如:10kg猪=1.27ml/hr泵速)974p=0.127ml/kg/hr(例如:10kg猪=1.27ml/hr泵速)6小时输注速率:lc=0.071ml/kg/hr(例如:10kg猪=0.71ml/hr泵速)hc=0.0355ml/kg/hr(例如:10kg猪=0.355ml/hr泵速)974p=0.0355ml/kg/hr(例如:10kg猪=0.355ml/hr泵速)。血浆取样时间点:0.5、1、1.5、2、4、6、8、9、10、12小时研究结果证实,如图2和3示出的,与在半小时推注和6小时输注条件下给予lc配制品相比,高浓度左旋多巴/卡比多巴肠凝胶展示出可比较的cmax、tmax和auc值。11.07mg/kg的左旋多巴盒以及2.77mg/kg的卡比多巴一水合物盒以80μl/kg(lc凝胶)或40μl/kg(hc凝胶和974p对照)给药。左旋多巴的生物利用度总结在下表7和8中。示于表7和8中的半衰期计算为调和平均值。表7.左旋多巴血浆浓度卡比多巴的生物利用度进一步总结在以下中。表8.卡比多帕血浆浓度使用羧甲基纤维素钠(nacmc)的lc和hc左旋多巴/卡比多巴肠凝胶以商业规模制造。首先将nacmc添加至水中,并使用均化器在高剪切下混合以制备含水凝胶。然后用氮气吹扫这一凝胶以除去大部分溶解氧。将左旋多巴和卡比多巴一水合物添加至在单独容器里的水中,并使用均化器在高剪切下混合(这个步骤可以使用低剪切进行)以制备浆液。然后将浆液添加至凝胶中并使用均化器在高剪切下混合(对于hc配制品,浆液步骤重复两次)。然后将整个组合物脱气并填充至盒中。然后将hc配制品包装在7的药剂盒中并立即置于-20℃。将lc配制品包装在箔袋中,所述箔袋填充有除氧剂并在密封之前用氮气吹扫。使用类似于实例1中解释的方法,在实验室规模下使用974p制备hc左旋多巴/卡比多巴肠凝胶。实例4:在12周、室温,使用971p的物理稳定性的最小屈服值类似于实例1,使用3种不同浓度的971p:0.1w/w%、0.2w/w%、和0.5w/w%制备左旋多巴-卡比多巴肠凝胶40-10mg/ml(lcig40/10)的三种配制品。将它们用naoh中和,使最终ph为约6.5。最初使用0.2w/w%卡波姆配制品确定达到约6.5的ph所需的与naoh的比率。0.1w/w%、0.2w/w%、和0.5w/w%配制品的屈服值分别为0.2pa、1.1pa和4.5pa。将配制品在室温(约20℃)置于高小瓶中,并用纸板覆盖以防止光降解。所有3种配制品在启动时间点均匀地为白色。8周后,0.1w/w%配制品开始沉降并形成透明的层。12周后,0.5w/w%和0.2w/w%配制品仍在视觉上可接受,如图5示出。基于这些结果,需要至少1.1pa的屈服值来抵抗沉降。数据总结于下表9中。表9.抵抗沉降需要的最小屈服值实例5:左旋多巴/卡比多巴组合物的物理稳定性如表11概述的制备药物组合物,所述药物组合物包含(a)左旋多巴,其量为总组合物的3.88w/w%;(b)卡比多巴一水合物,其量为总组合物的0.97w/w%;(c)指示量的基于聚合物的悬浮剂;(d)指示量的氢氧化钠,和(e)水。提供了在基于这些配制品的不同时间点-第1周、第8周、和第15周,就左旋多巴验收值、粘度、和屈服值而言的udc状态。还提供了左旋多巴粒度(api粒度)。组合物在箔袋中储存在约25℃的温度和约60%的相对湿度下。基于这些结果,需要至少0.3pa的屈服值来抵抗沉降。数据总结于表11中。在类似的研究中,制备包含(a)左旋多巴,其量为总组合物的3.77w/w%(粒度:d50=3μm、d90=7μm和d100=18μm);(b)卡比多巴一水合物,其量为总组合物的0.94w/w%(粒度:(d50=2μm、d90=6μm和d100=16μm);(c)974p,其量为总组合物的0.18w/w%;(d)氢氧化钠,其量为总组合物的0.306w/w%和(e)水的药物组合物,并将其在表12指示的条件下储存在箔袋中。提供了药物组合物的物理稳定性和化学稳定性。在表12中指示的条件下储存的、在约0.131/s下测量的低剪切(ls)粘度和在约271/s下测量的高剪切(hs)粘度分别示于图6和图7中。使用来自ta仪器的discoveryhr-2流变计测量表11中的屈服值和粘度以及表12的屈服值。流变计配备有同心圆柱。首先将样品在25℃浸泡600秒,或直至达到平衡。如果需要,将样品以2001/s预剪切120秒。通过首先将预剪切的样品浸泡360秒,然后经300秒将剪切速率从0.0011/s增加到2501/s来使流动渐增。如果需要,将样品以2501/s保持另外的300秒。最后,经300秒从2501/s至0.0011/s来使流动渐降。将由此产生的流动渐降与herschel-bulkley模型拟合以获得屈服值和粘度。为了确定验收值,将药物组合物从一次性药物贮库(ddr)中通过集成管以十个大约相等的部分取出。使用高压液相色谱法分析每个部分的药物浓度。参见usp,第905章和图8。实例6:使用包含大和小左旋多巴粒度的配制品进行的小型猪药代动力学(pk)研究通过外科手术修饰小型猪,以将j管置于空肠a。经由医用泵通过j管递送配制品b(左旋多巴大粒度)和配制品c(左旋多巴小粒度)。参见表13。使用交叉设计,每个臂中有四只小型猪。每个小型猪在恒定输注速率下在30分钟内给药0.6ml。在0、0.1、0.25、0.5、1处取出血液样品。通过lc-ms测量2、4、6、7小时和血浆左旋多巴浓度。pk数据示于表14和图9中。两种凝胶配制品之间的auc、tmax、cmax没有显著差异。表13表14当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1