用于治疗由特发性肺纤维化引起的慢性咳嗽的色甘酸组合物的制作方法
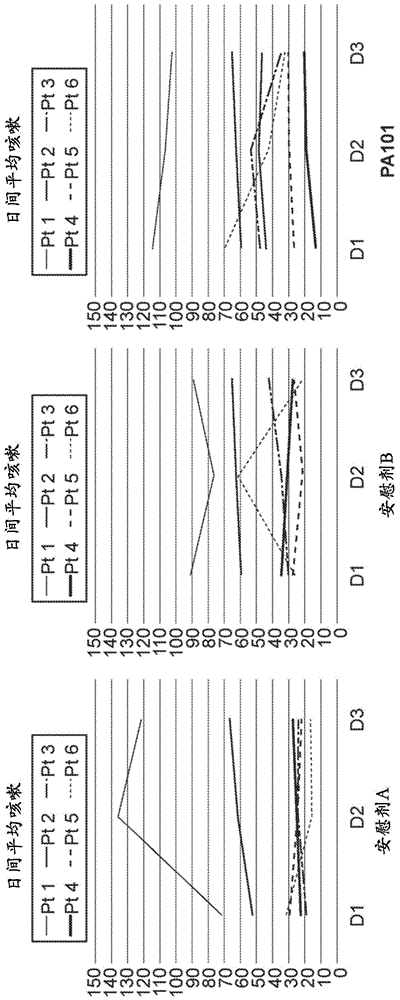
本申请要求2016年8月31日提交的美国临时申请号62/381,914和2016年11月4日提交的美国临时申请号62/417,898的优先权权益,这两个专利都通过引用以其全文结合在此。本披露涉及医学领域,并且特别是包含色甘酸的组合物用于治疗由特发性肺纤维化引起的慢性咳嗽的用途。
背景技术:
:本领域长期存在但一直未满足的对有效治疗由特发性肺纤维化(ipf)引起的慢性咳嗽的需求,因为大多数患有病症的个体对目前可用的治疗无应答。本披露提供了对这种长期存在但一直未满足的需求的解决方案。技术实现要素:本披露提供了用于治疗由ipf引起的慢性咳嗽的组合物和方法。与接受安慰剂的那些受试者相比,用本披露中提供的组合物和配制品治疗的受试者在治疗14天后在客观咳嗽率方面表现出统计学显著的和医学相关的改善。这些受试者具有与ipf相关的难治性慢性咳嗽,并且不能用目前可用的治疗(不包括本文披露的组合物或方法)得到缓解。具体地,本披露提供了治疗患有特发性肺纤维化(ipf)的受试者的慢性咳嗽的方法,该方法包括使用雾化器给予受试者包含从约1%(按重量计)至约10%(按重量计)的色甘酸钠和离子渗透剂的药物组合物。在某些实施例中,该药物组合物包含约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、或约10%(按重量计)的色甘酸钠。在某些实施例中,该药物组合物包含约2%(按重量计)的色甘酸钠。在某些实施例中,该药物组合物包含约4%(按重量计)的色甘酸钠。在某些实施例中,该药物组合物包含约6%(按重量计)的色甘酸钠。本披露提供了用于治疗患有特发性肺纤维化(ipf)的受试者的慢性咳嗽的药学上可接受的气溶胶,该气溶胶包含水溶液的液滴,所述水溶液包含(i)从约2%至约6%(按重量计)的色甘酸钠以及(ii)同渗容摩调节剂,其包含(a)在约0.1%与约0.5%(按重量计)之间(包括端值)的氯化钠,以及(b)任选地乙二胺四乙酸(edta)的盐,其中所述气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm),并且其中所述受试者的所述慢性咳嗽的所述治疗是通过所述受试者口服吸入所述药学上可接受的气溶胶经由递送治疗有效量的色甘酸钠至受试者的肺部来达到的。本披露提供了用于治疗患有特发性肺纤维化(ipf)的受试者的慢性咳嗽的药学上可接受的气溶胶,该气溶胶由以下水溶液的液滴组成,所述水溶液由以下组成:(i)从约2%至约6%(按重量计)的色甘酸钠以及(ii)同渗容摩调节剂,其由以下组成:(a)在约0.1%与约0.5%(按重量计)之间(包括端值)的氯化钠,以及(b)任选地乙二胺四乙酸(edta)的盐,其中所述气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm),并且其中所述受试者的所述慢性咳嗽的所述治疗是通过所述受试者口服吸入所述药学上可接受的气溶胶经由递送治疗有效量的色甘酸钠至受试者的肺部来达到的。本披露提供了一种药学上可接受的溶液,其包含按重量计从约1%至约10%的色甘酸钠和渗透剂,其中从该药学上可接受的溶液产生的气溶胶适于由患有由特发性肺纤维化引起的慢性咳嗽的受试者吸入。在某些实施例中,该气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm)。在某些实施例中,该气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm)和如通过usp<1601>测量的至少约75%的可吸入级分(≤5μm)。本披露提供一种用于治疗患有特发性肺纤维化(ipf)的受试者的慢性咳嗽的剂型,该剂型包含:(a)水性药物组合物,其包含(i)从约2%至约6%(按重量计)的色甘酸钠,以及(ii)同渗容摩调节剂,其由以下组成:(a)在约0.1%至约0.5%之间(包括端值)的氯化钠;和(b)任选地,edta的盐;以及(b)形成所述药物组合物的气溶胶的吸入装置,所述气溶胶显示出如通过usp<1601>测量的至少约60%的所述药物组合物的可吸入级分(≤5μm)。在某些实施例中,该药物组合物进一步包含纯化水和edta钠盐。在某些实施例中,该药物组合物包含从约5mg至约80mg的色甘酸钠。在某些实施例中,该药物组合物包含从约36mg至约44mg的色甘酸钠。在某些实施例中,该气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm)。在某些实施例中,该气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm)和如通过usp<1601>测量的至少约75%的可吸入级分(≤5μm)。在某些实施例中,其中该同渗容摩调节剂由在0.1%与0.2%之间(包括端值)的氯化钠组成。贯穿本披露的术语药物组合物、组合物、溶液和配制品可互换地使用。在本披露的组合物和配制品的某些实施例中,该离子渗透剂可包含离子渗透剂或由离子渗透剂组成。在本披露的组合物和配制品的某些实施例中,该离子渗透剂可包含氯化钠或由氯化钠组成。本披露组合物的离子渗透剂可构成该组合物按重量计的0.1%至0.7%,包括端值。在某些实施例中,本披露组合物的可包含该组合物按重量计的0.1%至0.2%的离子渗透剂,包括端值。在某些实施例中,本披露组合物可包含该组合物按重量计的0.2%的离子渗透剂。本披露的组合物和配制品可进一步包含螯合剂。在某些实施例中,该螯合剂可以占该组合物的约0.01%、或约0.02%、或约0.03%、或约0.04%、或约0.05%、或约0.06%、或约0.07%、或约0.08%、或约0.09%、或约0.1%、或约0.2%、或约0.3%、或约0.4%、或约0.5%、或约0.6%、或约0.7%、或约0.8%、或约0.9%、或约1%(按重量计)。在某些实施例中,该螯合剂包含乙二胺四乙酸(edta)、edta钠盐、或柠檬酸钠。在某些实施例中,该螯合剂包含edta。在某些实施例中,该螯合剂包含edta钠盐。在某些实施例中,该螯合剂包含柠檬酸钠。本披露的组合物和配制品可进一步包含非离子渗透剂,优选地,其中该非离子渗透剂包含甘露醇或由甘露醇组成。本披露的组合物和配制品可以排除或可以不包含非离子渗透剂。在某些实施例中,本披露的组合物可以不包含非离子渗透剂,该非离子渗透剂包含甘露醇、糖醇和/或丙二醇或由甘露醇、糖醇和/或丙二醇组成。在某些实施例中,本披露的组合物不包含丙二醇,无论丙二醇的任何潜在的功能作用如何。本披露的组合物和配制品可以排除或可以不包含非离子渗透剂。在某些实施例中,本披露的组合物可以不包含非离子渗透剂,该非离子渗透剂包含甘露醇、任何其他糖醇和/或丙二醇或由甘露醇、任何其他糖醇和/或丙二醇组成。在某些实施例中,本披露的组合物不包含甘露醇、任何其他糖醇和/或丙二醇,不论本领域普通技术人员已知的甘露醇、任何其他糖醇和/或丙二醇的任何潜在的功能作用、化学特性或用途如何。本披露的组合物和配制品可以具有对组合物主要在外周肺区域(包括细支气管和肺泡)的沉积、渗透或保留有效的表面张力。在某些实施例中,本披露的组合物和配制品可以具有在类似于水的表面张力或更高的范围内的表面张力。在某些实施例中,根据本披露的组合物和配制品具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m,如在约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的范围内的表面张力。本披露的组合物和配制品可以排除或可以不包含表面活性剂。在某些实施例中,本披露的组合物可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,本组合物和配制品中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。本披露的组合物和配制品可进一步包含用于注射的纯化水。水的量可根据例如所使用的具体高效雾化器所需的填充体积而变化。在某些实施例中,本披露的组合物包含适量(q.s.)提供的用于注射的纯化水。本披露的组合物和配制品可具有约100mosm/kg至约200mosm/kg的同渗重摩,包括端值。本披露的组合物和配制品可具有约125mosm/kg至约135mosm/kg的同渗重摩,包括端值。本披露的组合物和配制品可具有约100mosm/kg至约125mosm/kg的同渗重摩,包括端值。本披露的组合物和配制品可具有约100mosm/kg至约135mosm/kg的同渗重摩,包括端值。本披露的组合物和配制品可以具有为约100mosm/kg的同渗重摩。本披露的组合物和配制品可具有约125mosm/kg的同渗重摩。本披露的组合物和配制品可以具有为约135mosm/kg的同渗重摩。本披露的组合物和配制品可以具有为约200mosm/kg的同渗重摩。本披露的组合物和配制品可以呈具有填充体积为约0.1ml至约5ml的溶液的形式。本披露的组合物和配制品可以呈填充体积为约0.1ml、约0.5ml、约1ml、约1.5ml、约2ml、约2.5ml、约3ml、约3.5ml、约4ml、约4.5ml、或约5ml的水性溶液的形式。本披露的组合物和配制品可以包含从约5mg至约80mg的色甘酸钠,包括端值。本披露的组合物和配制品可以包含从约36mg至约44mg的色甘酸钠,包括端值。给予本披露的组合物或配制品的雾化器可提供具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm)和如通过usp<1601>测量的至少约65%的可吸入级分(≤5μm)的气溶胶。给予本披露的组合物或配制品的雾化器可提供具有如通过usp<1601>测量的至少约45%的可吸入级分(≤3.3μm)和如通过usp<1601>测量的至少约75%的可吸入级分(≤5μm)的气溶胶。根据本披露的方法,使用雾化器给予本披露的药物组合物可以导致所给予的气溶胶主要在肺内沉积,而在其他呼吸道中沉积最少。在某些实施例中,沉降是气溶胶沉积的主要机制。在某些实施例中,使用雾化器给予本披露药物组合物提供肺沉积(肺沉积剂量)为至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、约20%至约40%、约25%至约35%、约25%至约30%、约25%至约75%、约30%至约50%、约35%至约90%、约40%至约80%、约40%至约60%、约50%至约60%、约50%至约70%、或约60%至约75%(基于组合物的标称剂量)。根据本披露的方法,使用雾化器给予本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)大于约150ng*hr/ml,色甘酸钠的cmax大于约50ng/ml,且色甘酸钠的肺沉积剂量大于约4mg。根据本披露的方法,使用雾化器给予本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)大于约175ng*hr/ml,色甘酸钠的cmax大于约60ng/ml,且色甘酸钠的肺沉积剂量大于约4mg。根据本披露的方法,使用雾化器给予本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)大于约100ng*hr/ml,色甘酸钠的cmax大于约40ng/ml,且色甘酸钠的肺沉积剂量大于约4mg。肺沉积百分比根据本披露的方法,使用雾化器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约120ng*hr/ml与约350ng*hr/ml之间。根据本披露的方法,使用雾化器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约340ng*hr/ml的80%至125%之内。根据本披露的方法,使用雾化器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-6)在约120ng*hr/ml与约350ng*hr/ml之间。根据本披露的方法,使用雾化器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-6)在约237ng*hr/ml的80%至125%之内。根据本披露的方法,使用雾化器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约40ng/ml至约150ng/ml之间。根据本披露的方法,使用雾化器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约85ng/ml、或约75ng/ml、或约82ng/ml、或约93ng/ml的80%至125%之内。根据本披露的方法,使用雾化器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约250ng*hr/ml与约1000ng*hr/ml之间。根据本披露的方法,使用雾化器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约542ng*hr/ml的80%至125%之内。根据本披露的方法,使用雾化器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-6)在约200ng*hr/ml与约700ng*hr/ml之间。根据本披露的方法,使用雾化器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-6)在约389ng*hr/ml的80%至125%之内。根据本披露的方法,使用雾化器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约50ng/ml与约250ng/ml之间。根据本披露的方法,使用雾化器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约134ng/ml、或约119ng/ml、或约148ng/ml、或约157ng/ml的80%至125%之内。根据本披露的方法,使用雾化器给予包含约80mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约300ng*hr/ml与约800ng*hr/ml之间。根据本披露的方法,使用雾化器给予包含约80mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约526ng*hr/ml的80%至125%之内。根据本披露的方法,使用雾化器给予包含约80mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约90ng/ml与约450ng/ml之间。根据本披露的方法,使用干粉吸入器给予本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)大于约150ng*hr/ml,色甘酸钠的cmax大于约50ng/ml,且色甘酸钠的肺沉积剂量大于约4mg。根据本披露的方法,使用雾化器给予本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)大于约175ng*hr/ml,色甘酸钠的cmax大于约60ng/ml,且色甘酸钠的肺沉积剂量大于约4mg。根据本披露的方法,使用雾化器给予本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)大于约100ng*hr/ml,色甘酸钠的cmax大于约40ng/ml,且色甘酸钠的肺沉积剂量大于约4mg。根据本披露的方法,使用干粉吸入器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约120ng*hr/ml与约350ng*hr/ml之间。根据本披露的方法,使用干粉吸入器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约340ng*hr/ml的80%至125%之内。根据本披露的方法,使用干粉吸入器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-6)在约120ng*hr/ml与约350ng*hr/ml之间。根据本披露的方法,使用干粉吸入器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-6)在约237ng*hr/ml的80%至125%之内。根据本披露的方法,使用干粉吸入器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约40ng/ml与约150ng/ml之间。根据本披露的方法,使用干粉吸入器给予包含约40mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约85ng/ml、或约75ng/ml、或约82ng/ml、或约93ng/ml的80%至125%之内。根据本披露的方法,使用干粉吸入器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约250ng*hr/ml与约1000ng*hr/ml之间。根据本披露的方法,使用干粉吸入器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约542ng*hr/ml的80%至125%之内。根据本披露的方法,使用干粉吸入器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-6)在约200ng*hr/ml与约700ng*hr/ml之间。根据本披露的方法,使用干粉吸入器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-6)在约389ng*hr/ml的80%至125%之内。根据本披露的方法,使用干粉吸入器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约50ng/ml与约250ng/ml之间。根据本披露的方法,使用干粉吸入器给予包含约60mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约134ng/ml、或约119ng/ml、或约148ng/ml、或约157ng/ml的80%至125%之内。根据本披露的方法,使用干粉吸入器给予包含约80mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约300ng*hr/ml与约800ng*hr/ml之间。根据本披露的方法,使用干粉吸入器给予包含约80mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的auc(0-∞)在约526ng*hr/ml的80%至125%之内。根据本披露的方法,使用干粉吸入器给予包含约80mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约90ng/ml与约450ng/ml之间。根据本披露的方法,使用干粉吸入器给予包含约80mg的色甘酸钠的本披露的药物组合物可以在受试者中产生的色甘酸钠的cmax在约236ng/ml的80%至125%之内。根据本披露的方法,在某些实施例中,每天给予该药物组合物。在某些实施例中,以每天一次给予该药物组合物。在某些实施例中,以每天两次给予该药物组合物。在某些实施例中,以每天三次给予该药物组合物。在某些实施例中,以每天四次给予该药物组合物。在某些实施例中,以每天五次给予该药物组合物。根据本披露的方法,在某些实施例中,以每天三次给予该药物组合物持续至少7天。在某些实施例中,以每天三次给予该药物组合物持续至少14天。在某些实施例中,以每天三次给予该药物组合物作为每日维持疗法(例如,至少7天或至少14天,治疗总长度无限制)。根据本披露的方法,在某些实施例中,该药物组合物可以与任何其他治疗组合物一起作为组合疗法给予,用于治疗与受试者的诊断为ipf相关的或由于诊断为ipf而引起的慢性咳嗽。附图说明图1是显示使用pa101或使用两种安慰剂治疗之一治疗后实例1中每个受试者的日间平均咳嗽次数的一系列图。图2是显示使用pa101或使用两种安慰剂治疗之一治疗后实例1中每个受试者的日间咳嗽的总次数的一系列图。图3是描绘肺功能(测量为一秒用力呼气量(fev1))作为实例1中所述的每个治疗组的时间函数的图。图4是实例4中描述的第ii阶段研究的设计示意图。图5是显示在实例4中描述的研究的基线、第7天和第14天经安慰剂治疗(n=21)和经pa101治疗的受试者(n=23)的作为时间函数的日间平均咳嗽次数(咳嗽/小时)的图。平均咳嗽次数/小时是该第ii阶段研究的主要功效终点。图6是显示在实例4中描述的研究的基线、第7天和第14天经安慰剂治疗和经pa101治疗的受试者的作为时间函数的日间平均咳嗽次数/小时的从基线的平均变化的图。在第7天和第14天,经pa101治疗的组(封闭圆圈)中从基线的平均变化具有统计学意义(p=0.03)。在第14天,经pa101治疗的组(封闭圆圈)中从基线的平均变化具有统计学意义(p=0.04)。图7是一对图,显示了经安慰剂调节的咳嗽减少(左图)(其表示为实例4中所述研究的经安慰剂与经pa101治疗的受试者在第14天的日间平均咳嗽/小时从基线的百分比变化)以及针对该咳嗽减少的pa101/安慰剂ls平均值比率(95%ci)(右图)(其表示为实例4中所述研究的经安慰剂与经pa101治疗的受试者在第14天的对数转化的日间平均咳嗽/小时的变化)。在第14天,经pa101治疗的组中对数转化的日间平均咳嗽/小时的变化是统计学显著的(p=0.02)。图8是显示针对第7天和第14天在经pa101治疗的受试者中日间咳嗽减少的pa101/安慰剂ls平均值比率(95%ci)的图(参见实例4)。在第7天,经pa101治疗的组中对数转化的日间平均咳嗽/小时的变化是统计学显著的(p=0.03)。在第14天,经pa101治疗的组中对数转化的日间平均咳嗽/小时的变化是统计学显著的(p=0.02)。图9是一对图,描绘了在实例4中描述的研究的基线或第14天,每个经安慰剂和经pa101治疗的组中每个受试者的日间平均咳嗽/小时。图10是提供针对日间咳嗽的应答者分析结果的图,表示为实例4中描述的研究中受试者(这些受试者与基线相比,经历了日间平均咳嗽/小时的百分比(%)下降)的百分比(%)。应答者超过30%:n=8,用pa101治疗(其中3名受试者伴随服用一种或多种其他ipf治疗,而另外5名受试者未伴随给予一种或多种其他ipf治疗)以及n=4,用安慰剂治疗(其中1名受试者伴随服用一种或多种其他ipf治疗,而另外3名受试者未伴随给予一种或多种其他ipf治疗)。“伴随服用”或“伴随给予”是指特定受试者在被给与至少一种包含色甘酸钠的本文披露的配制品的同时还被给予一种或多种其他ipf治疗,例如吡非尼酮或乙磺酸尼达尼布。图11是提供针对24小时咳嗽的应答者分析结果的图,表示为实例4中描述的研究中受试者(这些受试者与基线相比,经历了24小时平均咳嗽/小时的百分比(%)下降)的百分比(%)。应答者超过30%:n=8,用pa101治疗(其中3名受试者伴随服用一种或多种其他ipf治疗,而另外5名受试者未伴随给予一种或多种其他ipf治疗)以及n=4,用安慰剂治疗(其中1名受试者伴随服用一种或多种其他ipf治疗,而另外3名受试者未伴随给予一种或多种其他ipf治疗)。“伴随服用”或“伴随给予”是指特定受试者在被给与至少一种包含色甘酸钠的本文披露的配制品的同时还被给予一种或多种其他ipf治疗,例如吡非尼酮或乙磺酸尼达尼布。图12是显示在实例4中描述的研究的基线、第7天和第14天经安慰剂治疗和经pa101治疗的受试者的作为时间函数的夜间平均咳嗽/小时(咳嗽/小时)的图。夜间平均咳嗽次数是该第ii阶段研究的次级功效终点。图13是显示在实例4中描述的研究的第14天经安慰剂治疗和经pa101治疗的受试者的作为时间函数的夜间平均咳嗽次数/小时的从基线的平均变化的图。图14是显示在实例4中描述的研究的基线、第7天和第14天经安慰剂治疗和经pa101治疗的受试者的作为时间函数的24小时期间平均咳嗽次数(咳嗽/小时)的图。24小时期间平均咳嗽次数/小时是该第ii阶段研究的次级功效终点。图15是显示24小时期间经安慰剂调节的咳嗽减少的图,表示为在实例4中描述的研究的经安慰剂治疗和经pa101治疗的受试者在第7天和第14天在24小时期间平均咳嗽/小时从基线的百分比变化。图16是显示针对安慰剂调节的咳嗽减少的pa101/安慰剂ls平均值比率(95%ci)的图,表示为在实例4中描述的研究的经安慰剂治疗和经pa101治疗的受试者在第7天和第14天在24小时期间对数转化的平均咳嗽/小时的变化。在第7天,经pa101治疗的组中在24小时期间对数转化的平均咳嗽/小时的变化是统计学显著的(p=0.016)。在第14天,经pa101治疗的组中在24小时期间对数转化的平均咳嗽/小时的变化是统计学显著的(p=0.025)。图17是一对图,显示了经安慰剂调节的咳嗽减少(左图)(其表示为实例4中所述研究的经安慰剂与经pa101治疗的受试者在第14天的24小时平均咳嗽/小时从基线的百分比变化)以及针对该咳嗽减少的pa101/安慰剂ls平均值比率(95%ci)(右图)(其表示为实例4中所述研究的经安慰剂与经pa101治疗的受试者在第14天的对数转化的24小时平均咳嗽/小时的变化)。在第14天,经pa101治疗的组中对数转化的24小时平均咳嗽/小时的变化是统计学显著的(p=0.025)。图18是一对图,描绘了接受安慰剂或pa101作为实例4中描述的第ii阶段研究的一部分的患有由ipf引起的慢性咳嗽的24小时咳嗽谱。图19是显示来自实例4的应答者分析结果的一对图。在用pa101治疗的基线和第14天,比较来自该研究的应答者的lcq和vas评分。图20是实例5中描述的研究的设计示意图。图21是一对图,描绘了在实例5中描述的研究的基线或第14天,每个经安慰剂和经pa101治疗的组中每个受试者的日间平均咳嗽/小时。图22是显示在实例5中描述的研究的基线、第7天和第14天经安慰剂治疗和经pa101治疗的受试者的作为时间函数的平均24小时咳嗽次数(咳嗽/小时)的图。平均24小时咳嗽次数/小时是该第ii阶段研究的次级功效终点。图23是显示针对第7天和第14天在经pa101治疗的受试者中日间咳嗽减少的pa101/安慰剂ls平均值比率(95%ci)的图(参见实例5)。在第7天,经pa101治疗的组中对数转化的日间平均咳嗽/小时的变化是统计学显著的(p=0.038)。在第14天,经pa101治疗的组中对数转化的日间平均咳嗽/小时的变化不具统计学显著性(p=0.33)。图24是提供针对日间咳嗽的应答者分析结果的图,表示为实例5中描述的研究中受试者(这些受试者与基线相比,经历了日间平均咳嗽/小时的百分比(%)下降)的百分比(%)。图25是显示针对第7天和第14天在经pa101治疗的受试者中24小时期间咳嗽减少的pa101/安慰剂ls平均值比率(95%ci)的图(参见实例5)。图26是一对图,显示对于患有由ipf引起的慢性咳嗽的受试者(实例4)与患有慢性特发性咳嗽(cic)的受试者(实例5)的日间平均咳嗽/小时的应答者分析。图27是一对图,显示对于患有由ipf引起的慢性咳嗽的受试者(实例4)与患有慢性特发性咳嗽(cic)的受试者(实例5)的24小时平均咳嗽/小时的应答者分析。图28是显示患有由ipf引起的慢性咳嗽的受试者(实例4)与患有慢性特发性咳嗽(cic)的受试者(实例5)的对数转化的日间平均咳嗽/小时的图。图29是显示患有由ipf引起的慢性咳嗽的受试者(实例4)与患有慢性特发性咳嗽(cic)的受试者(实例5)的对数转化的24小时平均咳嗽/小时的图。具体实施方式包含色甘酸钠和离子渗透剂的本披露组合物对于治疗由ipf引起的慢性咳嗽是安全有效的。与接受安慰剂的那些受试者相比,用本披露中提供的组合物和配制品治疗的受试者在治疗14天后在客观咳嗽率方面表现出统计学显著的和医学相关的改善。这些受试者具有与ipf相关的难治性慢性咳嗽,其每个均不能用目前可用的治疗(不包括本披露的配制品和方法)得到缓解。慢性咳嗽在美国,咳嗽是受试者寻求医疗护理的最常见的诉因,并且是进行一般医学检查的第二大常见原因,每年的诊所就诊量超过2600万(国家卫生统计中心(nationalcenterforhealthstatistics)美国国家非卧床患者医疗护理调查(nationalambulatorymedicalcaresurvey):2008)。上呼吸道感染(即普通感冒)是迄今为止咳嗽最常见的原因,但感染后咳嗽、原因不明的慢性咳嗽和由肺部疾病(如哮喘、慢性阻塞性肺病(copd)、特发性肺纤维化(ipf)和肺癌)导致的咳嗽也很常见。咳嗽通过清除气道中过多的粘液、刺激物或异常物质(如水肿液或脓液)起到了潜在的有益作用。虽然多咳嗽可能起到有用的作用,但咳嗽也会导致各种各样的问题,包括力竭(57%)、感觉不自在(55%)、失眠(45%)、生活方式改变(45%)、肌肉骨骼疼痛(45%)、声音嘶哑(43%)、出汗过多(42%)和尿失禁(39%)。在慢性和急性咳嗽的情况下,这些问题更可能是突出的。因此,慢性咳嗽导致高达38%的肺部患者医院就诊。对于患有咳嗽对个体来说,存在显著的经济成本,并且对于社会来说,存在例如缺勤和生产力下降。咳嗽是由有髓咳嗽受体和无髓鞘c纤维(其细胞体位于颈静脉和结节神经节)的活化引起的。在气道上皮下发现广泛的c纤维末端,而咳嗽受体末端终止于上皮和平滑肌之间的粘膜。肥大细胞在咳嗽中起重要作用,因为脱颗粒肥大细胞释放可活化c纤维的介质,导致p物质、组胺、血清素和蛋白酶的释放。物质p的释放导致炎症、血管舒张、神经敏化和极度活跃的咳嗽反射。特发性肺纤维化(ipf)ipf是一种进行性危及生命的疾病,其解剖学上特征在于肺部瘢痕以及症状上表征为劳力性呼吸困难。其病因尚不清楚,而且其起始和发展过程中涉及的致病机制知之甚少。ipf特征在于肺成纤维细胞的积累和细胞外基质沉积,最终导致组织结构和肺功能受损。ipf的临床特征包括干咳、呼吸急促、限制性呼吸生理学、末端吸气性爆裂声、氧合作用减少,并且杵状指高分辨率计算机断层扫描(hrct)显示出该病后期胸膜下阴影和蜂窝纤维化的独特模式。ipf中的慢性咳嗽(也称为ipf中的难治性慢性咳嗽)ipf是一种罕见的病因不明的肺病,影响美国约135,000人。ipf的一个共同特征似乎是导致纤维化的异常伤口愈合。截至本披露日期,不存在治愈性疗法。ipf受试者的生存中值为3至5年。如本文所用,与ipf相关的慢性咳嗽可定义为无痰干咳(每小时高达100次咳嗽),尽管用标准护理进行治疗仍持续超过八周。与ipf相关的慢性咳嗽显著影响生活质量,例如导致头痛、眩晕、出汗、尿失禁、肋骨骨折、喉部创伤、呕吐、呼吸系统疾病恶化、失眠、力竭和焦虑中的一种或多种。此外,与ipf相关的慢性咳嗽显著影响心理社会因素,包括但不限于失业、不愿参加公共活动和抑郁症。与ipf相关的慢性咳嗽可能是ipf疾病进展的独立预测因子。大约80%的ipf受试者患有慢性咳嗽。在这些80%受试者中,约40%的那些受试者具有对可用的治疗(可用的治疗不包括本披露的配制品、组合物或方法)来说难治的慢性咳嗽形式。咳嗽的可用治疗选择有很大的局限性。非处方药提供的功效可以忽略不计。处方药以阿片类药物为主,偶尔有效,但常与便秘、困倦、呼吸抑制和成瘾风险相关。在过去的50年里,没有新的非阿片类药物产品被批准用于咳嗽。患有由ipf引起的慢性咳嗽的个体可能在日间频繁咳嗽,夜间咳嗽相对较少。咳嗽率可能范围很广,并且似乎不受受试者年龄或性别的影响。色甘酸、和类似物、衍生物及其药学上可接受的盐如本文使用的,色甘酸是指5,5′-(2-羟基丙烷-1,3-二基)双(氧基)双(4-氧代-4h-色烯-2-甲酸)二钠,且具有如下结构:色甘酸(cromolyn)也称为色甘酸钠(sodiumcromolyn)、色甘酸(cromoglicicacid)、色甘酸二钠(dscg)、色甘酸钠(sodiumcromoglicate)、和色甘酸(cromoglicate)。药学上可接受的色甘酸的盐包括但不限于色甘酸钠、色甘酸赖氨酸盐、色甘酸铵、和色甘酸镁。色甘酸钠也称为5,5'-[(2-羟基三亚甲基)二氧]双[4-氧代-4h-1-苯并吡喃-2-甲酸]二钠。本文所述的色甘酸及其药学上可接受的盐可作为前药制备。“前药”是指在体内转化为母体药物的药剂。该前药可以被设计成改变药物的代谢稳定性或运输特征,掩蔽副作用或毒性,改进药物的香味或改变药物的其他特征或特性。在某些实施例中,相对于母体药物,该前药具有改进的生物利用度。在某些实施例中,该前药在药物组合物中具有改进的超过母体药物的溶解性。在某些实施例中,前药可设计为可逆药物衍生物,作为调节剂使用,以增强药物转运至特定部位的组织。在某些实施例中,色甘酸的前药是色甘酸的酯,其被水解成羧酸,即母体化合物。在某些实施例中,前药包含键合至酸基团上的短肽(聚氨基酸),其中该肽在体内新陈代谢以揭示母体药物。在某些实施例中,体内给药后,前药经化学转化为生物、药物或治疗活性形式的色甘酸。在某些实施例中,前药通过一个或多个步骤或过程酶促代谢成母体化合物。在某些实施例中,使用色甘酸的前药。在具体的实施例中,色甘酸的前药是赖色甘酯。为了产生前药,对药学上有活性的色甘酸进行修饰,这样使得所述活性化合物可以在体内给药后再生。在某些实施例中,色甘酸的前药是根据体内药效动力学过程和药物代谢的知识设计的。参见,例如nogrady(1985)medicinalchemistryabiochemicalapproach[药物化学一种生化方法],牛津大学出版社,纽约,第388-392页;silverman(1992),theorganicchemistryofdrugdesignanddrugaction[药物设计与药物作用的有机化学],学术出版社公司,圣地亚哥,第352-401页,saulnier等人,(1994),bioorganicandmedicinalchemistryletters[生物有机和药物化学快报],第4卷,第1985页;rooseboom等人,pharmacologicalreviews[药理学评论],56:53–102,2004;miller等人,j.med.chem.[医药化学杂志]第46卷,第24期,第5097-5116页,2003;aesopcho,“recentadvancesinoralprodrugdiscovery[口服前药发现的最新进展]”,annualreportsinmedicinalchemistry[医药化学年报]第41卷,第395-407页,2006。在某些实施例中,本文披露的色甘酸及其药学上可接受的盐是同位素标记的化合物,这些化合物与在此所叙述的那些化合物相同,但一个或多个原子被原子质量或质量数与通常见于自然界中的原子质量或质量数不同的原子替代。可以掺入本化合物中的同位素的实例包括氢、碳、氮、氧、氟和氯的同位素,分别为例如比如,2h、3h、13c、14c、15n、18o、17o、35s、18f、36cl。本文所述的某些同位素标记的化合物,例如被同位素(如氘,即2h)标记可以提供由更大的代谢稳定性(如例如增加的体内半衰期或减少的剂量需要)带来的某些治疗优势。在某些实施例中,共同给予同位素标记的色甘酸。在一些实施例中,色甘酸的药学上可接受的盐(例如色甘酸钠)是同位素标记的。在某些实施例中,色甘酸的药学上可接受的盐是氘标记的色甘酸钠。在某些实施例中,本文所述的色甘酸及其药学上可接受的盐是聚乙二醇化的,其中一种或多种聚乙二醇(peg)聚合物共价连接到色甘酸或其药学上可接受的盐上。在某些实施例中,聚乙二醇化增加了聚乙二醇化化合物在体内的半衰期。在某些实施例中,聚乙二醇化增加了聚乙二醇化化合物的水合粒径,降低了肾清除率。在某些实施例中,聚乙二醇化增加了聚乙二醇化化合物的溶解度。在某些实施例中,保护聚乙二醇化合物不被蛋白水解降解。色甘酸和药学上可接受的盐、前药、及其加合物可通过本领域已知的方法制备。色甘酸或其药学上可接受的盐可以以本文披露的方法以如本领域普通技术人员确定的适合的剂量或标称剂量给予。在某些实施例中,色甘酸或其药学上可接受的盐以小于约1mg/剂量、约1mg/剂量至约100mg/剂量、约1mg/剂量至约120mg/剂量、约5mg/剂量至约80mg/剂量、约20mg/剂量至约60mg/剂量、约30mg/剂量至约50mg/剂量、或大于约100mg/剂量的剂量或标称剂量给予。在某些实施例中,色甘酸或其药学上可接受的盐以小于约1mg、约1mg、约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、或约1000mg剂量给予。在某些实施例中,色甘酸或其药学上可接受的盐以约30mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约40mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约50mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约60mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约70mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约80mg给予。在本文披露的方法的某些实施例中,色甘酸钠以小于约1mg/剂量、约1mg/剂量至约100mg/剂量、约1mg/剂量至约120mg/剂量、约5mg/剂量至约80mg/剂量、约20mg/剂量至约60mg/剂量、或约30mg/剂量至约50mg/剂量,或大于约100mg/剂量的剂量或标称剂量给予。在其他实施例中,色甘酸钠以小于约1mg、约1mg、约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg、约135mg、约140mg、约145mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、或约1000mg剂量给予。在某些实施例中,色甘酸或其药学上可接受的盐以约30mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约40mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约50mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约60mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约70mg给予。在某些实施例中,色甘酸或其药学上可接受的盐以约80mg给予。配制品dscg因其抗过敏、抗炎和免疫调节特性以及其独特的安全谱而具有悠久的使用历史。然而,dscg的可用配制品(不包括本披露的组合物)不适合用于与ipf相关的慢性咳嗽,因为dscg的可用配制品由于递送效率差和生物利用度非常低(约1%)而受到限制。本披露的组合物和配制品提高了生物利用度,并对与ipf相关的慢性咳嗽的衰弱症状提供了有效的治疗。本披露的组合物和配制品实现了显著高于当前现有的配制品的肺和周围组织分布,这些参数都是治疗与ipf相关的慢性咳嗽中的功效所必需的。表1a提供了本披露组合物的示例性的、非限制性的配制品,其中配制品的各组分的量表示为配制品的总重量的重量百分比。表1b提供了本披露组合物的其他示例性的、非限制性的配制品,其中配制品的各组分的量表示为配制品的总重量的重量百分比。pa101b配制品4%(按重量计)和6%(按重量计),均为高浓缩、耐受性良好、室温稳定的色甘酸二钠配制品,其经优化可经由电子雾化器递送。在某些实施例中,本披露的组合物可以包含离子同渗容摩调节剂或离子同渗重摩调节剂,但不包含非离子同渗容摩调节剂或非离子同渗重摩调节剂。离子同渗容摩调节剂或离子同渗重摩调节剂可以选自,例如,碱金属盐,如钠盐和钾盐。此类盐的实例包括但不限于氯化钠、葡萄糖酸钠、丙酮酸钠和氯化钾。可以使用单一的离子张力调节剂,例如氯化钠、或此类试剂的混合物。由于盐的形成过程,盐可以被添加或在原位形成。然而,在本披露的具体实施例中,非离子同渗容摩调节剂或非离子同渗重摩调节剂是甘露醇。非离子同渗容摩调节剂或非离子同渗重摩调节剂可以选自,例如,碳水化合物的组。可用于等渗化的碳水化合物的实例包括但不限于糖(如葡萄糖、乳糖、蔗糖和海藻糖)以及糖醇(如甘露醇、木糖醇、山梨醇和异麦芽醇)。然而,在本披露的具体实施例中,非离子同渗容摩调节剂或非离子同渗重摩调节剂不是丙二醇、环糊精或甘露醇。本披露提供了用于治疗患有特发性肺纤维化(ipf)的受试者的慢性咳嗽的药学上可接受的气溶胶,该气溶胶包含水溶液的液滴,所述水溶液包含(i)从约2%至约6%(按重量计)的色甘酸钠以及(ii)同渗容摩调节剂,其包含(a)在约0.1%与约0.5%(按重量计)之间(包括端值)的氯化钠,以及(b)任选地乙二胺四乙酸(edta)的盐,其中所述气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm),并且其中所述受试者的所述慢性咳嗽的所述治疗是通过所述受试者口服吸入所述药学上可接受的气溶胶经由递送治疗有效量的色甘酸钠至受试者的肺部来达到的。在某些实施例中,该药学上可接受的气溶胶包含含有edta的盐的水溶液的液滴,其中所述盐选自edta钠盐。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有从约5mg至约80mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有从约36mg至约44mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约44mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、或约80mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其具有如通过usp<1601>测量的至少约75%的可吸入级分(≤5μm)。在某些实施例中,涉及药学上可接受的气溶胶,其中所述氯化钠的浓度为按重量计0.1%至0.2%,包括端值。本披露提供了用于治疗患有特发性肺纤维化(ipf)的受试者的慢性咳嗽的药学上可接受的气溶胶,该气溶胶由以下水溶液的液滴组成,所述水溶液由以下组成:(i)从约2%至约6%(按重量计)的色甘酸钠以及(ii)同渗容摩调节剂,其由以下组成:(a)在约0.1%与约0.5%(按重量计)之间(包括端值)的氯化钠,以及(b)任选地乙二胺四乙酸(edta)的盐,其中所述气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm),并且其中所述受试者的所述慢性咳嗽的所述治疗是通过所述受试者口服吸入所述药学上可接受的气溶胶经由递送治疗有效量的色甘酸钠至受试者的肺部来达到的。在某些实施例中,该药学上可接受的气溶胶包含含有edta的盐的水溶液的液滴,其中所述盐选自edta钠盐。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有从约5mg至约80mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有从约36mg至约44mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约44mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、或约80mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其具有如通过usp<1601>测量的至少约75%的可吸入级分(≤5μm)。在某些实施例中,涉及药学上可接受的气溶胶,其中所述氯化钠的浓度为按重量计0.1%至0.2%,包括端值。在某些实施例中,提供了治疗患有特发性肺纤维化(ipf)的受试者的慢性咳嗽的方法,该方法包括通过经口吸入给予所述受试者药学上可接受的气溶胶,所述药学上可接受的气溶胶由如下水溶液的液滴组成,该水溶液由以下组成:(i)按重量计从约2%至约6%的色甘酸钠,(ii)按重量计约0.1%至约0.5%的氯化钠,包括端值,和(iii)任选地,乙二胺四乙酸(edta)的盐。在某些实施例中,涉及药学上可接受的气溶胶,其中所述气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm)。在某些实施例中,涉及药学上可接受的气溶胶,其中所述气溶胶具有如通过usp<1601>测量的至少约75%的可吸入级分(≤5μm)。在某些实施例中,该药学上可接受的气溶胶包含含有edta的盐的水溶液的液滴,其中所述盐选自edta钠盐。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有从约5mg至约80mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有从约36mg至约44mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其中该水溶液含有约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约31mg、约32mg、约33mg、约34mg、约35mg、约36mg、约37mg、约38mg、约39mg、约40mg、约41mg、约42mg、约43mg、约44mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、或约80mg的色甘酸钠。在某些实施例中,涉及药学上可接受的气溶胶,其具有如通过usp<1601>测量的至少约75%的可吸入级分(≤5μm)。在某些实施例中,涉及药学上可接受的气溶胶,其中所述氯化钠的浓度为按重量计0.1%至0.2%,包括端值。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约100ng*hr./ml、大于约110ng*hr./ml、大于约120ng*hr./ml、大于约130ng*hr./ml、大于约140ng*hr./ml、大于约150ng*hr./ml、大于约160ng*hr./ml、大于约170ng*hr./ml、大于约180ng*hr./ml、大于约190ng*hr./ml、大于约200ng*hr./ml、大于约225ng*hr./ml、大于约250ng*hr./ml、大于约275ng*hr./ml、大于约300ng*hr./ml、大于约325ng*hr./ml、大于约350ng*hr./ml、大于约375ng*hr./ml、大于约400ng*hr./ml、大于约425ng*hr./ml、大于约450ng*hr./ml、大于约475ng*hr./ml、大于约500ng*hr./ml、大于约525ng*hr./ml、大于约550ng*hr./ml、大于约575ng*hr./ml、大于约600ng*hr./ml、大于约625ng*hr./ml、大于约650ng*hr./ml、大于约675ng*hr./ml、大于约700ng*hr./ml、大于约725ng*hr./ml、大于约750ng*hr./ml、大于约775ng*hr./ml、大于约800ng*hr./ml、大于约825ng*hr./ml、大于约850ng*hr./ml、大于约875ng*hr./ml、大于约900ng*hr./ml、大于约925ng*hr./ml、大于约950ng*hr./ml、大于约975ng*hr./ml、或大于约1000ng*hr./ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约100ng*hr./ml、大于约110ng*hr./ml、大于约120ng*hr./ml、大于约130ng*hr./ml、大于约140ng*hr./ml、大于约150ng*hr./ml、大于约160ng*hr./ml、大于约170ng*hr./ml、大于约180ng*hr./ml、大于约190ng*hr./ml、大于约200ng*hr./ml、大于约225ng*hr./ml、大于约250ng*hr./ml、大于约275ng*hr./ml、大于约300ng*hr./ml、大于约325ng*hr./ml、大于约350ng*hr./ml、大于约375ng*hr./ml、大于约400ng*hr./ml、大于约425ng*hr./ml、大于约450ng*hr./ml、大于约475ng*hr./ml、大于约500ng*hr./ml、大于约525ng*hr./ml、大于约550ng*hr./ml、大于约575ng*hr./ml、大于约600ng*hr./ml、大于约625ng*hr./ml、大于约650ng*hr./ml、大于约675ng*hr./ml、大于约700ng*hr./ml、大于约725ng*hr./ml、大于约750ng*hr./ml、大于约775ng*hr./ml、大于约800ng*hr./ml、大于约825ng*hr./ml、大于约850ng*hr./ml、大于约875ng*hr./ml、大于约900ng*hr./ml、大于约925ng*hr./ml、大于约950ng*hr./ml、大于约975ng*hr./ml、或大于约1000ng*hr./ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)为约100ng*hr./ml、约110ng*hr./ml、约120ng*hr./ml、约130ng*hr./ml、约140ng*hr./ml、约150ng*hr./ml、约160ng*hr./ml、约170ng*hr./ml、约180ng*hr./ml、约190ng*hr./ml、约200ng*hr./ml、约225ng*hr./ml、约250ng*hr./ml、约275ng*hr./ml、约300ng*hr./ml、约325ng*hr./ml、约350ng*hr./ml、约375ng*hr./ml、约400ng*hr./ml、约425ng*hr./ml、约450ng*hr./ml、约475ng*hr./ml、约500ng*hr./ml、约525ng*hr./ml、约550ng*hr./ml、约575ng*hr./ml、约600ng*hr./ml、约625ng*hr./ml、约650ng*hr./ml、约675ng*hr./ml、约700ng*hr./ml、约725ng*hr./ml、约750ng*hr./ml、约775ng*hr./ml、约800ng*hr./ml、约825ng*hr./ml、约850ng*hr./ml、约875ng*hr./ml、约900ng*hr./ml、约925ng*hr./ml、约950ng*hr./ml、约975ng*hr./ml、或约1000ng*hr./ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)为约100ng*hr./ml、约110ng*hr./ml、约120ng*hr./ml、约130ng*hr./ml、约140ng*hr./ml、约150ng*hr./ml、约160ng*hr./ml、约170ng*hr./ml、约180ng*hr./ml、约190ng*hr./ml、约200ng*hr./ml、约225ng*hr./ml、约250ng*hr./ml、约275ng*hr./ml、约300ng*hr./ml、约325ng*hr./ml、约350ng*hr./ml、约375ng*hr./ml、约400ng*hr./ml、约425ng*hr./ml、约450ng*hr./ml、约475ng*hr./ml、约500ng*hr./ml、约525ng*hr./ml、约550ng*hr./ml、约575ng*hr./ml、约600ng*hr./ml、约625ng*hr./ml、约650ng*hr./ml、约675ng*hr./ml、约700ng*hr./ml、约725ng*hr./ml、约750ng*hr./ml、约775ng*hr./ml、约800ng*hr./ml、约825ng*hr./ml、约850ng*hr./ml、约875ng*hr./ml、约900ng*hr./ml、约925ng*hr./ml、约950ng*hr./ml、约975ng*hr./ml、或约1000ng*hr./ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的auc(0-∞)大于约100ng*hr./ml、大于约110ng*hr./ml、大于约120ng*hr./ml、大于约130ng*hr./ml、大于约140ng*hr./ml、大于约150ng*hr./ml、大于约160ng*hr./ml、大于约170ng*hr./ml、大于约180ng*hr./ml、大于约190ng*hr./ml、大于约200ng*hr./ml、大于约225ng*hr./ml、大于约250ng*hr./ml、大于约275ng*hr./ml、大于约300ng*hr./ml、大于约325ng*hr./ml、大于约350ng*hr./ml、大于约375ng*hr./ml、大于约400ng*hr./ml、大于约425ng*hr./ml、大于约450ng*hr./ml、大于约475ng*hr./ml、大于约500ng*hr./ml、大于约525ng*hr./ml、大于约550ng*hr./ml、大于约575ng*hr./ml、大于约600ng*hr./ml、大于约625ng*hr./ml、大于约650ng*hr./ml、大于约675ng*hr./ml、大于约700ng*hr./ml、大于约725ng*hr./ml、大于约750ng*hr./ml、大于约775ng*hr./ml、大于约800ng*hr./ml、大于约825ng*hr./ml、大于约850ng*hr./ml、大于约875ng*hr./ml、大于约900ng*hr./ml、大于约925ng*hr./ml、大于约950ng*hr./ml、大于约975ng*hr./ml、或大于约1000ng*hr./ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸钠的auc(0-∞)大于约100ng*hr./ml、大于约110ng*hr./ml、大于约120ng*hr./ml、大于约130ng*hr./ml、大于约140ng*hr./ml、大于约150ng*hr./ml、大于约160ng*hr./ml、大于约170ng*hr./ml、大于约180ng*hr./ml、大于约190ng*hr./ml、大于约200ng*hr./ml、大于约225ng*hr./ml、大于约250ng*hr./ml、大于约275ng*hr./ml、大于约300ng*hr./ml、大于约325ng*hr./ml、大于约350ng*hr./ml、大于约375ng*hr./ml、大于约400ng*hr./ml、大于约425ng*hr./ml、大于约450ng*hr./ml、大于约475ng*hr./ml、大于约500ng*hr./ml、大于约525ng*hr./ml、大于约550ng*hr./ml、大于约575ng*hr./ml、大于约600ng*hr./ml、大于约625ng*hr./ml、大于约650ng*hr./ml、大于约675ng*hr./ml、大于约700ng*hr./ml、大于约725ng*hr./ml、大于约750ng*hr./ml、大于约775ng*hr./ml、大于约800ng*hr./ml、大于约825ng*hr./ml、大于约850ng*hr./ml、大于约875ng*hr./ml、大于约900ng*hr./ml、大于约925ng*hr./ml、大于约950ng*hr./ml、大于约975ng*hr./ml、或大于约1000ng*hr./ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的auc(0-∞)为约100ng*hr./ml、约110ng*hr./ml、约120ng*hr./ml、约130ng*hr./ml、约140ng*hr./ml、约150ng*hr./ml、约160ng*hr./ml、约170ng*hr./ml、约180ng*hr./ml、约190ng*hr./ml、约200ng*hr./ml、约225ng*hr./ml、约250ng*hr./ml、约275ng*hr./ml、约300ng*hr./ml、约325ng*hr./ml、约350ng*hr./ml、约375ng*hr./ml、约400ng*hr./ml、约425ng*hr./ml、约450ng*hr./ml、约475ng*hr./ml、约500ng*hr./ml、约525ng*hr./ml、约550ng*hr./ml、约575ng*hr./ml、约600ng*hr./ml、约625ng*hr./ml、约650ng*hr./ml、约675ng*hr./ml、约700ng*hr./ml、约725ng*hr./ml、约750ng*hr./ml、约775ng*hr./ml、约800ng*hr./ml、约825ng*hr./ml、约850ng*hr./ml、约875ng*hr./ml、约900ng*hr./ml、约925ng*hr./ml、约950ng*hr./ml、约975ng*hr./ml、或约1000ng*hr./ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的auc(0-∞)为约100ng*hr./ml、约110ng*hr./ml、约120ng*hr./ml、约130ng*hr./ml、约140ng*hr./ml、约150ng*hr./ml、约160ng*hr./ml、约170ng*hr./ml、约180ng*hr./ml、约190ng*hr./ml、约200ng*hr./ml、约225ng*hr./ml、约250ng*hr./ml、约275ng*hr./ml、约300ng*hr./ml、约325ng*hr./ml、约350ng*hr./ml、约375ng*hr./ml、约400ng*hr./ml、约425ng*hr./ml、约450ng*hr./ml、约475ng*hr./ml、约500ng*hr./ml、约525ng*hr./ml、约550ng*hr./ml、约575ng*hr./ml、约600ng*hr./ml、约625ng*hr./ml、约650ng*hr./ml、约675ng*hr./ml、约700ng*hr./ml、约725ng*hr./ml、约750ng*hr./ml、约775ng*hr./ml、约800ng*hr./ml、约825ng*hr./ml、约850ng*hr./ml、约875ng*hr./ml、约900ng*hr./ml、约925ng*hr./ml、约950ng*hr./ml、约975ng*hr./ml、或约1000ng*hr./ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的cmax大于约40ng/ml、大于约50ng/ml、大于约60ng/ml、大于约70ng/ml、大于约80ng/ml、大于约90ng/ml、大于约100ng/ml、大于约110ng/ml、大于约120ng/ml、大于约130ng/ml、大于约140ng/ml、大于约150ng/ml、大于约160ng/ml、大于约170ng/ml、大于约180ng/ml、大于约190ng/ml、大于约200ng/ml、大于约210ng/ml、大于约220ng/ml、大于约230ng/ml、大于约240ng/ml、大于约250ng/ml、大于约260ng/ml、大于约270ng/ml、大于约280ng/ml、大于约290ng/ml、大于约300ng/ml、大于约310ng/ml、大于约320ng/ml、大于约330ng/ml、大于约340ng/ml、大于约350ng/ml、大于约360ng/ml、大于约370ng/ml、大于约380ng/ml、大于约390ng/ml、或大于约400ng/ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的cmax大于约40ng/ml、大于约50ng/ml、大于约60ng/ml、大于约70ng/ml、大于约80ng/ml、大于约90ng/ml、大于约100ng/ml、大于约110ng/ml、大于约120ng/ml、大于约130ng/ml、大于约140ng/ml、大于约150ng/ml、大于约160ng/ml、大于约170ng/ml、大于约180ng/ml、大于约190ng/ml、大于约200ng/ml、大于约210ng/ml、大于约220ng/ml、大于约230ng/ml、大于约240ng/ml、大于约250ng/ml、大于约260ng/ml、大于约270ng/ml、大于约280ng/ml、大于约290ng/ml、大于约300ng/ml、大于约310ng/ml、大于约320ng/ml、大于约330ng/ml、大于约340ng/ml、大于约350ng/ml、大于约360ng/ml、大于约370ng/ml、大于约380ng/ml、大于约390ng/ml、或大于约400ng/ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的cmax为约50mg/ml、约60ng/ml、约70ng/ml、约80ng/ml、90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml、约200ng/ml、约210ng/ml、约220ng/ml、约230ng/ml、约240ng/ml、约250ng/ml、260ng/ml、约270ng/ml、约280ng/ml、约290ng/ml、约300ng/ml、约310ng/ml、约320ng/ml、约330ng/ml、约340ng/ml、约350ng/ml、约360ng/ml、约370ng/ml、约380ng/ml、约390ng/ml、或约400ng/ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的cmax为约50mg/ml、约60ng/ml、约70ng/ml、约80ng/ml、90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml、约200ng/ml、约210ng/ml、约220ng/ml、约230ng/ml、约240ng/ml、约250ng/ml、260ng/ml、约270ng/ml、约280ng/ml、约290ng/ml、约300ng/ml、约310ng/ml、约320ng/ml、约330ng/ml、约340ng/ml、约350ng/ml、约360ng/ml、约370ng/ml、约380ng/ml、约390ng/ml、或约400ng/ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的cmax大于约40ng/ml、大于约50ng/ml、大于约60ng/ml、大于约70ng/ml、大于约80ng/ml、大于约90ng/ml、大于约100ng/ml、大于约110ng/ml、大于约120ng/ml、大于约130ng/ml、大于约140ng/ml、大于约150ng/ml、大于约160ng/ml、大于约170ng/ml、大于约180ng/ml、大于约190ng/ml、大于约200ng/ml、大于约210ng/ml、大于约220ng/ml、大于约230ng/ml、大于约240ng/ml、大于约250ng/ml、大于约260ng/ml、大于约270ng/ml、大于约280ng/ml、大于约290ng/ml、大于约300ng/ml、大于约310ng/ml、大于约320ng/ml、大于约330ng/ml、大于约340ng/ml、大于约350ng/ml、大于约360ng/ml、大于约370ng/ml、大于约380ng/ml、大于约390ng/ml、或大于约400ng/ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸钠的cmax大于约40ng/ml、大于约50ng/ml、大于约60ng/ml、大于约70ng/ml、大于约80ng/ml、大于约90ng/ml、大于约100ng/ml、大于约110ng/ml、大于约120ng/ml、大于约130ng/ml、大于约140ng/ml、大于约150ng/ml、大于约160ng/ml、大于约170ng/ml、大于约180ng/ml、大于约190ng/ml、大于约200ng/ml、大于约210ng/ml、大于约220ng/ml、大于约230ng/ml、大于约240ng/ml、大于约250ng/ml、大于约260ng/ml、大于约270ng/ml、大于约280ng/ml、大于约290ng/ml、大于约300ng/ml、大于约310ng/ml、大于约320ng/ml、大于约330ng/ml、大于约340ng/ml、大于约350ng/ml、大于约360ng/ml、大于约370ng/ml、大于约380ng/ml、大于约390ng/ml、或大于约400ng/ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的cmax为约50mg/ml、约60ng/ml、约70ng/ml、约80ng/ml、90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml、约200ng/ml、约210ng/ml、约220ng/ml、约230ng/ml、约240ng/ml、约250ng/ml、约260ng/ml、约270ng/ml、约280ng/ml、约290ng/ml、约300ng/ml、约310ng/ml、约320ng/ml、约330ng/ml、约340ng/ml、约350ng/ml、约360ng/ml、约370ng/ml、约380ng/ml、约390ng/ml、或约400ng/ml。在某些实施例中,本文披露的方法中给予的配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸钠的cmax为约50mg/ml、约60ng/ml、约70ng/ml、约80ng/ml、90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml、约200ng/ml、约210ng/ml、约220ng/ml、约230ng/ml、约240ng/ml、约250ng/ml、约260ng/ml、约270ng/ml、约280ng/ml、约290ng/ml、约300ng/ml、约310ng/ml、约320ng/ml、约330ng/ml、约340ng/ml、约350ng/ml、约360ng/ml、约370ng/ml、约380ng/ml、约390ng/ml、或约400ng/ml。色甘酸或其药学上可接受的盐可在本文披露的方法中吸入装置(如雾化器)给予受试者。色甘酸或其药学上可接受的盐可以配置为任何合适的剂型,包括但不限于气溶胶、口服水性分散体、自乳化分散体、脂质体分散体、聚乙二醇化脂质体、液体、酏剂、悬浮液、气溶胶、控制释放配制品、冻干配制品、粉末、延迟释放配制品、延长释放配制品、多颗粒配制品或混合的立即释放配制品。这些配制品可以用传统的方式制造,例如(仅通过示例)传统的混合、溶解或造粒过程。在某些实施例中,本文披露的配制品可包括提供该配制品的合适特性的一种或多种非活性成分或药物赋形剂。此类非活性成分可能包括以下一类或多类。“白蛋白”是指球蛋白家族,最常见的是血清白蛋白。白蛋白常见于血浆中,起调节血液胶体渗透压的作用。血浆中发现的白蛋白与一些药物化合物结合以形成复合物。白蛋白与药物化合物(如色甘酸或其药学上可接受的盐)的络合可通过阻止络合化合物的代谢和/或排泄而影响药物化合物在体内的血浆半衰期和/或生物半衰期。在某些实施例中,本文披露的组合物包括白蛋白和色甘酸或其药学上可接受的盐(例如色甘酸钠)。“消泡剂”可减少加工过程中的发泡,这使水分散体凝固,减少成品膜中的气泡,或减少通常影响加工的气泡。示例性消泡剂包括硅乳液或山梨聚糖倍半油酸酯。例如,“抗氧化剂”包括例如丁基羟基甲苯(bht)、抗坏血酸钠、抗坏血酸、焦亚硫酸钠和生育酚。在某些实施例中,抗氧化剂可在需要时增强化学稳定性。“粘合剂”赋予粘合性质,包括例如海藻酸及其盐;纤维素衍生物,例如羧甲基纤维素、甲基纤维素(如)、羟丙基甲基纤维素、羟乙基纤维素、羟丙基纤维素(如)、乙基纤维素(如)和微晶纤维素(如)。微晶葡萄糖;直链淀粉;镁铝硅酸盐;多糖酸;皂土;明胶;聚乙烯吡咯烷酮/乙酸乙烯酯共聚物;交联聚维酮;聚维酮;淀粉;预胶化淀粉;黄芪胶、糊精、糖(例如蔗糖(如)、葡萄糖、右旋糖、糖蜜、甘露醇、山梨醇、木糖醇(如)、和乳糖;天然或合成树胶(例如阿拉伯树胶、黄芪胶、印度树胶、依撒伯尔(isapol)外皮的粘液、聚乙烯吡咯烷酮(如cl、cl、xl-10)、落叶松阿拉伯半乳聚糖、聚乙二醇、蜡、海藻酸钠等)。“载体”或“载体材料”包括任何药剂学中常用的赋形剂,并且应根据与色甘酸或其药学上可接受的盐的相容性以及所希望的剂型的释放特性来选择。示例性载体材料包括,例如,粘合剂、悬浮剂、崩解剂、填充剂、表面活性剂、增溶剂、稳定剂、润滑剂、湿润剂、稀释剂等。“药学上相容的载体材料”包括但不限于阿拉伯树胶、明胶、二氧化硅胶体、甘油磷酸钙、乳酸钙、麦芽糖糊精、丙三醇、硅酸镁、聚乙烯吡咯烷酮(pvp)、胆固醇、胆固醇酯、酪蛋白酸钠、大豆卵磷脂、牛磺胆酸、磷脂酰胆碱、氯化钠、磷酸三钙、磷酸氢二钾、纤维素和纤维素轭合物、糖硬脂酰乳酸钠、角叉菜胶、甘油单酯、甘油二酯、预糊化淀粉等。参见,例如,remington:thescienceandpracticeofpharmacy[雷明顿:药学科学与实践],nineteenthed(easton,pa.:mackpublishingcompany,1995)[第19版,宾夕法尼亚州伊斯顿:马克出版公司,1995];hoover,johne.,remington’spharmaceuticalsciences[雷明顿药物科学],mackpublishingco.,easton,pennsylvania1975[马克出版公司,宾夕法尼亚州伊斯顿1975];liberman,h.a.和lachman,l.编辑,pharmaceuticaldosageforms[药物剂型],marceldecker,newyork,n.y.,1980[马塞尔·德克尔公司,纽约州纽约市,1980];以及pharmaceuticaldosageformsanddrugdeliverysystems[药物剂型和药物递送系统],seventhed.(lippincottwilliams&wilkins1999)[第7版,利平科特威廉姆斯·威尔金斯1999]。“分散剂”和/或“粘度调节剂”包括控制药物通过液体介质或造粒方法或混合方法扩散和均质化的材料。在某些实施例中,这些试剂还有助于包被或腐蚀基质的有效性。示例性扩散促进剂/分散剂包括,例如亲水聚合物、电解质、60或80、peg、泰洛沙泊、聚乙烯吡咯烷酮(pvp;商品名称为)、和碳水化合物类分散剂,比如例如羟丙基纤维素(如hpc、hpc-sl、和hpc-l)、羟丙基甲基纤维素(如hpmck100、hpmck4m、hpmck15m、和hpmck100m)、羧甲基纤维素钠、甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、乙酸羟丙基甲基纤维素硬脂酸酯(hpmcas)、非结晶纤维素、硅酸镁铝、三乙醇胺、聚乙烯醇(pva)、乙烯基吡咯烷酮/乙酸乙烯酯共聚物(s630)、4-(1,1,3,3-四甲基丁基)-苯酚与环氧乙烷和甲醛的聚合物(也成为泰洛沙泊)、泊洛沙姆(如pluronics和它们是环氧乙烷和环氧丙烷的嵌段共聚物);以及泊洛沙姆(如tetronic也称为泊洛沙姆它是通过向乙二胺顺序添加环氧丙烷和环氧乙烷而衍生的四官能团嵌段共聚物(basf公司,帕西波尼,新泽西州))、聚乙烯吡咯烷酮k12、聚乙烯吡咯烷酮k17、聚乙烯吡咯烷酮k25、或聚乙烯吡咯烷酮k30、聚乙烯吡咯烷酮/乙酸乙烯酯共聚物(s-630)、聚乙二醇(如可以具有为约300至约6000、或约3350至约4000、或约7000至约5400的分子量的聚乙二醇)、羧甲基纤维素钠、甲基纤维素、聚山梨酸酯-80、海藻酸钠、树胶(例如如黄蓍胶和阿拉伯树胶)、瓜尔豆胶、黄原胶(xanthans)(包括黄原胶(xanthangum))、糖、纤维素(例如如羧甲基纤维素钠、甲基纤维素、羧甲基纤维素钠)、聚山梨酸酯-80、海藻酸钠、聚乙氧基化山梨聚糖单月桂酸酯、聚乙氧基化山梨聚糖单月桂酸酯、聚维酮、卡波姆、聚乙烯醇(pva)、海藻酸盐、壳聚糖及其组合。增塑剂如纤维素或三乙基纤维素也可用作分散剂。在脂质体分散和自乳化分散中特别有用的分散剂为二肉豆蔻酰磷脂酰胆碱、来自蛋的天然磷脂酰胆碱、来自蛋的天然磷脂酰甘油、胆固醇和肉豆蔻酸异丙酯。“稀释剂”是指在递送前用于稀释目的化合物(即色甘酸或其药学上可接受的盐)的化学化合物。稀释剂还可以用于稳定化合物,因为它们可以提供更稳定的环境。溶解在缓冲溶液中的盐(包括但不限于磷酸盐缓冲盐水溶液)在本领域中用作稀释剂,还可以提供ph控制或维持。在某些实施例中,稀释剂增加组合物的体积以促进压缩或产生足够用于胶囊填充的均匀混合的体积。此类化合物包括例如,乳糖,淀粉,甘露醇,山梨糖醇,右旋糖,微晶纤维素(如);磷酸氢钙,磷酸氢钙二水合物;磷酸三钙,磷酸钙;无水乳糖,喷雾干燥的乳糖;预胶化淀粉,可压缩糖(如di-(amstar));甘露醇、羟丙基甲基纤维素,乙酸羟丙基甲基纤维素硬脂酸酯,蔗糖基稀释剂,糖粉;一水单碱式硫酸钙,二水合硫酸钙;乳酸钙三水合物,葡萄糖结合剂;水解谷物固体,直链淀粉;粉末纤维素,碳酸钙;甘氨酸,高岭土;甘露醇,氯化钠;肌醇,膨润土,以及类似物。本文所述的配制品中有用的“调味剂”和/或“甜味剂”包括,例如,阿拉伯胶糖浆、阿力甜、阿力甜、八角、苹果、阿斯巴甜、香蕉、巴伐利亚乳脂、浆果、红醋栗、奶油硬糖、柠檬酸钙、樟脑、焦糖、樱桃、樱桃奶油、巧克力、肉桂、泡泡糖、柑橘、柑橘渣、柑橘霜、棉花糖、可可、可乐、冷樱桃、冷柑橘、环磺酸盐、环己基氨基磺酸、dentomint、右旋糖、桉树、丁子香酚、果糖、水果酒、姜、甘草次酸盐、甘草(甘草汁)糖浆、葡萄、葡萄柚、蜂蜜、异麦芽酮糖醇、柠檬、酸橙、柠檬霜、甘草酸一铵麦芽酚、甘露醇、枫树、棉花糖、薄荷醇、薄荷霜、混合浆果、新橙皮苷dc、纽甜、桔子、梨、桃子、薄荷糖、薄荷糖霜、粉、覆盆子、沙士、朗姆酒、糖精、黄樟油精、山梨醇、留兰香、留兰香霜、草莓、草莓霜、甜叶菊、三氯蔗糖、蔗糖、糖精钠、糖精、阿斯巴甜、乙酰氨基磺酸钾、甘露醇、踝蛋白、sylitol、三氯蔗糖、山梨醇、瑞士霜、塔格糖、橘子、索马甜、百果糖、香草、胡桃、西瓜、野黑樱桃、冬青油、木糖醇、或这些调味成分的任何组合,例如八角-薄荷醇、樱桃-八角、肉桂-桔子、樱桃-肉桂、巧克力-薄荷、蜂蜜-柠檬、柠檬-酸橙、柠檬-薄荷、薄荷醇-桉树、桔子-霜、香草-薄荷、及其混合物。“润滑剂”和“助流剂”是防止、减少或抑制材料粘附或摩擦的化合物。示例性润滑剂包括例如,硬脂酸、氢氧化钙、滑石、硬脂酰醇富马酸钠、碳氢化合物(例如矿物油)、或氢化植物油(例如氢化大豆油)、高级脂肪酸及其碱金属和碱土金属(例如铝、钙、镁、锌)盐、硬脂酸、硬脂酸钠、甘油、滑石、蜡、硼酸、苯甲酸钠、乙酸钠、氯化钠、亮氨酸、聚乙二醇(如peg-4000)或甲氧基聚乙二醇(如carbowaxtm)、油酸钠、苯甲酸钠、甘油二十二烷酸酯、聚乙二醇、十二烷基硫酸镁或钠、硅胶(如syloidtm、cab-o-)、淀粉(例如玉米淀粉)、硅油、表面活性剂等。“增塑剂”是用于软化微胶囊材料或薄膜涂层使其脆性降低的化合物。适合的增塑剂包括,例如,聚乙二醇类,如peg300、peg400、peg600、peg1450、peg3350、和peg800、硬脂酸、丙二醇、油酸、三乙基纤维素和三醋精。在某些实施例中,增塑剂还可作为分散剂或湿润剂。在某些实施例中,本文提供的组合物还可以包括用于抑制微生物活性的一种或多种防腐剂。适合的防腐剂包括含汞物质(如硼酸苯汞和硫柳汞);稳定二氧化氯;奥替尼啶;以及季铵化合物(如氯化苯甲烃铵、溴化十六烷基三甲铵和氯化十六烷基吡啶。“增溶剂”包括例如三醋精、柠檬酸三乙酯、油酸乙酯、辛酸乙酯、十二烷基硫酸钠、多库酯钠、维生素etpgs、聚山梨醇酯(tweens)、二甲基乙酰胺、n-甲基吡咯烷酮、n-羟乙基吡咯烷酮、聚乙烯吡咯烷酮、羟丙基甲基纤维素、羟丙基环糊精、乙醇、正丁醇、异丙醇、胆固醇、胆盐、聚乙二醇200-600、糖原质、还氧二元醇、丙二醇、和异山梨醇二甲醚等的化合物。“稳定剂”包括例如任何抗氧化剂(如柠檬酸、edta及其药学上可接受的盐)、缓冲液、酸、防腐剂等化合物。“悬浮剂”包括例如如下的化合物:聚乙烯吡咯烷酮(如聚乙烯吡咯烷酮k12、聚乙烯吡咯烷酮k17、聚乙烯吡咯烷酮k25、或聚乙烯吡咯烷酮k30)、乙烯基吡咯烷酮/乙酸乙烯酯共聚物(s630)、聚乙二醇(如聚乙二醇可以具有为约300至约6000、或约3350至约4000、或约7000至约5400的分子量)、羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、乙酸羟甲基纤维素硬脂酸酯、聚山梨酸酯-80、羟乙基纤维素、海藻酸钠、树胶(如黄芪胶和阿拉伯树胶)、瓜尔豆胶、黄原胶(包括黄原胶)、糖类、纤维素(如羧甲基纤维素钠、甲基纤维素、羧甲基纤维素钠、羟丙基甲基纤维素、羟乙基纤维素)、聚山梨酸酯-80、海藻酸钠、聚乙氧基化山梨聚糖单月桂酸酯、聚乙氧基化山梨聚糖单月桂酸酯、聚维酮等。“表面活性剂”包括例如如下的化合物:月桂烷硫酸酯、多库酯钠、tween60或80、三醋精、维生素etpgs、山梨聚糖单油酸酯、聚氧乙烯山梨聚糖单油酸酯、聚山梨酸酯、polaxomers、胆盐、单硬脂酸甘油酯、环氧乙烷和环氧丙烷的共聚物(如(basf))等。一些其他表面活性剂包括聚氧乙烯脂肪酸甘油酯和植物油,例如聚乙二醇(60)氢化蓖麻油;和聚氧乙烯烷基醚和烷基苯基醚,例如辛苯聚醇10、辛苯聚醇40。在某些实施例中,可包括表面活性剂以增强物理稳定性或用于其他目的。“粘度增强剂”包括例如甲基纤维素、黄原胶、羧甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素、乙酸羟甲基纤维素硬脂酸酯、羟丙基甲基纤维素邻苯二甲酸酯、卡波姆、聚乙烯醇、海藻酸盐、阿拉伯树胶、壳聚糖及其组合物。“湿润剂”包括例如如下的化合物:油酸、单硬脂酸甘油酯、山梨聚糖单油酸酯、山梨聚糖单月桂酸酯、三乙醇胺油酸酯、聚氧乙烯山梨聚糖单油酸酯、聚氧乙烯山梨聚糖单月桂酸酯、多库酯钠(sodiumdocusate)、油酸钠、十二烷基硫酸钠、多库酯钠(sodiumdoccusate)、三醋精、tween80、维生素etpgs、铵盐等。应该认识到,非活性成分的类别之间有相当多的重叠。因此,以上列出的成分应仅作为示例,而不应限制本文所述的配制品中所包含的非活性成分的类型。此类非活性成分的量可以很容易地由本领域技术人员根据所希望的特定的性质确定。液体口服配制品用于口服给予的液体配制品剂型可以是选自下组的水性悬浮液,该组包括但不限于药学上可接受的水性口服分散体、乳液、溶液、酏剂、凝胶和糖浆。参见例如singh等人,encyclopediaofpharmaceuticaltechnology[制剂技术百科全书],第2版,第754-757页(2002)。除色甘酸或其药学上可接受的盐的颗粒之外,液体剂型还可包括如下添加剂,例如:(a)崩解剂;(b)分散剂;(c)湿润剂;(d)至少一种防腐剂,(e)增粘剂,(f)至少一种甜味剂,和(g)至少一种调味剂。在某些实施例中,水分散体可以进一步包括晶体抑制剂。在某些实施例中,通过将渗透增强剂包括在液体口服配制品中,使用液体口服配制品可获得全身有效量的色甘酸或其药学上可接受的盐。在水悬浮液和分散液中使用的崩解剂的实例包括但不限于淀粉(例如天然淀粉(如玉米淀粉或马铃薯淀粉)、预胶凝淀粉(如national1551或)、羧基乙酸淀粉钠(如或))、纤维素(如木制品)、甲基结晶纤维素(如ph101、ph102、ph105、p100、ming和solka-)、甲基纤维素、交联羧甲纤维素或交联纤维素(例如交联羧甲基纤维素钠(ac-di-)、交联羧甲基纤维素或交联的交联羧甲基纤维);交联淀粉(如羧基乙酸淀粉钠);交联聚合物(如交聚维酮);交联聚乙烯吡咯烷酮;海藻酸盐(如海藻酸或海藻酸的盐,如海藻酸钠);粘土(如hv(镁铝硅酸盐));树胶如琼脂、瓜尔胶、刺槐豆、木瓜胶、果胶或黄芪胶;羧基乙酸淀粉钠;膨润土;天然海绵;表面活性剂;树脂(如阳离子交换树脂);柑橘渣;十二烷基硫酸钠;十二烷基硫酸钠与淀粉组合等。在某些实施例中,本文所述的适用于水悬浮液和分散液的分散剂包括,例如,亲水聚合物、电解质、60或80、peg、聚乙烯吡咯烷酮(pvp;商品名称为)以及基于碳水化合物的分散剂,例如羟丙基纤维素和羟丙基纤维素醚(如hpc、hpc-sl和hpc-l)、羟丙基甲基纤维素和羟丙基甲基纤维素醚(如hpmck100、hpmck4m、hpmck15m和hpmck100m)、羧甲基纤维素钠、甲基纤维素、羟乙基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、乙酸羟丙基甲基纤维素硬脂酸酯、非晶纤维素、镁铝硅酸盐、三乙醇胺、聚乙烯醇(pva)、聚乙烯吡咯烷酮/乙酸乙烯酯共聚物(如s-630)、4-(1,1,3,3-四甲基丁基)-苯酚与环氧乙烷和甲醛的聚合物(也称为泰洛沙泊)、泊咯沙姆(如pluronics和它们是环氧乙烷和环氧丙烷的嵌段共聚物)以及泊洛沙姆(例如tetronic也称为泊洛沙姆它是通过向乙二胺顺序添加环氧丙烷和环氧乙烷而衍生的四官能团嵌段共聚物(basf公司,帕西波尼,新泽西州))。在其它实施例中,分散剂选自不包含如下试剂之一的组:亲水聚合物;电解质;60或80;peg;聚乙烯吡咯烷酮(pvp);羟丙基纤维素和羟丙基纤维素醚(如hpc、hpc-sl和hpc-l)、羟丙基甲基纤维素和羟丙基甲基纤维素醚(如hpmck100、hpmck4m、hpmck15m和hpmck100m和usp2910(shin-etsu));羧甲基纤维素钠;甲基纤维素;羟乙基纤维素;羟丙基甲基纤维素邻苯二甲酸酯;乙酸羟丙基甲基纤维素硬脂酸酯;非晶纤维素;镁铝硅酸盐;三乙醇胺;聚乙烯醇(pva);4-(1,1,3,3-四甲基丁基)-苯酚与环氧乙烷和甲醛的聚合物;泊咯沙姆(如pluronics和它们是环氧乙烷和环氧丙烷的嵌段共聚物)或泊洛沙姆(例如tetronic也称为泊洛沙姆)。适用于本发明的水悬浮液和分散液的湿润剂包括但不限于鲸蜡醇、单硬脂酸甘油、聚氧乙烯山梨聚糖脂肪酸酯(如可商购的(如tween和tween(icispecialtychemicals(ici专用化学品公司))))、以及聚乙二醇(如carbowaxs和和carbopol(unioncarbide(联合碳化物公司)))、油酸、单硬脂酸甘油酯、山梨聚糖单油酸酯、山梨聚糖单月桂酸酯、三乙醇胺油酸酯、聚氧乙烯山梨聚糖单油酸酯、山梨聚糖聚氧乙烯酯、油酸钠、十二烷基硫酸钠、多库酯钠、三醋精、维生素etpgs、牛磺胆酸钠、二甲基硅油、磷脂酰胆碱等。本披露的组合物和配制品可以具有对组合物主要在外周肺区域(包括细支气管和肺泡)的沉积、渗透或保留有效的表面张力。在某些实施例中,本披露的组合物和配制品可以具有在类似于水的表面张力或更高的范围内的表面张力。在某些实施例中,根据本披露的组合物和配制品具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。在一些实施例中,该组合物和配制品具有约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的范围内的表面张力。本披露的组合物和配制品可以排除或可以不包含表面活性剂。在某些实施例中,本披露的组合物可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,本组合物和配制品中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。吸入疗法如本文使用的“吸入装置”是指任何能给予药物配制品至受试者的呼吸道的装置。吸入装置包括常规吸入装置(如雾化器)、定量吸入器(mdi)、干粉吸入器(dpi)、喷射雾化器、超声波雾化器、加热气化器、和软雾吸入器。吸入装置也包括雾化器。雾化器、定量吸入器和软雾吸入器通过形成气溶胶递送药物,气溶胶包括易于吸入的液滴大小。受试者可在吸入治疗的范围内使用该气溶胶,在吸入该气溶胶后,色甘酸或药物上可接受的盐到达受试者的呼吸道。在某些实施例中,本文披露的方法包括通过吸入装置(如雾化器)给予受试者标称剂量的色甘酸或其药学上可接受的盐。在本文披露的方法的某些实施例中,吸入装置不是气管镜。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器、干粉吸入器、定量吸入器、热气溶胶吸入器、或基于电流体的溶液雾化吸入器)给予受试者包含色甘酸或其药学上可接受的盐(如色甘酸钠)的组合物对于治疗或预防因ipf引起的慢性咳嗽是有效的,因为可以在受试者中达到色甘酸或其药学上可接受的盐的全身有效剂量和色甘酸或其药学上可接受的盐的高肺沉积剂量。因此,在本文披露的方法的某些实施例中,使用吸入装置(如雾化器、干粉吸入器、定量吸入器、热气溶胶吸入器、或基于电流体的溶液雾化吸入器)给予受试者包含色甘酸或其药学上可接受的盐(如色甘酸钠)的组合物对于治疗或预防因ipf(其被认为是不易用色甘酸或其药学上可接受的盐治疗或预防)引起的慢性咳嗽是有效的,因为可以在受试者中达到色甘酸或其药学上可接受的盐的全身有效剂量和色甘酸或其药学上可接受的盐的高肺沉积剂量。此外,在使用吸入装置(如雾化器、干粉吸入器、定量吸入器、热气溶胶吸入器、或基于电流体的溶液雾化吸入器)给予色甘酸或其药学上可接受的盐的某些实施例中,相对于通过不同的给药途径(例如肠胃外或口服)给予全身有效量的色甘酸或其药学上可接受的盐,本文披露的方法提供了由ipf引起的慢性咳嗽的治疗和预防的改善的功效,因为使用吸入装置(如雾化器、干粉吸入器、定量吸入器、热气溶胶吸入器、或基于电流体的溶液雾化吸入器)给予色甘酸或其药学上可接受的盐提供了色甘酸或其药学上可接受的盐的全身有效剂量和色甘酸或其药学上可接受的盐的高肺沉积剂量。在某些实施例中,全身有效量的色甘酸或其药学上可接受的盐是通过递送气溶胶中的色甘酸或其药学上可接受的盐到达的,所述气溶胶是通过振动产生液滴(mmd为3.0-4.0μm且gsd为1.5-1.8)的网孔雾化器产生的。在本文披露的方法的某些实施例中,通过使用正常潮式呼吸的雾化器的口罩给予该气溶胶。吸入装置特性特定的吸入装置的效率可以以许多不同的方式表征出来,包括药代动力学性质、肺沉积(肺沉积剂量)、可吸入剂量(rd)、递送剂量(dd)、可吸入级分(rf)、可吸入药物递送率(rddr)、体积或质量中值直径(vmd或mmd)、质量中值空气动力学直径(mmad)与几何标准差(gsd)、以及总输出率(tor)组合等等。mmad和gsd可以使用如美国药典(usp<1601>)中描述的级联冲击器测量。dd可以用如在或usp<1601>中描述的呼吸模拟仪器来测量。rf衍生自测量具有特定截止粒度的级联冲击器板上沉积的药物的量,并将其表示为沉积在级联冲击器板、进气口和过滤器上的总量的比例。因此,rf是指气溶胶颗粒的分布,表示为含有某些大小的颗粒的气溶胶的总质量或体积的百分比。此类表示为可吸入级分(rf)的质量/体积分布不同于基于具有某些颗粒大小的的气溶胶中颗粒总数的百分比的分布。由于较少的大颗粒可以等于大量小颗粒的质量或体积,因此气溶胶中所包含的颗粒的数量分布可以与同一气溶胶中相同颗粒的质量分布显著不同。作为一个简化的数值实例,设想总共含有9个颗粒的气溶胶:大小(直径):三个1μm颗粒、三个2μm颗粒、和三个3μm颗粒。为这些颗粒建立数量分布将生成一个分布,其中每个颗粒大小占总数的三分之一。然而,建立相同颗粒的质量分布将产生一个分布,其中气溶胶的75%的总质量/体积来自3μm颗粒,不到3%来自1μm颗粒。如下确定:直径d的球形颗粒的体积是4/3*π*(d/2)3。因此,1μm、2μm和3μm颗粒的体积将是0.52μ3、4.2μ3、和14.13μ3。假设所有颗粒的单位密度,这些数字也表示颗粒的质量。因此,3μm颗粒将构成总质量的100*14.13/(0.52+4.2+14.13)=74.96%。同样,2μm颗粒将构成总质量的22.3%,1μm颗粒将构成总质量的2.8%。rd是由dd乘以rf计算的。tor是由雾化完成前后雾化器的重量差除以雾化持续时间来测量的。vmd或mmd可以用标准的激光散射仪如malvernspraytec测量。药代动力学研究的是药物在受试者体内的吸收、分布、代谢和排泄。药代动力学特性包括设计的一种或多种生物学测量,用于测量药物在受试者体内的吸收、分布、代谢和排泄。药代动力学特性的一种可视化方法是通过血浆浓度曲线,这是一个在y-轴上描述受试者的平均活性成分血浆浓度并且在x-轴上描述时间(通常以小时为单位)的图。一些药代动力学参数可以通过血浆浓度曲线可视化,包括auclast、auc(0-∞)、cmax、t1/2、和tmax。增加的auclast、auc(0-∞)、cmax或t1/2,降低的tmax或升高的tmax均可显示受试者体内药代动力学特征的增强。提高受试者血浆中色甘酸或其药学上可接受的盐的水平可更好地控制或改善由ipf引起的慢性咳嗽的症状。肺沉积剂量可以表示为沉积在受试者肺中的标称剂量的百分比。例如,30%的肺沉积意指30%的标称剂量沉积在受试者的肺中。同样,60%的肺沉积意指60%的标称剂量沉积在受试者的肺中,等等。可以使用闪烁扫描法或反褶积法来确定肺沉积量(肺沉积剂量)。由于色甘酸钠在体内不能代谢,约50%的被吸收的色甘酸排泄到尿液中(auty等人,br.jdis.chest[英国胸腔疾病杂志]第81卷,第4期,1987,371-380),并且由于其口服生物利用度非常低(~1%),因此,也可以通过测量尿液中色甘酸钠含量并将其乘以二来确定吸入期间色甘酸的肺沉积剂量。rf、dd、rd和rddr是基于体外数据计算的参数,这些数据为吸入装置的效率提供了技术维度。rf表示进入肺部气体交换区域的递送的气溶胶或吸入的物质的百分比。rf可以用级联冲击器或激光衍射仪测量。rf在此表示为使用吸入装置递送的具有特定颗粒直径或颗粒直径范围的气溶胶的百分比。例如,如本文使用的术语“rf(≤3.3μm)”是指使用吸入装置递送的具有颗粒直径小于或等于3.3μm的气溶胶的百分比。类似地,如本文使用的术语“rf(1-5μm)”和“rf(≤5μm)”是指使用吸入装置递送的具有颗粒直径分别在1μm至5μm的范围或小于5μm的气溶胶的百分比。dd是实际从装置的口罩射出的标称剂量的一部分或百分比。标称剂量与dd之间的差异是主要作为残留(即给药后残留在吸入装置内的药物量)的损失的药物量,或在呼出过程中以气溶胶形式损失的药物量。rd是由吸入装置(如dpi、mdi或雾化器)射出的具有一定直径(小到足以深入受试者的肺部)的液滴或颗粒中所含药物递送量的表达。rd是由dd乘以rf确定的。rddr是将药物的可吸入剂量递送到受试者肺部的速度。rddr是g/min或mg/min的函数,通过将rd除以吸入所需的时间量来确定。吸入所需要的时间量测量为给予从雾化器、dpi或mdi射出的液滴或粉末第一时间开始到射出或递送的可吸入直径的液滴或粉末递送至肺的时间量。气溶胶颗粒/液滴大小是确定气溶胶药物在气道中沉积的一个因素。气溶胶颗粒/液滴大小的分布可以关于vmd/mmad和gsd中的一种或多种来表示。gsd是与表征vmd、mmd和mmad等术语相关的液滴大小分布曲线的二维测量。通常,特定粒径分布的gsd越小,分布曲线越窄。吸入装置吸入装置可以是机械的或电气的,包括,例如,喷射雾化器和超声波雾化器。喷射雾化器通常利用压缩机产生压缩空气,将液体药物分解成可吸入的小液滴,形成气溶胶的(雾化的)雾。在某些实施例中,当受试者吸气时,顶部的阀门打开,从而允许空气进入设备,从而加速雾的产生;当受试者呼气时,顶部的阀门关闭,从而减缓雾的产生,同时允许受试者通过吹口盖的开口呼气。一些雾化器能以连续的模式(例如,来自paripharmastarnberg的eflow),通过呼吸增强模式(例如,来自paristarnberg的parilcplus或sprint),通过依赖于受试者的呼吸模式的呼吸驱动模式(例如,来自加拿大trudell的aeroeclipse或来philipsrespironics的i-neb),或根据给定的吸入曲线(例如,来自德国gmuendenactivaero的akita)提供气溶胶。一些常规的吸入装置披露于美国专利号6,513,727、6,513,519、6,176,237、6,085,741、6,000,394、5,957,389、5,740,966、5,549,102、5,461,695、5,458,136、5,312,046、5,309,900、5,280,784、和4,496,086,这些申请各自通过引用以其全部内容结合在此。商业常规吸入装置可获得自:pari(德国)商品名为parilclc和pari-a&hproducts,inc.(塔尔萨,俄克拉菏马州)商品名为hudsonrci(特曼库拉(temecula),加利福尼亚州)商品名为ava-intersurgical,inc.(利物浦,纽约)商品名为salterlabs(尔湾市,加利福尼亚州)商品名为salterrespironics(默里斯维尔,宾夕法尼亚州)商品名为bunnell(盐湖城,犹他州)商品名为whispersmiths-medical(肯特,英国)商品名为以及devilbiss(萨默塞特,宾夕法尼亚州)商品名为或trudell,加拿大,商品名为在本文披露的方法的某些实施例中,使用干粉吸入器给予包含色甘酸或其药学上可接受的盐的组合物。在本文披露的方法的某些实施例中,使用干粉吸入器给予的组合物包含一种或多种纳米颗粒、喷雾干燥材料、低质量中数直径但高几何直径的工程化的多孔粒子、脂质体和隐蔽(或聚乙二醇化)脂质体。在某些实施例中,本文披露的方法中通过干粉吸入器给予的组合物包含纳米颗粒簇,它们在中性或碱性ph下聚集成微米大小的颗粒,但在肺中遇到的ph值下解离成纳米颗粒。在某些实施例中,纳米颗粒簇包括延胡索酰基二酮哌嗪。在某些实施例中,使用干粉吸入器给予的组合物包含乳糖。在某些实施例中,使用干粉吸入器给予的组合物不包含乳糖。在某些实施例中,使用干粉吸入器给予的组合物具有在2与4μm之间的mmad、在1.5与2.5μm之间的gsd、和在30%与80%之间的rf(≤5μm)。在某些实施例中,用于在本文披露的方法中给予吸入配制品的干粉吸入器包含预计量的剂量,例如plastiape单剂量吸入器,其包含预先填充粉末的胶囊。在某些实施例中,用于在本文披露的方法中给予吸入配制品的干粉吸入器具有装置计量系统,例如twisthaler,由先灵葆雅公司(schering-plough)销售的,其包括用于储存粉末的储箱和用于分配每一剂量的拧盖。用于使用干粉吸入器给予的吸入配制品可通过混合色甘酸或其药学上可接受的盐(如色甘酸钠)与乳糖,或喷雾干燥色甘酸或其药学上可接受的盐(如色甘酸钠),或通过粒化色甘酸或其药学上可接受的盐(如色甘酸钠)以形成自由流动的球形聚集物来制备。在本文披露的方法的某些实施例中,使用定量吸入器给予包含色甘酸或其药学上可接受的盐的组合物。在某些实施例中,在本文披露的方法中使用定量吸入器给予的组合物包含一种或多种纳米颗粒、喷雾干燥材料、低质量中数直径但高几何直径的工程化的多孔粒子、脂质体和隐蔽(或聚乙二醇化)脂质体。在本文披露的方法的某些实施例中,使用热气溶胶吸入器给予包含色甘酸或其药学上可接受的盐的组合物。在某些实施例中,热气溶胶吸入器中的气溶胶是通过直接加热和蒸发色甘酸或其药学上可接受的盐(如色甘酸钠)的固体薄膜,或通过加热和蒸发色甘酸或其药学上可接受的盐(如色甘酸钠)在溶剂(如丙二醇和/或甘油和水)中的溶液产生的。在本文披露的方法的某些实施例中,使用基于电流体的溶液雾化吸入器给予包含色甘酸或其药学上可接受的盐的组合物。在某些实施例中,基于电流体的溶液雾化吸入器中的气溶胶是通过使色甘酸或其药学上可接受的盐(如色甘酸钠)的溶液、或包含色甘酸或其药学上可接受的盐(如色甘酸钠)的脂质体或聚乙二醇化脂质体通过静电能经受电流体力产生的。雾化器雾化器是吸入装置,其包括微孔膜,通过该微孔膜,液体溶液通过电学或机械手段转化为适合吸入的气溶胶液滴。雾化器可以向受试者递送大部分的装填剂量。在某些实施例中,该雾化器还使用一种或多种主动或被动振动的微孔膜。在某些实施例中,该雾化器包含一个或多个振荡膜。在某些实施例中,该雾化器含有具有多个孔的振动网或板以及任选地带有气溶胶混合室的振动发生器。在一些此类实施例中,混合室的功能是从气溶胶发生器收集(或分级)气溶胶。在某些实施例中,还使用吸入阀以允许环境空气在吸入阶段进入混合室,并在呼气阶段关闭以防止气溶胶从混合室逸出。在一些此类实施例中,呼出阀设置在可拆卸地安装在混合室的面罩上,且受试者通过该面罩从混合室吸入气溶胶。再者,在某些实施例中,该雾化器含有搏动膜。在某些实施例中,该雾化器是连续地操作的。在某些实施例中,雾化器含有锥形喷嘴的振动微孔膜,该喷嘴不需要压缩气体就能产生液滴流。在这些实施例中,微孔膜雾化器中的溶液与膜接触,膜的另一侧向空气开放。该膜由雾化头的大量喷嘴孔穿孔。当溶液中交替的声压在膜附近形成,使膜上液体侧的液体通过喷嘴作为均匀大小的液滴射出时产生气溶胶。雾化器的某些实施例使用被动喷嘴膜和用来刺激膜的单独的压电式转换器。相反地,一些雾化器采用主动喷嘴膜,其使用雾化器内的声压经由喷嘴膜的高频振动产生非常细小的溶液液滴。一些雾化器含有谐振系统。在一些此类雾化器中,薄膜是由一定频率驱动的,在这个频率下,薄膜中心的振动运动振幅特别大,导致在喷嘴附近有聚焦的声压;谐振频率可为约100khz。灵活的安装是用来将雾化头的机械环境的不必要的振动能量的损失保持在最低。在某些实施例中,雾化器的振动膜可由不锈钢制成,或由电铸镍钯合金制成。在某些实施例中,雾化器可被调调适或能被调适与单位剂型(如安瓿或小瓶)一起操作,该单位剂型含有单一剂量的组合物,该组合物包含用于治疗由ipf引起的慢性咳嗽的色甘酸或其药学上可接受的盐。该单位剂型包括含有吸入配制品的容器,该吸入配制品含有色甘酸或其药学上可接受的盐(例如色甘酸钠)。该容器被调适于与雾化器装置配合,以便允许给予受试者标称剂量的吸入配制品。在某些实施例中,雾化器和单位剂型配置为可一起使用,但不能与其他装置或剂型一起使用。在一些特定的实施例中,单位剂型被配置为使其适配于雾化器中的钥匙孔状结构,但不会与其他雾化器装置一起操作。在此类实施例中,雾化器被配置为使其能够接受含有色甘酸或其药学上可接受的盐的单位剂型并正确地与含有色甘酸或其药学上可接受的盐的单位剂型一起操作,但不能与其他剂型一起操作。商业高效雾化器可获得自:pari(德国)商品名为aerogen,ltd.(爱尔兰)商品名为go和pro、solo、和使用雾化器技术的其他雾化器;respironics(默里斯维尔,加利福尼亚州)商品名为i-omron(班诺克市,伊利诺伊州)商品名为micro-activaero(德国)商品名为和aerovectrx(亚特兰大,乔治亚州)商品名为在某些实施例中,本文披露的方法包括使用雾化器给予受试者标称剂量的色甘酸或其药学上可接受的盐,其中给予受试者标称剂量的色甘酸或其药学上可接受的盐提供了以下优点的一种或多种:(1)与给予口服溶液相比,药代动力学曲线增强;(2)与给予口服溶液相比,治疗效果增强;(3)与使用一些吸入装置连同其他色甘酸钠组合物的给药相比,肺沉积(肺沉积剂量)增强,这一点通过闪烁扫描术或反褶积法来证明,或源自合适的体外指标例如增强的rd、rddr、rf、和降低的gsd(与使用一些吸入装置连同其他色甘酸钠组合物的给药相比);(4)与使用一些其他配制品和吸入装置相比,给药时间、周期和/或体积减少;(5)与色甘酸或其药学上可接受的盐的口服配制品相关的不良副作用如胃肠道刺激减少;以及(6)与使用其他吸入装置给予使用其他色甘酸钠配制品的口服溶液或吸入配制品相比,治疗效果持续时间更长。在某些实施例中,表示为使用本文披露方法中的雾化器给予的标称剂量的色甘酸或其药学上可接受的盐的百分比的dd是至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、约65%、约70%、约30%至约90%、约40%至约80%、约45%至约75%、约50%至约70%、约30%至约75%、约40%至约70%、约45%至约60%、或约60%至约70%。tor是含有色甘酸或其药学上可接受的盐的液体从吸入装置给药的速度。在某些实施例中,使用雾化器给予色甘酸或其药学上可接受的盐提供了使用常规吸入装置(如雾化器)能达到的tor的至少约2倍、3倍或4倍的tor。例如,在某些实施例中,tor为至少约至少约150mg/min、至少约200mg/min、至少约250mg/min、至少300mg/min、至少350mg/min、至少400mg/min、至少500mg/min、或从200至约700mg/min。在某些实施例中,在本文披露的方法中雾化器的使用提供了包含色甘酸或其药学上可接受的盐的溶液的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、或约55%至约90%的rf(≤3.3μm)。在某些实施例中,在本文披露的方法中雾化器的使用提供了包含色甘酸或其药学上可接受的盐的溶液的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、或约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、约55%至约90%、约40%至约50%、约35%至约45%、约35%至约50%、约30%至约50%、约44%、或约36%的色甘酸钠的rf(≤3.3μm)。在某些实施例中,该溶液包含渗透剂,所述渗透剂包含氯化钠。在某些实施例中,该溶液包含渗透剂,所述渗透剂由氯化钠组成。在某些实施例中,该溶液的同渗重摩在约100mosm/kg与约175mosm/kg之间、或在约100mosm/kg与约170mosm/kg之间、或在约100mosm/kg与约165mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约115mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约130mosm/kg之间。在某些实施例中,该溶液的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在某些实施例中,本披露的溶液可以排除或可以不包含表面活性剂。在某些实施例中,本披露的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,本发明溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,在本文披露的方法中雾化器的使用提供了气溶胶,其包含具有适合于该组合物主要在外周肺区域(包括细支气管和肺泡)沉积、渗透或保留的表面张力的颗粒。在某些实施例中,在本文披露的方法中雾化器的使用提供了溶液的气溶胶,其包含具有在类似于水的表面张力或更高的范围内的表面张力的颗粒。在某些实施例中,在本文披露的方法中雾化器的使用提供了溶液的气溶胶,其包含具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力的颗粒。在一些实施例中,在本文披露的方法中雾化器的使用提供了溶液的气溶胶,其包含具有在约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m范围内的表面张力的颗粒。在某些实施例中,在本文披露的方法中雾化器的使用提供了包含色甘酸或其药学上可接受的盐的溶液的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、或约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、或约55%至约90%的色甘酸或其药学上可接受的盐的rf(1-5μm)。在某些实施例中,在本文披露的方法中雾化器的使用提供了包含色甘酸或其药学上可接受的盐的溶液的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、或约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、或约55%至约90%的色甘酸钠的rf(1-5μm)。在某些实施例中,该溶液包含渗透剂,所述渗透剂包含氯化钠。在某些实施例中,该溶液包含渗透剂,所述渗透剂由氯化钠组成。在某些实施例中,该溶液包含渗透剂,所述渗透剂包含氯化钠。在某些实施例中,该溶液包含渗透剂,所述渗透剂由氯化钠组成。在某些实施例中,该溶液的同渗重摩在约100mosm/kg与约175mosm/kg之间、或在约100mosm/kg与约170mosm/kg之间、或在约100mosm/kg与约165mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约115mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约130mosm/kg之间。在某些实施例中,该溶液的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在某些实施例中,本披露的溶液可以排除或可以不包含表面活性剂。在某些实施例中,本披露的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,本发明溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,在本文披露的方法中雾化器的使用提供了气溶胶,其包含具有适合于该组合物主要在外周肺区域(包括细支气管和肺泡)沉积、渗透或保留的表面张力的颗粒。在某些实施例中,在本文披露的方法中雾化器的使用提供了溶液的气溶胶,其包含具有在类似于水的表面张力或更高的范围内的表面张力的颗粒。在某些实施例中,在本文披露的方法中雾化器的使用提供了溶液的气溶胶,其包含具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力的颗粒。在一些实施例中,在本文披露的方法中雾化器的使用提供了溶液的气溶胶,其包含具有在约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m范围内的表面张力的颗粒。在某些实施例中,在本文披露的方法中雾化器的使用提供了包含色甘酸或其药学上可接受的盐的溶液的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、约55%至约90%、约70%至约80%、或约75%的色甘酸或其药学上可接受的盐的rf(≤5μm)。在某些实施例中,在本文披露的方法中雾化器的使用提供了包含色甘酸或其药学上可接受的盐的溶液的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、约55%至约90%、约70%至约80%、约65%至约75%、约65%至约80%、约60%至约80%、约66%、或约75%的色甘酸钠的rf(≤5μm)。在某些实施例中,该溶液包含渗透剂,所述渗透剂包含氯化钠。在某些实施例中,该溶液包含渗透剂,所述渗透剂由氯化钠组成。在某些实施例中,该溶液的同渗重摩在约100mosm/kg与约175mosm/kg之间、或在约100mosm/kg与约170mosm/kg之间、或在约100mosm/kg与约165mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约115mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约130mosm/kg之间。在某些实施例中,该溶液的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在某些实施例中,本披露的溶液可以排除或可以不包含表面活性剂。在某些实施例中,本披露的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,本发明溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,由本发明方法或雾化器提供的气溶胶包含如下颗粒,这些颗粒具有适合于组合物主要在周围肺区(包括细支气管和肺泡)的沉积、渗透或保留的表面张力。在某些实施例中,由本发明方法或雾化器提供的气溶胶包含与水相似或更高的表面张力的范围的颗粒。在某些实施例中,由本发明方法或雾化器提供的气溶胶包含如下颗粒,这些颗粒具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。在一些实施例中,由本发明方法或雾化器提供的气溶胶包含如下颗粒,这些颗粒具有范围为约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的表面张力。本披露提供了药学上可接受的溶液,其包含从约1%至约10%(按重量计)的色甘酸钠、渗透剂,其中渗透剂由氯化钠组成,其中从该药学上可接受的溶液中产生的气溶胶适合患有由特发性肺纤维化引起的慢性咳嗽的受试者吸入。在某些实施例中,该气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm)。在某些实施例中,该气溶胶具有如通过usp<1601>测量的至少约30%的可吸入级分(≤3.3μm)和如通过usp<1601>测量的至少约75%的可吸入级分(≤5μm)。在某些实施例中,该药学上可接受的溶液包含约1%、或约2%、或约3%、或约4%、或约5%、或约6%、或约7%、或约8%、或约9%、或约10%(按重量计)的色甘酸钠。在某些实施例中,该渗透剂包含离子渗透剂并且不包括任何非离子渗透剂。在某些实施例中,该渗透剂由氯化钠组成。在某些实施例中,该溶液的同渗重摩在约100mosm/kg与约175mosm/kg之间、或在约100mosm/kg与约170mosm/kg之间、或在约100mosm/kg与约165mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约115mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约130mosm/kg之间。在某些实施例中,该溶液的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在某些实施例中,本披露的药学上可接受的溶液可以排除或可以不包含表面活性剂。在某些实施例中,本披露的药学上可接受的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,从本发明的药学上可接受的溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,该药学上可接受的溶液具有适合于组合物主要在周围肺区(包括细支气管和肺泡)的沉积、渗透或保留的表面张力。在某些实施例中,药学上可接受的溶液的表面张力的范围可与水的相似或更高。该药学上可接受的溶液具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。该药学上可接受的溶液具有范围为约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的表面张力。本披露提供了本文所披露的方法或药学上可接受的溶液的任一项,其中该药学上可接受的溶液具有小于约250mosm/kg、或小于约225mosm/kg、或小于约200mosm/kg、或小于约190mosm/kg、或小于约180mosm/kg、或小于约175mosm/kg、或小于约170mosm/kg、或小于约165mosm/kg、或小于约160mosm/kg、或小于约155mosm/kg、或小于约150mosm/kg、或小于约145mosm/kg、或小于约140mosm/kg、或小于约135mosm/kg、或小于约130mosm/kg、或小于约125mosm/kg、或小于约120mosm/kg、或小于约115mosm/kg、或小于约110mosm/kg、或小于约105mosm/kg、或小于约100mosm/kg的同渗重摩。在某些实施例中,该药学上可接受的溶液具有在约70mosm/kg与约200mosm/kg之间、或在约70mosm/kg与约190mosm/kg之间、或在约70与约180mosm/kg之间、或在约70mosm/kg与约170mosm/kg之间、或在约70mosm/kg与约160mosm/kg之间、或在约70mosm/kg与约150mosm/kg之间、或在约70mosm/kg与约140mosm/kg之间、或在约80mosm/kg与约200mosm/kg之间、或在约80mosm/kg与约190mosm/kg之间、或在约90mosm/kg与约180mosm/kg之间、或在约90mosm/kg与约175mosm/kg之间、或在约90mosm/kg与约170mosm/kg之间、或在约90mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约110mosm/kg与约145mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约110mosm/kg与约135mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间的同渗重摩。在某些实施例中,该药学上可接受的溶液的同渗重摩为约100mosm/kg、或约110mosm/kg、或约115mosm/kg、或约120mosm/kg、或约125mosm/kg、或约130mosm/kg、或约135mosm/kg、或约140mosm/kg、或约145mosm/kg、或约150mosm/kg、或约155mosm/kg、或约160mosm/kg、或约165mosm/kg、或约170mosm/kg、或约175mosm/kg、或约180mosm/kg、或约185mosm/kg、或约190mosm/kg、或约195mosm/kg、或约200mosm/kg。本披露提供本文披露的方法或药学上可接受的溶液中的任何一种,其中该药学上可接受的溶液可以排除或者可以不包含表面活性剂。在某些实施例中,本披露的药学上可接受的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,从本发明的药学上可接受的溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。本披露提供本文披露的方法或药学上可接受的溶液中的任何一种,其中该药学上可接受的溶液具有适合于组合物主要在周围肺区(包括细支气管和肺泡)的沉积、渗透或保留的表面张力。在某些实施例中,药学上可接受的溶液的表面张力的范围可与水的相似或更高。该药学上可接受的溶液具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。在一些实施例中,该药学上可接受的溶液具有范围为约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的表面张力。本披露提供了药学上可接受的溶液,其包含从约2%至约6%(按重量计)的色甘酸钠和同渗容摩调节剂,其中同渗容摩调节剂由氯化钠组成,其中从该药学上可接受的溶液中产生的气溶胶适合有此需要的受试者吸入。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、或至少约80%的rf(≤3.3μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、或至少约35%、或至少约40%、或至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%的rf(≤5μm)。在某些实施例中,本披露的药学上可接受的溶液可以排除或可以不包含表面活性剂。在某些实施例中,本披露的药学上可接受的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,从本发明的药学上可接受的溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,该药学上可接受的溶液具有适合于组合物主要在周围肺区(包括细支气管和肺泡)的沉积、渗透或保留的表面张力。在某些实施例中,药学上可接受的溶液的表面张力的范围可与水的相似或更高。该药学上可接受的溶液具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。该药学上可接受的溶液具有范围为约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的表面张力。本披露提供了药学上可接受的气溶胶,其包含溶液液滴,所述溶液包含从约1%至约10%(按重量计)的色甘酸钠和同渗容摩调节剂,其中同渗容摩调节剂由氯化钠组成。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、或至少约80%的rf(≤3.3μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、或至少约35%、或至少约40%、或至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%的rf(≤5μm)。在某些实施例中,该溶液的同渗重摩在约100mosm/kg与约175mosm/kg之间、或在约100mosm/kg与约170mosm/kg之间、或在约100mosm/kg与约165mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约115mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约130mosm/kg之间。在某些实施例中,该溶液的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在某些实施例中,本披露的药学上可接受的溶液可以排除或可以不包含表面活性剂。在某些实施例中,本披露的药学上可接受的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,从本发明的药学上可接受的溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,药学上可接受的气溶胶的液滴具有适合于组合物主要在周围肺区(包括细支气管和肺泡)的沉积、渗透或保留的表面张力。在某些实施例中,药学上可接受的气溶胶的液滴的表面张力的范围可与水的相似或更高。在某些实施例中,药学上可接受的气溶胶的液滴具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。在一些实施例中,在某些实施例中,药学上可接受的气溶胶的液滴具有范围为约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的表面张力。本披露提供了给予有此需要的受试者治疗有效量的色甘酸钠的方法,该方法包括给予受试者包含从约2%至约6%(按重量计)的色甘酸钠和由氯化钠组成的渗透剂的药物组合物,其中通过以气溶胶形式吸入给予该药物组合物,所述气溶胶呈现如通过usp<1601>测量的至少约60%的rf(≤5μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%的rf(≤3.3μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、或至少约80%的rf(≤3.3μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、或至少约35%、或至少约40%、或至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%的rf(≤5μm)。在某些实施例中,该药物组合物的同渗重摩在约100mosm/kg与约175mosm/kg之间、或在约100mosm/kg与约170mosm/kg之间、或在约100mosm/kg与约165mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约115mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约130mosm/kg之间。在某些实施例中,该药物组合物的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在某些实施例中,本披露的药学上可接受的溶液或组合物可以排除或者可以不包含表面活性剂。在某些实施例中,本披露的药学上可接受的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,从本发明的药学上可接受的溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,药学上可接受的气溶胶的液滴具有适合于组合物主要在周围肺区(包括细支气管和肺泡)的沉积、渗透或保留的表面张力。在某些实施例中,药学上可接受的气溶胶的液滴的表面张力的范围可与水的相似或更高。在某些实施例中,药学上可接受的气溶胶的液滴具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。在一些实施例中,在某些实施例中,药学上可接受的气溶胶的液滴具有范围为约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的表面张力。本披露提供了剂型,该剂型包括:(a)药物组合物,其包含从约2%至约6%(按重量计)的色甘酸钠和同渗容摩调节剂,其中该同渗容摩调节剂由氯化钠组成;以及(b)形成该药物组合物的气溶胶的吸入装置,该气溶胶显示出如通过usp<1601>测量的至少约60%的该药物组合物的可吸入级分(≤5μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%的rf(≤3.3μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、或至少约80%的rf(≤3.3μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、或至少约35%、或至少约40%、或至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%的rf(≤5μm)。在某些实施例中,该药物组合物的同渗重摩在约100mosm/kg与约175mosm/kg之间、或在约100mosm/kg与约170mosm/kg之间、或在约100mosm/kg与约165mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约115mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约130mosm/kg之间。在某些实施例中,该药物组合物的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在某些实施例中,本披露的药学上可接受的剂型可以排除或者可以不包含表面活性剂。在某些实施例中,本披露的药学上可接受的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,从本发明的药学上可接受的溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,药学上可接受的气溶胶的液滴具有适合于组合物主要在周围肺区(包括细支气管和肺泡)的沉积、渗透或保留的表面张力。在某些实施例中,药学上可接受的气溶胶的液滴的表面张力的范围可与水的相似或更高。在某些实施例中,药学上可接受的气溶胶的液滴具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。在一些实施例中,在某些实施例中,药学上可接受的气溶胶的液滴具有范围为约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的表面张力。本披露提供了剂型,该剂型包括:(a)药物组合物,其包含从约2%至约6%(按重量计)的色甘酸钠和同渗容摩调节剂,其中该同渗容摩调节剂由氯化钠组成;以及(b)用于产生该药物组合物的气溶胶的手段,该气溶胶显示出如通过usp<1601>测量的至少约60%的该药物组合物的可吸入级分(≤5μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%的rf(≤3.3μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、或至少约80%的rf(≤3.3μm)。在某些实施例中,该气溶胶呈现如通过usp<1601>测量的至少约30%、或至少约35%、或至少约40%、或至少约45%、或至少约50%、或至少约55%、或至少约60%、或至少约65%、或至少约75%、或至少约80%、或至少约85%、或至少约90%、或至少约95%的rf(≤5μm)。在某些实施例中,该药物组合物的同渗重摩在约100mosm/kg与约175mosm/kg之间、或在约100mosm/kg与约170mosm/kg之间、或在约100mosm/kg与约165mosm/kg之间、或在约100mosm/kg与约160mosm/kg之间、或在约100mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约150mosm/kg之间、或在约110mosm/kg与约140mosm/kg之间、或在约115mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约140mosm/kg之间、或在约120mosm/kg与约130mosm/kg之间。在某些实施例中,该药物组合物的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在某些实施例中,本披露的药学上可接受的剂型可以排除或者可以不包含表面活性剂。在某些实施例中,本披露的药学上可接受的溶液可以不包含任何分散剂、增溶剂、或展开剂。本发明的组合物和配制品中排除的表面活性剂的一些实例包括:peg(聚乙二醇)400;可在商品名(20-40-60等)下获得的十二烷基硫酸钠、山梨聚糖月桂酸酯、山梨聚糖棕榈酸酯、山梨聚糖硬脂酸酯;可在商品名tween(聚山梨酸酯,20-40-60等)下获得的聚氧乙烯(20)山梨聚糖单月桂酸酯、聚氧乙烯(20)山梨聚糖单棕榈酸酯、聚氧乙烯(20)山梨聚糖单硬脂酸酯;泰洛沙泊;丙二醇;和苯扎氯铵、维生素-tpgs和卵磷脂、(glaxosmithkline)、表面活性蛋白。在某些实施例中,从本发明的药学上可接受的溶液中排除的表面活性剂包括任何降低组合物表面张力的化合物或试剂。在某些实施例中,药学上可接受的气溶胶的液滴具有适合于组合物主要在周围肺区(包括细支气管和肺泡)的沉积、渗透或保留的表面张力。在某些实施例中,药学上可接受的气溶胶的液滴的表面张力的范围可与水的相似或更高。在某些实施例中,药学上可接受的气溶胶的液滴具有至少约30mn/m、或至少约40mn/m、或至少约50mn/m、或至少约60mn/m、或至少约70mn/m的表面张力。在一些实施例中,在某些实施例中,药学上可接受的气溶胶的液滴具有范围为约30mn/m至约75mn/m、或约50mn/m至约75mn/m、或约70mn/m至约75mn/m的表面张力。在某些实施例中,在本文披露的方法中雾化器的使用提供了使用常规吸入装置可达到的rddr的至少约2倍、至少约3倍或至少约4倍的rddr。例如,当色甘酸或其药学上可接受的盐是色甘酸钠时,在某些实施例中,rddr是至少约5mg/min、至少约10mg/min、至少约15mg/min、至少约20mg/min、至少约25mg/min、至少约30mg/min、至少约35mg/min、至少约40mg/min、至少约45mg/min、至少约50mg/min、至少约55mg/min、或至少约60mg/min。在某些实施例中,在本文披露的方法中使用雾化器给予色甘酸或其药学上可接受的盐提供了射出的液滴大小分布的gsd为约1.1至约2.1、约1.2至约2.0、约1.3至约1.9、小于约2、至少约1.4至约1.8、至少约1.5至约1.7、约1.4、约1.5、约1.6、或约1.7。在某些实施例中,在本文披露的方法中使用雾化器给予色甘酸或其药学上可接受的盐提供了液滴大小的mmad为约1μm至约5μm、约2至约4μm、约3至约4μm、约3.5至约4.5μm、或约3.5μm。在一些具体实施例中,在本文披露的方法中给予色甘酸或其药学上可接受的盐提供了具有具体mmad和gsd的组合的液滴,例如:mmad为小于约5μm且gsd为约1.1至约2.1;mmad为小于约4.5μm且gsd为约1.1至约2.1;mmad为约1μm至约5μm且gsd为约1.1至约2.1;mmad为约1.5至约4.5μm且gsd为约1.1至约2.1;mmad为小于约5μm且gsd为约1.1至约2.0;mmad为小于约4.5μm且gsd为约1.1至约2.0;mmad为约1μm至约5μm且gsd为约1.1至约2.0;mmad为约1.5至约4.5μm且gsd为约1.1至约2.0;mmad为小于约5μm且gsd为约1.1至约1.9;mmad为小于约4.5μm且gsd为约1.1至约1.9;mmad为约1μm至约5f.m并且gsd为约1.1至约1.9;mmad为约1.5至约4.5μm且gsd为约1.1至约1.9;mmad为小于约5μm且gsd为约1.1至约1.8;mmad为小于约4.5μm且gsd为约1.1至约1.8;mmad为约1μm至约5μm且gsd为约1.1至约1.8;mmad为约1.5至约4.5μm且gsd为约1.1至约1.8;mmad为约3.5μm或更低且gsd为约1.7;mmad为约4.1μm或更低且gsd为约1.7;mmad为约3.5μm且gsd为约1.7;或mmad为约4.1μm且gsd为约1.7。在某些实施例中,使用雾化器给予的色甘酸或其药学上可接受的盐气溶胶的中值粒径在约1μm与约6μm之间、在约2μm与约5μm之间、在约3μm与约5μm之间、在约3μm与约4μm之间、约1μm、约2μm、约3μm、约4μm、约5μm、或约6μm。在某些实施例中,使用雾化器给予的色甘酸钠气溶胶的中值粒径在约1μm与约6μm之间、在约2μm与约5μm之间、在约3μm与约5μm之间、在约3μm与约4μm之间、约1μm、约2μm、约3μm、约4μm、约5μm、或约6μm。吸入配制品在本文披露的某些实施例中,提供了包含从约2%至约10%(按重量计)色甘酸钠和由氯化钠组成的渗透剂的配制品,其中当储存于25℃持续至少4周、或至少6周、或至少8周、或至少10周、或至少12周、或至少6个月、或至少8个月、或至少10个月、或至少12个月、或至少14个月、或至少16个月、或至少18个月、或至少20个月、或至少24个月时该配制品是稳定的。在某些实施例中,当储存于25℃持续这些相同的时间时,该配制品保持是澄清的溶液。在某些实施例中,当储存于25℃持续这些相同的时间时,该配制品呈现小于1%(按重量计)的总杂质。在某些实施例中,该配制品包含约4%(按重量计)的色甘酸钠。在某些实施例中,该配制品包含约6%(按重量计)的色甘酸钠。在某些实施例中,该配制品的同渗重摩在约100mosm/kg和约175mosm/kg之间、或在约100mosm/kg和约170mosm/kg之间、或在约100mosm/kg和约165mosm/kg之间、或在约100mosm/kg和约160mosm/kg之间、或在约100mosm/kg和约150mosm/kg之间、或在约110mosm/kg和约150mosm/kg之间、或在约110mosm/kg和约140mosm/kg之间、或在约115mosm/kg和约140mosm/kg之间、或在约120mosm/kg和约140mosm/kg之间、或在约120mosm/kg和约130mosm/kg之间。在某些实施例中,该配制品的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在本文披露的某些实施例中,提供了包含从约2%至约10%(按重量计)色甘酸钠和由氯化钠组成的渗透剂的配制品,其中当储存于40℃持续至少4周、或至少6周、或至少8周、或至少10周、或至少12周、或至少6个月、或至少8个月、或至少10个月、或至少12个月、或至少14个月、或至少16个月、或至少18个月、或至少20个月、或至少24个月时该配制品是稳定的。在某些实施例中,当储存于40℃持续这些相同的时间时,该配制品保持是澄清的溶液。在某些实施例中,当储存于40℃持续这些相同的时间时,该配制品呈现小于1%(按重量计)的总杂质。在某些实施例中,该配制品包含约4%(按重量计)的色甘酸钠。在某些实施例中,该配制品包含约6%(按重量计)的色甘酸钠。在某些实施例中,该配制品的同渗重摩在约100mosm/kg和约175mosm/kg之间、或在约100mosm/kg和约170mosm/kg之间、或在约100mosm/kg和约165mosm/kg之间、或在约100mosm/kg和约160mosm/kg之间、或在约100mosm/kg和约150mosm/kg之间、或在约110mosm/kg和约150mosm/kg之间、或在约110mosm/kg和约140mosm/kg之间、或在约115mosm/kg和约140mosm/kg之间、或在约120mosm/kg和约140mosm/kg之间、或在约120mosm/kg和约130mosm/kg之间。在某些实施例中,该配制品的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在本文披露的方法的某些实施例中,将吸入配制品通过吸入装置例如雾化器给予,以提供全身有效量的色甘酸或其药学上可接受的盐,用于治疗由ipf引起的慢性咳嗽。在某些实施例中,本文披露的方法包括使用吸入装置(如雾化器)给予受试者水性吸入溶液中的标称剂量的色甘酸或其药学上可接受的盐。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约100ng*hr/ml、大于约110ng*hr/ml、大于约120ng*hr/ml、大于约130ng*hr/ml、大于约140ng*hr/ml、大于约150ng*hr/ml、大于约160ng*hr/ml、大于约170ng*hr/ml、大于约180ng*hr/ml、大于约190ng*hr/ml、大于约200ng*hr/ml、大于约225ng*hr/ml、大于约250ng*hr/ml、大于约275ng*hr/ml、大于约300ng*hr/ml、大于约325ng*hr/ml、大于约350ng*hr/ml、大于约375ng*hr/ml、大于约400ng*hr/ml、大于约425ng*hr/ml、大于约450ng*hr/ml、大于约475ng*hr/ml、大于约500ng*hr/ml、大于约525ng*hr/ml、大于约550ng*hr/ml、大于约575ng*hr/ml、大于约600ng*hr/ml、大于约625ng*hr/ml、大于约650ng*hr/ml、大于约675ng*hr/ml、大于约700ng*hr/ml、大于约725ng*hr/ml、大于约750ng*hr/ml、大于约775ng*hr/ml、大于约800ng*hr/ml、大于约825ng*hr/ml、大于约850ng*hr/ml、大于约875ng*hr/ml、大于约900ng*hr/ml、大于约925ng*hr/ml、大于约950ng*hr/ml、大于约975ng*hr/ml、或大于约1000ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约100ng*hr/ml、大于约110ng*hr/ml、大于约120ng*hr/ml、大于约130ng*hr/ml、大于约140ng*hr/ml、大于约150ng*hr/ml、大于约160ng*hr/ml、大于约170ng*hr/ml、大于约180ng*hr/ml、大于约190ng*hr/ml、大于约200ng*hr/ml、大于约225ng*hr/ml、大于约250ng*hr/ml、大于约275ng*hr/ml、大于约300ng*hr/ml、大于约325ng*hr/ml、大于约350ng*hr/ml、大于约375ng*hr/ml、大于约400ng*hr/ml、大于约425ng*hr/ml、大于约450ng*hr/ml、大于约475ng*hr/ml、大于约500ng*hr/ml、大于约525ng*hr/ml、大于约550ng*hr/ml、大于约575ng*hr/ml、大于约600ng*hr/ml、大于约625ng*hr/ml、大于约650ng*hr/ml、大于约675ng*hr/ml、大于约700ng*hr/ml、大于约725ng*hr/ml、大于约750ng*hr/ml、大于约775ng*hr/ml、大于约800ng*hr/ml、大于约825ng*hr/ml、大于约850ng*hr/ml、大于约875ng*hr/ml、大于约900ng*hr/ml、大于约925ng*hr/ml、大于约950ng*hr/ml、大于约975ng*hr/ml、或大于约1000ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)为约100ng*hr/ml、约110ng*hr/ml、约120ng*hr/ml、约130ng*hr/ml、约140ng*hr/ml、约150ng*hr/ml、约160ng*hr/ml、约170ng*hr/ml、约180ng*hr/ml、约190ng*hr/ml、约200ng*hr/ml、约225ng*hr/ml、约250ng*hr/ml、约275ng*hr/ml、约300ng*hr/ml、约325ng*hr/ml、约350ng*hr/ml、约375ng*hr/ml、约400ng*hr/ml、约425ng*hr/ml、约450ng*hr/ml、约475ng*hr/ml、约500ng*hr/ml、约525ng*hr/ml、约550ng*hr/ml、约575ng*hr/ml、约600ng*hr/ml、约625ng*hr/ml、约650ng*hr/ml、约675ng*hr/ml、约700ng*hr/ml、约725ng*hr/ml、约750ng*hr/ml、约775ng*hr/ml、约800ng*hr/ml、约825ng*hr/ml、约850ng*hr/ml、约875ng*hr/ml、约900ng*hr/ml、约925ng*hr/ml、约950ng*hr/ml、约975ng*hr/ml、或约1000ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)为约100ng*hr/ml、约110ng*hr/ml、约120ng*hr/ml、约130ng*hr/ml、约140ng*hr/ml、约150ng*hr/ml、约160ng*hr/ml、约170ng*hr/ml、约180ng*hr/ml、约190ng*hr/ml、约200ng*hr/ml、约225ng*hr/ml、约250ng*hr/ml、约275ng*hr/ml、约300ng*hr/ml、约325ng*hr/ml、约350ng*hr/ml、约375ng*hr/ml、约400ng*hr/ml、约425ng*hr/ml、约450ng*hr/ml、约475ng*hr/ml、约500ng*hr/ml、约525ng*hr/ml、约550ng*hr/ml、约575ng*hr/ml、约600ng*hr/ml、约625ng*hr/ml、约650ng*hr/ml、约675ng*hr/ml、约700ng*hr/ml、约725ng*hr/ml、约750ng*hr/ml、约775ng*hr/ml、约800ng*hr/ml、约825ng*hr/ml、约850ng*hr/ml、约875ng*hr/ml、约900ng*hr/ml、约925ng*hr/ml、约950ng*hr/ml、约975ng*hr/ml、或约1000ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的auc(0-∞)大于约100ng*hr/ml、大于约110ng*hr/ml、大于约120ng*hr/ml、大于约130ng*hr/ml、大于约140ng*hr/ml、大于约150ng*hr/ml、大于约160ng*hr/ml、大于约170ng*hr/ml、大于约180ng*hr/ml、大于约190ng*hr/ml、大于约200ng*hr/ml、大于约225ng*hr/ml、大于约250ng*hr/ml、大于约275ng*hr/ml、大于约300ng*hr/ml、大于约325ng*hr/ml、大于约350ng*hr/ml、大于约375ng*hr/ml、大于约400ng*hr/ml、大于约425ng*hr/ml、大于约450ng*hr/ml、大于约475ng*hr/ml、大于约500ng*hr/ml、大于约525ng*hr/ml、大于约550ng*hr/ml、大于约575ng*hr/ml、大于约600ng*hr/ml、大于约625ng*hr/ml、大于约650ng*hr/ml、大于约675ng*hr/ml、大于约700ng*hr/ml、大于约725ng*hr/ml、大于约750ng*hr/ml、大于约775ng*hr/ml、大于约800ng*hr/ml、大于约825ng*hr/ml、大于约850ng*hr/ml、大于约875ng*hr/ml、大于约900ng*hr/ml、大于约925ng*hr/ml、大于约950ng*hr/ml、大于约975ng*hr/ml、或大于约1000ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的auc(0-∞)大于约100ng*hr/ml、大于约110ng*hr/ml、大于约120ng*hr/ml、大于约130ng*hr/ml、大于约140ng*hr/ml、大于约150ng*hr/ml、大于约160ng*hr/ml、大于约170ng*hr/ml、大于约180ng*hr/ml、大于约190ng*hr/ml、大于约200ng*hr/ml、大于约225ng*hr/ml、大于约250ng*hr/ml、大于约275ng*hr/ml、大于约300ng*hr/ml、大于约325ng*hr/ml、大于约350ng*hr/ml、大于约375ng*hr/ml、大于约400ng*hr/ml、大于约425ng*hr/ml、大于约450ng*hr/ml、大于约475ng*hr/ml、大于约500ng*hr/ml、大于约525ng*hr/ml、大于约550ng*hr/ml、大于约575ng*hr/ml、大于约600ng*hr/ml、大于约625ng*hr/ml、大于约650ng*hr/ml、大于约675ng*hr/ml、大于约700ng*hr/ml、大于约725ng*hr/ml、大于约750ng*hr/ml、大于约775ng*hr/ml、大于约800ng*hr/ml、大于约825ng*hr/ml、大于约850ng*hr/ml、大于约875ng*hr/ml、大于约900ng*hr/ml、大于约925ng*hr/ml、大于约950ng*hr/ml、大于约975ng*hr/ml、或大于约1000ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的auc(0-∞)为约100ng*hr/ml、约110ng*hr/ml、约120ng*hr/ml、约130ng*hr/ml、约140ng*hr/ml、约150ng*hr/ml、约160ng*hr/ml、约170ng*hr/ml、约180ng*hr/ml、约190ng*hr/ml、约200ng*hr/ml、约225ng*hr/ml、约250ng*hr/ml、约275ng*hr/ml、约300ng*hr/ml、约325ng*hr/ml、约350ng*hr/ml、约375ng*hr/ml、约400ng*hr/ml、约425ng*hr/ml、约450ng*hr/ml、约475ng*hr/ml、约500ng*hr/ml、约525ng*hr/ml、约550ng*hr/ml、约575ng*hr/ml、约600ng*hr/ml、约625ng*hr/ml、约650ng*hr/ml、约675ng*hr/ml、约700ng*hr/ml、约725ng*hr/ml、约750ng*hr/ml、约775ng*hr/ml、约800ng*hr/ml、约825ng*hr/ml、约850ng*hr/ml、约875ng*hr/ml、约900ng*hr/ml、约925ng*hr/ml、约950ng*hr/ml、约975ng*hr/ml、或约1000ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的auc(0-∞)为约100ng*hr/ml、约110ng*hr/ml、约120ng*hr/ml、约130ng*hr/ml、约140ng*hr/ml、约150ng*hr/ml、约160ng*hr/ml、约170ng*hr/ml、约180ng*hr/ml、约190ng*hr/ml、约200ng*hr/ml、约225ng*hr/ml、约250ng*hr/ml、约275ng*hr/ml、约300ng*hr/ml、约325ng*hr/ml、约350ng*hr/ml、约375ng*hr/ml、约400ng*hr/ml、约425ng*hr/ml、约450ng*hr/ml、约475ng*hr/ml、约500ng*hr/ml、约525ng*hr/ml、约550ng*hr/ml、约575ng*hr/ml、约600ng*hr/ml、约625ng*hr/ml、约650ng*hr/ml、约675ng*hr/ml、约700ng*hr/ml、约725ng*hr/ml、约750ng*hr/ml、约775ng*hr/ml、约800ng*hr/ml、约825ng*hr/ml、约850ng*hr/ml、约875ng*hr/ml、约900ng*hr/ml、约925ng*hr/ml、约950ng*hr/ml、约975ng*hr/ml、或约1000ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的cmax大于约40ng/ml、大于约50ng/ml、大于约60ng/ml、大于约70ng/ml、大于约80ng/ml、大于约90ng/ml、大于约100ng/ml、大于约110ng/ml、大于约120ng/ml、大于约130ng/ml、大于约140ng/ml、大于约150ng/ml、大于约160ng/ml、大于约170ng/ml、大于约180ng/ml、大于约190ng/ml、大于约200ng/ml、大于约210ng/ml、大于约220ng/ml、大于约230ng/ml、大于约240ng/ml、大于约250ng/ml、大于约260ng/ml、大于约270ng/ml、大于约280ng/ml、大于约290ng/ml、大于约300ng/ml、大于约310ng/ml、大于约320ng/ml、大于约330ng/ml、大于约340ng/ml、大于约350ng/ml、大于约360ng/ml、大于约370ng/ml、大于约380ng/ml、大于约390ng/ml、或大于约400ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的cmax大于约40ng/ml、大于约50ng/ml、大于约60ng/ml、大于约70ng/ml、大于约80ng/ml、大于约90ng/ml、大于约100ng/ml、大于约110ng/ml、大于约120ng/ml、大于约130ng/ml、大于约140ng/ml、大于约150ng/ml、大于约160ng/ml、大于约170ng/ml、大于约180ng/ml、大于约190ng/ml、大于约200ng/ml、大于约210ng/ml、大于约220ng/ml、大于约230ng/ml、大于约240ng/ml、大于约250ng/ml、大于约260ng/ml、大于约270ng/ml、大于约280ng/ml、大于约290ng/ml、大于约300ng/ml、大于约310ng/ml、大于约320ng/ml、大于约330ng/ml、大于约340ng/ml、大于约350ng/ml、大于约360ng/ml、大于约370ng/ml、大于约380ng/ml、大于约390ng/ml、或大于约400ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的cmax为约50mg/ml、约60ng/ml、约70ng/ml、约80ng/ml、约90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml、约200ng/ml、约210ng/ml、约220ng/ml、约230ng/ml、约240ng/ml、约250ng/ml、约260ng/ml、约270ng/ml、约280ng/ml、约290ng/ml、约300ng/ml、约310ng/ml、约320ng/ml、约330ng/ml、约340ng/ml、约350ng/ml、约360ng/ml、约370ng/ml、约380ng/ml、约390ng/ml、或约400ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸或其药学上可接受的盐的cmax为约50mg/ml、约60ng/ml、约70ng/ml、约80ng/ml、约90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml、约200ng/ml、约210ng/ml、约220ng/ml、约230ng/ml、约240ng/ml、约250ng/ml、约260ng/ml、约270ng/ml、约280ng/ml、约290ng/ml、约300ng/ml、约310ng/ml、约320ng/ml、约330ng/ml、约340ng/ml、约350ng/ml、约360ng/ml、约370ng/ml、约380ng/ml、约390ng/ml、或约400ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸钠的盐的cmax大于约40ng/ml、大于约50ng/ml、大于约60ng/ml、大于约70ng/ml、大于约80ng/ml、大于约90ng/ml、大于约100ng/ml、大于约110ng/ml、大于约120ng/ml、大于约130ng/ml、大于约140ng/ml、大于约150ng/ml、大于约160ng/ml、大于约170ng/ml、大于约180ng/ml、大于约190ng/ml、大于约200ng/ml、大于约210ng/ml、大于约220ng/ml、大于约230ng/ml、大于约240ng/ml、大于约250ng/ml、大于约260ng/ml、大于约270ng/ml、大于约280ng/ml、大于约290ng/ml、大于约300ng/ml、大于约310ng/ml、大于约320ng/ml、大于约330ng/ml、大于约340ng/ml、大于约350ng/ml、大于约360ng/ml、大于约370ng/ml、大于约380ng/ml、大于约390ng/ml、或大于约400ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者或受试者该配制品后在受试者中产生的色甘酸钠的盐的cmax大于约40ng/ml、大于约50ng/ml、大于约60ng/ml、大于约70ng/ml、大于约80ng/ml、大于约90ng/ml、大于约100ng/ml、大于约110ng/ml、大于约120ng/ml、大于约130ng/ml、大于约140ng/ml、大于约150ng/ml、大于约160ng/ml、大于约170ng/ml、大于约180ng/ml、大于约190ng/ml、大于约200ng/ml、大于约210ng/ml、大于约220ng/ml、大于约230ng/ml、大于约240ng/ml、大于约250ng/ml、大于约260ng/ml、大于约270ng/ml、大于约280ng/ml、大于约290ng/ml、大于约300ng/ml、大于约310ng/ml、大于约320ng/ml、大于约330ng/ml、大于约340ng/ml、大于约350ng/ml、大于约360ng/ml、大于约370ng/ml、大于约380ng/ml、大于约390ng/ml、或大于约400ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的cmax为约50mg/ml、约60ng/ml、约70ng/ml、约80ng/ml、约90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml、约200ng/ml、约210ng/ml、约220ng/ml、约230ng/ml、约240ng/ml、约250ng/ml、约260ng/ml、约270ng/ml、约280ng/ml、约290ng/ml、约300ng/ml、约310ng/ml、约320ng/ml、约330ng/ml、约340ng/ml、约350ng/ml、约360ng/ml、约370ng/ml、约380ng/ml、约390ng/ml、或约400ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品在给予受试者该配制品后在受试者中产生的色甘酸钠的cmax为约50mg/ml、约60ng/ml、约70ng/ml、约80ng/ml、约90ng/ml、约100ng/ml、约110ng/ml、约120ng/ml、约130ng/ml、约140ng/ml、约150ng/ml、约160ng/ml、约170ng/ml、约180ng/ml、约190ng/ml、约200ng/ml、约210ng/ml、约220ng/ml、约230ng/ml、约240ng/ml、约250ng/ml、约260ng/ml、约270ng/ml、约280ng/ml、约290ng/ml、约300ng/ml、约310ng/ml、约320ng/ml、约330ng/ml、约340ng/ml、约350ng/ml、约360ng/ml、约370ng/ml、约380ng/ml、约390ng/ml、或约400ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予吸入配制品在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml和/或色甘酸或其药学上可接受的盐的平均cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予吸入配制品在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml和/或色甘酸或其药学上可接受的盐的cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约200ng*hr/ml和色甘酸或其药学上可接受的盐的平均cmax大于约80ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予吸入配制品在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约200ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约80ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予吸入配制品在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约330ng*hr/ml和色甘酸或其药学上可接受的盐的平均cmax大于约150ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予吸入配制品在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约330ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约150ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予吸入配制品在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约525ng*hr/ml和色甘酸或其药学上可接受的盐的平均cmax大于约230ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予吸入配制品在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约525ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约230ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约120ng*hr/ml和/或色甘酸钠的平均cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约120ng*hr/ml和/或色甘酸钠的cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约120ng*hr/ml和色甘酸钠的平均cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约120ng*hr/ml和色甘酸钠的cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约200ng*hr/ml和色甘酸钠的平均cmax大于约80ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约200ng*hr/ml和色甘酸钠的cmax大于约80ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约330ng*hr/ml和色甘酸钠的平均cmax大于约150ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约330ng*hr/ml和色甘酸钠的cmax大于约150ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约525ng*hr/ml和色甘酸钠的平均cmax大于约230ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产的色甘酸钠的auc(0-∞)大于约525ng*hr/ml和色甘酸钠的cmax大于约230ng/ml。在本文披露的方法的某些实施例中,通过吸入装置的手段给予受试者包含约40mg的色甘酸钠或其药学上可接受的盐的配制品在受试者中提供的色甘酸钠的cmax或平均cmax为从约30ng/ml至约120ng/ml、或从约40ng/ml至约120ng/ml、或从约40ng/ml至约110ng/ml。在某些实施例中,通过吸入装置的手段给予受试者包含约40mg的色甘酸钠或其药学上可接受的盐的配制品在受试者中提供的色甘酸钠的auc(0-∞)在约100ng*hr/ml与约350ng*hr/ml之间、或在约100ng*hr/ml与约325ng*hr/ml之间、或在约115ng*hr/ml与约325ng*hr/ml之间、或在约120ng*hr/ml与约320ng*hr/ml之间、或在约125ng*hr/ml与约300ng*hr/ml之间。在某些实施例中,该配制品包含在1%与10%(按重量计)之间的色甘酸钠、或在约4%(按重量计)与6%(按重量计)之间的色甘酸钠。在某些实施例中,该配制品包含4%(按重量计)的色甘酸钠。在某些实施例中,该配制品包含6%(按重量计)的色甘酸钠。在某些实施例中,使用雾化器给予该配制品提供了包含色甘酸或其药学上可接受的盐的配制品的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、或约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、约55%至约90%、约70%至约80%、或约75%的色甘酸或其药学上可接受的盐的rf(≤5μm)。在某些实施例中,在本文披露的方法中雾化器的使用提供了包含色甘酸或其药学上可接受的盐的溶液的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、或约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、约55%至约90%、约70%至约80%、约65%至约75%、约65%至约80%、约60%至约80%、约66%、或约75%的色甘酸钠的rf(≤5μm)。在某些实施例中,该配制品包含渗透剂,所述渗透剂包含氯化钠。在某些实施例中,该配制品包含渗透剂,所述渗透剂由氯化钠组成。在某些实施例中,该配制品的同渗重摩在约100mosm/kg和约175mosm/kg之间、或在约100mosm/kg和约170mosm/kg之间、或在约100mosm/kg和约165mosm/kg之间、或在约100mosm/kg和约160mosm/kg之间、或在约100mosm/kg和约150mosm/kg之间、或在约110mosm/kg和约150mosm/kg之间、或在约110mosm/kg和约140mosm/kg之间、或在约115mosm/kg和约140mosm/kg之间、或在约120mosm/kg和约140mosm/kg之间、或在约120mosm/kg和约130mosm/kg之间。在某些实施例中,该配制品的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在本文披露的方法的某些实施例中,通过吸入装置的手段给予受试者包含约60mg的色甘酸钠或其药学上可接受的盐的配制品在受试者中提供的色甘酸钠的cmax或平均cmax从约50ng/ml至约175ng/ml、或从约60ng/ml至约175ng/ml、或从约60ng/ml至约170ng/ml、或从约60ng/ml至约165ng/ml、或从约70ng/ml至约165ng/ml。在某些实施例中,通过吸入装置的手段给予受试者包含约60mg的色甘酸钠或其药学上可接受的盐的配制品在受试者中提供的色甘酸钠的auc(0-∞)在约200ng*hr/ml与约600ng*hr/ml之间、或在约200ng*hr/ml与约575ng*hr/ml之间、或在约200ng*hr/ml与约550ng*hr/ml之间、或在约200ng*hr/ml与约525ng*hr/ml之间、或在约210ng*hr/ml与约525ng*hr/ml之间、或在约215ng*hr/ml与约515ng*hr/ml之间、或在约175ng*hr/ml与约500ng*hr/ml之间、或在约195ng*hr/ml与约515ng*hr/ml之间、或在约200ng*hr/ml与约500ng*hr/ml之间。在某些实施例中,该配制品包含在1%与10%(按重量计)之间的色甘酸钠、或在约4%(按重量计)与6%(按重量计)之间的色甘酸钠。在某些实施例中,该配制品包含4%(按重量计)的色甘酸钠。在某些实施例中,该配制品包含6%(按重量计)的色甘酸钠。在某些实施例中,使用雾化器给予该配制品提供包含色甘酸或其药学上可接受的盐的配制品的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、或约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、约55%至约90%、约70%至约80%、或约75%的色甘酸或其药学上可接受的盐的rf(≤5μm)。在某些实施例中,在本文披露的方法中雾化器的使用提供了包含色甘酸或其药学上可接受的盐的溶液的气溶胶,其中该气溶胶呈现至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、约20%至约95%、约35%至约90%、或约40%至约80%、约40%至约90%、约40%至约95%、约45%至约90%、约45%至约95%、约50%至约90%、约65%至约90%、约60%至约95%、约65%至约95%、约70%至约90%、约55%至约90%、约70%至约80%、约65%至约75%、约65%至约80%、约60%至约80%、约66%、或约75%的色甘酸钠的rf(≤5μm)。在某些实施例中,该配制品包含渗透剂,所述渗透剂包含氯化钠。在某些实施例中,该配制品包含渗透剂,所述渗透剂由氯化钠组成。在某些实施例中,该配制品的同渗重摩在约100mosm/kg和约175mosm/kg之间、或在约100mosm/kg和约170mosm/kg之间、或在约100mosm/kg和约165mosm/kg之间、或在约100mosm/kg和约160mosm/kg之间、或在约100mosm/kg和约150mosm/kg之间、或在约110mosm/kg和约150mosm/kg之间、或在约110mosm/kg和约140mosm/kg之间、或在约115mosm/kg和约140mosm/kg之间、或在约120mosm/kg和约140mosm/kg之间、或在约120mosm/kg和约130mosm/kg之间。在某些实施例中,该配制品的同渗重摩为约120mosm/kg、约125mosm/kg、约130mosm/kg、约135mosm/kg、约140mosm/kg、约145mosm/kg、或约150mosm/kg。在本文披露的方法的某些实施例中,当用吸入装置给予40mg标称剂量的色甘酸钠时,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约330ng*hr/ml和色甘酸钠的平均cmax为约150ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予40mg标称剂量的色甘酸钠时,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约330ng*hr/ml和色甘酸钠的cmax为约150ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予80mg标称剂量的色甘酸钠时,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约525ng*hr/ml和色甘酸钠的平均cmax为约230ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予80mg标称剂量的色甘酸钠时,用吸入装置(例如雾化器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约525ng*hr/ml和色甘酸钠的cmax为约230ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予40mg标称剂量的色甘酸钠时,用吸入装置(例如喷雾器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约180ng*hr/ml至约220ng*hr/ml和色甘酸钠的平均cmax为约70ng/ml至约90ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予40mg标称剂量的色甘酸钠时,用吸入装置(例如喷雾器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约180ng*hr/ml至约220ng*hr/ml和色甘酸钠的cmax为约70ng/ml至约90ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予40mg标称剂量的色甘酸钠时,用吸入装置(例如喷雾器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约300ng*hr/ml至约360ng*hr/ml和色甘酸钠的平均cmax为约135ng/ml至约165ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予40mg标称剂量的色甘酸钠时,用吸入装置(例如喷雾器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约300ng*hr/ml至约360ng*hr/ml和色甘酸钠的cmax为约135ng/ml至约165ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予80mg标称剂量的色甘酸钠时,用吸入装置(例如喷雾器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约475ng*hr/ml至约575ng*hr/ml和色甘酸钠的平均cmax为约200ng/ml至约260ng/ml。在本文披露的方法的某些实施例中,当用吸入装置给予80mg标称剂量的色甘酸钠时,用吸入装置(例如喷雾器)给予的吸入配制品在受试者中产生的色甘酸钠的auc(0-∞)为约475ng*hr/ml至约575ng*hr/ml和色甘酸钠的cmax为约200ng/ml至约260ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了包含色甘酸或其药学上可接受的盐的肺沉积(肺沉积剂量)为至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、约20%至约40%、约25%至约35%、约25%至约30%、约25%至约75%、约30%至约50%、约35%至约90%、约40%至约80%、约40%至约60%、约50%至约60%、约50%至约70%、或约60%至约75%(基于色甘酸或其药学上可接受的盐的标称剂量)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了包含色甘酸钠沉积(肺沉积剂量)为至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、约20%至约40%、约25%至约35%、约25%至约30%、约25%至约75%、约30%至约50%、约35%至约90%、约40%至约80%、约40%至约60%、约50%至约60%、约50%至约70%、或约60%至约75%(基于色甘酸钠的标称剂量)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了包含色甘酸或其药学上可接受的盐的肺沉积(肺沉积剂量)为约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、或约100%(基于色甘酸或其药学上可接受的盐的标称剂量)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了色甘酸钠肺沉积(肺沉积剂量)为约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、或约100%(基于色甘酸钠的标称剂量)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了包含色甘酸或其药学上可接受的盐的肺沉积(肺沉积剂量)为大于约0.5mg、大于约1mg、大于约1.5mg、大于约2mg、大于约2.5mg、大于约3mg、大于约3.5mg、大于约4mg、大于约5mg、大于约6mg、大于约7mg、大于约8mg、大于约9mg、大于约10mg、大于约11mg、大于约12mg、大于约13mg、大于约14mg、或大于约15mg。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了包含色甘酸或其药学上可接受的盐的肺沉积(肺沉积剂量)为约0.5mg、约1.0mg、约1.5mg、约2.0mg、约2.5mg、约3.0mg、约3.5mg、约4.0mg、约5.0mg、约6.0mg、约7.0mg、约8.0mg、约9.0mg、约10mg、约11mg、约12mg、约13mg、约14mg、或约15mg。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了色甘酸钠肺沉积(肺沉积剂量)为大于约0.5mg、大于约1mg、大于约1.5mg、大于约2mg、大于约2.5mg、大于约3mg、大于约3.5mg、大于约4mg、大于约5mg、大于约6mg、大于约7mg、大于约8mg、大于约9mg、大于约10mg、大于约11mg、大于约12mg、大于约13mg、大于约14mg、或大于约15mg。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了色甘酸钠的肺沉积(肺沉积剂量)为约0.5mg、约1.0mg、约1.5mg、约2.0mg、约2.5mg、约3.0mg、约3.5mg、约4.0mg、约5.0mg、约6.0mg、约7.0mg、约8.0mg、约9.0mg、约10mg、约11mg、约12mg、约13mg、约14mg、或约15mg。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予含有色甘酸或其药学上可接受的盐的吸入配制品,给予的量为小于约1mg/剂量、约1mg/剂量至约100mg/剂量、约5mg/剂量至约80mg/剂量、约20mg/剂量至约60mg/剂量、约30mg/剂量至约50mg/剂量、或大于100mg/剂量。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予含有色甘酸钠的吸入配制品,给予的量为小于约1mg/剂量、约1mg/剂量至约100mg/剂量、约5mg/剂量至约80mg/剂量、约20mg/剂量至约60mg/剂量、约30mg/剂量至约50mg/剂量、或大于100mg/剂量。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)以吸入配制品以约1mg、约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg剂量s、约135mg、约140mg、约145mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、或约1000mg剂量给予色甘酸或其药学上可接受的盐。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)以吸入配制品以约1mg、约5mg、约10mg、约15mg、约20mg、约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约105mg、约110mg、约115mg、约120mg、约125mg、约130mg剂量s、约135mg、约140mg、约145mg、约150mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg、约600mg、约650mg、约700mg、约750mg、约800mg、约850mg、约900mg、约950mg、或约1000mg剂量给予色甘酸钠。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%、大于约6%、大于约7%、大于约8%、大于约9%、大于约10%、大于约11%、大于约12%、大于约13%、大于约14%、大于约15%、大于约16%、大于约17%、大于约18%、大于约19%、大于约20%、大于约25%、大于约30%、大于约35%、大于约40%、大于约45%、大于约50%、大于约55%、或大于约60%的标称剂量的色甘酸或其药学上可接受的盐的生物利用度。在某些实施例中,在本文披露的方法中,使用吸入装置(如雾化器)给予吸入配制品提供了约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、或约60%的标称剂量的色甘酸或其药学上可接受的盐的生物利用度。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%、大于约6%、大于约7%、大于约8%、大于约9%、大于约10%、大于约11%、大于约12%、大于约13%、大于约14%、大于约15%、大于约16%、大于约17%、大于约18%、大于约19%、大于约20%、大于约25%、大于约30%、大于约35%、大于约40%、大于约45%或大于约50%的标称剂量的色甘酸钠的生物利用度。在某些实施例中,在本文披露的方法中,使用吸入装置(如雾化器)给予水性吸入配制品提供了约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约25%、约30%、约35%、约40%、约45%、或约50%的标称剂量的色甘酸钠的生物利用度。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml和/或色甘酸或其药学上可接受的盐的平均cmax大于约55ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml和/或色甘酸或其药学上可接受的盐的cmax大于约55ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml和色甘酸或其药学上可接受的盐的平均cmax大于约55ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约55ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约200ng*hr/ml和色甘酸或其药学上可接受的盐的平均cmax大于约80ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约200ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约80ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约330ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约150ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约330ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约150ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约525ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约230ng/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约525ng*hr/ml和色甘酸或其药学上可接受的盐的cmax大于约230ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约120ng*hr/ml和/或色甘酸钠的平均cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约120ng*hr/ml和/或色甘酸钠的cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约120ng*hr/ml和色甘酸钠的平均cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约120ng*hr/ml和色甘酸钠的cmax大于约55ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml和色甘酸钠的平均cmax大于约80ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml和色甘酸钠的cmax大于约80ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml和色甘酸钠的平均cmax大于约150ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml和色甘酸钠的cmax大于约150ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml和色甘酸钠的平均cmax大于约230ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml和色甘酸钠的cmax大于约230ng/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如喷雾器)给予的吸入配制品提供了大于约5%的色甘酸或其药学上可接受的盐的生物利用度并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约120ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约120ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的包含40mg的色甘酸钠的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的包含40mg的色甘酸钠的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的包含40mg的色甘酸钠的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的包含40mg的色甘酸钠的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的包含80mg的色甘酸钠的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,用吸入装置(例如雾化器)给予的包含80mg的色甘酸钠的吸入配制品提供了大于约5%的色甘酸钠的生物利用度并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约120ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸或其药学上可接受的盐的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约120ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约120ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的包含40mg色甘酸钠的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的包含40mg色甘酸钠的吸入配制品具有至少约30%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约200ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的包含40mg色甘酸钠的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的包含40mg色甘酸钠的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约330ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的包含80mg色甘酸钠的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的包含80mg色甘酸钠的吸入配制品具有至少约40%的rf(≤3.3μm)并在受试者中产生的色甘酸钠的auc(0-∞)大于约525ng*hr/ml。在本文披露的方法的某些实施例中,当用吸入装置向受试者给予40mg标称剂量的色甘酸钠时,用吸入装置(例如雾化器)给予的吸入配制品在该受试者中产生的色甘酸钠auc(0-∞)为约8.5ng*hr/ml/mg色甘酸钠和色甘酸钠的平均cmax为约3.9ng/ml/mg色甘酸钠。在本文披露的方法的某些实施例中,当用吸入装置向受试者给予40mg标称剂量的色甘酸钠时,用吸入装置(例如雾化器)给予的吸入配制品在该受试者中产生的色甘酸钠auc(0-∞)为约8.5ng*hr/ml/mg色甘酸钠和色甘酸钠的平均cmax为约1.9ng/ml/mg色甘酸钠。在本文披露的方法的某些实施例中,当用吸入装置向受试者给予60mg标称剂量的色甘酸钠时,用吸入装置(例如雾化器)给予的吸入配制品在该受试者中产生的色甘酸钠的auc(0-∞)为约9ng*hr/ml和色甘酸钠的cmax为约2.6ng/ml/mg色甘酸钠。在本文披露的方法的某些实施例中,当用吸入装置向受试者给予80mg标称剂量的色甘酸钠时,用吸入装置(例如雾化器)给予的吸入配制品在该受试者中产生的色甘酸钠的auc(0-∞)为约6.6ng*hr/ml和色甘酸钠的平均cmax为约2.95ng/ml/mg色甘酸钠。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)以小于约0.25ml、小于约0.5ml、至少约0.5ml至约1.5ml、至少约0.5ml至约1.8ml、至少约1.5ml、或至少约2.0ml的填充体积给予含有色甘酸或其药学上可接受的盐(如色甘酸钠)的吸入配制品。在某些实施例中,使用吸入装置(如雾化器)以约0.1ml至约5.0ml、约0.25ml至约2.0ml、约0.5ml至约1.8ml、约0.5ml至约2ml、约0.5ml至约1.5ml、约0.5ml至约1.0ml、约0.5ml或更少、约1ml或更少、约1.5ml或更少、约2.0ml或更少、约2.5ml或更少、约3.0ml或更少、约3.5ml或更少、约4.0ml或更少、约4.5ml或更少、或约5.0ml或更少的填充体积给予吸入配制品。在某些实施例中,使用吸入装置(如雾化器)以约0.5ml、约1.0ml、约1.5ml、约1.8ml、约2.0ml、约2.5ml、约3.0ml、约3.5ml、约4.0ml、约4.5ml、或约5.0ml的填充体积给予吸入配制品。在某些实施例中,使用吸入装置(如雾化器)给予吸入配制品,其在给予色甘酸或其药学上可接受的盐后提供了色甘酸或其药学上可接受的盐的残余量为小于约10%、小于约5%、或小于约3%的标称剂量。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予含有色甘酸或其药学上可接受的盐的吸入配制品,其中色甘酸或其药学上可接受的盐的浓度为大于约1%(按重量计)、大于约2%(按重量计)、大于约3%(按重量计)、大于约4%(按重量计)、大于约5%(按重量计)、大于约6%(按重量计)、大于约7%(按重量计)、大于约8%(按重量计)、大于约9%(按重量计)、或大于约10%(按重量计)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予含有色甘酸或其药学上可接受的盐的吸入配制品,其中色甘酸或其药学上可接受的盐的浓度为从约1%(按重量计)至约10%(按重量计)、从约2%(按重量计)至约8%(按重量计)、从约2%(按重量计)至约6%(按重量计),或从约3%(按重量计)至约5%(按重量计)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予含有色甘酸或其药学上可接受的盐的吸入配制品,其中色甘酸或其药学上可接受的盐的浓度为约1%(按重量计)、约2%(按重量计)、约3%(按重量计)、约4%(按重量计)、约5%(按重量计)、约6%(按重量计)、约7%(按重量计)、约8%(按重量计)、约9%(按重量计)、或约10%(按重量计)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予含有色甘酸钠的吸入配制品,其中色甘酸钠的浓度为大于约1%(按重量计)、大于约2%(按重量计)、大于约3%(按重量计)、大于约4%(按重量计)、大于约5%(按重量计)、大于约6%(按重量计)、大于约7%(按重量计)、大于约8%(按重量计)、大于约9%(按重量计)、或大于约10%(按重量计)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予含有色甘酸钠的吸入配制品,其中色甘酸钠的浓度为从约1%(按重量计)至约10%(按重量计)、从约2%(按重量计)至约8%(按重量计)、从约2%(按重量计)至约6%(按重量计),或从约3%(按重量计)至约5%(按重量计)。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予含有色甘酸钠的吸入配制品,其中色甘酸钠的浓度为约1%(按重量计)、约2%(按重量计)、约3%(按重量计)、约4%(按重量计)、约5%(按重量计)、约6%(按重量计)、约7%(按重量计)、约8%(按重量计)、约9%(按重量计)、或约10%(按重量计)。在某些实施例中,使用吸入装置(如雾化器)以约0.25至约10分钟、约0.50至约8分钟、小于约8分钟、小于约7分钟、小于约6分钟、小于约5分钟、小于约4分钟、小于约3分钟、小于约2分钟、小于约1.8分钟、小于约1.5分钟、或小于1分钟给予含有色甘酸或其药学上可接受的盐的吸入配制品。在某些实施例中,以约3分钟或更短时间给予该吸入配制品。在某些实施例中,以约1分钟、约2分钟、约3分钟、约4分钟、约5分钟、约6分钟、约7分钟、约8分钟、约9分钟、或约10分钟给予该吸入配制品。在本文披露的方法的某些实施例中,与使用常规吸入装置或口服配制品(如液体口服配制品、片剂或胶囊)给予相同的或更低的标称剂量的色甘酸或其药学上可接受的盐相比,使用雾化器给予色甘酸或其药学上可接受的盐提供了auclast、auc(0-∞)、或cmax的一种或多种的至少约1.5倍、至少约1.8倍、至少约两倍、至少约三倍、至少约四倍、或至少约五倍的增加。在本文披露的方法的某些实施例中,使用雾化器给予的吸入配制品基本上不含防腐剂(如苄醇)。在本文披露的方法的某些实施例中,使用雾化器给予的吸入配制品进一步包含至少一种赋形剂。在某些实施例中,该赋形剂选自下组,该组由以下组成:稳定剂和抗氧化剂(如柠檬酸、抗坏血酸、乙二胺四乙酸(edta)、焦亚硫酸钠、或其任何盐)、同渗容摩调节剂(如氯化钠、甘露醇、或山梨糖醇)、表面活性剂(如聚山梨酯80、维生素e、生育酚聚乙二醇、和泰洛沙泊)、或ph缓冲液。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品是低渗的。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品是亚等渗的。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有大于约70mosm/kg的同渗重摩。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约100mosm/kg的同渗重摩。在本文披露的方法的某些实施例中,使用吸入装置(如雾化器)给予的吸入配制品具有至少约150mosm/kg的同渗重摩。联合疗法在本文披露的某些实施例中,将包含按重量计从约2%至约10%的色甘酸钠和由氯化钠组成的渗透剂的配制品与用于治疗ipf的另外的试剂组合向有需要的受试者给予。在某些实施例中,另外的药剂选自吡非尼酮,血小板衍化生长因子受体(pdgfr)α、血小板衍化生长因子受体(pdgfr)β的抑制剂,成纤维细胞生长因子受体(fgfr)1-3的抑制剂,血管内皮生长因子受体(vegfr)1-3的抑制剂,及类fms酪氨酸激酶-3(flt3)的抑制剂。在某些实施例中,该另外的药剂是吡非尼酮或尼达尼布乙磺酸盐。在某些实施例中,该另外的药剂是吡非尼酮。在某些实施例中,该另外的药剂是尼达尼布乙磺酸盐。在某些实施例中,披露了治疗患有ipf的受试者的慢性咳嗽的方法,该方法包括向该受试者给予以下的组合(a)包含按重量计从约2%至约10%的色甘酸钠和由氯化钠组成的渗透剂的配制品,和(b)另外的试剂。在某些实施例中,另外的药剂选自吡非尼酮,血小板衍化生长因子受体(pdgfr)α、血小板衍化生长因子受体(pdgfr)β的抑制剂,成纤维细胞生长因子受体(fgfr)1-3的抑制剂,血管内皮生长因子受体(vegfr)1-3的抑制剂,及类fms酪氨酸激酶-3(flt3)的抑制剂。在某些实施例中,该另外的药剂是吡非尼酮或尼达尼布乙磺酸盐。在某些实施例中,该另外的药剂是吡非尼酮。在某些实施例中,该另外的药剂是尼达尼布乙磺酸盐。在本文披露的方法的某些实施例中,通过不同的给药途径共同给予色甘酸或其药学上可接受的盐的一种或多种不同配制品以提供全身有效量的色甘酸或其药学上可接受的盐。例如,在某些实施例中,使用干粉吸入器给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的组合物,并且以液体口服配制品的形式共同给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的不同组合物以治疗由ipf引起的慢性咳嗽。在某些实施例中,使用定量吸入器给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的组合物,并且以液体口服配制品的形式共同给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的不同组合物以治疗由ipf引起的慢性咳嗽。在某些实施例中,使用干粉吸入器给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的组合物,并且用定量吸入器共同给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的不同组合物以治疗由ipf引起的慢性咳嗽。在某些实施例中,使用干粉吸入器给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的组合物,并且用定量吸入器共同给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的不同组合物以治疗由ipf引起的慢性咳嗽。在某些实施例中,使用雾化器给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的组合物,并且以液体口服配制品的形式共同给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的不同组合物以治疗由ipf引起的慢性咳嗽。在某些实施例中,使用喷射雾化器给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的组合物,并且以液体口服配制品的形式共同给予包含色甘酸或其药学上可接受的盐(如色甘酸钠)的不同组合物以治疗由ipf引起的慢性咳嗽。术语的定义除非另外限定,否则在此使用的所有技术术语和科学术语均具有与本文所述的发明所属领域的技术人员通常理解的相同的含义。本说明书中提到的所有出版物、专利和专利申请都通过引入特此结合,如同每一单独的出版物、专利或专利申请具体且单独地通过引入结合在此。如本文使用的,术语“约(about)”与术语“大约(approximately)”同义使用。说明性地,关于某一治疗有效药物剂量术语“约”的使用表明跨越列举的值的范围内的值,例如在列举的值的正负达10%的范围内的值,也是有效和安全的。如本文使用的,术语“包含(comprising)”、“包括(including)”、“比如(suchas)”、和“例如(forexample)”(或“如(e.g.)”)是以开放的、非限制性的意义使用的。如本文使用的,术语“基本上由……组成”是用于权利要求中的过渡短语以表示成分、部分或方法步骤的随后列表必须出现在请求保护的组合物、机器或方法中,但该权利要求对未列出的对本发明的基本的和新颖的特性没有实质性影响的成分、部分或方法步骤是开放性的。如本文使用的“标称剂量”是指装填剂量,即在给予受试者前吸入装置中的活性药物成分(api)的量。含有标称剂量的溶液体积称为“填充体积”。如本文所用,“auclast”是指从时间零至活性药物成分(api)最后可测量浓度的时间的曲线下面积。如本文所用,“auclasthen”是指用雾化器给予的标称剂量的活性药物成分(api)的直至最后时间点的血浆浓度曲线下的面积。如本文所用,“auclastconv”是指用常规吸入装置给予的标称剂量的活性药物成分(api)的直至最后时间点的血浆浓度曲线下的面积。如本文使用的“auc(0-∞)”是指活性药物成分(api)的血浆浓度曲线下的总面积。如本文所用,“auc(0-∞)hen”是指用雾化器给予的标称剂量的活性药物成分(api)的血浆浓度曲线下的总面积。如本文所用,“auc(0-∞)conv”是指用常规吸入装置给予的标称剂量的活性药物成分(api)的血浆浓度曲线下的总面积。可以通过本领域技术人员已知的方法来确定auc(0-∞)。例如,api的auc(0-∞)可以通过如下方法确定:在给予受试者api后的不同的时间点收集来自受试者的血液样品;从血液样品中分离血浆;从分离的血浆样品中提取api(例如通过固相萃取);将来自分离的血浆的每个样品的提取的api定量(例如通过液相色谱串联质谱法(lc-ms/ms));绘制每个样品中api的浓度相比于给药后的收集时间的图,并计算曲线下面积。如本文使用的“基本上相同的标称剂量”意指活性药物成分(api)的第一标称剂量,其含有与色甘酸或其药学上可接受的盐的第二标称剂量约相同微摩尔数的色甘酸或其药学上可接受的盐。如本文使用的“生物利用度”是指到达体循环的未改变api的量,该量被表示为给予受试者的api的剂量的百分比。根据定义,含有活性药物成分(api)的静脉内溶液的生物利用度为100%。可以通过本领域技术人员已知的方法来确定api的生物利用度。例如,api的生物利用度可以通过如下方法确定:在给予受试者api后的不同的时间点收集来自受试者的尿液样品;从尿液样品中提取api(例如通过固相萃取);将来自每个尿液样品的api定量;通过基于排泄到尿液中的到达体循环的api的量的因子调整收集自尿液的api的量,并计算给予受试者的到达受试者体循环的api百分比。在具体的实施例中,色甘酸钠的生物利用度可以如下方法确定,描述于walker等人,24j.pharm.pharmacol.[药学与药理学杂志]525-31(1972)。在色甘酸钠的情况下,从尿液中分离的化合物的量乘以二来计算给药后达到体循环的总量,因为已知该化合物在尿液和粪便中以等份排泄而未代谢,即到达体循环的约50%的量的色甘酸钠排泄到尿液中,到达体循环的约50%的量的色甘酸钠排泄到粪便中。如本文所用,“增强的肺沉积”是指由例如改善的药物递送效率引起的药物沉积(肺沉积剂量)的增加。“沉积剂量”或“肺沉积剂量”是色甘酸或其药学上可接受的盐沉积在肺中的量。沉积剂量或肺沉积剂量可以表示为绝对意义,例如以沉积在肺中的api的mg或μg。肺沉积剂量也表示为相对意义,例如将沉积的api的量计算为占标称剂量的百分比。如本文使用的“cmax”是指活性药物成分(api)的最大血浆浓度。如本文所用,“cmaxhen”是指用雾化器给予的标称剂量的活性药物成分(api)的最大血浆浓度。如本文所用,“cmaxconv”是指用常规吸入装置给予的标称剂量的活性药物成分(api)的最大血浆浓度。可以通过本领域技术人员已知的方法来确定cmax。例如,api的cmax可以通过如下方法确定:在给予受试者api后的不同的时间点收集来自受试者的血液样品;从血液样品中分离血浆;从分离的血浆样品中提取api(例如通过固相萃取);将来自分离的血浆的每个样品的提取的api定量(例如通过lc-ms/ms);绘制每个样品中api的浓度相比于给药后的收集时间的图,并鉴定曲线上api的浓度峰值。“增强的药代动力学特征”意指某些药代动力学参数的改善。可以改善的药代动力学参数包括auc(0-4或0-6或0-8h)、auclast、auc(0-∞)、tmax、t1/2和cmax。在某些实施例中,增强的药代动力学特征可以通过将通过一种给予途径(例如吸入装置,如雾化器)给予的标称剂量的活性药物成分(api)获得的药代动力学参数与通过不同给予途径(例如不同类型的吸入装置或口服配制品(例如口服片剂、口服胶囊或口服溶液))给予的相同标称剂量的活性药物成分(api)获得的相同药代动力学参数进行比较来定量测量。“血浆浓度”是指受试者或受试者群体血液血浆成分中活性药物成分(api)的浓度。“受试者”是指被治疗的动物(特别是哺乳动物)或人。“受试者组(subjectgroup)”或“受试者组(subjectgroup)”具有足够数量的受试者以提供相关药代动力学参数的统计学上显著的平均测量值。“受试者组(subjectgroup)”或“受试者组(subjectgroup)”的所有成员均具有落入统计学正常范围(即,没有异常值)内的色甘酸或其药学上可接受的盐的药代动力学参数,并且在非标准或不寻常的测量值的基础上不包括任何成员。如本文使用的“雾化器”是指将药物、组合物、配制品、悬浮液和混合物等转变成细小的气溶胶以递送至肺的设备。“药物吸收”或简称“吸收”,通常是指从药物的递送部位穿过屏障进入血管或作用部位的药物移动过程,例如药物经由肺泡的肺毛细血管床被吸收进入体循环。如本文使用的“tmax”是指活性药物成分(api)达到最大血浆浓度所需的时间。如本文所用,“tmaxhen”是指标称剂量的活性药物成分(api)在用雾化器给予后达到最大血浆浓度所需的时间量。如本文所用,“tmaxconv”是指标称剂量的活性药物成分(api)在用常规吸入装置给予后达到最大血浆浓度所需的时间量。术语“治疗”(treat)及其语法变体(例如,“治疗(totreat)”、“治疗(treating)”和“治疗(treatment)”)是指以改善或减少受试者的病症或疾病状态的一种或多种症状的发生为目的给予该受试者活性药物成分。此类症状可以是慢性的或者是急性的;且此类改善可以是部分的或者是完全的。在本发明的背景下,治疗需要经由本文披露的任何给药途径给予色甘酸或其药学上可接受的盐。如本文使用的,术语“高浓度”是指浓度大于1%(按重量计)。例如,在具体的实施例中,色甘酸钠的“高浓度”配制品包含浓度大于1%(按重量计)的色甘酸钠。如本文使用的,术语“低渗”是指具有张力小于295mosm/kg的配制品。术语“预防”是指将活性药物成分给予受试者,目的是减少与受试者疾病状态或病症有关的一种或多种急性症状的发生或复发。在本发明的背景下,预防需要经由本文披露的任何给药途径给予色甘酸或其药学上可接受的盐。因此,预防包括减少由ipf引起的慢性咳嗽的发生或复发率。然而,预防并非旨在包括完全预防先前未被鉴定为患有因ipf引起的慢性咳嗽的患者的疾病状态或病症的发作。如本文使用的,“全身有效量”是受试者身体作为整体的色甘酸或其药学上可接受的盐的量,该量对于由ipf引起的慢性咳嗽的治疗或预防有效。“全身有效量”可以表示为,例如,受试者的血浆中色甘酸或其药学上可接受的盐的质量,或色甘酸或其药学上可接受的盐的浓度。“全身有效量”可以取决于色甘酸或其药学上可接受的盐的配制品而不同。如本文所用,“局部有效量”是有效用于治疗或预防由ipf引起的慢性咳嗽的受试者身体的特定区域中色甘酸或其药学上可接受的盐的量。“局部有效量”可以表示为,例如,受试者的组织中色甘酸或其药学上可接受的盐的质量,或色甘酸或其药学上可接受的盐的浓度。“局部有效量”可以取决于色甘酸或其药学上可接受的盐的配制品而不同。如本文使用的,如果本领域技术人员认识到差异可能是真实的,那么这种差异就是“显著的”。在某些实施例中,显著性可以通过统计学来确定,在这种情况下,两个测量参数可以被称为统计学上显著的。在某些实施例中,统计显著性可以关于所述置信区间(ci)定量,如大于90%、大于95%、大于98%等。在某些实施例中,统计显著性可以关于p值定量,如小于0.5、小于0.1、小于0.05等。本领域技术人员将认识到这些表达的意义,并将知道如何将它们适当地应用于正在进行比较的具体参数。实例实例1:患有慢性咳嗽的ipf受试者吸入的pa101的安全性和耐受性如表1中所示,pa101含有4%(按重量计)的色甘酸作为活性物质、0.2%氯化钠作为渗透剂、0.02%edta作为螯合剂、1.25%甘露醇作为非离子渗透剂、和充足的量的纯化水。pa101具有200mosm/kg的同渗重摩。安慰剂a含有0.4%氯化钠作为渗透剂、0.02%edta作为螯合剂、1.25%甘露醇作为非离子渗透剂、和充足的量的纯化水,但不含色甘酸钠。安慰剂a的同渗重摩调节至约200mosm/kg。安慰剂b含有0.6%氯化钠作为渗透剂、0.02%edta作为螯合剂、和充足的量的纯化水,但不含色甘酸钠或甘露醇。安慰剂b的同渗重摩调节至约200mosm/kg。该研究的主要目的是评估吸入的pa101(包括配制品中的赋形剂甘露醇)在患有难治性慢性咳嗽的ipf受试者中的安全性和耐受性。本研究的第二个目的是评估给药3天后吸入的pa101的潜在功效。研究设计如下:在6名患有难治性慢性咳嗽的ipf受试者(40-79岁)中的1b期、随机、双盲、单中心、3期交叉研究。每项研究治疗每日给予三次(tid),持续3天,第四日一个计量(共10个计量)。72小时持续监测咳嗽次数。给予的治疗为以下之一:1)40mgpa101,2)安慰剂-a(a=不含色甘酸钠,但包括甘露醇),以及3)安慰剂-b(b=不含甘露醇也不含色甘酸钠)。所有治疗均使用eflow雾化器口服吸入给予。在给予受试者治疗和两种安慰剂后,记录所有不良事件。表2提供了按严重程度、类型和治疗划分的不良事件的总结。表2.在给予受试者治疗和两种安慰剂后,记录每个受试者日间咳嗽的次数。图1提供了每个受试者在日间三个时间点的平均咳嗽次数的总结。图2提供了每个受试者在日间三个时间点的总咳嗽次数的总结。图1和图2中提供的咳嗽次数是基于受试者主观报告的,如下的咳嗽次数是基于客观测量的。为了获得受试者咳嗽的客观数量,研究使用了leicester咳嗽监测仪(lcm),这是一种经过验证的24小时自动咳嗽频率监测仪。lcm要求受试者佩戴贴在胸部的麦克风,并将麦克风连接到监视器上(使用肩带携带),该监视器每天24小时在受试者身上以记录所有咳嗽。表3提供了每种治疗条件下每个受试者每小时平均咳嗽的lcm计数,以及24小时、日间和夜间的数据统计。sd=标准差。表3.本研究包括两个另外的主观指标:咳嗽严重程度和急迫性咳嗽,都在视觉模拟评量表(vas)上作为测量定量地提供。例如,当使用视觉模拟量表(vas)测量咳嗽严重程度时,受试者被要求在“不咳嗽”和“最严重咳嗽”之间的100mm范围上打分。例如,当使用视觉模拟量表(vas)测量急迫性咳嗽时,受试者被要求在“不急迫”和“最急迫的咳嗽”之间的100mm范围上打分。表4提供了提供在研究的第1天或第4天的治疗的每个参数的vas评分的平均值、标准差(sd)和中值。表4.为了评估使用pa101或两种安慰剂配制品中的一种治疗后的每个受试者的肺功能,使用用力肺活量(fvc)测试对受试者进行评估。分别在治疗的第1天或第3天测量每个受试者的第一秒用力呼气量(fev1),即在fvc测试的第一秒用力呼出的空气量。图3总结了每个治疗组的结果。本研究的数据表明,在患有难治性慢性咳嗽的ipf受试者中每日三次、持续3天给药后,用配制品(包括甘露醇作为的赋形剂)中的40mgpa101的治疗总体安全,耐受性良好。用甘露醇配制的pa101、用甘露醇配制的安慰剂和没有甘露醇的安慰剂在耐受性方面未观察到差异。大多数不良事件的强度较轻微,且不需要治疗。报告的最常见的不良事件是咳嗽、喉咙发炎、头晕、和头痛。治疗3天后,两治疗组间的咳嗽次数、咳嗽严重程度、急迫性咳嗽均无临床显著性变化。实例2:pa101在健康受试者中的第i阶段药代动力学、相对生物利用度和安全性研究(pk-01)。本研究的主要目的是确定使用两种不同的气溶胶膜(30l和40l)经由雾化器(pari)递送的单一剂量的代表性吸入色甘酸钠配制品(pa-101)与色甘酸钠的上市的配制品(口服溶液和气溶胶吸入剂)比较在健康受试者中的全身利用率和药代动力学(pk)曲线。本研究的第二个目的是评估pa-101与色甘酸钠的上市的配制品(口服溶液和气溶胶吸入剂)比较的安全性和耐受性。这是一项在12名18-45岁的健康成人受试者中进行的1期、随机、开放标签、单中心、剂量范围、交叉研究。研究治疗、剂量及给药方式:1.40mgpa-101(4%dscg,40mg/1ml),经由eflow30l口服吸入。2.80mgpa-101(4%dscg,80mg/2ml),经由eflow30l口服吸入。3.40mgpa-101(4%dscg,40mg/1ml),经由eflow40l口服吸入。4.20mg色甘酸钠气溶胶吸入剂(1%dscg,20mg/2ml)(可商购产品),经由lcplus口服吸入。5.200mg口服色甘酸钠溶液(可商购产品),口服给予。所有研究受试者均在上午(上午8:00,+/-30分钟)接受作为单一剂量治疗的每项研究的治疗。在各给药日之前,受试者在早晨进入诊所接受基线(剂量前)评估。受试者被要求在各给药日研究给药后在诊所停留12小时。治疗随访间隔2至5天的清除时间。给予pa-101的主要递送装置是开放系统eflow雾化器(使用30l气溶胶头,其产生大小中值为约3.0μm的气溶胶颗粒)。研究持续时间为一天。用于评价的标准:药代动力学测量:评估血浆色甘酸钠(dscg)的pk参数是最大浓度(cmax)、到达最大浓度的时间(tmax)、最终消除半衰期(t1/2)、血浆浓度时间曲线下面积(从时间=0至最后可测量的药物浓度(auc0-t)的时间)、和血浆浓度时间曲线下面积(从时间=0至无穷大(auc0-∞)。测定尿液dscg水平用于尿液中总dscg排泄量,并从测定的水平计算dscg的生物利用度。安全性测量:不良事件包括胃肠道紊乱(如腹痛、恶心、呕吐)、生命体征改变、12导联ecg和临床实验室检查(血液学、化学和尿液分析)。统计测量:列出并总结了药代动力学参数和血浆浓度。汇总统计以几何平均数、算术平均数、算术标准差(sd)、最小值、中值、最大值和n表示。不表示tmax的几何统计量。采用包括受试者术语和治疗术语的方差分析(anova)计算点估计值,并且计算与pk参数(90%ci)有关的治疗差异的置信区间(ci)。比较治疗组之间ae的发生率:所有安全性测量都提供了汇总表和单独的受试者清单,结果由治疗组示出。描述性统计用于在适当时总结数据。结果:单一剂量研究测定的药代动力学参数如下表所示:表5:括号中显示的数值是(±sd)。使用finlay模型对来自30l和40l装置的气溶胶的肺沉积进行建模(finlay、wh、和armartin,"recentadvancesinpredictiveunderstandingrespiratorytractdeposition"[预测理解呼吸道沉积的最新进展],journalofaerosolmedicine[气溶胶医学杂志],第21卷:189-205(2008))表明,使用这两种装置的肺沉积应该非常相似。然而,使用30l装置在40mg剂量下获得的auc值(338ng*hr/ml)与来自使用40l装置的auc值(212ng*hr/ml)相比出人意外地高。色甘酸钠不会在体内代谢,而是经由胆汁和尿液完整地排泄出来。吸入过程中沉积在肺中的色甘酸钠会出现在血浆中,并且因此auc可以是沉积在肺中的色甘酸钠的替代指标。任何在吸入过程中吞下的色甘酸钠都会对auc产生可以忽视的作用,因为色甘酸的口服生物利用度只有约1%(richards等人,jpharmacolexpther[药理学与实验治疗学杂志],第241卷,第3期:1028-1032(1987))。因此,auc数据表明,在相同剂量(40mg)下,使用30l装置的肺沉积出人意外地高于使用40l装置的肺沉积。单一剂量研究观察到的不良事件的次数如下表所示:表6.表7提供了使用pa101配制品与安慰剂或其他可用的色甘酸配制品治疗后观察到的不良事件的总结。表7实例3:三种不同pa101配制品在健康受试者中的第ii阶段药代动力学、相对生物利用度和耐受性研究(pk-02)。如表1中所示,pa101含有4%(按重量计)的色甘酸作为活性物质、0.2%氯化钠作为渗透剂、0.02%edta作为螯合剂、1.25%甘露醇作为非离子渗透剂、和充足的量的纯化水。pa101具有200mosm/kg的同渗重摩。pa101-b含有4%或6%(按重量计)的色甘酸作为活性物质、0.2%氯化钠作为渗透剂、0.02%edta作为螯合剂、和充足的量的纯化水。pa101-b(40mg)具有125mosm/kg的同渗重摩。pa101-b(60mg)具有135mosm/kg的同渗重摩。本研究的主要目的是评估健康受试者中三种不同pa101配制品的药代动力学、相对生物利用度和耐受性。该研究设计为使用12名年龄在18岁至45岁之间的健康志愿者的随机、双盲、4期交叉研究。给予的治疗为以下之一:1)40mgpa101(含有甘露醇),2)40mgpa101b(不含甘露醇),3)60mgpa101b(不含甘露醇),以及4)安慰剂tid(不含甘露醇)。所有治疗均以每天三次(tid)给予作为一天的治疗。每个研究治疗通过最少24hr的洗脱期分开。所有配制品均使用parieflow30l装置给予。安慰剂含有0.2%氯化钠作为渗透剂、0.02%edta作为螯合剂、和充足的量的纯化水。安慰剂的同渗重摩为约65mosm/kg。研究人口统计资料:受试者总计13人,男性5人,女性8人,平均年龄28岁(总范围为21-40岁)。分布:13名受试者被随机分组。12名受试者完成了研究,而1名受试者在治疗1期(受试者接受安慰剂治疗)因不良事件(服药后1分钟开始咳嗽,持续3分钟)而停止了研究。表8提供了本研究中观察到的不良事件的总结。表8表9a和9b提供了本研究中观察到的所有不良事件的解释。表9a表9b表10提供了本研究中观察到的与给予pa101或pa101-b相关的不良事件的总结。表10表11提供了本研究中观察到的中度不良事件的总结。表11药代动力学结果表12提供了对研究的每个pa101配制品测量的每个药代动力学参数的平均值和标准差(sd)。如本文使用的,“ke1”=消除速率常数,其描述了pa101或pa101-b配制品的色甘酸从受试者体内去除的速率。这一测量相当于每单位时间(t-1,或在这种情况下为1/小时(h))去除的色甘酸的比率。表12第i阶段研究(描述于实例2-pk-01)的和第ii阶段研究(描述于该实例-pk-02)的pa101治疗的药代动力学参数在下表13中进行比较。需注意,在pk-01之一的受试者中,40mg组使用parieflow40l装置给予包含色甘酸钠的配制品,而在研究中所有其他受试者使用parieflow30l装置给予配制品。在pk-01研究中,有三名受试者的血浆值与平均值相比非常高,这些异常值扭曲了pk-01研究中的cmax和auc结果。如果通过排除这些异常值来分析数据,则pk-01和pk-02研究的cmax和auc结果是可比较的。这得到了两项研究中尿液色甘酸水平相似的发现的支持。表13.来自一期和二期研究的pa101配制品是安全的,耐受性良好。据至少2位受试者报道,最常见的不良事件包括咳嗽、喉咙发炎、头晕、头痛和导管部位反应。治疗相关的不良事件包括咳嗽、喉咙发炎、头晕、口干和恶心。活性药物治疗组和安慰剂治疗之间不良事件的频率和严重程度是可比较的,这是出乎意料的,因为pa101-b配制品(不含甘露醇)展现与含有甘露醇的配制品显著不同的同渗重摩。因此,大多数不良事件具有轻微的强度和短暂的持续时间。因此,pa101-b配制品(40mg和60mg剂量)耐受性良好,不良事件(ae)谱与pa101类似。pa101-b配制品(40mg和60mg剂量)与pa101具有可比较的药代动力学谱。实例4:患有由特发性肺纤维化(ipf)引起的慢性咳嗽的受试者中色甘酸配制品的第ii阶段安全性和功效研究。这是一项在48名慢性咳嗽患者中进行的随机、双盲、安慰剂对照、2期交叉、2-组群、多中心的2期研究:展示出与特发性肺纤维化相关的慢性咳嗽的24名受试者(ipf,组群1)和患有与ipf无关的慢性特发性咳嗽的24名受试者(cic,组群2)(参见实例5)。该研究由两个14天的治疗期组成,每个治疗期由在第1期和第2期之间的14天(±2天)的洗脱期分开。筛选就诊将在第1期基线就诊前14天内进行。这两期是相同的,除了在第2期中,根据1:1随机化方案,受试者交叉以交替第1期接受的治疗。在筛选就诊时,对使用线性100mm视觉模拟量表具有日间咳嗽严重度程度评分>40mm的受试者使用lcm咳嗽监测仪进行24小时客观咳嗽计数监测。在筛选就诊时使用lcm,日间平均咳嗽计数为每小时至少15次咳嗽的受试者有资格进行随机化。在每个期的期间,受试者自我给予研究药物(即,通过eflow给予40mgpa101或安慰剂pa101)每天三次(即,8:00am±1小时,2:00pm±1小时和8:00pm±1小时),每个期持续连续14天(例如,第1-14天)。受试者在基线/治疗就诊(第2次就诊,第1天)之前的早晨在诊所进行研究前就诊(第1次就诊,第-1天),并且分配咳嗽计数装置(lcm)以测量基线24小时咳嗽计数。受试者在第二天早晨(第2次就诊,第1天)返回诊所以归还装置、评估生活质量测量值,并接受第一剂研究治疗。治疗期间的额外治疗就诊发生在第7±1天(第3次就诊)和第15±1天(第5次就诊)。受试者在第7±1天(第3次就诊)和第14天±1天(第4次就诊)的早晨到诊所就诊,并且分配lcm装置以测量24小时咳嗽计数。研究评估包括在每个治疗期的第1、7和15天评估生活质量(lcq和k-bild)、咳嗽严重程度(vas)、肺功能试验(第1秒用力呼气量(fev1)、用力肺活量[fvc]和fev1/fvc比率)、呼出的一氧化氮分数(feno)和安全性评估(ae、生命体征和ecg)。肺功能测试和k-bild评估仅在ipf组群中进行。在最后一次研究治疗后7±2天内安排安全性随访通话。在每个治疗期的治疗开始和结束(在第1治疗期期间的筛选就诊和第5次就诊,以及第2治疗期期间的第2次就诊和第5次就诊)时收集临床安全性实验室样品。所有给药后研究程序均从时间0开始。时间0定义为每个期的第一次研究药物给予的开始(即,当雾化器已经打开时)。在ipf组群中,允许受试者在研究过程中使用抗纤维化疗法,即吡非尼酮、尼达尼布、和n-乙酰半胱氨酸,条件是在筛选就诊之前和整个研究期期间剂量稳定至少3个月。受试者在筛选就诊前至少2周内和整个研究期间不得使用下列药物(即泼尼松、麻醉性镇咳剂、巴氯芬、加巴喷丁、吸入性皮质类固醇、苯佐那酯、右美沙芬、喷托维林、和h1抗组胺药、白三烯调节剂和色甘酸钠)。在基线就诊前至少1周和研究期间不允许使用含有支气管扩张剂(包括β-2激动剂和抗胆碱能药)的药物。如表1中所示,pa101含有4%(按重量计)的色甘酸作为活性物质、0.2%氯化钠作为渗透剂、0.02%edta作为螯合剂、1.25%甘露醇作为非离子渗透剂、和充足的量的纯化水。pa101具有200mosm/kg的同渗重摩。该研究的主要目的是评估通过parieflow30l雾化器递送的吸入的pa101治疗因ipf引起的慢性咳嗽的有效性。本研究设计以图表形式提供于图4中。纳入标准:1)年龄在40至79岁之间的男性或女性受试者,包括端值,2)基于高分辨率计算机断层扫描(hrct)上存在明确或可能的普通型间质性肺炎(uip)模式并在排除其他诊断(包括与环境和职业暴露、结缔组织疾病和药物相关的肺部疾病)之后在多学科团队的共识下诊断为特发性肺纤维化(ipf),3)慢性咳嗽出现至少8周并对现有疗法无应答,4)在筛选就诊时,视觉模拟量表上日间咳嗽严重程度评分>40mm,5)在筛选就诊时使用客观咳嗽计数监测器,日间平均咳嗽计数为至少15次咳嗽/小时,6)在筛选就诊的12个月内,血红蛋白校正后一氧化碳转移容量(tlcoc)>25%预测值以及在筛选就诊的1个月内,用力肺活量(fvc)>50%预测值,以及7)愿意并有能力提供书面知情同意书。排除标准:1)如研究者所确定的可能使受试者处于危险之中或损害研究数据质量的临床上显著的医疗状况、实验室异常或疾病的当前或近期病史,2)显著的冠状动脉疾病(即筛选就诊的6个月内发生心肌梗塞或1个月内出现不稳定的心绞痛),3)筛选就诊的4周内出现上呼吸道感染或下呼吸道感染,4)筛选就诊的3个月内ipf急性加重,5)长期每日氧疗(>10小时/天),6)存在肺动脉高压,活动受限,7)过去5年内治疗或未治疗的任何器官系统恶性肿瘤史,局部基底细胞癌或原位宫颈癌除外,8)过度使用或滥用酒精的当前或近期史(过去12个月),9)滥用合法药物或使用非法药物或物质的当前或近期史(过去12个月),10)在筛选就诊前4周内参与任何其他试验药研究,11)在筛选就诊的2周内使用以下药物:泼尼松、麻醉性镇咳剂、巴氯芬、加巴喷丁、吸入性皮质类固醇、苯佐那酯、右美沙芬、喷托维林、h1抗组胺药、白三烯调节剂和色甘酸钠,12)怀孕或哺乳期女性,或者在研究期间不愿意采取可接受的节育或禁欲手段(例如禁欲、联合屏障和杀精子剂,或荷尔蒙)的有生育潜力的女性,以及13)对色甘酸钠过敏或不耐受史。表14提供了研究参与者的人口统计学信息。表14.数量(n)24年龄67±6(56-79岁)性别15名男性/9名女性种族2名亚裔/22名白种人体重指数(bmi)29.1±3.8自ipf诊断以来的时间4.1±3.3(1-13岁)自咳嗽诊断以来的时间5.6±4.2(1-16岁)用力肺活量(fvc)-平均值(l)2.54±0.96用力肺活量(fvc)-预测值(%)73±15fev1/fvc(%)83±9fev1=在用力呼气的第一秒结束时呼出的量安全性结果:下表15总结了针对至少两名患有因ipf引起的慢性咳嗽的受试者报告的治疗紧急不良事件(ae)。表15.有两名参与者退出研究。一名接受安慰剂治疗的参与者从第1天开始出现呼吸短促和咳嗽(轻度,可能相关),持续到第13天,症状消失。另一名参与者接受了pa101治疗并从第5天开始感染感冒(中度,不太可能与治疗有关),持续到第17天,症状消失。功效结果:咳嗽计数由莱斯特咳嗽监测仪(lcm)测量。图5提供了在研究的基线、第7天和第14天接受pa101或安慰剂的患有由ipf引起的慢性咳嗽的受试者的日间平均咳嗽/小时的总结。当分析从基线的变化时(参见图6),对于经pa101治疗的受试者,在第7天和第14天出现统计学上显著的差异。为了证明该结果的临床相关性,这种统计学上显著的差异可以表示为经安慰剂调节的(pbo调节的)咳嗽频率降低(见图7)和最小二乘(ls)均值值比率(95%置信区间(ci))(见图7和图8)。总之,数据表明用pa101治疗可以减少咳嗽,该减少不仅具有统计学意义,而且具有临床意义。表16总结了图7和图8中以图表形式显示的数据。表16.表17总结了图7和图8中以图表形式显示的数据。表17.图12提供了在研究的基线、第7天和第14天接受pa101或安慰剂的患有由ipf引起的慢性咳嗽的受试者的夜间平均咳嗽/小时的总结。与针对日间咳嗽进行的分析类似,图13提供了经pa101治疗的受试者在第7天和第14天夜间咳嗽从基线的变化。表18总结了图12和图13中以图表形式显示的数据。表18.为了证明经pa101治疗的受试者24小时平均咳嗽/小时变化的临床相关性,这种差异可以表示为经安慰剂调节的(pbo调节的)咳嗽频率降低(见图15和图17)和最小二乘(ls)均值值比率(95%置信区间(ci))(见图16和图17)。总之,数据表明用pa101治疗可以减少24小时平均咳嗽/小时,具有临床意义。表19总结了图15-17中以图表形式显示的数据。表19.图18合成来自日间、夜间和24小时咳嗽/小时分析的数据,以产生针对本研究中接受安慰剂或pa101的患有由ipf引起的慢性咳嗽的受试者的24小时咳嗽曲线。对于每个治疗组,将基线比率与在给予安慰剂或pa10114天后显示的比率对比,绘制在24小时窗口内的平均咳嗽/小时比率。经pa101治疗的组到第14天(特别是从8am至11pm的小时)在咳嗽/小时比率方面显示出统计学显著且临床相关的降低。除了使用lcm捕获的客观咳嗽/小时数据之外,还从研究受试者收集主观数据。通过莱斯特咳嗽问卷(leicestercoughquestionnaire,lcq)和金氏间质性肺病简式问卷(king’sbriefinterstitiallungdiseasequestionnaire,k-bild)测量生活质量评分。表20总结了使用莱斯特咳嗽问卷收集的数据,以评估从基线到第7天和第14天的生活质量变化。生活质量是第二阶段研究的次级终点。lcq:最差得分=3,最好得分=21;mid:>1.3。表20.表21总结了测量生活质量的莱斯特咳嗽问卷中从基线的变化。表21.表22总结了应答者中咳嗽特定的生活质量。应答者在本文中定义为患有由ipf引起的慢性咳嗽的那些受试者,其在用本披露的组合物或本研究中的pa101治疗后经历日间平均咳嗽减少超过30%。表22.表23总结了使用金氏间质性肺病简式问卷(k-bild)收集的数据以评估从基线到第14天的生活质量变化。疾病特定的生活质量是第二阶段研究的次级功效终点。lcq:最差得分=15,最好得分=100。表23.表24总结了k-bild心理学方面从基线的变化,其使用混合评分模型测量用安慰剂或pa101治疗的患有由ipf引起的慢性咳嗽的受试者的生活质量。表24.表25总结了k-bild呼吸急促和活动方面从基线的变化,其使用混合评分模型测量用安慰剂或pa101治疗的患有由ipf引起的慢性咳嗽的受试者的生活质量。表25.表26总结了k-bild胸部症状方面从基线的变化,其使用混合评分模型测量用安慰剂或pa101治疗的患有由ipf引起的慢性咳嗽的受试者的生活质量。表26.表27总结了k-bild总评分方面从基线的变化,其使用混合评分模型测量用安慰剂或pa101治疗的患有由ipf引起的慢性咳嗽的受试者的生活质量。表27.表28总结了来自通过vas测量用安慰剂或pa101治疗的患有由ipf引起的慢性咳嗽的受试者的咳嗽严重程度的数据。通过视觉模拟量表(vas)测量咳嗽严重程度。例如,当使用视觉模拟量表(vas)测量咳嗽严重程度时,受试者被要求在“不咳嗽”和“最严重咳嗽”之间的100mm范围上打分。vas:较差得分=100,最好得分=0。表28.表29总结了通过vas用安慰剂或pa101治疗的患有由ipf引起的慢性咳嗽的受试者的咳嗽严重程度从基线的变化。表29.表30总结了来自通过vas测量应答者的咳嗽严重程度的数据。表30.比较了应答者中的lcq和vas评分(参见图19)。数据表明在基线和第14天之间用pa101治疗的应答者的vas评分的显著差异。这种咳嗽严重程度的主观测量证实了提供使用咳嗽监测仪测量的咳嗽频率的客观测量。两种方法均显示在用pa101治疗14天后由ipf引起的慢性咳嗽症状的临床相关减少。该第ii阶段研究证实pa101具有非常好的安全性。此外,来自该研究的数据显示,与安慰剂相比,客观咳嗽计数降低了30%,具有统计学显著性。数据显示咳嗽特定的生活质量(qol)测量值(lcq)和受试者报告的咳嗽严重程度(vas)的积极趋势。该数据还显示出最小的安慰剂效应,这对于ipf-慢性咳嗽的未来试验具有临床相关性。实例5:患有慢性特发性咳嗽的受试者中色甘酸配制品的第ii阶段安全性和功效研究。这是一项在48名慢性咳嗽患者中进行的随机、双盲、安慰剂对照、2期交叉、2-组群、多中心的2期研究:24名患有特发性肺纤维化(ipf,组群1)的受试者(参见实例4)和24名患有慢性特发性咳嗽(cic,组群2)的受试者。该研究由两个14天的治疗期组成,每个治疗期由在第1期和第2期之间的14天(±2天)的洗脱期分开。筛选就诊将在第1期基线就诊前14天内进行。这两期是相同的,除了在第2期中,根据1:1随机化方案,受试者交叉以交替第1期接受的治疗。在筛选就诊时,对使用线性100mm视觉模拟量表具有日间咳嗽严重度程度评分>40mm的受试者使用lcm咳嗽监测仪进行24小时客观咳嗽计数监测。在筛选就诊时使用lcm,日间平均咳嗽计数为每小时至少15次咳嗽的受试者有资格进行随机化。在每个期的期间,受试者自我给予研究药物(即,通过parieflow30l装置给予40mgpa101或安慰剂pa101)每天三次(即,8:00am±1小时,2:00pm±1小时和8:00pm±1小时),每个期持续连续14天(例如,第1-14天)。受试者在基线/治疗就诊(第2次就诊,第1天)之前的早晨在诊所进行研究前就诊(第1次就诊,第-1天),并且分配咳嗽计数装置(lcm)以测量基线24小时咳嗽计数。受试者在第二天早晨(第2次就诊,第1天)返回诊所以归还装置、评估生活质量测量值,并接受第一剂研究治疗。治疗期间的额外治疗就诊发生在第7±1天(第3次就诊)和第15±1天(第5次就诊)。受试者在第7±1天(第3次就诊)和第14天±1天(第4次就诊)的早晨到诊所就诊,并且分配lcm装置以测量24小时咳嗽计数。研究评估包括在每个治疗期的第1、7和15天评估生活质量(lcq和k-bild)、咳嗽严重程度(vas)、肺功能试验(第1秒用力呼气量(fev1)、用力肺活量[fvc]和fev1/fvc比率)、呼出的一氧化氮分数(feno)和安全性评估(ae、生命体征和ecg)。在最后一次研究治疗后7±2天内安排安全性随访通话。在每个治疗期的治疗开始和结束(在第1治疗期期间的筛选就诊和第5次就诊,以及第2治疗期期间的第2次就诊和第5次就诊)时收集临床安全性实验室样品。所有给药后研究程序均从时间0开始。时间0定义为每个期的第一次研究药物给予的开始(即,当雾化器已经打开时)。受试者在筛选就诊前至少2周内和整个研究期间不得使用下列药物(即泼尼松、麻醉性镇咳剂、巴氯芬、加巴喷丁、吸入性皮质类固醇、苯佐那酯、右美沙芬、喷托维林、和h1抗组胺药、白三烯调节剂和色甘酸钠)。在基线就诊前至少1周和研究期间不允许使用含有支气管扩张剂(包括β-2激动剂和抗胆碱能药)的药物。如表1中所示,pa101含有4%(按重量计)的色甘酸作为活性物质、0.2%氯化钠作为渗透剂、0.02%edta作为螯合剂、1.25%甘露醇作为非离子渗透剂、和充足的量的纯化水。pa101具有200mosm/kg的同渗重摩。该研究的主要目的是评估通过eflow雾化器递送的吸入的pa101治疗慢性特发性咳嗽的有效性。本研究设计以图表形式提供于图20中。慢性特发性咳嗽(cic)组群的纳入标准是:1)年龄在18至75岁之间的男性或女性受试者,包括端值,2)慢性咳嗽已出现至少8周,3)诊断为慢性特发性咳嗽(cic),其对鉴定的潜在诱因(即后鼻滴、哮喘性/非哮喘性嗜酸粒细胞性支气管炎和胃食管反流病)的靶向治疗无应答,4)筛选就诊时视觉模拟量表上咳嗽评分>40mm,5)在筛选就诊时使用客观咳嗽计数监测器,日间平均咳嗽计数为至少15次咳嗽/小时,以及6)愿意并有能力提供书面知情同意书。慢性特发性咳嗽(cic)组群的排除标准是:1)如研究者所确定的可能使受试者处于危险之中或损害研究数据质量的临床上显著的医疗状况、实验室异常或疾病的当前或近期病史,2)筛选就诊的4周内出现上呼吸道感染或下呼吸道感染,3)过去5年内治疗或未治疗的任何器官系统恶性肿瘤史,局部基底细胞癌或原位宫颈癌除外,4)过度使用或滥用酒精的当前或近期史(过去12个月),5)滥用合法药物或使用非法药物或物质的当前或近期史(过去12个月),5)在筛选就诊前4周内参与任何其他试验药研究,6)在筛选就诊的2周内使用以下药物:泼尼松、麻醉性镇咳剂、巴氯芬、加巴喷丁、吸入性皮质类固醇、苯佐那酯、右美沙芬、喷托维林、h1抗组胺药、白三烯调节剂和色甘酸钠,7)怀孕或哺乳期女性,或者在研究期间不愿意采取可接受的节育或禁欲手段(例如禁欲、联合屏障和杀精子剂,或荷尔蒙)的有生育潜力的女性,以及8)对色甘酸钠过敏或不耐受史。表31总结了cic组群人口统计学信息。表31.受试者数量(n)27年龄62±11(23-73岁)性别6名男性/21名女性种族2名非裔美国人/25名白种人bmi27.7±5.7自诊断以来的时间9.9±9.8(2-43岁)安全性结果:如实例4中所示,该研究表明使用pa101是安全的,因为在接受pa101的受试者和接受安慰剂的受试者中观察到的不良事件的数量在统计学上没有显著差异。表32总结了在cic组群的至少两个受试者中观察到的治疗紧急不良事件(ae)。表32.接受安慰剂的两名受试者退出研究,一名受试者在给药后经历喉咙痛和头痛(第1期-第3天),并且另一名受试者经历眩晕(第1期-第7天)。接受pa101的两名受试者退出该研究,一名受试者经历血管性水肿(被认为可能是对ip的过敏反应)(第2期-第6天),并且另一名受试者经历增加的咳嗽和呼吸短促(第2期-第7天)。功效结果:与实例4中提供的ipf组群的结果形成鲜明对比,该研究表明pa101对于治疗慢性特发性咳嗽无效。与接受安慰剂的cic受试者相比,接受pa101的cic受试者没有呈现统计学上显著的或临床相关的改善。咳嗽计数由莱斯特咳嗽监测仪(lcm)测量。表33提供了cic受试者的日间平均咳嗽/小时的总结。表33.表34提供了cic受试者的对数转化的日间平均咳嗽/小时从基线变化的总结。此数据以图表形式提供于图23中。表34.图21中提供了在基线和第14天,针对cic组群的个体日间平均咳嗽/小时比率。图22描绘了针对cic组群从基线对数转化的日间平均咳嗽/小时的变化。对于用pa101治疗相比于安慰剂治疗cic有应答的受试者数量如图24所示。图22中提供了在基线、第7天和第14天,针对cic组群的24小时平均咳嗽/小时比率。图25描绘了针对cic组群从基线对数转化的日间平均咳嗽/小时的变化。表35提供了cic受试者的对数转化的24小时平均咳嗽/小时从基线变化的总结。表35.除了使用lcm捕获的客观咳嗽/小时数据之外,还从研究受试者收集主观数据。通过莱斯特咳嗽问卷(lcq)测量生活质量评分。表36总结了使用莱斯特咳嗽问卷收集的数据,以评估从基线到第7天和第14天的生活质量变化。生活质量是第二阶段研究的次级终点。lcq:最差得分=3,最好得分=21;mid:>1.3。表36.表37总结了针对cic组群的莱斯特咳嗽问卷中从基线的变化。表37.该研究包括附加的主观测量:咳嗽严重程度,作为视觉模拟量表(vas)测量而定量提供。例如,当使用视觉模拟量表(vas)测量咳嗽严重程度时,受试者被要求在“不咳嗽”和“最严重咳嗽”之间的100mm范围上打分。表38提供了在针对cic组群的研究的第7天或第14天的治疗的每个参数的vas评分的平均值、标准差(sd)和中值。表38.表39总结了通过针对cic组群的vas评分测量的咳嗽严重程度从基线的变化。表39.表40a和40b总结了使用针对cic组群的日间平均计数的治疗期效果。表40a.表40b.总之,pa101具有用于治疗cic的非常好的安全性谱。在cic组群中使用pa101的功效结果并未表明使用计数咳嗽率的客观测量值的各治疗组之间存在统计学显著性差异。接受用于cic的pa101的那些受试者和那些接受用于cic的安慰剂的受试者在治疗开始后7天和14天呈现相似的结果。使用vas量表,咳嗽特定的生活质量测量值(lcq)或受试者报告的咳嗽严重程度方面没有出现有利趋势。结果不支持使用pa101用于治疗cic。实例6:色甘酸钠配制品用于治疗因ipf引起的慢性咳嗽与慢性特发性咳嗽(cic)。来自实例4的数据表明,本披露的组合物(其pa101是示例性配制品)对于治疗由ipf引起的慢性咳嗽是安全有效的。相反,来自实例5的数据表明,本披露的组合物(其pa101是示例性配制品)是安全的,但对于治疗慢性特发性咳嗽(cic)无效。为了进一步证明这一意外的临床结果,图26-29比较了患有由ipf引起的慢性咳嗽的受试者(实例4)与患有慢性特发性咳嗽(cic)的受试者(实例5)之间日间和24小时平均咳嗽/小时数据的结果。给予pa101(含有甘露醇)和pa101-b(不含甘露醇)的受试者中的药代动力学参数预期在患有与ipf相关的慢性咳嗽的受试者中相似。实例7:色甘酸钠配制品的稳定性本披露的组合物和配制品在物理和化学上都是稳定的。通过物理性质所示,表41表明,当每个配制品在25℃储存时,从制造到24个月时间点(即至少24个月),该配制品保持澄清,因此没有任何沉淀。通过物理性质所示,表42表明,当每个配制品在40℃储存时,从制造到24个月时间点(即至少24个月),该配制品保持澄清,因此没有任何沉淀。通过ph和同渗重摩的化学测量结果所示,表41表明,当每个配制品在25℃储存时,从制造到24个月时间点(即至少24个月),该配制品保持外观、ph、同渗重摩测定和相关物质的一致性。通过ph和同渗重摩的化学测量结果所示,表42表明,当每个配制品在40℃储存时,从制造到6个月时间点(即至少6个月),该配制品保持外观、ph、同渗重摩测定和相关物质的一致性。表41:25℃时的稳定性数据。表42;40℃时的稳定性通过引用并入除非明确排除或另外限制,在此引用的每一文献,包括任何交叉引用或相关专利或申请,特此通过引用以其全文结合在此。任何文献的引用都不是承认其是关于本文所披露的或所请求保护的任何发明的现有技术,也不承认其单独或与任何其他一篇或多篇参考文献组合教导、提示或披露任何此类发明。此外,在本文献中术语的任何含义或定义与通过引用结合的本文献中相同术语的任何含义或定义发生冲突的程度上,将以本文献中该术语指定的含义或定义为准。其他实施例虽然对本披露的具体的实施例进行了说明与描述,但在不偏离本披露的精神和范围时可以进行各种不同的变化和修改。所附权利要求的范围包括在本披露的范围内的所有此类变化和修改。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1