生物体物质测定装置以及生物体物质测定方法与流程
本发明涉及生物体物质测定装置以及生物体物质测定方法,特别涉及使用红外光来测定存在于生物体内的糖等生物体物质的生物体物质测定装置以及生物体物质测定方法。
背景技术:
以往的侵袭型传感器使用针来进行采血,解析生物体中的物质的成分。特别,关于日常地利用的血糖值传感器,为了缓和穿刺所致的患者的痛苦,要求非侵袭方式。作为非侵袭的血糖值传感器,有能够直接检测糖的指纹谱(fingerprintspectrum)的利用红外光的传感器,但红外光由于水的吸收强而无法从皮肤表面到达至深处。因此,要求即使生物体中的糖所致的吸收小仍稳定并且高精度地检测血糖值的技术。
针对这样的要求,例如,在专利文献1记载的装置中,通过使用atr(attenuatedtotalreflection,衰减全反射)棱镜的测定使sn比提高。在atr棱镜中传输的红外光在被测定皮肤与atr棱镜的边界面中反复反射。在反射的边界面中发生瞬逝光并侵入到被测定皮肤。瞬逝光被水、糖、以及其他生物体物质吸收以及散射,所以在atr棱镜中传输的红外光的强度衰减。因此,反复反射的次数越多,传输的红外光的强度越衰减。在该文献中,通过作为红外光源使用半导体的量子级联,能够实现使可搭载于便携电话的程度的小型化。
在专利文献2中,记载了在棱镜与致动器之间配置被测定物,使用致动器使施加到被测定物的压力变化,测定红外吸收光谱的装置。
现有技术文献
专利文献
专利文献1:日本特开2003-42952号公报
专利文献2:日本特开2003-35661号公报
技术实现要素:
皮肤包括表面附近的表皮和表皮下的真皮。表皮从表面附近起依次包含角质层、颗粒层、有棘层、以及基底层。认为糖、以及其他生物体物质存在于表皮中的组织间质液中,反映表皮的构造而在深度方向上不均匀地分布。
在由于atr棱镜和皮肤表面的接触,而表皮受到应力时,在表皮的构造中产生形变。在atr棱镜和皮肤表面的接触状态变化时,皮肤表面从atr棱镜接受的接触应力发生变化,所以表皮内的组织间质液的分布也变化,在被糖以及其他生物体物质吸收的红外光的瞬逝光的强度中产生偏差。
在专利文献2中,使被测定材料与棱镜密接并对被测定材料周期性地施加压力而根据压力变化取出调制信号,但在生物体是被测定物的情况下,难以使被测定材料侧的压力周期性地变化。
因此,本发明的目的在于提供一种能够防止由于atr棱镜与被测定皮肤之间的接触状态而被测定皮肤内的生物体物质的量的测定精度劣化的生物体物质测定装置以及生物体物质测定方法。
为了解决上述课题,本发明的生物体物质测定装置具备:atr棱镜,能够与被测定皮肤密接;红外光源,向atr棱镜放射生物体物质的吸收波长的全部区域或者一部分的波长区域的红外光;红外光检测器,检测从atr棱镜射出的红外光;棱镜振动控制部,安装于atr棱镜,使atr棱镜在与atr棱镜和被测定皮肤的接触面垂直的方向上振动;以及控制部,与振动同步地使红外光检测器检测红外光。
根据本发明,通过使atr棱镜在与atr棱镜和被测定皮肤的接触面垂直的方向上振动,与振动同步地检测红外光,能够防止由于atr棱镜与被测定皮肤之间的接触状态而被测定皮肤内的生物体物质的量的测定精度劣化。
附图说明
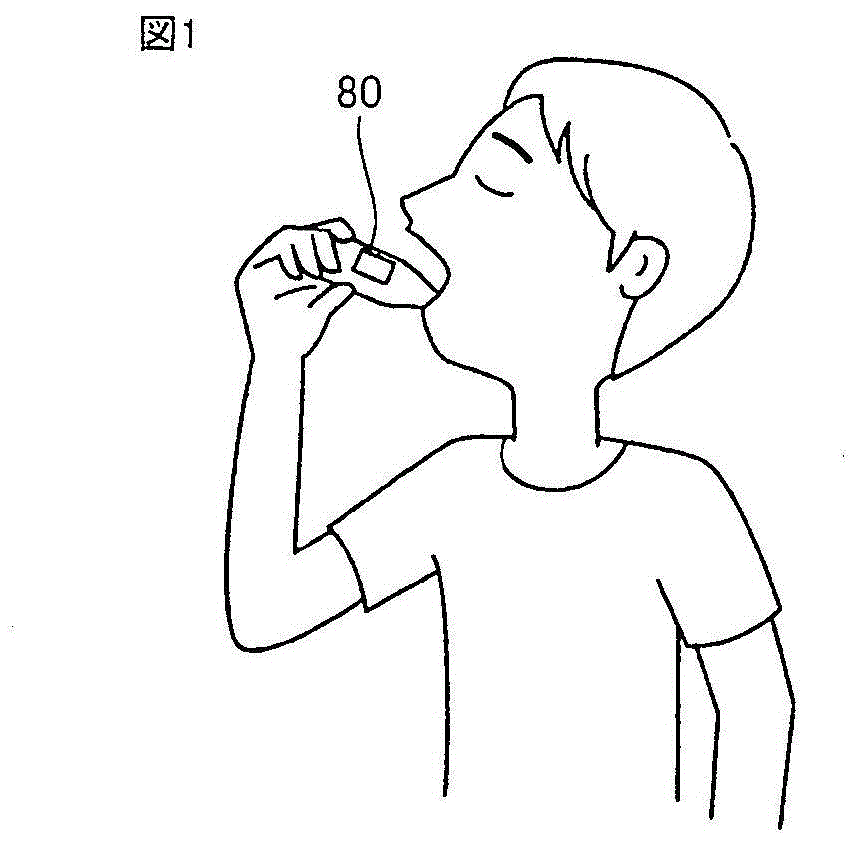
图1是示出实施方式1~5的便携型的非侵袭的血糖值传感器80的使用例的图。
图2是示出实施方式1的便携型的非侵袭的血糖值传感器80的结构的图。
图3是示出实施方式1的便携型的非侵袭的血糖值传感器80的结构的图。
图4是示出糖的指纹谱的图。
图5是示出实施方式1中的血糖值传感器80的动作步骤的流程图。
图6是示出实施方式2中的便携型的非侵袭的血糖值传感器80的动作步骤的流程图。
图7是示出测定定时k×t/8、和σdsk的例子的图。
图8是将图7的横轴的测定定时改变为atr棱镜20的向皮肤表面60的押入距离的图。
图9是示出实施方式3的便携型的非侵袭的血糖值传感器80的结构的图。
图10是示出锁定放大器70的结构的图。
图11是示出实施方式3中的血糖值传感器80的动作步骤的流程图。
图12是示出某个折射率n1和n2下的相对红外光的入射角的瞬逝光的侵入长度的例子的图。
图13是示出实施方式4的便携型的非侵袭的血糖值传感器80的结构的图。
图14是示出实施方式5的便携型的非侵袭的血糖值传感器80的结构的图。
(附图标记说明)
11a:入射红外光;11b:传输红外光;11c:放射红外光;20:atr棱镜;20a、20b、20c、20d:atr棱镜端面;30:红外光检测器;32:红外光源;40:被测定皮肤;50:控制部;52:棱镜振动控制部;54:显示器;60:皮肤表面;80:血糖值传感器;81:前置放大器;82:波形整形电路;83:相位电路;84:psd;85:lpf;90a、90b:角度调整部。
具体实施方式
以下,使用附图说明本发明的实施方式。
实施方式1.
以下,作为测定对象以血糖值为例子进行说明,但本发明的测定装置不限定于血糖值的测定,而还能够应用于其他生物体物质的测定。
图1是示出实施方式1~5的便携型的非侵袭的血糖值传感器80的使用例的图。
如图1所示,使便携型的非侵袭的血糖值传感器80的头接触到被检者的角质薄的唇,测定被检者的生物体内的血糖值。被测定部位最好为角质薄的唇,但不限于此,是如手掌那样的角质厚的部位以外即可。例如,在脸颊、耳垂、手背中也能够测定。
图2以及图3是示出实施方式1的便携型的非侵袭的血糖值传感器80的结构的图。在图2和图3中,非侵袭的血糖值传感器80和被测定皮肤40的接触状态不同。
如图2以及图3所示,非侵袭的血糖值传感器80具备atr棱镜20、棱镜振动控制部52、红外光源32、红外光检测器30、控制部50、以及显示器54。
红外光源32将生物体物质的吸收波长的全部区域、或者一部分的波长区域的红外光放射到atr棱镜20。
红外光检测器30检测从atr棱镜20射出的红外光。在此,检测的值既可以是某个波长的光的强度(功率)、或者也可以是光谱。以下,说明为检测某个波长的强度。
控制部50控制棱镜振动控制部52、红外光源32、以及红外光检测器30。控制部50根据由红外光检测器30检测出的红外光的强度,检测生物体中的血糖值的浓度。
在非侵袭的血糖值传感器80的头中,搭载有atr棱镜20。at棱镜20与被测定皮肤40的皮肤表面60接触。
图4是示出糖的指纹谱的图。
在使atr棱镜20接触到被检者的皮肤表面60并起动非侵袭的血糖值传感器80时,从红外光源32放射包含糖的指纹谱的波长范围8.5μm~10μm的全部的波长区域、或者其一部分的波长区域的红外光。从红外光源32射出的入射红外光11a在atr棱镜20的端面20c反射,成为传输红外光11b。传输红外光11b一边在atr棱镜20的端面20a以及20b反复反射,一边透射与被测定皮肤40接触的atr棱镜20的内部。在atr棱镜20内透射的传输红外光11b在atr棱镜20的端面20d反射,成为放射红外光11c。由红外光检测器30检测放射红外光11c的强度。
在atr棱镜20和被测定皮肤40的界面(端面20a)中,发生瞬逝光。该瞬逝光侵入到被测定皮肤40内,被糖吸收。
在被测定皮肤40和atr棱镜20的折射率差小时,瞬逝光变大。另外,在界面(端面20a)反射时从atr棱镜20向被测定皮肤40侧渗出的瞬逝光被被测定皮肤40内的生物体物质吸收,从而在端面20a反射的红外光的强度衰减。因此,在生物体物质多时,瞬逝光受到更多的吸收,所以反射的红外光的强度的衰减也变大。
皮肤包括表面附近的表皮、和表皮下的真皮。表皮从表面附近依次包含角质层、颗粒层、有棘层、以及基底层。各自的厚度是10μm、几μm、100μm、几μm程度。在基底层中生成细胞,在有棘层中堆积细胞。在颗粒层中,水分(组织间质液)无法到达,所以细胞死绝。在角质层中,死亡的细胞成为硬化的状态。糖以及其他生物体物质存在于表皮中的组织间质液中。组织间质液从角质层到有棘层增加。因此,根据瞬逝光的侵入长度,反射的红外光的强度也变化。在此,侵入长度还被称为侵入深度。
瞬逝光从界面向被测定皮肤40的方向按照指数函数衰减,其侵入长度是波长程度。因此,在使用atr棱镜20的分光中,能够测定直至侵入长度的区域的生物体物质的量。例如,糖的指纹谱由于波长为8.5μm~10μm,所以能够检测从atr棱镜20的棱镜面起该程度的区域的糖的量。
atr棱镜20具有长方体的一部分被削去的形状。atr棱镜的剖面具有将长方形的2个顶角以一定角度削去的形状。顶角被削去的短的一方的面作为测定面与被测定皮肤40接触。atr棱镜20的端面20c的角度被设定成在atr棱镜20的端面20a以及20b中,atr棱镜20内的传输红外光11b反射。另外,atr棱镜20的端面20d的角度被设定成放射红外光11c朝向红外光检测器30。例如,atr棱镜20的端面20d的角度被设定成放射红外光11c垂直地入射到红外光检测器30。
红外光源32和atr棱镜20被配置成红外光从红外光源32向atr棱镜20入射的入射角保持恒定。来自红外光源32的入射红外光11a入射的端面20c以及放射红外光11c向红外光检测器30射出的端面20d被实施无反射涂敷。或者,也可以使来自红外光源32的入射红外光11a成为p偏振光,以使入射/射出角成为布儒斯特角的方式,削去入射面20c以及射出面20d。
作为atr棱镜20的材料,使用在中红外区域中透明、并且折射率比较小的硫化锌(zns)的单结晶。此外,atr棱镜20的材料不限定于硫化锌(zns)的单结晶,也可以是如硒化锌(znse)的公知的材料。在atr棱镜20的与被测定皮肤40的接触面20a,为了不对人体造成伤害,涂敷有sio2、sin等的薄膜。
作为红外光源32,使用例如宽频带的量子级联激光模块。量子级联激光器是单一光源,由于输出大且sn比(signal-to-noiseratio)高,所以能够进行高精度的测定。在量子级联激光模块中,搭载用于使光束准直的透镜。宽频带的量子级联激光器放射糖的指纹谱所存在的波长范围8.5μm~10μm的所有波长区域、或者一部分的波长区域的红外光。
除了宽频带的量子级联激光器以外,作为红外光源32也可以使用在灯丝中流过电流而加热的类型的热光源。在该情况下,能够通过施加的电流的量控制温度,所以被放射依照黑体放射的宽频带的红外线。或者,也可以作为红外光源32,并非灯丝,而使用在加热部中设置有周期图案的等离子体激元或者超材料光源。在该情况下,放射波长区域被表面构造规定,所以不需要的放射被抑制,所以红外光源32成为高效的光源。
用红外光检测器30接受从atr棱镜20放射的放射红外光11c。红外光检测器30检测从atr棱镜20释放的射出光。在此,检测的值既可以是光谱,也可以是某个波长的功率。红外光检测器30也可以包括检测分别不同的波长的光的非冷却红外线传感器的阵列。非冷却红外线传感器也可以在受光部表面包括利用等离子体激元共振的波长选择型吸收体。作为非冷却红外线传感器(热型的红外线传感器),能够使用热电型的传感器、或者包括辐射热计、热电堆、或者soi(silicononinsulator)型二极管的传感器。
根据atr棱镜20和被验者的皮肤表面60的接触状态,在被测定皮肤40的构造中发生形变,或者atr棱镜20与皮肤表面60之间的水、油脂等的厚度变化,瞬逝光到达的场所发生变化。例如,由于按押atr棱镜20的力,角质层的厚度增减,瞬逝光到达或者不到达颗粒层、有棘层。
因此,在本实施方式中,使用棱镜振动控制部52,使atr棱镜20振动。一边使atr棱镜20振动,一边从红外光源32释放红外光,通过红外光检测器30检测红外光。此时,由控制部50同步控制棱镜振动控制部52和红外光检测器30。
棱镜振动控制部52安装于atr棱镜20,使atr棱镜20在与作为atr棱镜20和被测定皮肤40的接触面的皮肤表面60垂直的方向上振动。棱镜振动控制部52例如通过依照来自控制部50的信号变位或者伸缩,使atr棱镜20振动。棱镜振动控制部52例如也可以包括压电致动器等。控制部50与atr棱镜20的振动同步地使红外光检测器30检测红外光。
在图3中,示出通过棱镜振动控制部52使atr棱镜20振动,atr棱镜20被押入到皮肤表面60的情形。
不论在图2的状态和图3的状态中的哪一个,atr棱镜20都与皮肤表面60相接,但在图2的状态和图3的状态中,向皮肤表面60的押入的程度不同。
如图2所示,在atr棱镜20的振动的1个周期的期间,atr棱镜20与皮肤表面60接触。将在atr棱镜20的振动的1个周期的期间,atr棱镜20不被向被测定皮肤40的方向压入,使最小压力作用于作为atr棱镜20和被测定皮肤40的接触面的皮肤表面60的状态,称为弱密接状态。
如图3所示,将在atr棱镜20的振动的1个周期的期间,atr棱镜20被向被测定皮肤40的方向最大幅押入,使最大压力作用于作为atr棱镜20和被测定皮肤40的接触面的皮肤表面60的状态,称为强密接状态。
通过棱镜振动控制部52,atr棱镜20反复进行将图3的弱密接状态→图4的强密接状态→图3的弱密接状态的状态转移作为1个周期的振动动作。在此,振动的振幅、即弱密接状态和强密接状态的押入距离差可以是几mm以下。
红外光检测器30与棱镜振动控制部52的动作同步地检测从atr棱镜20释放的放射红外光11c。通常,在由红外光检测器30检测的放射红外光11c中,混入谱信号、外部环境以及检测器自身的电噪声信号。进而,在接触状态的atr棱镜20与被检者的皮肤表面60之间有间隙时,成为噪声的原因,测定值的信噪比s/n劣化,并且瞬逝光的侵入长度也变短。
因此,在1个周期的振动期间,通过红外光检测器30,等间隔地检测多次放射红外光11c。在本实施方式中,关于红外光检测器30,在1个周期中,用红外光检测器30,等间隔地检测2次放射红外光11c。在此,为了得到高的检测灵敏度,将2次的检测定时设为成为图3的弱密接状态的定时、和成为图4的强密接状态的定时。
而且,控制部50将在图3的弱密接状态时由红外光检测器30检测出的放射红外光11c的强度设为s(a),将在图4的强密接状态时由红外光检测器30检测出的放射红外光11c的强度设为s(b),计算差分ds(=s(a)-s(b))。控制部50通过多次的测定,求出多个ds,计算其合计σds。
图5是示出实施方式1中的血糖值传感器80的动作步骤的流程图。
在步骤s100中,红外光源32输出红外光。
在步骤s101中,使atr棱镜20与被检者的皮肤表面60接触。
在步骤s102中,控制部50设定取得限度次数n。
在步骤s103中,控制部50通过使棱镜振动控制部52的振动开始,使atr棱镜20的振动开始。
上述步骤s100~s103的处理顺序也可以调换。
在步骤s104以及s105中,与atr棱镜20的振动同步地,红外光检测器30检测s(a)和s(b)。在步骤s104中,控制部50在弱密接状态下,使红外光检测器30检测放射红外光11c的强度,输出到控制部50。控制部50将取得的放射红外光11c的强度设为s(a)。在步骤105中,控制部50在强密接状态下,使红外光检测器30检测放射红外光11c的强度,输出到控制部50。控制部50将取得的放射红外光11的强度设为s(b)。在此,步骤s104和步骤s105也可以调换顺序。
在步骤s106中,控制部50计算并保存ds=s(a)-s(b)。为了计算被测定皮肤40内的糖的量,在使atr棱镜20振动之前,通过人手使atr棱镜20和被测定皮肤40接触而进行测定的准备的情况下,难以每次测定时使atr棱镜20与被测定皮肤40之间的间隙的大小等成为恒定。即,难以通过人手准确地做出初始状态的弱密接状态。因此,s(a)和s(b)针对每次测定成为偏移的值,但通过取s(a)和s(b)的差分,能够得到不受到每次测定的偏差的影响的值。即,ds能够高精度地反映被测定皮肤40中的糖的量。
在步骤s107中,控制部50比较此前的ds的取得次数n和在步骤s103中设定的取得限度次数n。如果取得次数n小于取得限度次数n,则处理返回到步骤s104,反复步骤s104~107的处理。在取得次数n等于取得限度次数n时,处理进入到步骤s108。
在步骤s108中,控制部50计算所保存的所有ds的合计σds。求出合计σds是为了使测定误差平滑化。也可以通过将合计σds进一步除以取得限度次数n,求出平均值σds/n。
在步骤s109中,控制部50在显示器54上显示计算出的σds的值。
在此,关于步骤103的取得限度次数n,用户或者设计者能够自由地决定,通过增加取得限度次数n,在步骤108中得到的σds的信噪比s/n变得良好,另一方面,测定所花费的时间也增加。
如以上所述,根据本实施方式,能够与atr棱镜20的振动同步地,检测从atr棱镜20放射的红外光。通过求出atr棱镜20与被测定皮肤40处于强密接状态下的红外光的强度和弱密接状态下的红外光的强度的差分,能够高精度地测定被测定皮肤40内的生物体物质的量。
(附记)
实施方式1的生物体物质测定装置(80)以及生物体物质测定方法具备以下的特征。
(1)生物体物质测定装置(80)具备:atr棱镜(20),能够与被测定皮肤(40)密接;红外光源(32),向atr棱镜(20)放射生物体物质的吸收波长的全部区域、或者一部分的波长区域的红外光;红外光检测器(30),检测从atr棱镜(20)射出的红外光;棱镜振动控制部(52),安装于atr棱镜(20),使atr棱镜(20)在与atr棱镜(20)和被测定皮肤(40)的接触面垂直的方向上振动;以及控制部(50),与振动同步地使红外光检测器(30)检测红外光。
由此,能够高精度地测定被测定皮肤(40)内的生物体物质的量。
(2)棱镜振动控制部(32)使atr棱镜(20)周期性地振动。控制部(50)使红外光检测器(30)在atr棱镜(20)的振动的1个周期的期间,检测2次以上红外光。
由此,能够得到高的检测灵敏度。
(3)控制部(50)使红外光检测器(30)在振动的1个周期的期间使最小压力作用于atr棱镜(20)和被测定皮肤(40)的接触面的弱密接状态的定时,检测红外光,并且在振动的1个周期的期间使最大压力作用于atr棱镜(20)和被测定皮肤(40)的接触面的强密接状态的定时,检测红外光。
由此,能够得到更高的检测灵敏度。
(4)控制部(50)计算在振动的1个周期的期间的弱密接状态的定时检测出的红外光的检测值、和在振动的1个周期的期间的强密接状态的定时检测出的红外光的检测值的差分。
由此,不会受到每次测定的atr棱镜(20)和被测定皮肤(40)的密接状态的偏差的影响,而能够测定生物体物质的量。
(5)控制部(50)在多个周期中计算多个差分,计算所计算出的多个差分的合计或者平均。
由此,能够去除包含于测定值的噪声分量。
(6)生物体物质测定方法具备:红外光源(32)放射生物体物质的吸收波长的全部区域、或者一部分的波长区域的红外光的步骤;atr棱镜(20)在与被测定皮肤(40)接触的状态下,接受从红外光源(32)释放的红外光,并使红外光透射atr棱镜(20)的内部之后,射出到外部的步骤;使atr棱镜(20)在与atr棱镜(20)和被测定皮肤(40)的接触面垂直的方向上振动的步骤;红外光检测器(30)在振动的1个周期的期间使最小压力作用于atr棱镜(20)和被测定皮肤(40)的接触面的弱密接状态的定时,检测从atr棱镜(20)射出的红外光的步骤;红外光检测器(30)在振动的1个周期的期间使最大压力作用于atr棱镜(20)和被测定皮肤(40)的接触面的强密接状态的定时,检测从atr棱镜(20)射出的红外光的步骤;以及计算在振动的1个周期的期间的弱密接状态的定时检测出的红外光的检测值、和在振动的1个周期的期间的强密接状态的定时检测出的红外光的检测值的差分的步骤。
由此,能够高精度地测定被测定皮肤(40)内的生物体物质的量。
实施方式2.
实施方式2的非侵袭的血糖值传感器80的结构相比于实施方式1的非侵袭的血糖值传感器的结构,除了控制部50的功能以外相同。
实施方式2与实施方式1的相异点是使atr棱镜20的1个周期的振动期间的红外光检测器30中的放射红外光11c的检测次数比2次更多。在本实施方式中,红外光检测器30例如在atr棱镜20的1个周期的振动期间,等间隔地检测8次放射红外光11c的强度。
将atr棱镜20的振动的振幅设为d,将振动的周期设为t,将1个周期的期间的采样次数设为8次。关于采样次数,也可以在希望更粗地测定的情况下比8次少,在希望更细地测定的情况下比8次多,但采样间隔成为等间隔。
图6是示出实施方式2中的便携型的非侵袭的血糖值传感器80的动作步骤的流程图。
步骤s200~s203与实施方式1的步骤s100~s103相同,所以不反复说明。
在步骤s204以及s205中,与振动同步地,红外光检测器30检测s0~s7。在步骤s204中,控制部50在弱密接状态下,使红外光检测器30检测放射红外光11c的强度,输出到控制部50。控制部50将取得的放射红外光11c的强度设为s0。此外,测定的开始定时既可以是弱密接状态也可以是强密接状态,但在图6中,将弱密接状态作为开始定时。
在步骤s205中,控制部50在从步骤s204每经过t/8周期,使红外光检测器30检测放射红外光11c,输出到控制部50。控制部50将依次取得的放射红外光11c的强度设为s1、s2、s3、s4、s5、s6、s7。
在步骤s206中,控制部50计算并保存在步骤s204中取得的s0和在步骤s205中取得的s1~s7的值的差分ds1(=s0-s1)、ds2(=s0-s2)、ds3(=s0-s3)、ds4(=s0-s4)、ds5(=s0-s5)、ds6(=s0-s6)、ds7(=s0-s7)。这样,求出ds1~ds7是为了获知被测定皮肤40内的从皮肤表面60起的每个深度的糖的分布。例如,ds2和ds1的差成为表示与从弱密接状态的定时起t/8的定时下的瞬逝光的侵入长度对应的皮肤表面60的深度下的糖的量、和与从弱密接状态的定时起2t/8的定时下的瞬逝光的侵入长度对应的皮肤表面60的深度下的糖的量的差的值。
在步骤s207中,控制部50比较此前的各dsi(i~7)的取得次数n和在步骤s203中设定的取得限度次数n。如果取得次数n小于取得限度次数n,则处理返回到步骤s204,反复步骤s204~207的处理。在取得次数n等于取得限度次数n时,处理进入到步骤s208。
在步骤s208中,控制部50计算所保存的所有ds1、ds2、ds3、ds4、ds5、ds6、ds7的合计σds1、σds2、σds3、σds4、σds5、σds6、σds7。例如,σds1成为n次的测定中的ds1的合计。求出合计σds是为了使测定误差平滑化。也可以通过将合计σds1~σds7进而除以取得限度次数n,求出平均值σds1/n~σds7/n。
在步骤s209中,控制部50在显示器54上显示计算出的σds1、σds2、σds3、σds4、σds5、σds6、σds7的值。
图7是示出测定定时k×t/8、和σdsk的例子的图。
在图7中,横轴表示测定定时、即令atr棱镜20以周期t振动时的利用红外光检测器30的放射红外光11c的检测定时。纵轴表示各个定时k×t/8下的合计σdsk。
预先判明atr棱镜20的振动振幅d,所以控制部50能够将图7的测定定时,变换为atr棱镜20对被测定皮肤40的垂直方向的押入距离。变换为被测定皮肤40的垂直方向的距离。即,测定定时0、t/8、2t/8、3t/8、4t/8、5t/8、6t/8、7t/8被变换为atr棱镜20对被测定皮肤40的垂直方向的押入距离0、d/4、d/2、3d/4、d、3d/4、d/2、d/4。
图8是将图7的横轴的测定定时改变为atr棱镜20对被测定皮肤40的向垂直方向的押入距离的图。
如图7、图8所示,σdsk的值在测定定时t/2、押入距离d下取极小值,之后折返。
如以上所述,在实施方式2中,能够得到与从皮肤表面起的每个深度的糖的分布有关的信息。
(附记)
实施方式2的生物体物质测定装置(80)以及生物体物质测定方法具备以下的特征。
(1)控制部(50)使红外光检测器(30)在atr棱镜(20)的振动的1个周期的期间,在3次以上的定时检测红外光。
由此,能够测定从被测定皮肤(40)的表面起垂直方向的生物体物质的分布。
(2)控制部(50)使红外光检测器(30),在振动的1个周期的期间使最小压力作用于atr棱镜(20)和被测定皮肤(40)的接触面的弱密接状态的定时,检测红外光,将在振动的1个周期的期间的弱密接状态的定时检测出的红外光的检测值、和在振动的1个周期的期间的3次以上的定时中的弱密接状态的定时以外的各定时检测出的红外光的检测值的差分,计算为各定时下的差分。
由此,能够细致地测定从被测定皮肤(40)的表面起垂直方向的生物体物质的分布。
(3)控制部(50)在多个周期中计算多个各定时下的差分,计算所计算出的多个各定时下的差分的合计或者平均。
由此,能够去除包含于测定值的噪声分量。
(4)控制部(50)将红外光的检测定时变换为atr棱镜(20)对被测定皮肤(40)的垂直方向的押入距离。
由此,能够测定从被测定皮肤(40)的表面起垂直方向的多个距离的每一个的生物体物质的量。
(5)控制部(50)使红外光检测器(30)在1个周期的期间,以相等的时间间隔检测红外光。
由此,能够测定从被测定皮肤(40)的表面起在垂直方向上每隔一定间隔存在的生物体物质的量。
(6)生物体物质测定方法具备:红外光源(32)放射生物体物质的吸收波长的全部区域、或者一部分的波长区域的红外光的步骤;atr棱镜(20)在与被测定皮肤(40)接触的状态下,接受从红外光源(32)释放的红外光,并一边使红外光反复反射一边透射atr棱镜(20)的内部之后,射出到外部的步骤;使atr棱镜(20)在与atr棱镜(20)和被测定皮肤(40)的接触面垂直的方向上振动的步骤;红外光检测器(30)在振动的1个周期的期间使最小压力作用于atr棱镜(20)和被测定皮肤(40)的接触面的弱密接状态的定时,检测从atr棱镜(20)射出的红外光的步骤;红外光检测器(30)在振动的1个周期的期间除了弱密接状态以外的2次以上的定时,检测从atr棱镜(20)射出的红外光的步骤;以及计算在振动的1个周期的期间的弱密接状态的定时检测出的红外光的检测值、和在弱密接状态以外的2次以上的定时中的各定时检测出的红外光的检测值的差分的步骤。
由此,能够测定从被测定皮肤(40)的表面起垂直方向的生物体物质的分布。
实施方式3.
图9是示出实施方式3的便携型的非侵袭的血糖值传感器80的结构的图。
如图9所示,血糖值传感器80具备红外光源32、atr棱镜20、红外光检测器30、棱镜振动控制部52、控制部50、以及锁定放大器70。
实施方式3的血糖值传感器80的结构与实施方式1或者2的血糖值传感器80的结构的相异点是实施方式3的血糖值传感器80具备锁定放大器70。
由红外光检测器30检测出的表示放射红外光11c的强度的测定信号被输入到锁定放大器70。该测定信号是微弱的信号。在检测微弱的信号的情况下,被噪声大幅影响,所以需要去除噪声。作为噪声的去除的方法,可以举出使用带通滤波器。在带通滤波器中使用的元件变动时,中心频率变动,对信号的振幅造成影响,所以带通滤波器不适合于检测微弱的信号。
在本实施方式中,为了检测被噪声淹没的作为微小信号的测定信号,利用使用锁定放大器70的频率变换技术。在频率变换技术中,利用psd(phasesensitivedetector,相敏检波器),从被噪声淹没的信号中,取出作为目的的微弱的信号。通过锁定放大器70的噪声去除得到的信号是直流,所以频带限制的滤波器仅为低通滤波器就够。关于低通滤波器,即使使用的元件变动,仅低通滤波器的截止频率变动,不会对直流信号的值造成影响。
图10是示出锁定放大器70的结构的图。
锁定放大器70具备前置放大器81、波形整形电路82、相位电路83、psd84、以及lpf(low-passfilter,低通滤波器)85。
对锁定放大器70,输入表示放射红外光11c的强度的测定信号s(t)。在将atr棱镜20的频率设为f时,用s(t)=asin(ωt+a)表示。其中,ω=2πf。另外,对锁定放大器70,输入参照信号r(t)。用r(t)=asin(ωt+b)表示。
前置放大器81将测定信号s(t)放大为期望的电压。
波形整形电路82将参照信号r(t)整形为矩形波。相位电路83调整矩形波的参照信号r′(t)与测定信号s(t)之间的相位差。具体而言,相位电路83将参照信号r′(t)与测定信号s(t)之间的相位差(a-b)调整为“0”。
psd84进行测定信号s(t)和参照信号r′(t)的信号波形的乘法(乘法运算)。通过调整为a=b,利用psd84,得到最大的直流分量a/2×cos(b-a)(=a/2)、和2倍的频率的交流分量a/2×cos(2ωt+a+b)(=a/2×cos(2ωt+2a))。
lpf85通过从psd84的输出信号去除交流分量而取出直流分量,输出测定信号s(t)的直流分量。由此,能够仅将被噪声淹没的目的信号取出为直流量的最大值。
图11是示出实施方式3中的血糖值传感器80的动作步骤的流程图。
从红外光源射出的红外光在atr棱镜内反复反射,入射到红外光检测器,但由红外光检测器检测的信号有时为微弱信号,所以需要得到高的信噪比sn的信号。
在步骤s300中,红外光源32输出红外光。
在步骤s301中,使atr棱镜20与被检者的皮肤表面60接触。
在步骤s302中,控制部50设定atr棱镜20的变位的频率f。
在步骤s303中,控制部50通过使棱镜振动控制部52的频率f下的振动开始,使atr棱镜20的变位的频率f下的振动开始。
此时,atr棱镜20的振动是在振动的上下动作中,不离开作为测定对象的被检者的皮肤表面60的动作幅度即可,是例如在图3的弱密接状态和图4的强密接状态之间来回的动作即可。
在步骤s304中,控制部50使红外光检测器30,以预定的间隔检测放射红外光11c的强度,输出到控制部50。控制部50生成表示取得的放射红外光11的强度的测定信号s(t)。
在步骤s305中,控制部50将频率f的参照信号r(t)=asin(ωt+b)输出到锁定放大器70。
在步骤s306中,锁定放大器70的前置放大器81将从红外光检测器30以预定的间隔输出的表示放射红外光11c的强度的测定信号s(t),放大为期望的电压。锁定放大器70的波形整形电路82将参照信号r(t)整形为矩形波。锁定放大器70的相位电路83将矩形波的参照信号r′(t)与测定信号s(t)之间的相位差调整为“0”。锁定放大器70的psd84进行测定信号s(t)和参照信号r′(t)的信号波形的乘法(乘法运算)。通过利用相位电路83将相位差调整为“0”,psd84输出最大的直流分量、和2倍的频率的交流分量。
在步骤s307中,锁定放大器70的lpf85通过从psd84的输出信号去除交流分量而取出直流分量,输出测定信号s(t)的直流分量。在用asin(ωt+a)表示测定信号s(t)的情况下,输出a/2。
如以上所述,根据本实施方式,得到目的信号的最大的直流值,能够提高测定精度。
(附记)
实施方式3的生物体物质测定装置(80)具备以下的特征。
(1)生物体物质测定装置(80)还具备被输入从红外光检测器(30)输出的信号的锁定放大器(70)。
由此,即使从红外光检测器(30)输出的信号是被噪声淹没的微小的大小,也能够检测。
(2)控制部(50)以使atr棱镜(20)以与输入到锁定放大器(70)的参照信号的频率相同的频率振动的方式,控制棱镜振动控制部(52)。
由此,锁定放大器(70)输出从红外光检测器(30)输出的信号的最大的直流值,所以能够提高测定精度。
实施方式4.
如在上述实施方式中的说明,在反射的边界面中发生瞬逝光而侵入到被测定皮肤。此时,瞬逝光被水、糖、以及其他生物体物质吸收以及散射,所以在atr棱镜20中传输的红外光的强度衰减。通过棱镜的折射率n1、被测定物的折射率n2、入射角θ、使用波长λ,用以下的式,表示该瞬逝光的侵入长度dp。
[式1]
图12是示出某个折射率n1和n2下的相对红外光的入射角的瞬逝光的侵入长度的例子的图。
如图12所示,在入射角40°下,瞬逝光的侵入长度成为极大值。仅通过将入射角改变少许,瞬逝光的侵入长度大幅变化。
图13是示出实施方式4的便携型的非侵袭的血糖值传感器80的结构的图。图13的血糖值传感器80与图2的实施方式1的血糖值传感器80的相异点是图13的血糖值传感器80具备角度调整部90a以及90b。
角度调整部90a设置于红外光源32与atr棱镜20之间。角度调整部90a包括反射镜或者透镜。角度调整部90a调整向atr棱镜20的红外光的入射角。
角度调整部90b设置于atr棱镜20与红外光检测器30之间。角度调整部90b包括反射镜或者透镜。角度调整部90b以使从atr棱镜20射出的红外光朝向红外光检测器30的方式,调整红外光的行进方向。
在将瞬逝光的侵入长度成为极大值的向atr棱镜20的红外光的入射角设为θ0时,角度调整部90a在侵入长度可担保的范围内,使入射角以θ0为中心而周期性地变化。由此,向atr棱镜20的入射角以恒定的幅度振动,瞬逝光的侵入长度按照大→小→大周期性地变化。角度调整部90b与角度调整部90a同步地,调整来自atr棱镜20的射出光的角度。
atr棱镜20的端面20d的角度被设定为在不存在角度调整部90a时,放射红外光11c垂直地入射到红外光检测器30。通过利用角度调整部90a调整红外光的入射角,从atr棱镜20射出的红外光的射出角变化,但通过利用角度调整部90b调整从atr棱镜20射出的红外光的行进方向,能够使放射红外光11c垂直地入射到红外光检测器30。能够预先求出相对利用角度调整部90a的入射角的调整量,应将角度调整部90b的角度的调整量设定为多少。
在图12的例子中,以使向atr棱镜20的红外光的入射角周期性地变化为38°→41°→38°的方式,角度调整部90a周期性地调整向atr棱镜20的红外光的入射光的角度。以使从atr棱镜20射出的红外光垂直地入射到红外光检测器30的方式,角度调整部90b与角度调整部90a同步地,周期性地调整从atr棱镜20射出的红外光的行进方向。
角度调整部90a以及角度调整部90b的角度的调整周期与实施方式1中的棱镜振动控制部52的振动周期一致。
根据实施方式1,棱镜振动控制部52反复强密接状态和弱密接状态。在本实施方式中,角度调整部90a以在振动的1个周期的期间的弱密接状态下,使向atr棱镜20的红外光的入射角成为最大,在振动的1个周期的期间的强密接状态下,使向atr棱镜20的红外光的入射角成为最小的方式,调整向atr棱镜20的红外光的入射角。由此,在强密接状态下,瞬逝光更深地侵入到被测定物,在弱密接状态下,瞬逝光更浅地侵入。
如以上所述,根据本实施方式,通过使向atr棱镜20的红外光的入射角变化,与实施方式1中的使atr棱镜20振动的方法同样地,能够求出强密接状态下的红外光的强度和弱密接状态下的红外光的强度。由此,在本实施方式中也能够与实施方式1同样地,高精度地测定被测定皮肤40内的生物体物质的量。
(附记)
实施方式4的生物体物质测定装置(80)具备以下的特征。
(1)生物体物质测定装置(80)具备:第1角度调整部(90a),设置于红外光源(32)与atr棱镜(20)之间,用于调整向atr棱镜(20)的红外光的入射角;以及第2角度调整部(90b),设置于atr棱镜(20)与红外光检测器(30)之间,用于调整从atr棱镜(20)射出的红外光的行进方向。
由此,能够高精度地测定被测定皮肤(40)内的生物体物质的量。
(2)生物体物质测定装置(80)具备设置于红外光源(32)与atr棱镜(20)之间的角度调整部(90a)。角度调整部(90a)以在振动的1个周期的期间的弱密接状态下,使向atr棱镜(20)的红外光的入射角成为最大,并且在振动的1个周期的期间的强密接状态下,使向atr棱镜(20)的红外光的入射角成为最小的方式,调整向atr棱镜(20)的红外光的入射角。
由此,能够得到更高的检测灵敏度。
实施方式5.
图14是示出实施方式5的便携型的非侵袭的血糖值传感器80的结构的图。图14的血糖值传感器80与图9的实施方式3的血糖值传感器80的相异点是图14的血糖值传感器80具备角度调整部90a以及90b。
角度调整部90a以及角度调整部90b与在实施方式4中说明的部件同样地配置且同样地动作。
本次公开的实施方式在所有方面仅为例示而不应认为是限制性的。本发明的范围并非基于上述说明而是基于权利要求书示出,意图包括与权利要求均等的意义以及范围内的所有变更。
- 还没有人留言评论。精彩留言会获得点赞!