生物标志物MUC21在骨肉瘤诊断和治疗中的应用的制作方法
本发明属于生物医药领域,涉及生物标志物MUC21在骨肉瘤诊断和治疗中的应用。
背景技术:
骨肉瘤是是最常见的骨原发恶性肿瘤,发病率占原发恶性骨肿瘤的20%,起源于间叶组织,长骨的间充质细胞,梭形细胞和类骨质形成为其病理学特点,瘤细胞生长快增殖迅速,生长方式呈浸润性生长破坏周围正常组织。骨肉瘤在各个年龄阶段都可发病,但以儿童和青少年发病多见,高发期在15-19岁,男性多于女性,骨肉瘤的好发部位在于患者长骨生长活跃的干垢端,其中以股骨远端和胫骨近端较多见,其次是肱骨和腓骨近端。骨肉瘤恶性程度高而且进展快,早期即易发生血道转移且易发生肺转移,复发率高,预后也比较差。是目前威胁最常见的原发恶性骨肿瘤。
虽然近几年我们对骨肉瘤的发病机制研究方面有了更新的认识,但是对于改善临床治疗效果方面还是不够,人类骨肉瘤的治疗仍是骨科当前所面临的难题。尽管目前骨肉瘤以外科手术切除为主再联合其他辅助治疗的综合治疗方法取得了很大进展,但是骨肉瘤恶性程度普遍较高,即使是不存在远处转移的骨肉瘤患者经过治疗后其5年生存是60%~65%。骨肉瘤患者多发生肺转移,伴有远处转移的骨肉瘤患者治疗后5年生存率仅为20~29%。
骨肉瘤的早期诊断主要依靠建立有效便捷的无创性诊断技术和骨肉瘤特异性分子标记的筛选;而治疗骨肉瘤转移首先明确骨肉瘤转移相关特异性分子并能进行筛选。目前这两个方面还没有有临床价值的研究。近年来兴起的基因在肿瘤方面的作用的研究为上述另个领域的探索提供了很有前景的研究策略,如专利CN 201510075917.2、CN 201510075920.4、CN201510075918.7、CN201510075919.1就对与骨肉瘤发生发展相关的基因进行了研究。但是迄今为止报道的骨肉瘤的生物标志物仍然较少,不能满足临床诊断和治疗的需要,因此寻找新的有效的生物标志物,对于实现骨肉瘤的个体化的精准诊断和治疗具有重要的意义。
技术实现要素:
为了弥补现有技术的不足,本发明的目的在于提供一种与骨肉瘤发生发展相关的生物标志物,进而应用于骨肉瘤的临床诊断和治疗,实现患者的精准医疗,提高患者的生活和生存质量。
为了实现上述目的,本发明采用如下技术方案:
本发明提供了一种MUC21基因的用途,用于制备预防或治疗骨肉瘤的药物组合物。
进一步,所述药物组合物包括MUC21功能性表达的抑制剂。所述抑制剂选自:以MUC21或其转录本为靶序列、且能够抑制MUC21基因表达或基因转录的干扰分子,包括:shRNA(小发夹RNA)、小干扰RNA(siRNA)、dsRNA、微小RNA、反义核酸,或能表达或形成所述shRNA、小干扰RNA、dsRNA、微小RNA、反义核酸的构建物;或特异性与MUC21编码的蛋白结合的结合分子(如能够抑制MUC21蛋白活性的抗体或配体)。
进一步,所述的抑制剂为siRNA。
进一步,所述siRNA的序列如SEQ ID NO.7和SEQ ID NO.8所示。
本发明提供了一种用于预防或治疗骨肉瘤的药物组合物,所述药物组合物包括MUC21功能性表达的抑制剂,和/或药学上可接受的载体。
进一步,所述抑制剂选自:
核酸抑制物,蛋白抑制剂,蛋白水解酶,蛋白结合分子,其能够在蛋白或基因水平上下调MUC21基因或其编码的蛋白的表达或活性。
在本发明中,所述MUC21的抑制剂还可用于抑制骨肉瘤细胞的增殖。
本发明提供了一种MUC21基因的用途,用于筛选预防或治疗骨肉瘤的候选化合物。
进一步,筛选预防或治疗骨肉瘤的候选化合物的步骤包括:
测试组中,在细胞的培养体系中添加测试化合物,并观察所述测试组的细胞中MUC21的表达量和/或活性;在对照组中,在相同细胞的培养体系中不添加测试化合物,并观察对照组的所述细胞中MUC21的表达量和/或活性;
其中,如果测试组中细胞的MUC21的表达量和/或活性低于对照组,就表明该测试化合物是对MUC21的表达和/或活性有抑制作用的治疗癌症的候选化合物。
在本发明中,所述的步骤还包括:对获得的候选化合物进行进一步的细胞实验和/或动物试验,以从候选化合物中进一步选择和确定对于预防、缓解或治疗骨肉瘤有用的物质。
在本发明中,筛选预防或治疗骨肉瘤的候选化合物的体系不限于细胞体系,还包括细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系等,所述体系不局限于上述形式,只要所述体系可以检测测试化合物可以降低MUC21的表达和/活性即可。
所述候选化合物包括但不限于:针对MUC21基因或其编码的蛋白或其上游或下游基因或蛋白设计的干扰分子、核酸抑制物、结合分子(如抗体或配体)、小分子化合物等。
本发明提供了一种检测MUC21基因表达水平的试剂在制备诊断骨肉瘤的产品中的应用。所述产品包括(但不限于)芯片、制剂或试剂盒。
进一步,所述试剂选自:
特异性识别MUC21的探针;或
特异性扩增MUC21的引物;或
特异性结合MUC21编码的蛋白的抗体或配体。
进一步,所述特异性性扩增MUC21的引物序列如SEQ ID NO.1~2所示。
附图说明
图1是利用QPCR检测MUC21基因在骨肉瘤组织中的表达情况图;
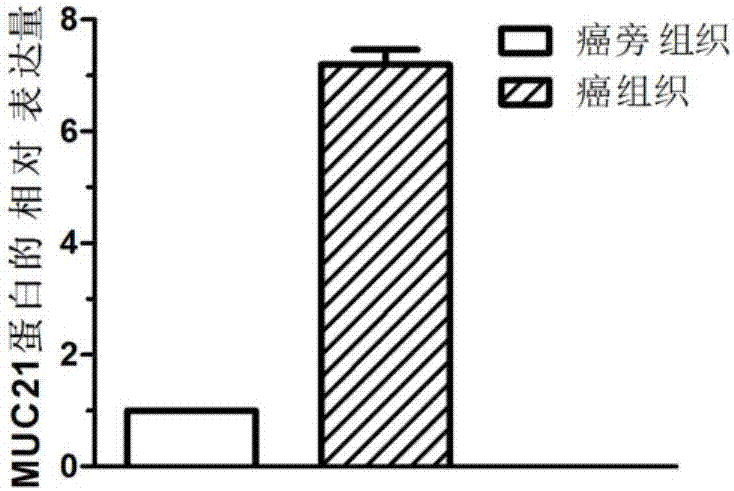
图2是利用Western Blot检测MUC21蛋白在骨肉瘤组织中的表达情况图;
图3是利用QPCR检测siRNA转染对骨肉瘤细胞中MUC21基因表达的影响图;
图4是利用western blot检测siRNA转染对骨肉瘤细胞中MUC21蛋白表达的影响图;
图5是用MTT法检测MUC21基因对骨肉瘤细胞增殖的影响图。
具体的实施方式
本发明经过广泛而深入的研究,通过高通量测序方法,检测骨肉瘤标本中基因在肿瘤组织和癌旁组织的表达,发现其中具有明显表达差异的基因片段,探讨其与骨肉瘤的发生之间的关系,从而为骨肉瘤的早期检测及靶向治疗寻找更好的途径和方法。通过筛选,本发明首次发现了骨肉瘤中MUC21显著性上调。实验证明,通过降低MUC21的表达水平,能够有效地抑制骨肉瘤细胞的增殖,提示检测MUC21基因的表达水平可成为骨肉瘤早期诊断的辅助诊断指标之一,干扰MUC21基因表达可成为预防或治疗骨肉瘤的新途径。
标志物
标志物(单独使用或与其他定性术语组合例如骨肉瘤标志物、骨肉瘤特异性标志物、对照标志物、外源标志物、内源标志物)指可测量、可计算或可以其他方式获得的,与任何分子或分子组合相关,可用作生物和/或化学状态的指示物的参数。在本发明中,“标志物”指与一个或多个生物分子相关的参数(即“生物标志物”)例如天然或人工合成产生的核酸(即个体基因,以及编码和非编码DNA和RNA)和蛋白(例如肽、多肽)。本发明中的“标志物”还包括指可通过考虑来自两个或多个不同标志物的表达数据计算或以其他方式获得的单个参数。
骨肉瘤标志物指可以用作(单独或与其他标志物组合)受试者中骨肉瘤指示物的特定类型的标志物,在本发明的具体实施方式中,骨肉瘤标志物可用于提供(单独或与其他标志物组合)受试者中骨肉瘤临床评估的标志物。
“内源标志物”指源自与待分析样品相同的受试者的标志物(例如核酸或多肽)。更具体地,“内源对照标志物”指可用作对照标志物(单独或与其他对照标志物组合),与待分析样品源自相同受试者的标志物。在一个实施方案中,内源对照标志物可包括一个或多个内源基因(即“对照基因”或“参比基因”),其表达相对稳定,例如在骨肉瘤与非骨肉瘤样品中,和/或在受试者之间。
“外源标志物”指源自与待分析样品不同的受试者的标志物(例如核酸或多肽)。更具体地,“外源对照标志物”指可用作对照标志物(单独或与其他对照标志物组合),未源自与待分析样品相同的受试者的标志物。在本发明中,一方面该外源标志物或外源对照标志物看从不同的受试者分离,或可合成地生产,可添加至待分析的样品。另一方面,该外源对照标志物可以是添加或加标至待分析样品中用作内部阳性或阴性对照物的分子。外源对照标志物可与一个或多个骨肉瘤标志物的检测共同使用以区分“真阴性”结果(例如非骨肉瘤诊断)和“假阴性”或“不提供信息的”结果(例如由于扩增反应的问题)。
“对照标志物”或“参比标志物”指用于(单独或与其他对照标志物组合)对照可能的干扰因素和/或提供关于样品质量、有效样品制备和/或适当的反应组合/进行(例如RT-PCR反应)的一个或更多指标的具体类型的标志物。在一些实施方案中,对照标志物可以是如本文中所述的内源对照标志物、外源对照标志物和/或骨肉瘤特异性对照标志物。对照标志物可与本发明的骨肉瘤标志物共检测或分别检测。对照标志物可以是一个或多个内源基因,例如管家基因或骨肉瘤特异性对照标志物或基因的组合。
MUC21基因
在本发明中,MUC21是位于人6号染色体短臂2区1带上的基因,MUC21包括野生型、突变型或其片段。一种代表性的MUC21基因具有数据库GeneBank中NC_000006.12所表示的核苷酸序列或氨基酸序列。
本发明的人MUC21核苷酸全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。对于PCR扩增法,可根据已公开的有关核苷酸序列,并用市售的cDNA库或按本领域技术人员已知的常规方法所制备的cDNA库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次PCR扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
本领域技术人员将认识到,本发明的实用性并不局限于对本发明的靶标基因的任何特定变体的基因表达进行定量。如果当核酸或其片段与其它核酸(或其互补链)最佳比对时(具有适当的核苷酸插入或缺失),在至少大约60%的核苷酸碱基、通常至少大约70%、更通常至少大约80%、优选至少大约90%、及更优选至少大约95-98%核苷酸碱基中存在核苷酸序列相同性,则这两个序列是“基本同源的”(或者基本相似的)。
或者,当核酸或其片段与另一核酸(或其互补链)、一条链或其互补序列在选择性杂交条件下杂交时,则其间存在基本同源或(相同性)。当杂交比特异性整体丧失发生更具选择性时,存在杂交选择性。典型地,当在至少大约14个核苷酸的一段序列存在至少大约55%相同性、优选至少大约65%、更优选至少大约75%及最优选至少大约90%相同性时,发生选择性杂交。如本文所述,同源对比的长度可以是较长的序列节段,在某些实施方案中通常为至少大约20个核苷酸,更通常为至少大约24个核苷酸,典型为至少大约28个核苷酸,更典型为至少大约32个核苷酸,及优选至少大约36或更多个核苷酸。
抑制剂和药物组合物
基于本发明人的发现,本发明提供了一种MUC21的抑制剂的用途,用于制备抑制骨肉瘤的药物组合物。如本文所用,所述的MUC21的抑制剂包括但不限于抑制剂、拮抗剂、阻滞剂、阻断剂、核酸抑制物等。
所述的MUC21基因或蛋白的抑制剂是指任何可降低MUC21蛋白的活性、降低MUC21基因或蛋白的稳定性、下调MUC21蛋白的表达、减少MUC21蛋白有效作用时间、或抑制MUC21基因的转录和翻译的物质,这些物质均可用于本发明,作为对于下调MUC21有用的物质,从而可用于预防或治疗骨肉瘤。例如,所述的抑制剂是:核酸抑制物,蛋白抑制剂,抗体,配体,蛋白水解酶,蛋白结合分子,只要其能够在蛋白或基因水平上下调MUC21蛋白或其编码基因的表达。
作为本发明的一种选择方式,所述的MUC21的抑制剂是一种特异性与MUC21结合的抗体。所述的抗体可以是单克隆抗体或多克隆抗体。可用MUC21蛋白免疫动物,如家兔,小鼠,大鼠等来生产多克隆抗体;多种佐剂可用于增强免疫反应,包括但不限于弗氏佐剂等。与之相似的,表达MUC21或其具有抗原性的片段的细胞可用来免疫动物来生产抗体。所述的抗体也可以是单克隆抗体,此类单克隆抗体可以利用杂交瘤技术来制备。抗体的“特异性”是指抗体能结合于MUC21基因产物或片段。较佳地,指那些能与MUC21基因产物或片段结合但不识别和结合于其它非相关抗原分子的抗体。本发明的抗体可以通过本领域内技术人员已知的各种技术进行制备。本发明不仅包括完整的单克隆或多克隆抗体,而且还包括具有免疫活性的抗体片段,如Fab’或(Fab)2片段;抗体重链;抗体轻链;遗传工程改造的单链Fv分子;或嵌合抗体。抗MUC21蛋白的抗体可用于免疫组织化学技术中,检测活检标本中的MUC21蛋白含量,还可以作为用于预防骨肉瘤的特异性治疗剂。血样或尿液中的MUC21蛋白的直接测定可以作为肿瘤的辅助诊断和愈后的观察指标,也可作为肿瘤早期诊断的依据。抗体可以通过ELISA、WesternBlot印迹分析,或者与检测基团偶联,通过化学发光、同位素示踪等方法来检测。
作为本发明的一种优选方式,所述MUC21的抑制剂是一种MUC21特异性的小干扰RNA分子。如本文所用,所述的“小干扰RNA”是指一种短片段双链RNA分子,能够以同源互补序列的mRNA为靶目标降解特定的mRNA,这个过程就是RNA干扰(RNAinterference)过程。小干扰RNA可以制备成双链核酸的形式,它含有一个正义链和一个反义链,这两条链仅在杂交的条件下形成双链。一个双链RNA复合物可以由相互分离的正义链和反义链来制备。因此,举例来讲,互补的正义链和反义链是化学合成的,其后可通过退火杂交,产生合成的双链RNA复合物。
在筛选有效的siRNA序列时,本发明人通过大量的比对分析,从而找出最佳的有效片段。本发明人设计合成了多种siRNA序列,并将它们分别通过转染试剂转染骨肉瘤细胞系进行验证,选出干扰效果最佳的siRNA,它们分别具有SEQIDNO.7、SEQIDNO.8所示的序列,进一步地在细胞水平实验,结果证明对于细胞试验而言抑制效率非常高。
作为本发明的一种可选方式,所述的MUC21的抑制剂也可以是一种“小发夹RNA(SmallhairpinRNA,shRNA)”,其是能够形成发夹结构的非编码小RNA分子,小发夹RNA能够通过RNA干扰途径来抑制基因的表达。如上述,shRNA可以由双链DNA模板来表达。双链DNA模板被插进一个载体,例如质粒或病毒载体,然后在体外或体内连接到一个启动子进行表达。shRNA在真核细胞内DICER酶的作用下,可被切割成小干扰RNA分子,从而进入RNAi途径。“shRNA表达载体”是指一些本领域常规用于构建shRNA结构的质粒,通常该质粒上存在“间隔序列”以及位于“间隔序列”两边的多克隆位点或供替换序列,从而人们可以将shRNA(或类似物)相应的DNA序列通过正向和反向的方式插入多克隆位点或替换其上的供替换序列,该DNA序列转录后的RNA可形成shRNA(ShortHairpin)结构。所述的“shRNA表达载体”目前已经完全可以通过商购的途径购买获得,例如一些病毒载体。
本发明的核酸抑制物如siRNA可以化学合成,也可以通过一个重组核酸结构里的表达盒转录成单链RNA之后进行制备。siRNA等核酸抑制物,可通过采用适当的转染试剂被输送到细胞内,或还可采用本领域已知的多种技术被输送到细胞内。
药物组合物
本发明还提供了一种药物组合物,它含有有效量的所述的MUC21的抑制剂,以及药学上可接受的载体。所述的组合物可用于抑制骨肉瘤。任何前述的MUC21的抑制剂均可用于组合物的制备。
如本文所用,所述“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。抑制剂的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的MUC21基因的抑制剂的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。
所述“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。该术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在组合物中药学上可接受的载体可含有液体,如水、盐水、缓冲液。另外,这些载体中还可能存在辅助性的物质,如填充剂、润滑剂、助流剂、润湿剂或乳化剂、pH缓冲物质等。所述的载体中还可以含有细胞(宿主细胞)转染试剂。
本发明可以采用用本领域熟知的多种方法来将所述的抑制剂或其编码基因、或其药物组合物给药于哺乳动物。包括但不限于:皮下注射、肌肉注射、经皮给予、局部给予、植入、缓释给予等;优选的,所述给药方式是非肠道给予的。
优选的,可采用基因治疗的手段进行。比如,可直接将MUC21的抑制剂通过诸如注射等方法给药于受试者;或者,可通过一定的途径将携带MUC21的抑制剂的表达单位(比如表达载体或病毒等,或siRNA或shRNA)递送到靶点上,并使之表达活性的MUC21抑制剂,具体情况需视所述的抑制剂的类型而定,这些均是本领域技术人员所熟知的。
术语“宿主细胞”可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属的细菌细胞;真菌细胞如酵母;植物细胞;果蝇S2或Sf9的昆虫细胞;CHO、COS、或293细胞的动物细胞等。
用重组DNA转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收DNA的感受态细胞可在指数生长期后收获,用CaCl2法处理,所用的步骤在本领域众所周知。另一种方法是使用MgCl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的DNA转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
本发明中的药物组合物包括MUC21的抑制剂、和/或与所述抑制剂配伍的其他药类以及药学上可接受的载体和/或辅料。
本发明的药物组合物还可与其他治疗骨肉瘤的药物联用,其他治疗性化合物可以与主要的活性成分同时给药,甚至在同一组合物中同时给药。
本发明的药物组合物还可以以单独的组合物或与主要的活性成分不同的剂量形式单独给予其它治疗性化合物。主要成分的部分剂量可以与其它治疗性化合物同时给药,而其它剂量可以单独给药。在治疗过程中,可以根据症状的严重程度、复发的频率和治疗方案的生理应答,调整本发明药物组合物的剂量。
药物筛选
本发明提供了一种筛选预防或治疗骨肉瘤药物的方法,即:
在实验组中,向细胞培养体系中加入待测化合物,并测定MUC21的表达水平;在对照组中,向同样的培养体系中不加入待测化合物,并测定MUC21的表达水平;其中,如果实验组中MUC21的表达水平大于对照组,则说明该候选化合物为MUC21的抑制剂。
在本发明中,所述的方法还包括:对上面步骤获得的候选化合物进一步测试其抑制骨肉瘤的效果,若测试化合物对骨肉瘤有显著的抑制效果,则说明该化合物为预防或治疗骨肉瘤的潜在物质。
检测方法
本发明可以利用本领域内已知的任何方法测定基因表达。本领域技术人员应当理解,测定基因表达的手段不是本发明的重要方面。本领域已知的定量样品中RNA表达的示例性方法包括但不限于Southern印迹、Northern印迹、微阵列、聚合酶链式反应(PCR)、NASBA、TMA、RT-PCR、实时荧光定量PCR。
在本发明中,术语“上调”或“过表达”指在癌组织(例如在骨肉瘤组织)中以相对于其他相应的组织中的水平高的表达(例如RNA和/或蛋白表达)基因。在癌中上调的基因以比其他相应的组织(例如正常或非癌性骨组织)中的表达水平高至少10%,优选地至少25%,更优选地至少50%,更优选地至少100%,更优选地至少200%,最优选地至少300%的水平表达。
芯片、试剂盒
本发明的所述的基因芯片包括:固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述的寡核苷酸探针特异性地对应于MUC21所示的部分或全部序列。
具体地,可根据本发明所述的基因,设计出适合的探针,固定在固相载体上,形成“寡核苷酸阵列”。所述的“寡核苷酸阵列”是指具有可寻址位置(即以区别性的,可访问的地址为特征的位置)的阵列,每个可寻址位置均含有一个与其相连的特征性寡核苷酸。根据需要,可将寡核苷酸阵列分成多个亚阵。
“探针”意欲包括在促进杂交的条件下与核酸或其补体中的靶标序列特异性杂交,从而允许检测靶标序列或其扩增的核酸的核酸寡聚体或适体。检测可以是直接(即由直接与靶标或扩增的序列杂交的探针产生)或间接(即由与连接探针和靶标或扩增的序列的中间分子结构杂交的探针产生)的。探针的“靶标”通常指扩增的核酸序列中与至少部分探针序列通过标准氢键或“碱基配对”特异性杂交的序列。“充分地互补”的序列允许探针序列与靶标序列稳定杂交,即使该两个序列不完全互补。探针可被标记或不标记。探针可通过具体DNA序列的分子克隆生产,也可被合成。本发明所属领域的技术人员可容易地确定可在本发明的背景下设计和使用的多种引物和探针。
本发明中所述固相载体可采用基因芯片领域的各种常用材料,例如包括但不限于塑料制品、微颗粒、膜载体等。所述塑料制品可通过非共价或物理吸附机制与抗体或蛋白抗原相结合,最常用的塑料制品为聚苯乙烯制成的小试管、小珠和微量反应板;所述微颗粒是由高分子单体聚合成的微球或颗粒,其直径多为微米,由于带有能与蛋白质结合的功能团,易与抗体(抗原)形成化学偶联,结合容量大;所述膜载体包括硝酸纤维素膜、玻璃纤维素膜及尼龙膜等微孔滤膜。
所述的MUC21芯片的制备可采用本领域已知的生物芯片的常规制造方法。例如,如果固相载体采用的是修饰玻片或硅片,探针的5’端含有氨基修饰的聚dT串,可将寡核苷酸探针配制成溶液,然后采用点样仪将其点在修饰玻片或硅片上,排列成预定的序列或阵列,然后通过放置过夜来固定,就可得到本发明的基因芯片。
本发明提供了一种试剂盒,所述试剂盒可用于检测MUC21基因或蛋白的表达。优选的,所述的制剂或试剂盒中还含有用于标记RNA样品的标记物,以及与所述标记物相对应的底物。此外,所述的试剂盒中还可包括用于提取RNA、PCR、杂交、显色等所需的各种试剂,包括但不限于:抽提液、扩增液、杂交液、酶、对照液、显色液、洗液等。此外,所述的试剂盒中还包括使用说明书和/或芯片图像分析软件。
试剂盒的组分可以以水介质的形式或以冻干的形式来包装。试剂盒中适当的容器通常至少包括一种小瓶、试管、长颈瓶、宝特瓶、针筒或其它容器,其中可放置一种组分,并且优选地,可进行适当地等分。在试剂盒中存在多于一种的组分时,试剂盒中通常也将包含第二、第三或其它附加的容器,其中分离地放置附加的组分。然而,不同组合的组分可被包含在一个小瓶中。本发明的试剂盒通常也将包括一种用于容纳反应物的容器,密封以用于商业销售。这种容器可包括注模或吹模的塑料容器,其中可保留所需的小瓶。
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring HarborLaboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1与骨肉瘤相关的基因标志物的筛选
1、样品收集
各收集6例骨肉瘤组织及癌旁组织样本,组织样本的取得获得患者的知情同意,并且取得均通过组织伦理委员会的同意。
2、RNA样品的制备
使用Invitrogen公司的组织RNA提取试剂盒提取RNA,具体操作参照说明书。
3、RNA样品的质量分析
利用Nanodrop2000对所提取的RNA浓度和纯度进行检测,琼脂糖凝胶电泳检测RNA完整性,Agilent2100测定RIN值。浓度≥200ng/μl,OD260/280介于1.8~2.2之间。
4、去除rRNA
使用Ribo-Zero试剂盒除去总RNA中的核糖体RNA。
5、构建cDNA文库
利用利用Illumina的Truseq RNA sample Prep Kit进行cDNA文库的构建,具体操作按说明书进行。
6、上机测序
使用Hiseq4000测序平台对cDNA文库进行测序,具体操作按说明书进行。
7、高通量转录组测序数据分析
对测序结果进行生物信息学分析,用cutadapt对reads的5’和3’端进行trim,trim掉质量<20的碱基,并且删掉N大于10%的reads,tophat比对到参考基因组上,使用cuffquant定量mRNA的表达量,cuffdiff比较对照组跟肿瘤组的表达差异,差异基因的筛选标准为以fdr<0.05,两组的fpkm平均值之差大于5。
8、结果
RNA-seq结果显示,在骨肉瘤患者中MUC21表达水平显著上调。
实施例2 QPCR测序验证MUC21基因的差异表达
1、对MUC21基因差异表达进行大样本QPCR验证。按照实施例1中的样本收集方式选择骨肉瘤患者癌旁组织和骨肉瘤组织各50例。
2、RNA提取具体步骤如实施例1所述。
3、逆转录
采用FastQuant cDNA第一链合成试剂盒(货号:KR106)进行mRNA反转录。具体步骤如下:
(1)加入5×gDNA Buffer 2.0μl,总RNA 1μg,加Rnase Free ddH2O使总体积至10μl,水浴锅中42℃加热3min;
(2)构建20μl反应体系:10×Fast RT Buffer 2.0μL,RT Enzyme Mix 1.0μl,FQ-RT Primer Mix 2.0μl,RNase Free ddH2O 5.0μl混合后加入(1)中的混合液中混匀;
(3)水浴锅中42℃加热15min,95℃加热3min,-20℃储存备用。
4、QPCR扩增
(1)引物设计
根据Genebank中MUC21基因和管家基因GAPDH基因的编码序列设计QPCR扩增引物,由博迈德公司合成。
MUC21基因的引物序列:
正向引物序列为5’-AATGTTCTCCTTATGTTTGGTCTA-3’(SEQ ID NO.1);
反向引物序列为5’-GATCCAGTGTTGGCAGAG-3’(SEQ ID NO.2)。
GAPDH基因的引物序列:
正向引物序列为5’-GGAGCGAGATCCCTCCAAAAT-3’(SEQ ID NO.3);
反向引物序列为5’-GGCTGTTGTCATACTTCTCATGG-3’(SEQ ID NO.4)。
(2)PCR反应体系:正向引物和反向引物各0.6μl,2×SuperReal PreMix Plus 10μl,DNA模板2μl,ddH2O 7.4μl,50×ROX Reference Dye△2μl,灭菌蒸馏水4.8μl。
(3)PCR反应条件:95℃15min,(95℃10s,55℃30s,72℃32s)×40个循环,95℃15s,60℃60s,95℃15s。在ABI 7300型荧光定量PCR仪上进行PCR反应,通过融解曲线分析和电泳确定目的条带,ΔΔCT法进行相对定量。
5、统计学方法
实验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用SPSS18.0统计软件来进行统计分析的,癌与癌旁组织的配对比较采用t检验,认为当P<0.05时具有统计学意义。
6、结果
结果如图1所示,与癌旁组织相比,MUC21在骨肉瘤组织中表达上调,差异具有统计学意义(P<0.05),同高通量测序结果一致。
实施例3蛋白免疫印记实验检测MUC21蛋白的差异表达
1、组织总蛋白的提取
用剪刀剪碎组织后将其放入置于冰内的玻璃匀浆器内,RIPA裂解液和PMSF以100:1的比例混匀,按照每20mg组织标本加入100μl裂解液的比例加入相应量的RIPA裂解液,玻璃匀浆器碾碎组织直至其充分裂解,将裂解后的液体吸至EP管中,4℃下14000rpm离心5min,收集上清。
2、总蛋白浓度测定
按照BCA蛋白浓度测定试剂盒的说明书进行蛋白浓度的测定。
3、SDS-PAGE电泳
按照SDS-PAGE凝胶配制试剂盒的说明书配制8%的分离胶和5%的浓缩胶并进行电泳。
4、western检测
1)电转移
将PVDF膜放入甲醇溶液中激活5min,放入转膜缓冲液中平衡20min。取出PAGE胶放入转膜缓冲液中,切下相应的PAGE胶,按照由下到上依次为滤纸、PVDF膜、PAGE胶、滤纸的顺序放到半干的转膜仪中,恒压25V转膜1.5h;
2)免疫杂交
取出PVDF膜,PBS冲洗后置于5%BSA溶液中室温下摇动封闭2h,将PVDF膜放入杂交袋中,加入一抗过夜,用TBST缓冲液洗涤PVDF膜,再加入相应的二抗,室温下孵育2h,TBST缓冲液洗涤。
3)DAB显色
PVDF膜稍干后滴加新鲜配制的DAB显色液,PVDF膜显色后扫描记录。以β-actin作为内参照,采用Quantity One凝胶成像分析系统对条带进行半定量灰度分析,实验重复3次,结果取平均灰度值;
5、统计学分析
采用SPSS18.0统计软件来进行统计分析,结果数据都是以平均值±标准差的方式来表示的,采用繁多样本均数的方差检验(ANOVA)进行分析,认为当P<0.05时具有统计学意义。
6、结果
结果如图2所示,在骨肉瘤组织中,MUC21蛋白表达水平显著高于癌旁组织。
实施例4 MUC21基因的沉默
1、细胞培养
人骨肉瘤细胞株U-2OS,以含10%胎牛血清和1%P/S的DMEM培养基在37℃、5%CO2、相对湿度为90%的培养箱中培养。2-3天换液1次,细胞生长良好,呈单层贴壁生长。使用0.25%含EDTA的胰蛋白酶常规消化传代。
2、转染
1)转染前细胞的处理
转染前一天,6孔培养板上种3~5×105个细胞/孔,在无抗生素培养基中培养一天,转染时细胞密度为30~50%,于转染前换成无血清培养基。
2)siRNA的设计
阴性对照siRNA序列(siRNA-NC):
正义链为5’-UUCUCCGAACGUGUCACGU-3’(SEQ ID NO.5)
反义链为5’-ACGUGACACGUUCGGAGAA-3’(SEQ ID NO.6)
siRNA1:
正义链为5’-ACAUAAGGAGAACAUUUCCUU-3’(SEQ ID NO.7)
反义链为5’-GGAAAUGUUCUCCUUAUGUUU-3’(SEQ ID NO.8)
siRNA2:
正义链为5’-UCUCAUUGGAAUUUGUUGCAG-3’(SEQ ID NO.9)
反义链为5’-GCAACAAAUUCCAAUGAGACU-3’(SEQ ID NO.10)
siRNA3:
正义链为5’-UGUGUUAAAGGUGUUUCUCAG-3’(SEQ ID NO.11)
反义链为5’-GAGAAACACCUUUAACACAGC-3’(SEQ ID NO.12)
将实验分为三组:对照组(U-2OS)、阴性对照组(siRNA-NC)和实验组(siRNA1、siRNA2、siRNA3),其中阴性对照组siRNA与MUC21基因的序列无同源性。
3)转染
采用Invitrogen公司的脂质体Lipofectamine 2000进行转染,按说明书进行操作,具体步骤如下:
a.取浓度为50pmol的siRNA 3μl加入47μl的无血清培养基,轻轻混匀,室温孵育5min;
b.取1μl Lipofectamine 2000加入49μl无血清培养基。轻轻混匀,室温孵育5min;
c.将上述两种混合物混合(总体积100μl),轻轻混匀,室温下孵育25min,以使复合体形成;
d.在6孔板中每孔加入100μl的复合物及适量培养基,轻轻混匀;
e.孵育48~96h后观察基因的沉默效应。
5、QPCR检测MUC21基因的转录水平
5.1细胞总RNA的提取
采用Qiagen的细胞RNA提取试剂盒对细胞中的RNA进行提取,实验操作按照说明书进行。
5.2逆转录步骤同实施例2。
5.3QPCR扩增步骤同实施例2
6、统计学方法
实验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用SPSS18.0统计软件来进行统计分析的,MUC21基因实验组与对照组之间的差异采用t检验,认为当P<0.05时具有统计学意义。
7、结果
结果如图3显示,与非转染组与转染siRNA-NC组相比,实验组siRNA1和siRNA2的mRNA水平都有所下降,而siRNA1干扰效力最高,因此选择siRNA1进行后续的实验。
实施例5 Western blot检测转染siRNA对MUC21蛋白表达的影响
1、细胞培养和转染步骤同实施例4
2、细胞总蛋白的提取
收集处于对数期的不同处理组的细胞,用预冷的PBS洗涤细胞。将RIPA细胞裂解液和PMSF以100:1的比例混匀,向细胞中加入上述裂解液150μl,冰上放置30min,使用细胞刮刀将裂解的细胞刮下来,使用移液器将裂解后的液体吸至EP管中,4℃下14000rpm离心5min。小心收集离心后的上清。
3、总蛋白浓度测定
按照BCA蛋白浓度测定试剂盒的说明书进行蛋白浓度的测定。
4、SDS-PAGE电泳
按照SDS-PAGE凝胶配制试剂盒的说明书配制8%的分离胶和5%的浓缩胶并进行电泳。
5、western检测步骤详见实施例3。
6、统计学分析
采用SPSS18.0统计软件来进行统计分析,结果数据都是以平均值±标准差的方式来表示的,采用繁多样本均数的方差检验(ANOVA)进行分析,认为当P<0.05时具有统计学意义。
7、结果
结果如图4所示,与对照组相比,转染siRNA1和siRNA2组的细胞中的MUC21蛋白表达量都下调,其中siRNA1组最为显著,因此选择siRNA1做后续实验的研究。
实施例6 MUC21基因对骨肉瘤细胞增殖的影响
采用MTT实验检测MUC21基因对骨肉瘤细胞增殖能力影响
1、取生长状况良好的细胞,常规消化成单细胞悬液后,计数细胞,将细胞稀释成合适浓度的细胞悬液。
2、于96孔培养板中,将稀释后的不同处理组细胞每孔接种2000细胞,至少设3个平行孔和无细胞培养基对照,37℃、5%CO2培养24h。
3、于接种后1、2、3、4、5天每天取出3孔细胞以MTT法检测其490nm的OD值,进行计数,计算平均值。
4、检测前弃去上清液,培养液洗3次,每孔加入MTT无血清培养基溶液(5mg/ml)10μl,37℃培养箱中继续培养4h,终止培养。
5、每孔加入100μl Formanzan溶解液,摇床慢摇1min。在酶标仪上用波长为490nm测定测定光密度(OD)值,以时间为横轴,光密度值为纵轴绘制细胞生长曲线。
6、统计学分析
实验都是按照重复3次来完成的,采用SPSS18.0统计软件来进行统计分析,两者之间的差异采用t检验,认为当P<0.05时具有统计学意义。
7、结果
结果如图5所示,与对照相比,实验组在转染siRNA1后,细胞的增殖明显受到了抑制,差异具有统计学意义(P<0.05),说明MUC21具有促进细胞增殖的作用。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
序列表
<110> 蚌埠医学院第一附属医院(蚌埠医学院附属肿瘤医院) 刘扬
<120> 生物标志物MUC21在骨肉瘤诊断和治疗中的应用
<160> 12
<170> SIPOSequenceListing 1.0
<210> 1
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
aatgttctcc ttatgtttgg tcta 24
<210> 2
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
gatccagtgt tggcagag 18
<210> 3
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ggagcgagat ccctccaaaa t 21
<210> 4
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
ggctgttgtc atacttctca tgg 23
<210> 5
<211> 19
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 5
uucuccgaac gugucacgu 19
<210> 6
<211> 19
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 6
acgugacacg uucggagaa 19
<210> 7
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 7
acauaaggag aacauuuccu u 21
<210> 8
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 8
ggaaauguuc uccuuauguu u 21
<210> 9
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 9
ucucauugga auuuguugca g 21
<210> 10
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 10
gcaacaaauu ccaaugagac u 21
<210> 11
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 11
uguguuaaag guguuucuca g 21
<210> 12
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 12
gagaaacacc uuuaacacag c 21
- 还没有人留言评论。精彩留言会获得点赞!