制备具有治疗皮肤疾病功效的杭菊萃取物的方法、杭菊萃取物与其应用与流程
本发明系关于一种植物萃取物的制备方法,且特别关于一种制备具有治疗皮肤疾病功效的杭菊萃取物的方法、与具有治疗皮肤疾病功效的杭菊萃取物,以及含此萃取物的用于治疗皮肤疾病的医药组合物。
背景技术:
皮肤疾病为全球最常见的疾病,约有1/3的人口于其一生中会出现一种病理性皮肤问题。在健康照护支出中,皮肤相关的医疗支出也高达25%。
皮肤疾病可分成四大类,分别为皮肤炎(例如,过敏性和接触性)、癌症(例如,黑色素瘤)、免疫疾病(例如,干癣)以及感染性皮肤疾病(例如,细菌,真菌和病毒感染)。
外用类固醇已被广泛使用于各类皮肤疾病,尤其是异位性皮肤炎与干癣,而于严重的皮肤炎患者,其类固醇使用剂量更高。许多被归类于类固醇(steroid)的化合物,例如倍他米松(betamethasone)或泼尼松龙(prednisolone)对于治疗发炎性疾病的效果非常好,然而,这些化合物长期使用却也可能造成患者的皮肤萎缩。患者若于类固醇治疗期间出现皮肤萎缩的现象,则一般被认为是类固醇反应者(steroidresponders)。皮肤萎缩对于已经具有皮肤疾病症状的患者(如,干癣患者)的影响是值得关切的。然而,即使是正常皮肤,在长期使用类固醇的情形下,亦会出现皮肤损伤的副作用。
因此,可取代类固醇的安全皮肤用药,特别是植物药的研发是一个重要的课题。
技术实现要素:
本发明提供一种制备具有治疗皮肤疾病功效的杭菊萃取物的方法,包括:(a)将杭菊以萃取溶剂进行萃取程序,以获得萃取液;以及(b)将至少一种糖苷酶加入该萃取液中,以发生酶反应而产生沉淀物,其中该沉淀物为具有治疗皮肤疾病功效的杭菊萃取物。
本发明也提供一种具有治疗皮肤疾病功效的杭菊萃取物,其系通过如上述的制备具有治疗皮肤疾病功效的杭菊萃取物的方法来获得。
本发明还提供另一种具有治疗皮肤疾病功效的杭菊萃取物,至少包括以下二个指标成分:木犀草素(luteolin)以及芹菜素(apigenin),其中于该杭菊萃取物中,该木犀草素以及该芹菜素的含量比为约1:1-30。
本发明更提供一种用于治疗皮肤疾病的医药组合物,包括:上述任一种的具有治疗皮肤疾病功效的杭菊萃取物;以及药学上可接受的介质、载体或盐类。
为了让本发明的上述和其他目的、特征、和优点能更明显易懂,下文特举较佳实施例,并配合所附图示,作详细说明如下:
附图说明
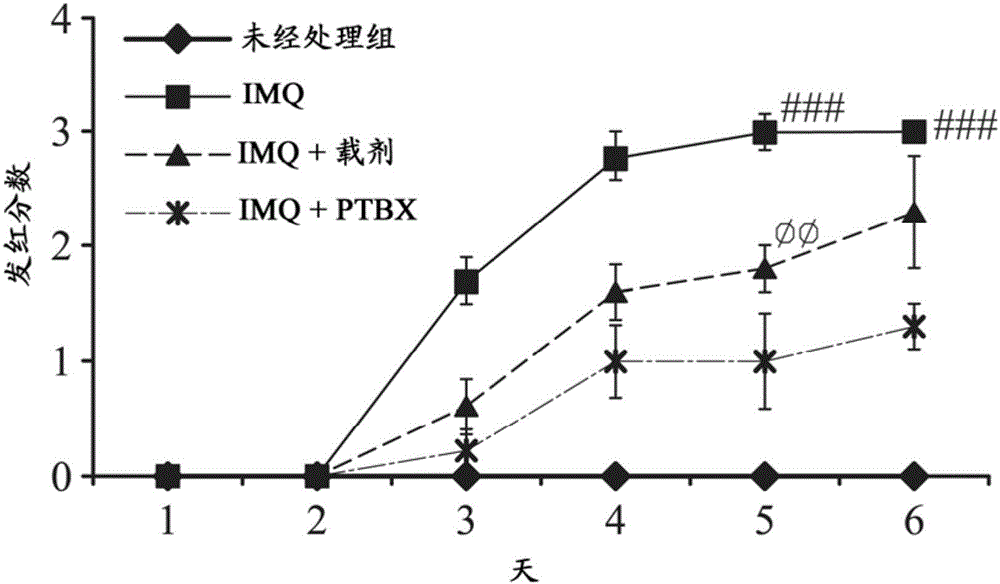
图1a显示,未经处理组(未经任何处理)、对照组(50mg的咪喹莫特(imiquimod,imq)乳膏)、咪喹莫特+载剂处理组(50mg的咪喹莫特乳膏+50mg的软膏载剂)与实验组(50mg的咪喹莫特乳膏+50mg的ptbx软膏)的小鼠的背部皮肤的发炎分数。平均值±标准差。###:p<0.001,相较于未经处理组;
图1b显示,未经处理组(未经任何处理)、对照组(50mg的咪喹莫特乳膏)、咪喹莫特+载剂处理组(50mg的咪喹莫特乳膏+50mg的软膏载剂)与实验组(50mg的咪喹莫特乳膏+50mg的ptbx软膏)的小鼠的背部皮肤的脱屑分数。平均值±标准差。###:p<0.001,相较于未经处理组;
图1c显示,未经处理组(未经任何处理)、对照组(50mg的咪喹莫特乳膏)、咪喹莫特+载剂处理组(50mg的咪喹莫特乳膏+50mg的软膏载剂)与实验组(50mg的咪喹莫特乳膏+50mg的ptbx软膏)的小鼠的背部皮肤的总评分。平均值±标准差。###:p<0.001,相较于未经处理组;
图1d显示,未经处理组(未经任何处理)、对照组(50mg的咪喹莫特乳膏)、咪喹莫特+载剂处理组(50mg的咪喹莫特乳膏+50mg的软膏载剂)与实验组(50mg的咪喹莫特乳膏+50mg的ptbx软膏)的小鼠的背部皮肤的照片与背部皮肤样本的苏木素-伊红(hematoxylinandeosin,h&e)染色结果。
图1e显示,未经处理组(未经任何处理)、对照组(50mg的咪喹莫特乳膏)、咪喹莫特+载剂处理组(50mg的咪喹莫特乳膏+50mg的软膏载剂)与实验组(50mg的咪喹莫特乳膏+50mg的ptbx软膏)的小鼠的背部皮肤的厚度。平均值±标准差。###:p<0.001,相较于未经处理组;*:p<0.05,相较于咪喹莫特+载剂处理组。t-测试。
图1f显示,未经处理组(未经任何处理)、对照组(50mg的咪喹莫特乳膏)、咪喹莫特+载剂处理组(50mg的咪喹莫特乳膏+50mg的软膏载剂)与实验组(50mg的咪喹莫特乳膏+50mg的ptbx软膏)的小鼠背部皮肤组织的角蛋白(keratin,k14)基因表达量。平均值±标准差。###:p<0.001,相较于未经处理组;*:p<0.05,相较于咪喹莫特+载剂处理组。t-测试。
图1g显示,未经处理组(未经任何处理)、对照组(50mg的咪喹莫特乳膏)、咪喹莫特+载剂处理组(50mg的咪喹莫特乳膏+50mg的软膏载剂)与实验组(50mg的咪喹莫特乳膏+50mg的ptbx软膏)的小鼠背部皮肤组织的丝聚蛋白(filaggrin,flg)基因表达量。平均值±标准差。#:p<0.05,相较于未经处理组;**:p<0.01,相较于咪喹莫特+载剂处理组。t-测试。
实施方式
本发明提供一种制备具有治疗皮肤疾病功效的杭菊萃取物的方法。于此所述的皮肤疾病,并无特别限制,可例如,皮肤炎(如,过敏性和接触性)、免疫疾病(如,干癣)、感染性皮肤疾病(如,细菌,真菌和病毒感染)等。
而上述方法可包括,但不限于下述步骤。
首先,将杭菊以萃取溶剂进行萃取程序,以获得萃取液。上述萃取液可为由上述萃取程序所直接获得的萃取液,也可为由上述萃取程序直接所获得的萃取液进一步干燥所形成的粉末以水或缓冲溶液回溶所形成的溶液,并无特别限制。而缓冲溶液的例子,可包括,但不限于,醋酸缓冲液(acetatebuffer)。
又,上述萃取溶剂的例子,可包括水、醇类等,但不限于此。在一实施例中,上述萃取溶剂可为水。
上述萃取程序的温度为约70-100℃,但不限于此。在一实施例中,上述萃取程序的温度可为约80-95℃。又,萃取程序的时间可为约1-3小时,但不限于此。在一实施例中,上述萃取程序的时间可为约1-2小时。
接着,将至少一种糖苷酶加入上述萃取液中,以发生酶反应而产生沉淀物,而所获得的沉淀物即为具有治疗皮肤疾病功效的杭菊萃取物。
上述至少一种糖苷酶与上述杭菊与的重量比可为约1:200-10000,例如,1:3000-8000、1:1500-4000、1:750-2000、1:300-800等,但不限于此。在一实施例中,上述至少一种糖苷酶与上述杭菊的重量比可为约1:3000-8000。在另一实施例中,上述至少一种糖苷酶与上述杭菊的重量比可为约1:1500-4000。在又另一实施例中,上述至少一种糖苷酶与上述杭菊的重量比可为约1:750-2000。又,在另一实施例中,上述至少一种糖苷酶与上述杭菊的重量比可为约1:300-800。
又,上述酶反应的温度可为约25-45℃,例如25℃、30℃、35℃、36℃、37℃、37.5℃、38℃、39℃、40℃,但不限于此。在一实施例中,上述酶反应的温度可为约37℃。此外,上述酶反应的时间可为,约5-30小时,例如,5-25小时、10-24小时等,但不限于此。在一实施例中,上述酶反应的时间可为约16-24小时。
而上述至少一种糖苷酶的例子,可包括,但不限于,葡萄糖苷酶(glucosidase)、半乳糖苷酶(galactosidase)、葡萄糖醛酸酶(glucuronidase)、上述的任意组合等。上述葡萄糖苷酶可包括α-葡萄糖苷酶、β-葡萄糖苷酶或其组合。上述半乳糖苷酶可包括α-半乳糖苷酶、β-半乳糖苷酶或其组合。而上述葡萄糖醛酸酶可包括α-葡萄糖醛酸酶、β-葡萄糖醛酸酶或其组合。
在一实施例中,上述至少一种糖苷酶可为葡萄糖苷酶,而于此实施例中,上述葡萄糖苷酶可为β-葡萄糖苷酶。又,于此实施例中,上述β-葡萄糖苷酶与上述杭菊的重量比可为约1:200-10000,例如,1:3000-8000、1:1500-4000、1:750-2000、1:300-800等,但不限于此。在一实施例中,上述β-葡萄糖苷酶与上述杭菊的重量比可为约1:3000-8000。在另一实施例中,上述β-葡萄糖苷酶与上述杭菊的重量比可为约1:1500-4000。在又另一实施例中,上述β-葡萄糖苷酶与上述杭菊的重量比可为约1:1500。又,在另一实施例中,上述β-葡萄糖苷酶与上述杭菊的重量比可为约1:750-2000。在又另一实施例中,上述β-葡萄糖苷酶与上述杭菊的重量比可为约1:300-800。
在另一实施例中,上述至少一种糖苷酶可为葡萄糖苷酶与葡萄糖醛酸酶。于此实施例中,葡萄糖苷酶与葡萄糖醛酸酶的重量比可为约1-2:1-2,例如1:1、1.5:1、2:1、1:1.5、1:2等,但不限于此。又,于此实施例中,葡萄糖苷酶加上葡萄糖醛酸酶与上述杭菊的重量比可为约1:200-10000,例如,1:3000-8000、1:1500-4000、1:750-2000、1:300-800等,但不限于此。在一实施例中,葡萄糖苷酶加上葡萄糖醛酸酶与上述杭菊的重量比可为约1:1500-4000。
又,在上述本发明的制备具有治疗皮肤疾病功效的杭菊萃取物的方法中,在一实施例中,如上述将杭菊以水进行上述萃取程序以获得杭菊水萃液。
而于此实施例中,上述萃取程序的温度可为约70-100℃,而上述萃取程序时间可为约1-3小时。
又,对于上述使用水为萃取溶剂的实施例中,在一特定实施例中,在将至少一种糖苷酶加入上述萃取液中,以发生酶反应而产生沉淀物的步骤中,所采用的至少一种糖苷酶为葡萄糖苷酶。此葡萄糖苷酶可为β-葡萄糖苷酶。又,上述酶反应的温度可为约25-45℃,例如25℃、30℃、35℃、36℃、37℃、37.5℃、38℃、39℃、40℃,但不限于此,而于一特定实施例中,上述酶反应的温度可为约37℃。此外,上述酶反应的时间可为约5-30小时,例如,5-25小时、16-24小时等,但不限于此,而于一特定实施例中,上述酶反应的时间可为约16-24小时。而在所采用的至少一种糖苷酶为β-葡萄糖苷酶的情况下,β-葡萄糖苷酶与杭菊的重量比可为约1:300-10000,例如,1:3000-8000、1:1500-4000、1:750-2000、1:400-800等,但不限于此。
另外,对于上述使用水为萃取溶剂的实施例中,在另一特定实施例中,在将至少一种糖苷酶加入上述萃取液中,以发生酶反应而产生沉淀物的步骤中,所采用的至少一种糖苷酶为葡萄糖苷酶与葡萄糖醛酸酶。此葡萄糖苷酶可为β-葡萄糖苷酶,而此葡萄糖醛酸酶则可为β-葡萄糖醛酸酶。又,上述酶反应的温度可为约35-40℃,例如35℃、36℃、37℃、37.5℃、38℃、39℃、40℃,但不限于此,而于一特定实施例中,上述酶反应的温度可为约37℃。此外,上述酶反应的时间可为约5-30小时,例如,5-25小时、16-24小时,但不限于此,而于一特定实施例中,上述酶反应的时间可为约16-24小时。而在所采用的至少一种糖苷酶为β-葡萄糖苷酶与β-葡萄糖醛酸酶的情况下,β-葡萄糖苷酶加上β-葡萄糖醛酸酶与杭菊的重量比可为约1:500-5000,例如,1:1500-4000等,但不限于此。又,β-葡萄糖苷酶与β-葡萄糖醛酸酶的重量比可为约1-2:1-2,例如1:1、1.5:1、2:1、1:1.5、1:2等。
关于上述本发明的制备具有治疗皮肤疾病功效的杭菊萃取物的方法,在另一实施例中,在将至少一种糖苷酶加入上述萃取液中,以发生酶反应而产生沉淀物的步骤中,于上述酶反应后,可更进行冷却程序以促进上述沉淀物产生。冷却程序的温度可为约2-15℃,例如4℃,但不限于此,而冷却程序的时间可为,但不限于约2-24小时,例如约24小时。
在又另一实施例中,上述本发明的制备具有治疗皮肤疾病功效的杭菊萃取物的方法,在将至少一种糖苷酶加入上述萃取液中,以发生酶反应而产生沉淀物的步骤之后,可更包括对上述沉淀物进行清洗程序。
而上述清洗程序则可包括,下述步骤,但不限于此。
首先,将上述沉淀物以醇类溶剂回溶,以形成混合液,而于此混合液可含有溶液部分与不溶物。在一实施例中,上述醇类溶剂的例子可包括,但不限于,甲醇、乙醇等。在一实施例中,上述醇类溶剂可为甲醇。
然后,将该上述溶液部分进行浓缩干燥以获得经清洗的沉淀物。此沉淀物具有治疗皮肤疾病的功效。
通过任一上述本发明制备具有治疗皮肤疾病功效的杭菊萃取物的方法,杭菊萃取物在经由酶处理而产生生物转换后,不仅可提升其活性成分的含量,并可改变其成分对溶剂的溶解度,进而达到沉淀纯化的目的。
又,通过任一上述本发明制备具有治疗皮肤疾病功效的杭菊萃取物的方法,可大幅提高杭菊萃取物中的二个指标成份,木犀草素(luteolin)与芹菜素(apigenin)的总含量,且仅以单步骤的酶处理即能够获得高纯度的杭菊萃取物,而得到一步骤纯化的效果。在通过任一上述本发明制备具有治疗皮肤疾病功效的杭菊萃取物的方法所获得的杭菊萃取物中,木犀草素与芹菜素含量总合可约为15-85wt%,但不限于此。
而木犀草素与芹菜素的含量比可为约约1:1-30,但不限于此。在一实施例中,木犀草素与芹菜素的含量比可为约1:1-30,例如1:1-25,但不限于此。
因此,由上述可知,本发明也可提供一种具有治疗皮肤疾病功效的杭菊萃取物,其可通过任一上述本发明制备具有治疗皮肤疾病功效的杭菊萃取物的方法来获得。
通过上述本发明的制备具有治疗皮肤疾病功效的杭菊萃取物的方法所获得的杭菊萃取物至少可包括,但不限于,木犀草素与芹菜素二个指标成份。在上述杭菊萃取物中,木犀草素与芹菜素含量总合可约为15-85wt%,但不限于此。
而于通过上述本发明的制备具有治疗皮肤疾病功效的杭菊萃取物的方法所获得的杭菊萃取物中,木犀草素与芹菜素的含量比可为约1:1-30,但不限于此。在一实施例中,木犀草素与芹菜素的含量比可为约1:1-30,例如1:1-25,但不限于此。
另外,本发明也可提供另一种具有治疗皮肤疾病功效的杭菊萃取物,其至少可包括,但不限于,木犀草素与芹菜素等二个指标成份,且木犀草素与该芹菜素的含量比可为约1:1-30,但不限于此。
在一实施例中,木犀草素与芹菜素的含量比可为约1:1-30,例如1:1-25,但不限于此。
此外,本发明更提供一种用于治疗皮肤疾病的医药组合物。本发明的用于治疗皮肤疾病的医药组合物可包括,但不限于,上述任一的本发明具有治疗皮肤疾病功效的杭菊萃取物与药学上可接受的介质、载体或盐类。
药学上可接受的介质可做为活性成分的稀释剂、分散剂或载体。药学上可接受的介质可包括常在皮肤护理产品中使用的材料,如水、液体或固体软化剂、硅酮油、乳化剂、溶剂、湿润剂、增稠剂、粉末、喷射剂与类似物。
介质可占上述组合物的80-99.9wt%,较佳为90-99wt%,并可以在没有其它佐剂的存在下构成组合物的其余部份。
又,前述组合物也可更包括其它特殊的皮肤受益活化物,如防晒剂及皮肤淡化剂。介质也可以进一步包括如抗氧化剂、香料、遮光剂、防腐剂、着色剂及缓冲液之类的佐剂。
此外,前述的所有组合物于一实施例中皆可制作成皮肤涂剂形式,包括,但不限于,乳剂、膏剂、凝胶、喷剂、化妆水、洗发水或摩丝等。一般来说,皮肤喷剂可由喷雾状共聚物所组成,例如,聚乙烯吡咯烷酮、醋酸乙烯及其类似物,且其可具有化妆水的功能。皮肤凝胶的制备方法与喷剂类似,但其为凝胶状且无乙醇的存在,可附着于皮肤上。皮肤摩丝为利用压力释放泡沫。皮肤乳剂为疏水性或亲水性乳剂、膏剂、凝胶、润肤剂、喷剂、涂剂、皮肤调理水、洗发水或摩丝。另外,更可添加适合的成份至皮肤乳剂,此额外添加的成份包括凡士林、蜡、羊毛脂、硅、微脂体、蔬菜、矿物油、增塑剂、香料、防腐剂、促渗透剂、ph值调整剂或其他适合用于局部皮肤的成份。此额外的成份可湿润皮肤,稳定活性化合物,增加前述组合物-皮肤的接触,进而提升局部区域的浓度,并控制组合物的释放。
前述药学上可接受的载体可包括,但不限于溶剂、分散介质(dispersionmedium)、包衣(coating)、抗菌与抗真菌试剂与等渗透压与吸收延迟(absorptiondelaying)试剂等与药学给予相容者。对于不同的给药方式,可利用一般方法将药学组合物配置成剂型(dosageform)。
又,上述药学上可接受的盐类可包括,但不限于盐类包括无机阳离子,例如,碱金属盐类,如钠、钾或胺盐,碱土金族盐类,如镁、钙盐,含二价或四价阳离子的盐类,如锌、铝或锆盐。此外,也可是为有机盐类,如二环己胺盐类、甲基-d-葡糖胺,氨基酸盐类,如精氨酸、赖氨酸、组氨酸、谷氨酰胺。
本发明医药组合物给药可以非口服、口服、经由吸入喷雾(inhalationspray)或通过植入贮存器(implantedreservoir)的方式。非口服可包括涂擦患部、皮下(subcutaneous)、皮内(intracutaneous)、静脉内(intravenous)、肌肉内(intramuscular)、关节内(intraarticular)、动脉内(intraarterial)、滑囊(腔)内(intrasynovial)、胸骨内(intrasternal)、鞘内(intrathecal)、疾病部位内(intralesional)注射以及灌注技术。
口服成分的形式可包括,但不限定于,药锭、胶囊、乳剂(emulsions)、水性悬浮液(aqueoussuspensions)、分散液(dispersions)与溶液。
而涂擦的局部用药成分的形式可包括软膏、乳剂、液剂、凝胶等,但不限于此。
本发明的减缓皮肤疾病的医药组合物可为局部给药剂型或全身给药剂型,但不限于此。在一实施例中,本发明的减缓皮肤疾病的医药组合物,且此局部给药剂型的例子可包括,但不限于软膏、乳剂、液剂、凝胶等。
上述本发明的任一种治疗皮肤疾病的医药组合物,可用于治疗各种皮肤疾病,并无特别限制。又,上述本发明的任一种治疗皮肤疾病的医药组合物对于治疗各种皮肤疾病,皆具有优良的功效,特别是对于具有发炎症状的皮肤疾病,具有优异的治疗及/或减缓皮肤发炎效果。
在一实施例中,上述本发明的任一种治疗皮肤疾病的医药组合物,可用于治疗过敏性或接触性皮肤炎。在另一实施例中,上述本发明的任一种治疗皮肤疾病的医药组合物,可用于治疗免疫性皮肤疾病,如干癣。
实施例
实施例1
粗萃物ptb1的制备
将杭菊(chrysanthemummorifolium)与15倍重量的水混合以形成混合物。将混和物加热至沸腾(约90-100℃),以进行加热萃取1小时,且之后移除其中的固体残余物,以获得萃取液。对此萃取液进行减压浓缩干燥程序,以获得粗萃物ptb1。所获得的粗萃物ptb1的重量与原始药材的重量的比例为约1:1.5-4。
实施例2
经酶处理的萃取物ptbx的制备
将杭菊与15倍重量的水混合以形成混合物。将混和物加热至沸腾(约90-100℃),以进行加热萃取1小时,且之后移除其中的固体残余物,以获得萃取液。
将萃取液冷却至室温后,加入酶,β-葡萄糖苷酶(β-glucosidase),而所添加的酶的重量与原始药材的重量的比例为1:1500。接着,将含有酶的萃取液,放置于37℃培养箱以进行反应16-24小时。于反应完成后,将经酶反应的萃取液置于4℃冰箱中24小时以促进沉淀产生。
将溶液固液分离以取出沉淀物,并以甲醇回溶,以形成混合液,而此混合液含有溶液部分与不溶物。然后,将溶液部分取出并进行减压浓缩干燥,以获得经酶处理的萃取物ptbx。
实施例3
1.ptbx软膏的制备
将ptbx干燥粉末(1g)与95%酒精(1.4g)、聚乙二醇400(10g)、聚乙二醇4000(4.5g)、和聚氧乙烯氢化蓖麻油(0.15g),及高纯度的去离子水(2.95ml)的混合物加热至60℃并搅拌至混合均匀,以制作成外用软膏剂型,其中95%酒精、聚乙二醇400、聚乙二醇4000、和聚氧乙烯氢化蓖麻油及高纯度的去离子水为载剂的成分。
2.单纯载剂的制备:
将95%酒精(1.4g)、聚乙二醇400(10g)、聚乙二醇4000(4.5g)、和聚氧乙烯氢化蓖麻油(0.15g),及高纯度的去离子水(2.95ml)的混合物加热至60℃并搅拌至混合均匀。
实施例4
杭菊萃取物于酶处理前后的化学成份变化
利用高效液相色谱(highperformanceliquidchromatography,hplc)来确认酶反应前后萃取物中的指标成分含量变化。
于本试验中选择两个黄酮类成分,木犀草素(luteolin)与芹菜素(apigenin)作为杭菊萃取物的指标成分,且同时观察以上述两个指标成份分别对应的糖基衍生物木犀草素-7-o-葡萄糖苷(luteolin7-o-glucoside)与芹菜素-7-o-葡萄糖苷(apigenin-7-o-glucoside)的含量变化,并以高效液相色谱进行各成分含量分析。
于酶处理前后的杭菊萃取物的高效液相色谱分析结果如表1所示。
表1、杭菊萃取物于酶处理前后的成份含量分析
依据表1可知,杭菊萃取物的木犀草素与芹菜素的总含量由酶处理前的0.063%(w/w,干基(drybase)),提升到酶处理后的60.848%(w/w,干基)。换言之,通过本发明所使用的酶处理可大幅提升木犀草素与芹菜素的总含量,并达到1个步骤纯化的效果。
实施例5
杭菊萃取物于酶处理前后的生物活性变化
1.经酶处理的萃取物ptbx的体外(invitro)抑制角质细胞增生的活性评估
将5×103个hacat角质细胞接种于96孔盘中,置于37℃及5%co2培养箱中培养。于培养16小时后,将此时间点(t0)的细胞数量作为细胞增生基准点,并对细胞分别加入不同制程的杭菊萃取物ptb1或ptbx以进行共同培养。于共同培养48小时(t48)之后,将培养盘中的上清液体移除,并对细胞加入50μlmtt溶液(0.5mg/ml)。之后,将培养盘置于37℃及5%co2培养箱并培养1.5小时,接着加入150μldmso并摇荡5分钟。然后,利用连续波长微孔盘分析仪测量波长570nm吸光值,且通过下列公式计算细胞增生率(cellproliferationactivity):
细胞增生率=odt0/odt48×100。
实验结果如表2所示。
2.对于经酶处理的萃取物ptbx的体外抑制脂多糖(lipopolysaccharide,lps)诱导的发炎的评估
将5×105个细胞/ml的raw264.7细胞种于96孔培养盘后于37℃、5%co2培养隔夜。将培养盘中的上清液去除,并加入脂多糖(50ng/ml)与不同浓度的ptb1或ptbx。
于反应24小时之后,吸取培养盘的上清液并通过griessreagent(promega,cat.no.g2930)来侦测其no含量。
而于培养盘中的细胞部分则加入50μl含mtt(0.5mg/ml)的培养液。之后,将培养盘置于37℃及5%co2培养箱并培养15-20小时,接着加入150μldmso并摇荡5-10分钟。最后以连续波长微孔盘分析系统读取od570,且通过下列公式计算细胞存活率:
细胞存活率(%)=(实验组od值/对照组od值)×100。
实验结果如表2所示。
3.经酶处理的萃取物ptbx体外抑制dnfb引起的过敏的活性评估
将2×104个人类初级角质细胞(normalhumanepidermalkeratinocytes,nhek)接种于96孔培养盘中,接着于培养盘加入重组蛋白tnf-α(100ng/ml;peprotechcat.no.300-01a)与细胞共同培养。于共培养6小时后,于培养盘中加入dnfb(1μm;sigmacat.no.d1529)与不同浓度的ptb1或ptbx继续培养48小时。之后,收集培养盘中的上清液体,并通过使用humanil-1βduosetelisa(invitrogen;cat.no.bms224)与根据制造商建议的操作步骤来分析上清液体中的il-1β含量,以确认细胞的il-1β表现量。
实验结果如表2所示。
4.经酶处理的萃取物ptbx体外抑制il-31导致的搔痒的活性评估
将2×104个人类初级角质细胞(nhek)接种于96孔培养盘中,接着于培养盘中加入tlr1/2刺激剂,pam3cys-ser-(lys)4(1μg/ml;abcam;cat.no.ab14208)与细胞共同培养。于共培养6小时后,于培养盘中加入重组蛋白il-31(100ng/ml;peprotech;cat.no.200-31)与不同浓度的ptb1或ptbx继续培养48小时。之后,收集培养盘中的上清液体,并通过使用人类ccl2/mcp-1duosetelisa(r&d;cat.no.dy279)与根据制造商建议的操作步骤来分析上清液体中的mcp-1含量,以确认细胞的mcp-1表现量。
实验结果如表2所示。
表2、杭菊萃取物于酶处理前后的体外生物活性分析
根据表2可知,经酶处理后的杭菊萃取物ptbx,在抑制皮肤角质细胞增生、发炎与接触性过敏以及止痒的效果上均显著被提升。
实施例6
经酶处理的萃取物ptbx降低小鼠类干癣皮肤发炎的功效评估
将balb/c小鼠(6~8周龄)的背部毛发剃除,并将小鼠分成四组,分别为未经处理组、对照组、咪喹莫特+载剂处理组以及实验组。于未经处理组中未给予小鼠任何处理;于对照组中,将50mg的咪喹莫特(imiquimod,imq)乳膏(aldara;3mpharmaceuticals)涂抹于小鼠背部,每天给予一次咪喹莫特乳膏,连续给予六天,以诱导小鼠皮肤类干癣症状产生;于咪喹莫特+载剂处理组中,将50mg的咪喹莫特乳膏(aldara;3mpharmaceuticals)涂抹于小鼠背部,接着局部涂抹软膏的载剂(50mg),每天给予一次咪喹莫特乳膏与软膏载剂,连续给予六天。于实验组中,则将50mg的咪喹莫特乳膏(aldara;3mpharmaceuticals)涂抹于小鼠背部,接着局部涂抹ptbx软膏(50mg),每天给予一次咪喹莫特乳膏与ptbx软膏,连续给予六天。
之后对小鼠背部的皮肤的发炎程度进行评分。皮肤发炎程度的评分项目包括发红(erythema)与脱屑(scaling)。小鼠背部的皮肤系依照发红或脱屑的严重程度给予0分(无病征)至4分(严重),并将发红及脱屑的评分加总以计算出总评分(cumulativescore)。各组小鼠的背部皮肤的发炎分数、脱屑分数以及总评分分别显示于图1a、图1b与图1c。
于牺牲前,将小鼠背部的皮肤的干癣病灶进行照相记录,并于牺牲后将小鼠背部皮肤进行切片、量测表皮厚度并进行苏木素-伊红(hematoxylinandeosin,h&e)染色。各组小鼠的背部皮肤的照片与h&e染色结果以及各组小鼠的背部皮肤的厚度分别显示于图1d与图1e。
此外,也将小鼠背部皮肤的部分组织分别进行角蛋白(keratin,k14)与丝聚蛋白(filaggrin,flg)的基因表达量的检测,结果如图1f与图1g所示。
图1a-图1e显示,在对照组中,给予50mg的咪喹莫特,可明显造成小鼠背部皮肤发红、脱屑与皮肤厚度增厚,然而在实验组中通过涂抹50mg的ptbx软膏可减缓皮肤发红与脱屑并减低皮肤厚度。
而在基因表达量方面,图1f与图1g显示,相较于未经处理组,对照组的k14表现明显增加(###p<0.001),然而涂抹50mg的ptbx软膏具有抑制k14表现的活性(*p<0.05)。相对于此,咪喹莫特造成flg表现的降低(#p<0.05),而涂抹50mg的ptbx软膏则具有维持flg表现的保护活性(**p<0.01)。实验结果以平均值±标准差表示。
实施例7
酶处理制程探讨:酶与萃取物的比例
将粗萃物ptb1的干燥粉末约1g以50ml醋酸钠缓冲液(sodiumacetatebuffer)(ph4.5)回溶,之后分别加入0.1、0.5、1、2及5mg的β-葡萄糖苷酶。接着将此含酶的溶液放置于37℃培养箱以进行反应16-24小时。于反应完成后,将此溶液置于4℃冰箱中24小时以促进沉淀产生。
将溶液固液分离以取出沉淀物,并将沉淀物以甲醇回溶,以形成混合液。之后将此混合液进行高效液相色谱分析,结果如表3所示。
表3、酶与萃取物比例条件探讨
nd:未检出
依据表3所示的结果可知,除了0.1mg的酶量无法产生沉淀物外,其他酶量均可产生沉淀效果。
实施例8
酶处理制程探讨:酶种类
将粗萃物ptb1的干燥粉末约1g以50ml醋酸盐缓冲液(ph4.5)回溶,之后分别加入1mg的β-葡萄糖苷酶、α-半乳糖苷酶(α-galactosidase)及β-葡萄糖醛酸酶(β-glucuronidase)。所添加的酶的重量与原始药材的重量的比例为约1:1500-4000(粗萃物ptb1的重量与原始药材的重量的比例为约1:1.5-4)。接着将此含酶的溶液放置于37℃培养箱以进行反应16-24小时。于反应完成后,将此溶液置于4℃冰箱中24小时以促进沉淀产生。
将溶液离心以分离出沉淀物,并将沉淀物以甲醇回溶,以形成混合液。之后将此混合液进行高效液相色谱分析以比较酶处理前后指标成分含量差异,结果如表4所示。
表4、不同酶的转换结果的指标成分含量分析
依据表4的结果可知,β-葡萄糖苷酶及β-葡萄糖醛酸酶均可通过生物转换增加杭菊萃取物中的木犀草素与芹菜素的含量。
实施例9
酶处理制程探讨:酶组合
将粗萃物ptb1的干燥粉末约1g以50ml醋酸盐缓冲液(ph4.5)回溶,之后同时加入1mg的β-葡萄糖苷酶与1mg的α-半乳糖苷酶,或1mg的β-葡萄糖苷酶与1mg的β-葡萄糖醛酸酶。所添加的酶的重量与原始药材的重量的比例为约1:750-2000(粗萃物ptb1的重量与原始药材的重量的比例为约1:1.5-4)。接着将此含酶的溶液放置于37℃培养箱以进行反应16-24小时。于反应完成后,将此溶液置于4℃冰箱中24小时以促进沉淀产生。
将溶液离心以分离出沉淀物,并将沉淀物以甲醇回溶,以形成混合液。之后将此混合液进行高效液相色谱分析以比较酶处理前后指标成分含量差异,结果如表5所示。
表5、不同酶的转换结果的指标成分含量分析
依据表5的结果可知,β-葡萄糖苷酶与β-葡萄糖醛酸酶同时存在时,可增加木犀草素-7-o-葡萄糖苷与芹菜素-7-o-葡萄糖苷分别对于木犀草素与芹菜素的转换。
实施例10
酶处理制程探讨:不同菊属植物
将金门油菊(chrysanthemumindicuml)、除虫菊(chrysanthemumcinerariifolium)或台湾小油菊(chrysanthemumindicum)与15倍重量的水混合以形成混合物。将混和物加热至沸腾(约90-100℃),以进行加热萃取1小时,且之后移除其中的固体残余物,以获得萃取液。
将萃取液冷却至室温后,加入酶,β-葡萄糖苷酶(β-glucosidase),而所添加的酶的重量与原始药材的重量的比例为1:1500。接着,将含有酶的萃取液,放置于37℃培养箱以进行反应16-24小时。于反应完成后,将经酶反应的萃取液置于4℃冰箱中24小时以促进沉淀产生。
之后将萃取液离心,分别取上清液与沉淀物进行高效液相色谱分析以确认其他菊属植物是否通过酶处理也可达成沉淀纯化的效果,并将沉淀物进行体外抑制角质细胞活性分析,结果如表6所示。
表6、菊属植物的酶转化制程活性分析结果
由表6所示的结果可知,其他菊属植物,例如金门油菊、除虫菊与台湾小油菊,皆无法通过酶处理来进行沉淀纯化与并藉此提高抑制角质细胞的活性。
然本发明已以较佳实施例揭露如上,然其并非用以限定本发明,任何熟习此技艺者,在不脱离本发明的精神和范围内,当可作些许的更动与润饰,因此本发明的保护范围当视后附的权利要求所界定者为准。
- 还没有人留言评论。精彩留言会获得点赞!