表达H7N9亚型禽流感病毒血凝素蛋白的重组杆状病毒灭活疫苗及其制备方法与应用与流程
本发明涉及一种疫苗技术领域,具体涉及一种表达h7n9亚型禽流感病毒血凝素蛋白的重组杆状病毒疫苗及其制备方法与应用。
技术背景
h7n9禽流感病毒(avianinfluenzavirus,aiv)可感染禽类、哺乳动物与人类,是一种严重威胁养禽业与人类健康的人兽共患病原。自2013年至今,我国经历了六波h7n9流感疫情流行,并在第五波流行季的人群和禽类中检测发现h7n9变异株,其ha蛋白裂解位点插入4个碱性氨基酸“krta”,标志着h7n9亚型aiv出现了由低致病性向高致病性的转变。h7n9亚型高致病性aiv的出现为中国的公共卫生和养禽业带来了更大的威胁和挑战,更引发了全球对aiv的关注。家禽是h7n9病毒的来源,因此控制家禽中h7n9病毒的流行是防控h7n9疫情的关键。
接种疫苗是减少流感病毒感染与控制疫情发展的最佳方法之一,而传统的鸡胚生产疫苗具有鸡胚供应不稳定、外源病毒污染、废弃物产量大等缺陷。近年来,利用mdck细胞、vero细胞的大规模悬浮培养技术生产的禽流感疫苗也陆续出现,但是aiv在细胞中扩增会导致ha蛋白的过度糖基化,进而影响疫苗的免疫原性。相反,采用杆状病毒表达系统表达ha蛋白能够很好地解决这些问题:sf9细胞可在无血清培养基中进行大规模悬浮培养,保证重组杆状病毒的增殖与ha蛋白的大量表达;细胞培养的周期短、易放大,保证疫苗生产的时效性;杆状病毒表达系统对糖蛋白的糖基化修饰与天然状态相似,保持抗原的免疫原性;细胞培养产生的废弃物量少、易无害化处理,对环境友好(bucklandb,boulangerr,finom,etal.technologytransferandscale-upoftheflublokrecombinanthemagglutinin(ha)influenzavaccinemanufacturingprocess[j].vaccine,2014,32(42):5496-5502./maninii,trombettacm,lazzerig,etal.egg-independentinfluenzavaccinesandvaccinecandidates.[j].vaccines,2017,5(3):18.)。此外,有文献证实,h7n9疫苗抗原的免疫原性普遍较低,而昆虫细胞和杆状病毒表达系统表达外源蛋白制备的疫苗在接种过程中可以产生有效的佐剂效应(huz,jiaox,liux.antibodyimmunityinducedbyh7n9avianinfluenzavaccines:evaluationcriteria,affectingfactors,andimplicationsforrationalvaccinedesign[j].frontiersinmicrobiology,2017,8:1898./stadlbauerd,rajabhathora,amanatf,etal.vaccinationwitharecombinanth7hemagglutinin-basedinfluenzavirusvaccineinducesbroadlyreactiveantibodiesinhumans[j].msphere,2017,2(6):e00502-17./kamalrp,blanchfieldk,belserja,etal.inactivatedh7influenzavirusvaccinesprotectmicedespiteinducingonlylowlevelsofneutralizingantibodies[j].journalofvirology,2017,91(20):jvi.01202-17.)。
血凝素ha是aiv的表面糖蛋白,具有免疫原性,诱导中和抗体,是禽流感疫苗研制的主要靶蛋白。ha负责与宿主细胞上的受体唾液酸结合,每个病毒粒子约有500个ha分子。由于ha在病毒生命周期中起着关键性作用,也是诱导体液免疫的主要蛋白,因此,ha是用于开发预防和治疗禽流感生物制品的最具吸引力的蛋白。杆状病毒表达系统(baculovirusexpressionvectorsystem,bevs)作为生产高质量重组蛋白的简单、可靠的方法已经被很好的建立和应用。自1983年bevs建立以来,已经采用该系统成功表达了数千种重组蛋白,其中有7种重组蛋白作为抗原制备的疫苗已被商品化。bevs具有安全性好、蛋白表达量高、可容纳较大的外源基因片段、完备的翻译后加工修饰功能、易于大规模生产等独特优势,在疫苗研制领域应用广泛,是制备禽流感疫苗的优选载体系统。
目前,运用bevs表达外源蛋白制备h7n9亚型禽流感疫苗的研究,大多数采用bac-to-bac技术(廖明,张娇,樊惠英,等.一种以杆状病毒为载体的h7n9亚型禽流感基因工程疫苗及其制备方法与应用,cn106421771a[p].2017./张耀洲,赵恩伟,张芳伟,等.含h7n9病毒ha基因的重组序列、重组杆状病毒及该病毒在疫苗制备中的应用,cn104711278a[p].2015.)。虽然bac-to-bac技术省去了空斑纯化的步骤,较为节省时间,但是运用该技术表达的重组杆状病毒在昆虫细胞中不稳定。而运用共转染技术,在构建重组杆状病毒质粒的过程中操作比较简单方便,杆状病毒基因组dna线性化技术的出现也大大提高了重组效率,而且表达的重组杆状病毒有很好的稳定性,为后期疫苗的制备提供了稳定性保障。因此,我们选择运用共转染的方法制备重组杆状病毒,进而研制h7n9禽流感疫苗。
技术实现要素:
为改进传统灭活疫苗制备技术存在的缺点与不足,本发明的目的是基于昆虫杆状病毒系统高效表达ha蛋白,用于h7n9禽流感疫病的防控。
本发明的另一目的在于提供上述表达h7n9亚型aiv血凝素蛋白的重组杆状病毒灭活疫苗的制备方法。
本发明的第三个目的在于提供上述表达h7n9亚型aiv血凝素蛋白的重组杆状病毒灭活疫苗的应用。
本发明的目的通过下述技术方案实现:一种表达h7n9亚型aiv血凝素蛋白的重组杆状病毒灭活疫苗,包括:重组杆状病毒rbac-jx148ha,该重组杆状病毒能够表达h7n9禽流感病毒主要免疫抗原ha蛋白,其免疫佐剂为seppic佐剂;其中所述的ha蛋白的核酸序列如seqidno:1所示。
所述的重组杆状病毒的构建所用的载体为pvl1393。
所述的杆状病毒为苜蓿银纹夜蛾核型多角体病毒(acmnpv)。
所述的重组穿梭质粒命名为pvl1393-jx148-ha。
所述的重组修饰的杆状病毒命名为重组杆状病毒rbac-jx148ha。
上述表达h7n9亚型aiv血凝素蛋白的重组杆状病毒灭活疫苗的制备方法,包括以下步骤:
(1)重组杆状病毒rbac-jx148ha的制备:
用rt-pcr方法扩增ha基因,所得的序列如seqidno:1所示,然后将seqidno:1克隆到杆状病毒转移载体pvl1393载体中,构建包含h7n9jx148株ha基因的重组转移载体,基于同源重组的原理,将重组转移载体与苜蓿银纹夜蛾多核型多角体病毒acmnpv线性化的基因组dna共转染至昆虫细胞sf9,成功拯救重组杆状病毒rbac-jx148ha,重组杆状病毒经过连续三轮空斑纯化后,在sf9悬浮细胞中扩大培养;
(2)灭活重组杆状病毒制备:
首先进行重组杆状病毒的遗传稳定性的鉴定,将重组病毒rbac-jx148ha在sf9悬浮细胞中连续传代,检测每代重组病毒的基因组内的ha基因;选择病毒滴度最高的一代作为抗原制备种毒,运用bei的方法灭活病毒制备抗原;将彻底灭活的抗原配合seppic佐剂乳化制成重组杆状病毒灭活疫苗。
优选地,步骤(2)所述的运用bei的方法灭活病毒制备抗原,具体是:将工作浓度为170mm/l的bei与抗原液按照体积比为1:17的比例混匀,置于37℃培养摇床,120rpm轻摇48h后终止灭活;取灭活样品分别进行血凝效价、ph值以及灭活效果测定,结果显示灭活的抗原血凝效价为25,ph=6.6,病毒分离率为0%。
本发明中,所述重组杆状病毒推荐传代15次,选择传代15次目的有两个:①比较每代病毒滴度,选择病毒滴度最高的一代作为抗原制备种毒;②验证重组杆状病毒的稳定性为后期疫苗的制备提供保障。
上述表达h7n9亚型aiv血凝素蛋白的重组杆状病毒灭活疫苗的应用,应用于h7n9亚型禽流感疫苗的制备。
本发明基于杆状病毒-昆虫细胞表达系统安全性好、蛋白表达量高、易于大规模生产等独特优势,利用杆状病毒转移载体pvl1393提供的ph启动子和多克隆位点,选择h7n9亚型aiv的血凝素ha作为疫苗设计的靶蛋白,构建了含有ha基因的重组穿梭质粒pvl1393-jx148-ha。并且杆状病毒转移载体pvl1393含有与杆状病毒基因组序列同源的重组序列,在共转染时,这些序列与线性失活的杆状病毒dna进行同源重组获得环化复活的重组杆状病毒rbac-jx148ha-p1,进而将重组病毒经过连续三轮空斑纯化后,在sf9悬浮细胞中扩大培养,对病毒的生长特性、遗传稳定性、外源蛋白表达等生物学特性进行鉴定,并优化了重组杆状病毒灭活的各项条件,制备了重组杆状病毒灭活疫苗,评价了其在spf鸡中的免疫原性与保护效力。以上内容不仅为研制h7n9禽流感疫苗提供了新思路,而且该疫苗在h7n9禽流感的防控上具有较好的应用前景,且符合兽用疫苗利用悬浮细胞培养技术进行大规模生产的趋势。
本发明与现有技术相比具有以下优点:
本发明提供一种表达h7n9亚型aiv血凝素蛋白的重组杆状病毒灭活疫苗,该h7n9亚型禽流感疫苗包括重组的杆状病毒,所述的杆状病毒能够表达h7n9亚型aiv血凝素ha蛋白。本发明在技术方面有所创新:基于线性失活的高效同源重组技术,可迅速、便捷地筛选出重组成功的病毒。另外,本发明在工艺方面有所创新:i.应用连续三轮的空斑纯化实验,保证了重组病毒的纯度,增强了表达外源基因的稳定性。ii.重组杆状病毒的灭活工艺对保持抗原的免疫原性也有重要影响。甲醛由于价格低廉而被用作大多数灭活疫苗的抗原灭活剂。但是,甲醛主要作用于抗原蛋白,易使蛋白结构发生变化而降低免疫原性。本发明选用一种烷化剂bei作为杆状病毒的灭活剂。bei作用于微生物的核酸,使其不再具有复制能力,但不影响蛋白质成分的结构与活性,能更大限度地保持抗原的免疫原性。
附图说明
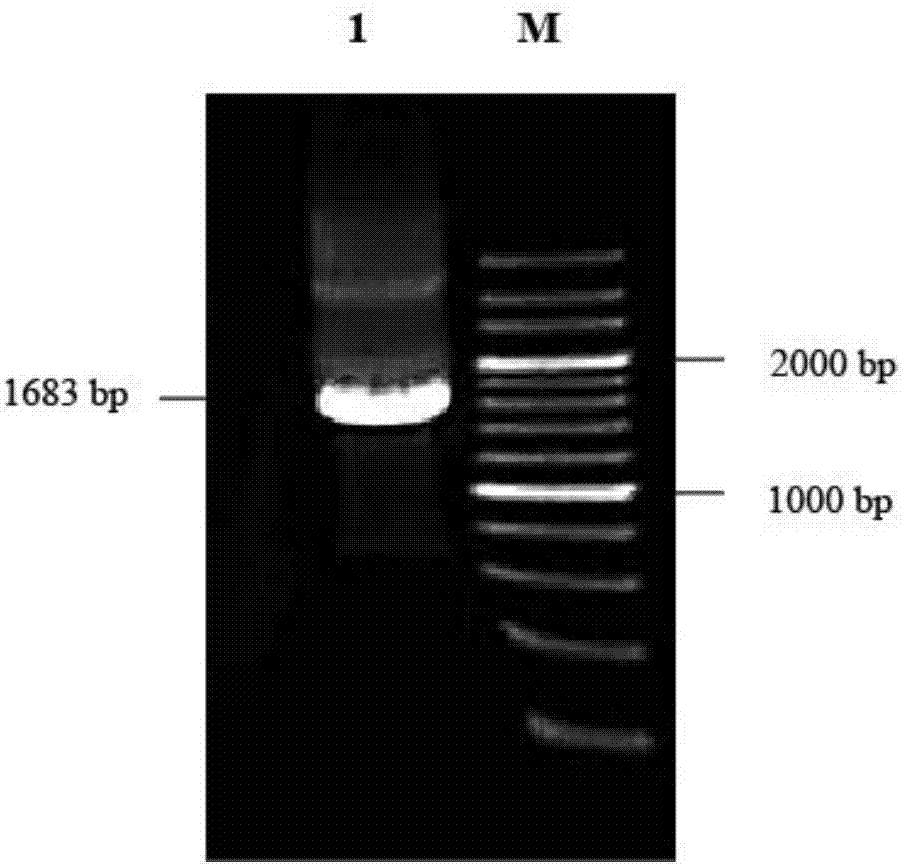
图1为扩增a/chicken/zhejiang/jx148/2014病毒ha的鉴定图,其中1为ha基因,m为200bpdnaladdermaker。
图2为重组质粒pvl1393-jx148-ha的酶切鉴定图,构建得到的重组杆状病毒转移质粒pvl1393-jx148-ha含有xbai、bglii单酶切位点,用这两个限制性内切酶进行双酶切鉴定。其中m为1kbdnaladdermaker,1为xbai单酶切产物,2为xbai和bglii双酶切产物。
图3为第1代至第15代重组杆状病毒外源蛋白ha测序结果,ha基因序列完全一致,保持了其序列正确性。
图4为制备抗原种毒感染sf9细胞后ha的表达情况鉴定结果,ha蛋白的表达量高,且其表达主要在细胞膜上。
图5为抗原制备条件的探索结果,将第7代重组杆状病毒分别以moi=0.1(a图)、moi=0.3(b图)、moi=0.5(c图)接种悬浮培养的sf9细胞,不同时间点测定培养物的ha效价的结果,以确定最优的蛋白表达条件。结果显示,以三个感染剂量接种sf9细胞,培养物的ha效价无明显差异,但是在以moi=0.1的感染剂量条件下,感染早期(第2天)的ha滴度较低。因此,选择以moi=0.3的感染剂量接种sf9悬浮细胞,培养4天后收获细胞培养物作为抗原。
图6为免疫后各组鸡的hi血清抗体水平结果。其中a图是用h7n9亚型低致病性禽流感病毒jx148作为抗原检测抗体水平的结果,b图是用h7n9亚型高致病性禽流感病毒gd15作为抗原检测抗体水平的结果。
图7为以h7n9亚型高致病性禽流感病毒gd15攻毒后各组spf鸡排毒情况测定结果,a图为攻毒后喉头的排毒情况,b图为攻毒后泄殖腔的排毒情况。结果显示,3种疫苗均可抑制gd15攻击的排毒。重组杆状病毒疫苗免疫鸡在攻毒后第3、5天的喉头排毒率比全病毒灭活疫苗免疫鸡的排毒率低,且排毒量更低。重组杆状病毒疫苗和商品化疫苗在抑制排毒方面无显著差异。
具体实施方式
本发明的实施方案通过下列实施例举例说明,所述实施例是为了举例说明本发明,而本发明的实施方案不限于实施例的特定细节。本发明的范围由附属的权利要求限定。
下述实施例中的实验材料,若无特别说明,均是来源于商业途径。所述的实验方法,若无特别说明,均为常规实验方法。
实施例1:重组杆状病毒质粒的构建与鉴定
(1)h7n9亚型禽流感病毒基因组rna的提取
本实验中使用的h7亚型禽流感病毒a/chicken/zhejiang/jx148/2014(以下简称jx148株)以及由其制备的阳性血清均由扬州大学农业部畜禽传染病重点开放实验室保存并提供(刘秀梵,何东昌,郝小利,顾敏,胡娇,王晓泉等.表达h7n9亚型禽流感病毒血凝素蛋白的重组火鸡疱疹病毒株rhmw及构建方法,cn106399267a[p].2017./刘秀梵,何东昌,郝小利,顾敏,胡娇,王晓泉等.表达h7n9亚型禽流感病毒嵌合型血凝素蛋白的重组火鸡疱疹病毒株rhmw及构建方法,cn106497893a[p].2017.)。将含有jx148病毒的鸡胚尿囊液8000rpm离心5min,取上清液350μl到无rnase的eppendorf管中,按照天津原平皓生物公司组织/细胞rna提取试剂盒的说明书提取rna。
①加入350μl裂解液(含β-巯基乙醇),剧烈振荡20s,充分裂解。
②加入等体积的70%乙醇,立即吹打混匀,勿离心。
③立即将混合物加入一个吸附柱ra中(吸附柱放入收集管中),12000rpm离心60s,弃掉废液。
④加700μl去蛋白液rw1,室温放置30s,12000rpm离心30s,弃掉废液。
⑤加入500μl漂洗液rw(已加无水乙醇)12000rpm离心30s,弃掉废液。重复该步骤。
⑥将吸附柱ra放回空收集管中,12000rpm离心2min,尽量除去漂洗液。
⑦取出吸附柱ra,放入一个rnasefree离心管中,根据预期rna产量在吸附膜的中间部位加35μlrnasefreewater,室温放置1min,12000rpm离心1min。
(2)rna反转录合成cdna
rt反应体系如下:向1.5ml离心管加入16μlrna模板及2μl12nt随机引物,72℃水浴15min后,按照roche公司amv反转录酶试剂盒的说明书进行反转录,即在25μl的pcr体系中加入以下各组分:5μl5×buffer、1μldntpmix(10mmol/l)、0.5μlamvreversetranscriptase(10u/μl)、0.5μlrnasin(40u/μl),42℃水浴2h。
根据禽流感病毒jx148ha的序列(gisaid:epi_isl_235293;genebank:ky005878),设计引物扩增ha基因orf的1~1683nt区域,引物命名为jx148-ha-f和jx148-ha-r。其中在jx148-ha-f、jx148-ha-r上下游引入xbai、bglii酶切位点,引物序列如下:
jx148-ha-f:5’-attctagagccaccatgaacactcaaatcctggtat-3’(seqidno:2)
jx148-ha-r:5’-atagatctttatatacaaatagtgcaccgca-3’(seqidno:3)
根据杆状病毒转移载体pvl1393的基因序列(http://www.addgene.org/browse/sequence_vdb/4621/),设计测序引物,引物命名为1393-sf和1393-sr,引物序列如下:
1393-sf:5’-aaatgataaccatctcgc-3’(seqidno:4)
1393-sr:5’-gtccaagtttccctg-3’(seqidno:5)
引物jx148-ha-f/jx148-ha-r的扩增条件为:94℃预变性4min后进入循环;循环参数为:94℃,90s,60℃,30s,72℃,90s;25个循环后72℃终延伸7min。将pcr产物回收并用xbai、bglii双酶切,同时将pvl1393载体质粒(allelebiotech公司)用xbai、bglii双酶切,连接,转化大肠杆菌dh5a感受态细胞,获得重组转移质粒pvl1393-jx148-ha。用xbai和bglii对质粒进行酶切鉴定,并对该质粒进行测序,结果正确(见图1和图2)
实施例2:重组杆状病毒rbac-jx148ha的获得与鉴定
(1)重组杆状病毒rbac-jx148ha的获得
按照allelebiotechnology公司杆状病毒转染试剂盒手册提供的方法进行:重组转移质粒pvl1393-jx148-ha与线性dna共转染sf9细胞,连续培养4~5天,收集细胞培养上清,即可获得第1代重组杆状病毒rbac-jx148ha-p1。
(2)重组ha蛋白成功表达的鉴定
①重组ha蛋白的间接免疫荧光检测。
②重组蛋白的蛋白电泳和western-blot。
③重组杆状病毒提取dna进行pcr鉴定。
实施例3:重组杆状病毒rbac-jx148ha的纯化
重组杆状病毒进行连续三轮空斑纯化,得到纯化的第4代重组杆状病毒rbac-jx148ha-p4。
实施例3:重组杆状病毒的扩增
(1)sf9细胞悬浮培养
①sf9细胞复苏后,经t25方瓶静置培养3代以上,待细胞状态良好,可转入三角摇瓶进行振荡悬浮培养。
②以初始密度为1×106cells/ml的接种量逐步扩大到250ml容量的三角摇瓶中,用sf900iiisfm无血清培养基进行培养,加入80ml细胞液,培养温度为27℃,转速为120rpm。
③细胞培养期间,每天进行细胞计数。
④当细胞生长密度达5×106~6×106cells/ml时进行传代,将高密度细胞液用新鲜培养基稀释至密度为1×106cells/ml,然后转移至新的无菌三角摇瓶中,保持总细胞液仍为80ml。
⑤sf9细胞摇瓶悬浮培养传代3代以上,细胞无聚团现象,状态良好即可用于后续重组杆状病毒的扩增。
(2)重组病毒的扩增
①以sf9细胞初始密度为1×106cells/ml的接种量,接种至250ml容量的摇瓶中,培养体积为80ml。
②将纯化后的rbac-jx148ha-p4进行10倍稀释。
③取500μl病毒稀释液加入到250ml容量的摇瓶中,置于摇床中进行振荡悬浮,培养温度为27℃,摇床转速为120rpm。
④连续培养4天,收获细胞上清,即第5代重组杆状病毒rbac-jx148ha-p5。
(3)病毒滴度测定(tcid50)
①铺96孔细胞板,细胞量为1×105cells/孔,27℃静置1h。
②将重组杆状病毒rbac-jx148ha-p5用sf900iiisfm培养基作10倍倍比稀释。
③吸弃96孔细胞板中培养基,取病毒10-1~10-6梯度稀释液依次加入96孔细胞板相应孔中,病毒接种量为每孔加100μl,每个稀释度重复接种8个孔。
④盖好盖子,27℃吸附1h。
⑤吸弃病毒液,换入含5%血清excell-420,27℃静置培养。
⑥连续培养4天后,进行ifa,根据gp64蛋白的表达情况判定病毒感染并计算。
(4)重组杆状病毒均以moi=0.01的感染复数,感染摇瓶sf9细胞,进行病毒传代扩增,由第5代传至第15代。
实施例4:重组杆状病毒的遗传稳定性鉴定
(1)重组杆状病毒滴度测定(tcid50),结果见表1。
表1.由第5代至第15代重组杆状病毒的病毒滴度(tcid50)测定结果
(2)重组杆状病毒传代后测外源蛋白ha序列
第1代至第15代重组杆状病毒dna提取按照全式金病毒提取试剂盒说明书进行。
①polyacarrierrna与bindingbuffer1:50混匀,称为mixa。
②每个样品取200μl上清,加入200μlbb5与20μl蛋白酶k,涡旋混匀。
③56℃孵育15min。
④加入250μl无水乙醇,涡旋混匀后室温放置15min。
⑤装好吸附柱,将混合液转移至柱内,12000rpm离心1min,弃去下层液体。
⑥加入500μlwb5,12000rpm离心1min,弃去下层液体,重复本步一次。
⑦12000rpm离心1min,弃去下层收集管,换1.5mleppendorf管。
⑧在柱内加入30μlelutionbuffer,室温放置1min,12000rpm离心1min洗脱核酸。
pcr扩增重组杆状病毒dna中ha片段,设计一对引物1393rf和1393rr,引物序列如下:
1393rf:5’-tttactgttttcgtaacagttttg-3’(seqidno:6)
1393rr:5’-caacaacgcacagaatctag-3’(seqidno:7)
引物1393rf/1393rr的扩增条件为:94℃预变性4min后进入循环;循环参数为:94℃,90s,55℃,30s,72℃,90s;25个循环后72℃终延伸7min。将pcr产物回收并送测序,测序结果进行序列比对第1代至第15代重组杆状病毒的ha序列完全一致,无突变现象,结果如图3所示。
实施例5:抗原的制备
根据重组杆状病毒遗传稳定性的鉴定结果,选择第7代重组杆状病毒rbac-jx148ha-p7做为制备抗原的种毒。首先运用激光共聚焦实验鉴定抗原种毒感染sf9细胞后ha蛋白的表达情况,结果表明ha表达可以很好的表达(图4)。然后分别以moi=0.1、moi=0.3、moi=0.5不同的感染复数去感染摇瓶sf9细胞以探索制备抗原的最佳培养条件,由结果得出,制备抗原的最佳条件是以moi=0.3的感染复数去感染摇瓶sf9细胞,连续培养4天收获的抗原表达量较高,血凝效价为27,也较稳定(图5)。
实施例6:病毒的灭活
本发明采用bei病毒灭活方法,灭活后病毒的血凝效价为25,进行病毒灭活监测,在sf9细胞上盲传两轮,验证出病毒灭活彻底,可用于后续实验。具体方法如下:
(1)0.3mnaoh和0.4mbea配制成170mm/l的bei,避光,现配现用。
(2)按照抗原液:bei=17:1的比例,将bei悬空加入抗原液里,边加边摇,加完bei混和均匀,立刻取出3ml抗原液移至10ml离心管中,并加入30μlna2s2o3·5h2o中和37℃,120rpm轻摇1h,作为灭活0h检测样品。将抗原液转移至新的无菌三角摇瓶中,用铝膜包裹好以避光,37℃,120rpm轻摇灭活72h。
(3)取样(用于病毒灭活监测):0h检测样品在第(2)步中已取。灭活过程中,每隔24h就取一次样品,同上取出3ml抗原液至10ml离心管中,并加入30μlna2s2o3·5h2o进行中和(避光,37℃,120rpm轻摇作用1h),然后分装入1.5ml无菌ep管中。每个时间点样品均分三份,分别进行以下实验:
①ha效价测定;
②ph值测定;
③病毒分离。
(4)终止灭活:37℃,120rpm轻摇灭活72h,向抗原液中加入na2s2o3·5h2o进行中和,可以按照na2s2o3·5h2o:抗原液=1:100的比例加入na2s2o3·5h2o,同样37℃,120rpm轻摇1h后即可结束。
(5)病毒分离
①每个时间点(0h、24h、48h、72h)的灭活样品分别感染sf9细胞.铺6孔板,每孔细胞量为1×106cells,每孔加200μl样品,并设置阴性对照和阳性对照。
②阳性对照用rbac-jx148ha-p7,将病毒稀释106倍,使其滴度在tcid50=100.5/ml~101.5/ml范围内。
③取200μl病毒稀释液加入6孔板中,27℃培养7天后收获上清。
④将所收获的上清液再次感染sf9细胞,铺6孔板,每孔细胞量为1×106cells,每孔接种上清液400μl,27℃连续培养。
⑤感染6天后,固定细胞进行ifa,检测gp64蛋白的表达。
由三次重复实验结果来看,病毒最适宜的灭活条件为37℃,120rpm轻摇灭活48h,向灭活的病毒液中加入na2s2o3·5h2o进行中和,37℃,120rpm轻摇1h后即可(表2)。
表2为抗原灭活条件的探究结果
实施例7:抗原的乳化
①按照抗原与seppic佐剂比例1:2的比例混合。
②在匀浆机上以6000r/min乳化5min,至混合液呈乳白色、均匀的乳剂。
③进行剂型检验:用滴管吸取少量乳制剂滴入自来水中,第1滴除外,均不扩散呈油包水型。
④静置于4℃观察一周,再次进行剂型检验。用滴管吸取少量乳白色、均匀的乳剂滴入自来水中,第1滴除外,均不扩散呈油包水型,可用于后续免疫实验。
实施例8:免疫实验
将35只3周龄spf鸡随机分成4组:pbs组(5只)、jx148全病毒灭活疫苗组(10只)、rbac-jx148ha重组疫苗组(10只)、商品化疫苗组(10只)。jx148全病毒灭活疫苗组和rbac-jx148ha重组疫苗组免疫剂量均为0.6ml/只(抗原含量为512个ha单位),商品化疫苗组免疫剂量按照说明书为0.3ml/只,pbs组每只spf鸡接种0.6ml无菌pbs。免疫方式为肌肉注射免疫。
免疫后2、3、4周翅静脉采血分离血清进行血凝抑制实验,分别用h7n9亚型低致病性禽流感病毒a/chicken/jiaxing/148/2014(jx148)和h7n9亚型高致病性禽流感病毒a/chicken/guangdong/gd15/2017(gd15)毒株作为检测抗原,检测血清抗体效价。
结果显示,以jx148毒株为抗原进行检测(图6a),免疫后第4周,jx148免疫组有60%的鸡血凝抑制效价达4log2以上,rbac-jx148ha组有90%的鸡血凝抑制效价达4log2以上,commercialvaccine组100%的鸡血凝抑制效价达4log2以上;以gd15毒株为抗原进行检测(图6b),免疫后第4周,jx148免疫组血凝抑制效价达4log2以上的鸡可占总数的50%,rbac-jx148ha组血凝抑制效价达4log2以上的鸡可占总数的70%,commercialvaccine组100%的鸡血凝抑制效价达4log2以上。此外,rbac-jx148ha灭活苗诱导的针对jx148与gd15的hi平均滴度比jx148全病毒灭活苗诱导的滴度高,但比commercialvaccine诱导的hi平均滴度低。免疫实验表明,重组杆状病毒灭活疫苗诱导的血清转化率与hi抗体水平均高于全病毒灭活苗,显示其良好的免疫原性。
实施例9:攻毒保护实验研究
免疫后4周,选择用gd15毒株进行攻毒保护实验,以106.0eid50去攻毒,采用滴鼻点眼的方式进行病毒接种。每天观察鸡的临床症状,临床观察2周,于攻毒后的第3、5、7天采集喉头棉拭子及泄殖腔棉拭子用于排毒情况的测定。
(1)攻毒后2周临床观察结果
rbac-jx148ha重组病毒疫苗组和商品化疫苗组鸡均未出现发病症状,死亡保护率均为100%。jx148全病毒灭活疫苗组鸡在攻毒后第4天死亡1只,攻毒2周期间,有2只出现鸡冠发紫,脚鳞出血;1只出现眼结膜炎;其他6只无明显症状,死亡保护率为90%,发病率为40%。pbs对照组鸡攻毒3天5只鸡中死亡1只,攻毒7天全部死亡,出现鸡冠肉髯发紫,眼睑水肿,脚鳞出血,偏头扭颈等症状。
(2)攻毒后棉拭子样品病毒分离和滴定,结果显示,三种疫苗均可抑制gd15攻击的排毒。重组杆状病毒疫苗免疫鸡在攻毒后第5天的喉头排毒率比全病毒灭活疫苗免疫鸡的排毒率低(表3)。重组杆状病毒疫苗和商品化疫苗在抑制排毒方面无显著差异(表3和图7)。
表3为各免疫组鸡gd15攻毒后的排毒情况
攻毒保护实验表明,重组杆状病毒灭活苗可提供针对h7n9hpaiv攻击的完全的临床保护,而全病毒灭活苗仅能提供60%保护。此外,重组杆状病毒灭活疫苗抑制排毒的能力强于全病毒疫苗,且与商品化疫苗无显著差异。
上述的利用杆状病毒表达系统表达外源蛋白制备的重组杆状病毒灭活疫苗在h7n9禽流感的防控上具有较好的应用前景,具有兽用疫苗利用悬浮细胞培养技术进行大规模生产的趋势。
sequencelisting
<110>扬州大学
<120>表达h7n9亚型禽流感病毒血凝素蛋白的重组杆状病毒灭活疫苗及其制备方法
与应用
<130>
<160>7
<170>patentinversion3.3
<210>1
<211>1683
<212>dna
<213>h7n9禽流感病毒
<400>1
atgaacactcaaatcctggtattcgctctgattgcgatcattccaacaaatgcagacaaa60
atctgcctcggacatcatgccgtgtcaaacggaaccaaagtaaacacattaactgaaaga120
ggagtggaagtcgtcaatgcaactgaaacagtggaacgaacaaacatccccaggatctgc180
tcaaaagggaaaaagacagttgacctcggtcaatgtggactactggggacaatcactgga240
ccacctcaatgtgaccaattcctagaattttcagccgatttaattattgagaggcgagaa300
ggaagtgatgtctgttatcctggaaaattcgtgaatgaagaagctctgaggcaaattctc360
agagaatcaggcggaattgacaaggaagcaatgggattcacatacagtggaataagaact420
aatggagcaaccagtgcatgtaggagatcaggatcttcattctatgcagaaatgaaatgg480
ctcctgtcaaacacagataatgctacattcccgcagatgactaagtcatataaaaataca540
agaaaaagcccagctctaatagtatgggggatccatcattccgtatcaactgcagagcaa600
accaagctatatgggagtggaaacaaactggtgacagttgggagttctaattatcaacaa660
tcttttgtaccgagcccaggggcgagaccacaagttaatggtcaatctggaagaattgac720
tttcattggctaatgctaaatcccaatgatacagtcactttcagtttcaatggggctttc780
atagctccagaccgtgcaagcttcctgagaggaaaatcgatgggaatccagagtggagta840
caggttgatgccaattgtgaaggggactgctatcatagtggaggaacaataataagtaac900
ttgccatttcagaacatagatagcagggcagttggaaaatgtccgagatatgttaagcaa960
aagagtctgctgctagcaacagggatgaagaatgttcctgagattcccaagggaagaggc1020
ctatttggtgctatagcgggtttcattgaaaatggatgggaaggcctaattgatggttgg1080
tatggtttcagacaccagaatgcacagggagagggaactgctgcagattacaaaagcact1140
caatcggcaattgatcaaataacaggaaaattaaaccggcttatagaaaaaaccaaccaa1200
caatttgagttgatagacaatgaattcaatgaggtagagaagcaaatcggtaatgtgata1260
aattggaccagagattctataacagaagtgtggtcatacaatgctgaactcttggtagca1320
atggagaaccagcatacaattgatctggctgattcagaaatggacaaactgtacgaacga1380
gtgaaaagacagctgagagagaatgctgaagaagatggcactggttgctttgaaatattt1440
cacaagtgtgatgatgactgtatggccagtattagaaataacacctatgatcacagcaag1500
tacagggaagaggcaatgcaaaatagaatacagattgacccagtcaaactaagcagcggc1560
tacaaagatgtgatactttggtttagcttcggggcatcatgtttcatacttctagccatt1620
gtaatgggccttgtcttcatatgtgtaaagaatggaaacatgcggtgcactatttgtata1680
taa1683
<210>2
<211>36
<212>dna
<213>人工序列
<400>2
attctagagccaccatgaacactcaaatcctggtat36
<210>3
<211>31
<212>dna
<213>人工序列
<400>3
atagatctttatatacaaatagtgcaccgca31
<210>4
<211>18
<212>dna
<213>人工序列
<400>4
aaatgataaccatctcgc18
<210>5
<211>15
<212>dna
<213>人工序列
<400>5
gtccaagtttccctg15
<210>6
<211>24
<212>dna
<213>人工序列
<400>6
tttactgttttcgtaacagttttg24
<210>7
<211>20
<212>dna
<213>人工序列
<400>7
caacaacgcacagaatctag20
- 还没有人留言评论。精彩留言会获得点赞!