一种禽用DNA疫苗组合物的制作方法
本发明属于生物技术领域,尤其是涉及一种禽用生物免疫制剂。
背景技术
现代工厂化肉禽养殖周期一般为40-60天,由于肉禽生产速度快、养殖密度过大,易反复爆发大规模病毒性传染疾病。抗体治疗能在短时间内起到防治病毒性疾病的效果,成为病毒性疾病爆发期间工厂化肉禽养殖首选和必选的治疗手段,但是抗体存在持续期短(一般为5-7天,此后抗体治疗效果会急剧衰减)、缺乏免疫刺激、在一个病毒性疾病爆发周期内需多次注射等缺点,为工厂化养殖带来高额的医疗成本和繁重的体力劳动。为此,有人提出合用抗体和疫苗,在抗体治疗的同时进行疫苗免疫以期延长治疗周期,但抗体和常规疫苗极易发生抗体抗原结合反应,使二者效果皆无,且常规疫苗免疫要达到完美的防治效果,至少需要在基础免疫的基础上完成一次加强免疫,仍不能显著降低劳动强度。
dna疫苗,又称核酸疫苗或基因疫苗,是指把携带编码外源抗原基因的dna(通常是质粒)直接导入体内,通过抗原基因表达产物刺激机体产生特异性免疫反应达到预防和治疗目的。其与抗体合用能有效解决抗体抗原结合反应的弊端,且在肉禽养殖周期内无需进行加强免疫就能达到良好的防治效果,但是其刺激机体产生免疫应答的周期较长,一般需要21天左右(此后,dna疫苗方具备治疗作用),和抗体合使用时,存在10天左右的免疫空白期
为解决上述问题,本发明提供一种禽用抗体与dna疫苗组合物,通过增加免疫刺激物增强并延长了抗体治疗周期的同时,改变组合物辅佐剂,缩短dna疫苗的免疫应答周期,填补常规抗体与dna疫苗组合物的防治空档期。
技术实现要素:
本发明的目的在于解决dna疫苗与抗体合用存在防治空档期的缺点,提供一种使用方便快捷、安全有效的dna疫苗组合物,该dna疫苗组合物兼具dna疫苗和抗体治疗的优点,同时规避了二者合用的缺点,兼具治疗与预防的功效,具备机体免疫应答产生快,持续期长,交叉保护广,使用方便等诸多优点。
为实现上述目的,本发明的技术方案为:
一种禽用dna疫苗组合物,由dna疫苗、抗体、纳米粒子和离子缓冲液组成;其中所述的dna疫苗为编码抗原性蛋白的dna质粒,所述的抗体为相对应的保护性抗体,所述的纳米粒子能包裹抗体起到缓释作用同时包裹dna提升其细胞转染效率,所述的离子缓冲液能在体液环境中稳定所述抗体的等电点同时稳定所述纳米粒子的疏水性。
更进一步的,所述的禽用dna疫苗组合物是将所述的纳米粒子和离子缓冲液配制成专用缓冲液后,加入处方比例的抗体和dna疫苗混合均匀后除菌处理得到的。
更进一步的,所述的编码抗原性蛋白的dna质粒上连接有cpg序列。
更进一步的,所述的抗体为与编码抗原性蛋白相对应的单克隆抗体、卵黄抗体或阳性血清分离抗体中的一种或多种。
更进一步的,所述的抗体优选为与编码抗原性蛋白相对应的卵黄抗体。
更进一步的,所述的纳米粒子能作为所述dna质粒表达产物的免疫刺激物。
更进一步的,所述的纳米粒子优选为壳聚糖,所述的离子缓冲液为中性盐溶液,优选为nacl溶液。
更进一步的,所述的壳聚糖的用量占所述禽用dna疫苗组合物的1%-5%。
更进一步的,所述nacl在所述禽用dna疫苗组合物中的浓度为0.5-2m。
更进一步的,所述的壳聚糖的用量占所述禽用dna疫苗组合物的2%,所述nacl在所述禽用dna疫苗组合物中的浓度为1.2m。
采用上述技术方案,本发明的作用机理在于:纳米粒子在中性弱偏酸(6.00<ph<7.0)的环境中在离子缓冲液的作用下带正电,igg抗体在该条件下带负电,纳米粒子能与抗体聚集并作为抗体缓释剂,在一定程度上延长抗体的作用时间;同时dna疫苗由于携带cpg序列,能够刺激并激活机体的免疫系统,从而增强抗体的治疗效果;在合适的离子强度下,dna疫苗的双螺旋结构由于疏水作用而更为紧密,粒径更小,有利于dna疫苗进入机体细胞;同时纳米粒子在与抗体蛋白形成聚合物的过程中包覆dna质粒,由于纳米粒子携带正电,与带负电的机体细胞更易吸附结合,从而有利于dna质粒进入机体细胞,从而提高dna质粒的转染效率,缩短dna疫苗的效应周期;在dna疫苗成功转染并表达翻译成相应的抗原后,纳米粒子与被翻译的抗原结合的同时作为免疫佐剂,通过破坏溶酶体膜的方式携带抗原进入胞浆,快速引发交叉呈递,从而缩短dna疫苗的免疫周期;同时dna质粒携带的cpg序列作为免疫增强剂提高了dna疫苗的抗体水平。
采用上述技术方案,本发明的技术优势在于:
1)将抗体的有效防治时间由5-7天延长至12-14天;
2)将dna疫苗的效应时间由21天左右缩短至12-16天;
3)有效填补常规抗体与dna疫苗组合物的免疫空白期;
4)治疗效果显著提高,保护率提高10-20%。
附图说明
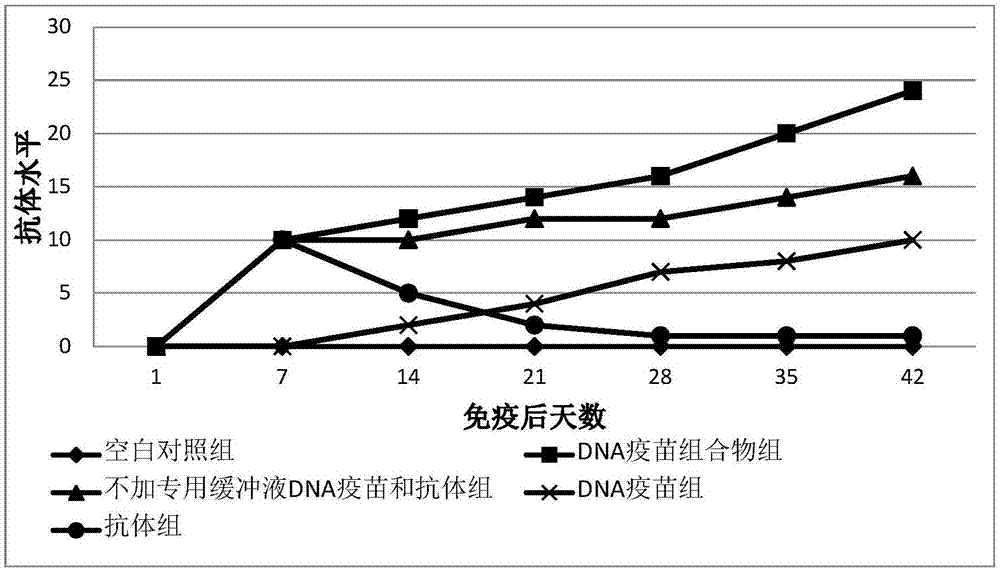
图1:i群4型禽腺病毒dna疫苗组合物的免疫效力试验
图中:空白对照组为每羽受试鸡肌注1ml生理盐水;dna疫苗组合物组为每羽受试鸡肌注1mldna疫苗组合物;不加专用缓冲液dna疫苗和抗体组为每羽受试鸡肌注1ml,其中只含有30ugdna疫苗和含量为1:16的卵黄抗体,无专用缓冲液;dna疫苗组为每羽受试鸡肌注1mldna疫苗,其中dna疫苗含量为30ug;抗体组为每羽受试鸡肌注1ml效价为agp=1:16的卵黄抗体。
图2:i群4型禽腺病毒dna疫苗组合物的治疗试验
图中:空白对照组为每羽受试鸡肌注1ml生理盐水;dna疫苗组合物组为每羽受试鸡肌注1mldna疫苗组合物;不加专用缓冲液dna疫苗和抗体组为每羽受试鸡肌注1ml,其中只含有30ugdna疫苗和含量为1:16的卵黄抗体,不加专用缓冲液;抗体组为每羽受试鸡肌注1ml效价为agp=1:16的卵黄抗体;dna疫苗组为每羽受试鸡肌注1mldna疫苗,其中dna疫苗含量为30ug;专用缓冲液对照组为每羽受试鸡肌注1ml专用缓冲液。
图3:禽流感dna疫苗组合物的免疫效力试验
图中:空白对照组为每羽受试鸡肌注1ml生理盐水;dna疫苗组合物组为每羽受试鸡肌注1mldna疫苗组合物;不加专用缓冲液dna疫苗和抗体组为每羽受试鸡肌注1ml,其中只含有30ugdna疫苗和含量为1:256的单克隆抗体,无专用缓冲液;dna疫苗组为每羽受试鸡肌注1mldna疫苗,其中dna疫苗含量为30ug;抗体组为每羽受试鸡肌注1ml效价为agp=1:256的单克隆抗体。
图4:小鹅瘟dna疫苗组合物的免疫效力试验
图中:空白对照组为每羽受试鹅肌注1ml生理盐水;dna疫苗组合物组为每羽受试鹅肌注1mldna疫苗组合物;不加专用缓冲液dna疫苗和抗体组为每羽受试鹅肌注1ml,其中只含有60ugdna疫苗和含量为1:64的阳性血清抗体,无专用缓冲液;dna疫苗组为每羽受试鹅肌注1mldna疫苗,其中dna疫苗含量为60ug;抗体组为每羽受试鹅肌注1ml效价为agp=1:64的阳性血清抗体。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及具体实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。
实施例1
i群4型禽腺病毒dna疫苗组合物制备、安全性检测及免疫效力实验
i群4型禽腺病毒dna疫苗组合物是由dna疫苗和抗体混合后加入专用缓冲液制备而成,其中dna疫苗为利用常规生物技术手段制备的携带i群4型禽腺病毒纤维蛋白c-末端基因的dna疫苗,抗体为利用灭活的i群4型禽腺病毒灭活疫苗制备的i群4型禽腺病毒卵黄抗体。专用缓冲液由2%的壳聚糖和1.2m的氯化钠组成。
1.1:i群4型禽腺病毒dna质粒的制备:
利用基因克隆技术,将i群4型禽腺病毒的纤维蛋白c-末端基因克隆到pcaggs载体,转化到宿主大肠杆菌发酵后,用使用endofree质粒大提试剂盒获得质粒dna疫苗。
设计合成一对引物:
引物1:5’aaacatatgtcgagctcggtaccttt3’;
引物2:5’aaactcgagttatgtaaagggaatgg3’。
fav-4强毒株分离自发病肉鸡。
以fav-4病毒为模板,按照94℃变性45s,56℃退火45s,72℃延伸1min,共进行30循环进行pcr扩增;将pcr产物直接克隆到pmd-18t载体(takara公司)上,构建pmd-18t-fav4c;根据鸡偏嗜密码子将基因进行密码子优化,优化后的fav-4-c基因合成到pmd-18t载体上,构建pmd-18t-optifav4c。
dna疫苗重组工程菌的构建:
将pmd-18t-optifav4c与pcaggs载体用ecori和smai双酶切,酶切产物进行1%琼脂糖凝胶电泳,分别回收目的片段和pcaggs,然后16℃连接过夜;将连接产物转化到e.colidh5α感受态细胞,挑取单菌落接种到2ml含100μg/ml氨苄青霉素的lb培养基,37℃振荡培养12h,提取质粒后用双酶切进行鉴定,获得质粒pcagoptifav4c。对重组表达质粒进行双酶切鉴定,并进行测序,确定基因序列及读码框的准确性。
使用endofree质粒大提试剂盒对重组表达质粒dna疫苗pcagoptifav4c进行提取纯化,按使用说明进行。
1.2:i群4型禽腺病毒卵黄抗体igy的制备
收集用i群4型禽腺病毒灭活疫苗多次免疫的高免蛋鸡所生产的鸡蛋,分离阳性卵黄进行酸化和萃取处理,萃取产物经除菌浓缩后即得卵黄抗体。具体过程是:用i群4型禽腺病毒灭活疫苗对产蛋鸡进行基础免疫后的第14天和28天,分别进行加强免疫;强化免疫后10~14日开始收集鸡蛋,抽样采用琼脂双相扩散试验(agp)测定高免鸡蛋卵黄中i群4型禽腺病毒的纤维蛋白抗体效价;对agp≥1:32的高免鸡蛋进行消毒除菌后,分离卵黄;卵黄经酸化灭活后离心取上清并用正辛酸萃取;用0.45μm滤器过滤澄清卵黄萃取液后用0.22μm滤器过滤除菌,过滤产物经截留分子量为100kd超滤膜进行浓缩后即得卵黄抗体。
用琼脂扩散试验测定i群4型禽腺病毒卵黄抗体效价。其具体操作方法是:制备含有1%硫柳汞的1%琼脂平板;在平板上进行梅花形打孔;将卵黄抗体进行倍比稀释后分别加注到梅花形孔的外周孔,中心孔用i群4型禽腺病毒标准抗原注满;把琼脂平板加盖后置于湿盒中,37℃作用24~48h;将中心孔与外周孔之间出现白色沉淀线的最大稀释倍数作为i群4型禽腺病毒卵黄抗体的效价。
1.3:i群4型禽腺病毒dna疫苗组合物的制备
具体制备方法按以下步骤操作:
(1)配制i群4型禽腺病毒dna疫苗含量为60ug。
(2)配制i群4型禽腺病毒卵黄抗体的效价为agp=1:32。
(3)将上述配制的dna疫苗和卵黄抗体进行等体积混合。
(4)在混合产物中加入壳聚糖使其终浓度为2%和氯化钠使其终浓度为1.2m,混匀后经除菌处理后即得dna疫苗组合物。
1.4:i群4型禽腺病毒dna疫苗组合物的安全检测
用14日龄spf鸡10羽,每只腿部肌肉分点注射dna疫苗组合物2.0ml(颈后部两侧皮下各注射1ml),观察14日,观察是否由dna疫苗组合物引起的任何局部和全身不良反应。结果显示,dna疫苗组合物注射的所有试验鸡精神、采食及饮水均未见异常,注射部位均无红肿反应。
1.5:i群4型禽腺病毒dna疫苗组合物的免疫效力试验
取14日龄spf鸡50羽,随机分为五组,暂养一日后,分别进行如下操作:
第一组:设为空白对照组,每羽肌注1ml生理盐水。
第二组:设为dna疫苗组合物组,每羽肌注1mldna疫苗组合物组。
第三组:设为dna疫苗和抗体不加专用缓冲液组,每羽肌注1ml含量为30ugdna疫苗和含量为1:16的抗体。
第四组:设为dna疫苗组,每羽肌注1ml含量为30ugdna疫苗。
第五组:设为抗体组,每羽肌注1ml含量为1:16的抗体。
上述各组在肌注免疫后,每隔一周随机取上述免疫鸡只,测其血清的抗体水平。取测得的各组血清抗体平均效价绘制图1。
结果表明:注射dna疫苗组合物的鸡体内开始产生免疫应答的时间要早于dna疫苗组;持续时间比抗体组长;抗体水平比不加专用缓冲液组高。
1.6:i群4型禽腺病毒dna疫苗组合物的治疗试验
取14日龄spf鸡60羽,随机分为四组,暂养一日后,分别进行如下操作:
第一组:设为空白对照组,每羽肌注1ml生理盐水。
第二组:设为dna疫苗组合物组,每羽肌注1mldna疫苗组合物。
第三组:设为dna疫苗和抗体不加专用缓冲液组,每羽肌注1ml含量为30ugdna疫苗和含量为1:16的抗体。
第四组:设为抗体组,每羽肌注1ml含量为1:16的抗体。
第五组:设为dna疫苗组,每羽肌注1ml含量为30ugdna疫苗。
第六组:设为缓冲液对照组,每羽肌注1ml专用缓冲液。
上述各组受试鸡在肌注免疫后7天,每羽鸡用1ml的favrp-8株强毒肌肉注射0.5ml,统计各实验组受试鸡的发病率和死亡率并计算保护率,所得实验结果绘制图2。
结果表明:dna疫苗组合物死亡率最低,保护率高达100%,治疗效果最好;不加专用缓冲液组,保护率为90%,治疗效果次之;单独使用抗体组,保护率只有70%,治疗效果一般;单独使用dna疫苗组几乎无治疗效果;空白对照组和单独缓冲液组受试鸡的死亡率高达100%。
实施例2
禽流感dna疫苗组合物制备、安全性检测及免疫效力实验
禽流感dna疫苗组合物是由dna疫苗和抗体混合后加入专用缓冲液制备而成,其中dna疫苗为利用常规生物技术手段制备的携带禽流感ha基因的dna疫苗,抗体为利用禽流感灭活疫苗制备的单克隆抗体。专用缓冲液由1%的壳聚糖和2m的氯化钠组成。
2.1:禽流感dna质粒的制备
dna疫苗重组工程菌的构建:根据禽流感流行趋势,参考genbank中禽流感ha基因,获得与流行趋势匹配的禽流感ha基因序列。根据鸡偏嗜密码子将基因进行密码子优化,合成密码子优化后基因到pmd-18t载体上,构建pmd-18t-optiha质粒。
将pmd-18t-optiha与pcaggs载体用ecori和smai双酶切,酶切产物进行1%琼脂糖凝胶电泳,分别回收目的片段和pcaggs,然后16℃连接过夜;将连接产物转化到e.colidh5α感受态细胞,挑取单菌落接种到2ml含100μg/ml氨苄青霉素的lb培养基,37℃振荡培养12h,提取质粒后用双酶切进行鉴定,获得质粒pcagoptiha。对重组表达质粒进行双酶切鉴定,并进行测序,确定基因序列及读码框的准确性。
使用endofree质粒大提试剂盒对重组表达质粒dna疫苗pcagoptiha进行提取纯化,按使用说明进行。
2.2:禽流感单克隆抗体的制备
将禽流感灭活疫苗进行动物免疫,将免疫血清与骨髓瘤细胞融合筛选出杂交瘤细胞,利用该方法筛选出性能优异的猪圆环病毒单克隆抗体细胞株,再对细胞株进行培养以大量表达单克隆抗体。
2.2.1动物免疫
将禽流感灭活疫苗皮下分点注射6周龄balb/c小鼠,每只1ml;2周后和4周后以相同方法再各免疫一次;6周后取相同剂量疫苗腹腔注射;3天后融合。
2.2.2融合
将加强免疫后3天的小鼠,眼眶采血作为阳性血清,颈脱臼将小鼠致死,无菌打开腹腔取出脾脏,用研磨棒挤压,使脾细胞充分释放,制成脾细胞悬液。选择生长状态良好的骨髓瘤细胞(sp2/0细胞)和制备好的脾淋巴细胞按1:5混合在一支融合管中,1000rpm离心10min,弃上清。将融合管置于手掌中,轻轻摩擦底部,使两种细胞充分混匀;在37℃水浴中45s内缓慢加入1ml预热的peg到融合管中,边加边轻轻摇匀;随即在90s内先慢后快滴加30ml37℃预热的无抗不完全dmem培养基,使peg稀释而失去作用,37℃静止10min,1000rpm离心10min;弃上清,用60mlhat培养基轻轻悬浮沉淀细胞,再加入适量的腹腔巨噬细胞;分装于96孔细胞培养板,然后将培养板置37℃5%co2培养箱内培养;5d后用新鲜的hat培养基换出一半培养基;10d后用预热的ht培养基换出hat培养基;观察杂交瘤细胞的生长情况,待其细胞培养上清变黄或克隆分布至孔底面积的1/10以上时,吸取适量细胞上清进行抗体检测。
2.2.3杂交瘤细胞的筛选
通过血凝抑制方法,对融合细胞上清液中的抗体进行检测。用血凝抑制试验测定禽流感卵黄抗体效价。其具体操作方法如2015版《中华人民共和国兽药典》第三部附录3404《红细胞血凝抑制试验法》。
2.2.4杂交瘤细胞的亚克隆
用有限稀释法将血凝抑制方法检测的阳性杂交瘤细胞吹下,按1个细胞/孔、3个细胞/孔、10个细胞/孔加入到装有饲养细胞的96孔板中;37℃5%co2培养箱培养7-10天,对出现单个细胞克隆孔的上清再用血凝抑制方法进行检测;连续进行3-4次亚克隆,至每个细胞孔上清均为阳性时可以定株。本次试验获得一株aiv-ha株,将其进行扩大培养和冻存。
2.2.5腹水的制备
取8周龄的balb/c小鼠,腹腔注射灭菌液体石蜡,0.5ml/只;1周后腹腔注射用pbs稀释的处于对数生长期的aiv-ha株细胞,1×106cfu/只;待小鼠腹部明显隆起时,用16号针头从腹腔采集腹水,2500rpm离心10min,去除脂肪组织,将上清取出,-4℃保存。
采用血凝抑制方法(hi)测定单克隆抗体的hi抗体效价;对hi≥1:512的单克隆抗体用12μm滤器过滤除菌即得单克隆抗体。
2.3:禽流感dna疫苗组合物的制备
具体制备方法按以下步骤操作:
(1)配制禽流感dna疫苗含量为60ug。
(2)配制禽流感单克隆抗体的效价为hi=1:512。
(3)将上述配制的dna疫苗和单克隆抗体进行等体积混合。
(4)在混合产物中加入壳聚糖使其终浓度为1%和氯化钠使其终浓度为2m,混匀后经除菌处理后即得dna疫苗组合物。
2.4:禽流感dna疫苗组合物的安全检测
用14日龄spf鸡10羽,每只腿部肌肉分点注射dna疫苗组合物2ml(颈后部两侧皮下各注射1ml),观察14日,观察是否由dna疫苗组合物引起的任何局部和全身不良反应。结果显示,dna疫苗组合物注射的所有试验鸡精神、采食及饮水均未见异常,注射部位均无红肿反应。
2.5:禽流感dna疫苗组合物的免疫效力试验
取14日龄spf鸡50羽,随机分为五组,暂养一日后,分别进行如下操作:
第一组:设为空白对照组,每羽肌注1ml生理盐水。
第二组:设为dna疫苗组合物组,每羽肌注1mldna疫苗组合物组。
第三组:设为dna疫苗和抗体不加专用缓冲液组,每羽肌注1ml含量为30ugdna疫苗和含量为1:256的抗体。
第四组:设为dna疫苗组,每羽肌注1ml含量为30ugdna疫苗。
第五组:设为抗体组,每羽肌注1ml含量为1:256的抗体。
上述各组在肌注免疫后,每隔一周随机取上述免疫鸡只,测其血清的抗体水平。取测得的各组血清抗体平均效价绘制图3。
结果表明:注射dna疫苗组合物的鸡体内开始产生免疫应答的时间要早于dna疫苗组;持续时间比抗体组长;抗体水平比不加专用缓冲液组高。
实施例3
小鹅瘟dna疫苗组合物制备、安全性检测及免疫效力实验
小鹅瘟dna疫苗组合物是由dna疫苗和抗体混合后加入专用缓冲液制备而成,其中dna疫苗为利用常规生物技术手段制备的携带小鹅瘟vp3基因的dna疫苗,抗体为利用小鹅瘟灭活疫苗制备的阳性血清抗体。专用缓冲液由5%的壳聚糖和0.5m的氯化钠组成。
3.1:小鹅瘟dna质粒的制备
dna疫苗重组工程菌的构建:根据小鹅瘟流行趋势,参考genbank中小鹅瘟vp3基因,获得与流行趋势匹配的小鹅瘟vp3基因序列。根据鹅偏嗜密码子将基因进行密码子优化,合成密码子优化后基因到pmd-18t载体上,构建pmd-18t-optivp3质粒。
将pmd-18t-optivp3与pcaggs载体用ecori和smai双酶切,酶切产物进行1%琼脂糖凝胶电泳,分别回收目的片段和pcaggs,然后16℃连接过夜;将连接产物转化到e.colidh5α感受态细胞,挑取单菌落接种到2ml含100μg/ml氨苄青霉素的lb培养基,37℃振荡培养12h,提取质粒后用双酶切进行鉴定,获得质粒pcagoptivp3。对重组表达质粒进行双酶切鉴定,并进行测序,确定基因序列及读码框的准确性。
使用endofree质粒大提试剂盒对重组表达质粒dna疫苗pcagoptivp3进行提取纯化,按使用说明进行。
3.2:小鹅瘟阳性血清抗体的制备
采集用小鹅瘟灭活疫苗多次免疫的高免马的血清,用自然凝结法分离阳性血清,除菌浓缩后即得阳性血清抗体。具体过程是:用小鹅瘟灭活疫苗对4-6岁易感马进行基础免疫后的第7天、14天、28天和59天,分别进行加强免疫;强化免疫后8日开始收集血清,抽样采用琼脂双相扩散试验(agp)测定高免马血清中的vp3抗体效价;对agp≥1:128的血清,自然凝结后离心取上清,用0.45μm滤器过滤澄清后用0.22μm滤器过滤除菌,过滤产物经截留分子量为100kd超滤膜进行浓缩后即得阳性血清抗体。
用琼脂扩散试验测定小鹅瘟阳性血清抗体效价。其具体操作方法是:制备含有1%硫柳汞的1%琼脂平板;在平板上进行梅花形打孔;将阳性血清抗体进行倍比稀释后分别加注到梅花形孔的外周孔,中心孔用小鹅瘟标准抗原注满;把琼脂平板加盖后置于湿盒中,37℃作用24~48h;将中心孔与外周孔之间出现白色沉淀线的最大稀释倍数作为小鹅瘟阳性血清抗体的效价。
3.3小鹅瘟dna疫苗组合物的制备
具体制备方法按以下步骤操作:
(1)配制小鹅瘟dna疫苗含量为120ug。
(2)配制小鹅瘟阳性血清抗体的效价为agp=1:128。
(3)将上述配制的dna疫苗和阳性血清抗体进行等体积混合。
(4)在混合产物中加入壳聚糖使其终浓度为1%和氯化钠使其终浓度为2m,混匀后经除菌处理后即得dna疫苗组合物。
3.4:小鹅瘟dna疫苗组合物的安全检测
用14日龄鹅10羽,每只腿部肌肉分点注射dna疫苗组合物2ml(颈后部两侧皮下各注射1ml),观察14日,观察是否由dna疫苗组合物引起的任何局部和全身不良反应。结果显示,dna疫苗组合物注射的所有试验鹅精神、采食及饮水均未见异常,注射部位均无红肿反应。
3.5:小鹅瘟dna疫苗组合物的免疫效力试验
取14日龄鹅50羽,随机分为五组,暂养一日后,分别进行如下操作:
第一组:设为空白对照组,每羽肌注1ml生理盐水。
第二组:设为dna疫苗组合物组,每羽肌注1mldna疫苗组合物组。
第三组:设为dna疫苗和抗体不加专用缓冲液组,每羽肌注1ml含量为60ugdna疫苗和含量为1:64的抗体。
第四组:设为dna疫苗组,每羽肌注1ml含量为60ugdna疫苗。
第五组:设为抗体组,每羽肌注1ml含量为1:64的抗体。
上述各组在肌注免疫后,每隔一周随机取上述免疫鹅,测其血清的抗体水平。取测得的各组血清抗体平均效价绘制图4。
结果表明:注射dna疫苗组合物的鹅体内开始产生免疫应答的时间要早于dna疫苗组;持续时间比抗体组长;抗体水平比不加专用缓冲液组高。
以上所述,仅是本发明的较佳实施例,并非对发明设计作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容作出些许更改或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!