一种含羟基红花黄色素A自微乳制剂及其制备方法与流程
本发明属于生物制药技术领域,特别是涉及一种含羟基红花黄色素a自微乳制剂及其制备方法。
背景技术
红花(carthamustinctoriusl.)是一种菊科、红花属植物,具有活血化瘀、散湿去肿等功效,在我国中医典籍《本草纲目》及《金匮要略》等均有记载,其历史可追溯到2000年前。羟基红花黄色素a(hydroxysaffloryellowa,hsya)是从红花中提取得到的主要药用活性成分之一,分子式为c27h32o16,为单查尔酮葡萄糖苷类化合物,具有抗血小板凝集、促进血液循环、抗血栓等药理作。其结构式如下所示:
由于其分子结构中含有大量羟基,使得其水溶性极强,但同时带来脂溶性差的特点,从而导致其口服生物利用度低。因此,目前临床上的给药方式以静脉注射为主,已经上市的药品有浙江永宁药业股份有限公司生产的“注射用红花黄色素”,商品名为“乐坦”,以及山西华辉凯德制药有限公司生产的“红花黄色素氯化钠注射液”,商品名为“西克”。
开发一种非静脉途径给药的剂型对提高羟基红花黄色素a的用药安全和改善患者顺应性具有重要意义,而其口服给药的研究是羟基红花黄色素a新剂型研究的热点。影响药物口服吸收的主要因素有药物的水溶性、脂溶性、膜渗透性以及外排泵作用等。依据生物药剂学分类系统(biopharmaceuticsclassificationsystem,bsc)的划分规则,羟基红花黄色素a属于bscⅲ类药,即高溶解性、低渗透性药物,口服后生物利用度仅为1.2%,肠道膜渗透性成为限制其吸收的主要限速步骤。
自微乳化给药系统(self-microemulsifyingdrugdeliverysystem,smedds)是由油相、表面活性剂、助表面活性剂和药物组成的固体或液体制剂,一种脂质给药系统,其在口服后于胃肠道轻微搅拌作用下可自发形成粒径在100nm以下的o/w型微粒,具有粒径小和热稳定性好等优点。与普通乳剂相比,自微乳化给药系统具有以下优势:(1)可在体内胃肠道环境中自发自微乳化形成微粒;(2)可提高药物的稳定性,便于运输与贮存;(3)可掩盖药物的不良气味,患者依从性好且不易受食物影响;(4)制备工艺简单,适合大规模工业化生产等。自微乳化给药系统还可以提高难溶性药物的口服生物利用度,促进其吸收,机制主要体现在以下方面:提高药物的溶解度并改善了药物的溶出;处方中大量的表面活性剂增加了肠道上皮细胞的穿透性,同时还能抑制p-糖蛋白(p-glycoprotein,p-gp)的外排作用;在胃肠道蠕动作用下,可自发形成微小的乳滴,增加了其比表面积;处方中的脂质可在胰酶或胆汁作用下降解,形成粒径更小的微乳乳滴和胆盐胶束,从而增加药物的溶解度和跨膜转运;另外,自微乳化给药系统还可促进药物通过淋巴系统吸收,克服药物的首过效应及减少大分子物质通过胃肠道上皮细胞吸收时的障碍,从而促进药物的吸收。
因此,本发明开发了一种含羟基红花黄色素a自微乳制剂的制备方法,通过该方法得到的含羟基红花黄色素a自微乳制剂,该制剂具有明显的肠溶特性,大大提高了羟基红花黄色素a口服后的生物利用度。
技术实现要素:
本发明的目的在于提供一种含羟基红花黄色素a自微乳制剂及其制备方法。
为了达到上述的目的,本发明提供如下技术方案:
一种含羟基红花黄色素a自微乳制剂的制备方法,该制备方法包括如下步骤:
(1)将吐温80与二乙二醇乙醚按照质量比为0.9:1~1.1:1混合,将将该混合乳化剂按照质量比85:15~88:12与油酸乙酯混合,得到空白自微乳浓缩液;
(2)将羟基红花黄色素a磷脂复合物以含量100~120mg/g加入至步骤(1)的空白自微乳浓缩液中,涡旋使其充分溶解,并恒温水浴下震荡平衡一定时间。
进一步地,所述步骤(1)中吐温80与二乙二醇乙醚的质量比为1.01:1。
进一步地,所述步骤(1)中混合乳化剂与油酸乙酯的质量比为87.07:12.93。
进一步地,所述步骤(2)中羟基红花黄色素a磷脂复合物通过如下方法制备得到:
①将羟基红花黄色素a与大豆卵磷脂按药脂质量比1:3混合分散于无水乙醇中,于40℃水浴下搅拌反应2h;
②旋蒸除去无水乙醇,加入适量三氯甲烷,摇晃均匀以充分复溶,过0.45μm微孔滤膜;
③通风状态下挥去三氯甲烷后于真空中进一步干燥,得到较为纯净的羟基红花黄色素a磷脂复合物。
磷脂是大多数生物膜的主要组成成分,一些动物组织,如脑、内脏、蛋黄,以及植物油(大豆、棉花种子、向日葵等)都是磷脂的最主要天然来源。磷原子上羟基中的氧原子具有较强的得电子倾向,而氮原子具有较强的失电子倾向,因而在一定条件下,磷脂能以特定的比例与含有可形成氢键基团的药物分子结合形成磷脂复合物(phospholipidcomplex,pc)。其机制认为包括静电力、氢键和范德华力等分子间作用力。当天然黄酮类成分与磷脂形成复合物后,其理化性质与生物特性呈现出明显的改变,并且能够减少药物的毒性、提高药物稳定性以及增加生物膜的渗透性。本发明将羟基红花黄色素a首先与大豆卵磷脂制备得到羟基红花黄色素a磷脂复合物能够大大提高羟基红花黄色素a的稳定性,同时能够使羟基红花黄色素a的脂溶性得到极大的提高。
进一步地,所述羟基红花黄色素a磷脂复合物以含量110mg/g加入至步骤(1)的空白自微乳浓缩液中。
进一步地,所述震荡平衡温度为37℃,时间为48h。
本发明还提供一种由上述方法制备得到的含羟基红花黄色素a自微乳制剂。
优选的,含羟基红花黄色素a自微乳制剂的粒径为15~17nm。
优选的,所述含羟基红花黄色素a自微乳制剂溶于50倍体积的去离子水中的zeta电位为-8~-9mv。
本发明具有以下技术特点:
1)本发明的含羟基红花黄色素a自微乳制剂的制备方法简单且制备过程中无需特殊的高能耗生产设备,成本低。
2)本发明通过羟基红花黄色素a与磷脂形成复合物,能够有效提高羟基红花黄色素a的稳定性,同时能够使羟基红花黄色素a的脂溶性得到极大的提高。
3)本发明通过利用自微乳体系包载羟基红花黄色素a,使羟基红花黄色素a能够通过口服途径给药,且促进了药物的吸收,大大提高了羟基红花黄色素a的生物利用度。
附图说明
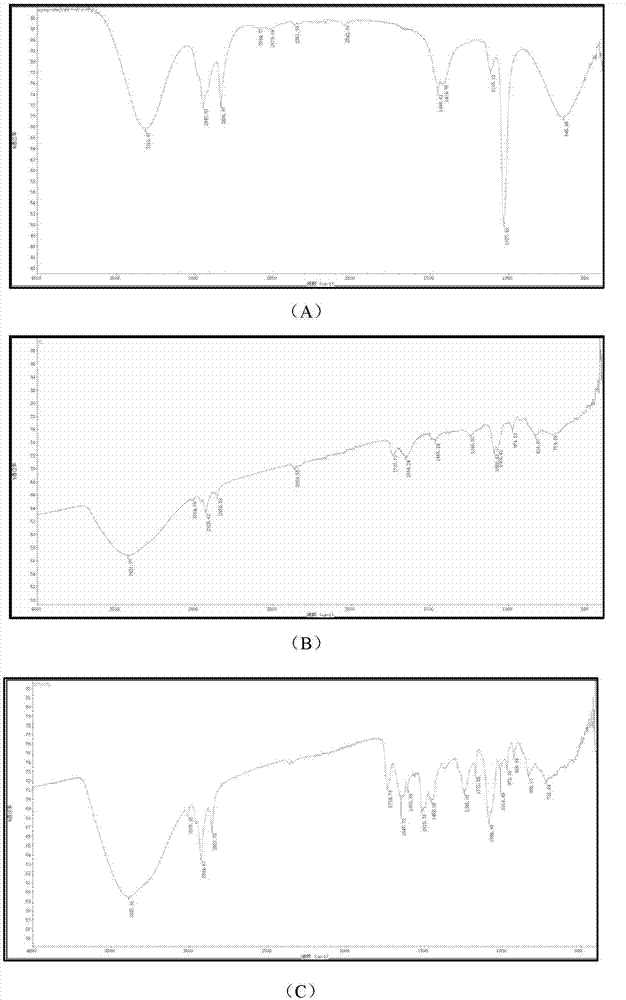
图1hsya(a)、大豆卵磷脂(b)、hsya和大豆卵磷脂的物理混合物(c)以及hsya-pc(d)红外光谱图。
图2hsya(a)、大豆卵磷脂(b)、hsya和大豆卵磷脂的物理混合物(c)以及hsya-pc(d)x-射线衍射图。
图3hsya(a)、大豆卵磷脂(b)、hsya和大豆卵磷脂的物理混合物(c)以及hsya-pc(d)差示扫描量热图。
图4hsya-pc-smedds肠溶胶囊在不同介质中的溶出度结果。
图5sd大鼠口服灌胃hsya-pc-smedds和hsya后平均血药浓度-时间曲线图。
具体实施方式
以下具体实施例是对本发明提供的方法与技术方案的进一步说明,但不应理解成对本发明的限制。
一、羟基红花黄色素a磷脂复合物的制备
①将羟基红花黄色素a(hsya)与大豆卵磷脂按药脂比1:3混合分散于无水乙醇中,使hsya的浓度为2mg/ml,于40℃水浴下搅拌反应2h;
②旋蒸除去无水乙醇,加入适量三氯甲烷,摇晃均匀以充分复溶,过0.45μm微孔滤膜;
③通风状态下挥去三氯甲烷后于真空中进一步干燥,得到较为纯净不含游离hsya的磷脂复合物。
二、羟基红花黄色素a磷脂复合物的表征
①红外光谱
采用atr法测定:将红花黄色素(hsya)、大豆卵磷脂、两者的物理混合物以及hsya-pc分别溶于色谱级甲醇中,采用atr法于nicoletis50红外光谱仪上对4000~400cm-1进行全谱扫描。红外光谱如图1所示。
②x-射线衍射
采用brukerd8advancex-射线衍射仪分别对hsya(a)、大豆卵磷脂(b)、两者物理混合物(c)以及hsya-pc(d)进行分析。检测条件如下:铜靶,波长=0.154056nm,电压40kv,电流40ma,扫描方式为步进扫描,步长0.01°,每步停留0.1s,扫描范围2θ为5~90°。结果如图2所示。
③差示扫描量热
采用sta449f3同步热分析仪分别对hsya、大豆卵磷脂、两者物理混合物以及hsya-pc进行分析。检测条件如下:升温速率:10℃/min,范围:50~400℃。结果如图3所示。
④图谱总结
由x射线衍射和差示扫描量热的结果可知,hsya与大豆卵磷脂的物理混合物的图谱几乎为hsya和大豆卵磷脂图谱的叠加,而hsya磷脂复合物的图谱则呈现出与物理混合物完全不同的形态;且红外图谱显示,在磷脂复合物中并未有新的特征峰出现,及未生成新的化学键,表明hsya与大豆卵磷脂间只是简单地生成了复合物而未生成新的化合物。
三、羟基红花黄色素a磷脂复合物表观溶解度的初步测定
精密量取10ml正辛醇于50ml离心管中,分别向正辛醇中加入hsya粉末、hsya与磷脂的物理混合物和hsya-pc,每组三份;25℃恒温水浴振荡6h后静置过夜,取上清液以25%甲醇稀释适宜倍数后,过0.45μm微孔滤膜,进hplc测定并计算三者在正辛醇中的表观溶解度;同法测定hsya粉末和hsya-pc在水中的表观溶解度。
表1hsya和hsya-pc在水及正辛醇中的表观溶解度
由表1可知,将hsya制备成hsya-pc后,其于正辛醇中的溶解度大大增加,即hsya的脂溶性得到了极大的提高。
四、羟基红花黄色素a磷脂复合物自微乳(hsya-pc-smedds)的制备:
①将吐温80与二乙二醇乙醚按照质量比为1.01:1混合,再将该混合乳化剂按质量比87.07:12.93与油酸乙酯混合;
②将hsya-pc以含量110mg/g加入上述空白自微乳浓缩液中,涡旋5min充分溶解,于37℃恒温水浴下振荡平衡48h。
五、hsya-pc-smedds理化性质的考察
①稀释介质及倍数对粒径与zeta电位的影响
表2以水稀释不同倍数下的粒径与电位
表3以ph1.2hcl溶液稀释不同倍数下的粒径与电位
表4以ph4.5醋酸-醋酸钠缓冲液稀释不同倍数下的粒径与电位
表5以ph6.8磷酸盐缓冲液稀释不同倍数下的粒径与电位
由上述表格可知,hsya-pc-smedds在不同的稀释介质与倍数下的粒径几乎无变化,而zeta电位则会随着溶液酸度的增加,即h+浓度的增大而增大。
六、溶出度实验
将hsya-pc-smedds灌装于肠溶胶囊壳内后,考察其在去离子水、ph6.8磷酸缓冲液、ph4.5醋酸缓冲液和ph1.2hcl溶液中的溶出情况。结果如图4所示。
由于hsya-pc-smedds可以迅速在水溶性介质中自乳化,因此其肠溶胶囊在不同介质中的溶出度主要受胶囊壳性质的影响,并且由结果来看其表现出明显的肠溶特性。
七、hsya-pc-smedds在大鼠体内药动学特性考察
①实验方案:采用雄性sd大鼠作为实验动物,禁食不禁水12h后,选取体重在200±20g的大鼠随机分为两组,每组5只;分别以20mg/kg(以hsya计)灌胃给予hsya-pc-smedds水溶液和hsya原药水溶液,并于不同时间点通过眼眶后静脉丛取血离心取上清,测定血浆中的hsya含量;sd大鼠口服灌胃hsya-pc-smedds和hsya后平均血药浓度-时间曲线图如图5所示,通过计算相应组别auc面积来计算相对生物利用度。
②实验结果:hsya-pc-smedds组的cmax和auc0→t分别为(1.28±0.62)μg/ml和(430.99±151.46)min·μg/ml,显著大于hsya水溶液组的(0.37±0.36)μg/ml和(147.29±137.63)min·μg/ml(p<0.05),其相对生物利用度为292.61%。
以上实施例的说明只是用于帮助理解本发明方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!