一种具有高亲和性的新型骨靶向纳米粒及其制备方法与流程
本发明属于医学材料技术领域,具体涉及一种具有高亲和性的新型骨靶向纳米粒及其制备方法。
背景技术:
骨质疏松症是一种以骨组织微结构的退变、骨量降低、骨脆性增加以及继发骨折危险性增加为主要特征的骨骼系统疾病。骨质疏松最常见的症状是疼痛,以腰背疼痛为主,严重骨痛可影响人的日常生活、饮食和睡眠等,常使病人生活无规律;骨质疏松症的严重症状为骨折,与普通创伤性骨折不同,骨质疏松性骨折是一种低能量脆性骨折,粉碎性骨折几率大大增加的同时短期治疗难以奏效,严重影响患者的生活质量。
创伤、肿瘤、感染、病理等因素造成的骨组织缺损较常见,因而长期以来,缺损骨骼的修复一直是骨研究的重要任务。目前常用的修复方法,如自体骨移植、异体骨移植、人工合成替代物质均在一定程度上存在问题。自体骨移植受自身供体有限性的限制,且二次手术给患者带来痛苦;异体骨移植主要存在免疫排异反应,有导致传染疾病和肿瘤生成的可能;其他各种以金属、陶瓷或高分子制造的人工骨替代材料也已应用于临床但多数是作为永久植体使用,材料不可降解,不能参与人体的新陈代谢,缺损区不能通过骨重建来再生骨。因此,研究者们都在努力对现有骨移植材料进行改进或研究、开发发明骨修复材料。
理想的骨缺损修复材料应具有良好的组织相容性、来源广泛安全可靠、具有骨传导和骨诱导性能、具有可塑性,并可生物降解,在组织过程中能逐渐分解,不影响新生组织的结构和功能。因此,本发明基于以上特点,提出了一种具有高亲和性的新型骨靶向纳米给药系统及其制备方法。
技术实现要素:
为解决上述问题,一方面,本发明提供了一种具有高亲和性的新型骨靶向纳米粒,该骨靶向纳米粒包括plga-peg-cooh聚合物药物载体、骨靶向物质四环素以及疏水性药物;另一方面,本发明还提供了一种高亲和性的新型骨靶向纳米粒的制备方法。
本发明技术方案如下。
一种具有高亲和性的新型骨靶向纳米粒的制备方法,包括如下步骤:
(1)plga-b-peg-cooh聚合物的合成;
将plga-cooh,nhs(n-羟基琥珀酰亚胺)和edc(1-(3-二甲氨基丙基)-3-乙基碳二亚胺)共同溶于二氯甲烷中反应,生成具有活性末端的plga-nhs,再将生成的plga-nhs滴入乙醚中沉淀,用冰的乙醚和甲醇混合液反复冲洗沉淀物,去除剩余的催化剂,之后,沉淀物在真空干燥箱中干燥;后精确称量具有活性末端的plga,1-2g溶于四氯甲烷中,之后再加入nh2-peg-cooh和n,n-diisopropylethylamine(n,n-二异丙基乙胺),磁力搅拌反应6-12小时后,将生成物逐渐滴入甲醇中沉淀,并用冰甲醇反复洗涤沉淀物3-5次,去除未反应的peg-cooh和催化剂,反应生成的聚合物,即plga-b-peg-cooh;
(2)plga-b-peg-tc聚合物的合成
利用脱水剂催化plga-b-peg-cooh的末端羧基与四环素(telracycline,tc)的羟基之间的酯化脱水反应,得到四环素-peg-b-plga嫁接物;为提高反应活性,整个过程需要在无水条件下进行,故利用无水dmf作为反应溶剂,同时添加氮气保护,减少空气中水分的介入;
(3)载药纳米粒的制备
称取20-30mg的plga-b-peg-tc与疏水性药物混合,加入2-3ml二氯甲烷,待材料完全溶解,即作为乳化溶剂挥发法的油相;
将聚乙烯醇(pva)配制成2%-5%(w/v)的水溶液作为水相,在高速剪切力的作用下,将2ml-5ml二氯甲烷作为油相注入2%-5%(w/v)的pva水溶液中,接着继续保持高速剪切力作用10-30min形成初乳液,将所得的初乳液探头超声20-30次,完成后转移至梨形瓶中,待二氯甲烷基本挥发完全,将梨形瓶取下,磁力搅拌过夜,挥干残余的二氯甲烷,同时使plga-b-peg-tc纳米粒固化,将所得悬液高速离心收集沉淀,用去离子水将纳米粒重新分散,即得载疏水性药物的plga-b-peg-tc纳米粒。
上述方法中,步骤(1)中,plga-cooh,nhs和edc三者的添加量满足质量比为:1:1:1.5;所述催化剂包括nhs和edc,添加比例范围为1:1.5-1:2。
上述方法中,步骤(2)中,所述脱水剂为hobt(1-羟基苯并三唑)。
上述方法中,所述plga-b-peg-cooh与四环素的质量比为2:1-3:1。
上述方法中,所述疏水性药物包括辛伐他汀、阿霉素、布洛芬、红霉素或头孢唑啉。
一种具有高亲和性的新型骨靶向纳米粒,包括可缓释载药纳米颗粒、骨靶向物质四环素以及疏水性药物。
进一步地,所述可缓释载药纳米颗粒分子量为16000-18000。
进一步地,可缓释载药纳米颗粒nh2-peg-cooh共聚物分子量为3300-3400。
进一步地,所述疏水性药物为抗骨质疏松类药物。
与现有技术相比,本发明的优势在于:
(1)本发明利用四环素的骨沉积能力,使载体具备骨组织靶向性能,以此实现对抗骨质疏松症药物的有效骨组织递送。
(2)本发明兼具抗骨质疏松药物的治疗功效和plga-peg-cooh的生物降解性优良、组织相容性好、降解产物不会在重要器官聚集的特点;同时本发明可以减少药物刺激,延长药物作用时间实现长效缓释,增加药物的稳定性;最重要的是,骨靶向plga-peg-cooh的羟基磷灰石亲和力相较于普通纳米粒提高近4.88倍,骨靶向纳米粒可以有效提高药物在骨组织中的分布,降低在非靶向组织中的分布,减少药物毒副作用,可作为优秀的骨修复材料应用于骨外科、整形外科及牙科领域。
附图说明
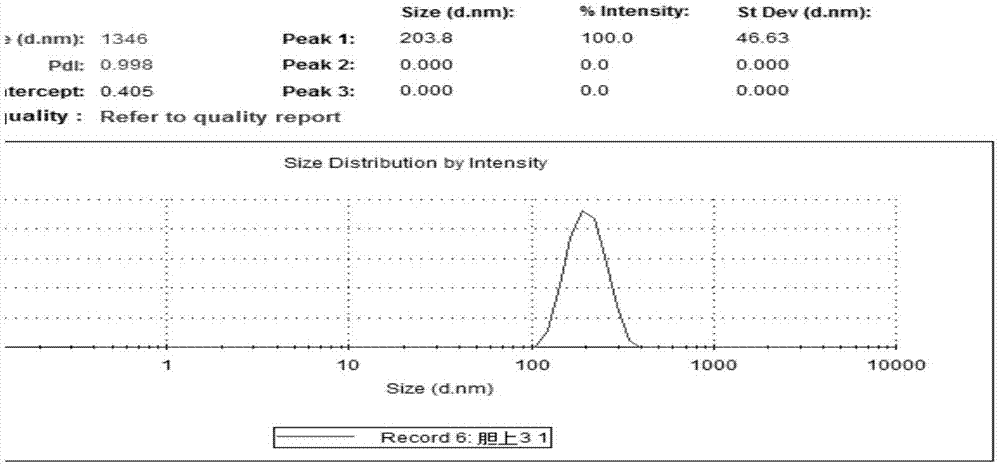
图1为plga-b-peg-cooh纳米粒粒度分布图;
图2为plga-b-peg-cooh与plga-b-peg-tc红外光谱图。
具体实施方式
以下结合实例对本发明作进一步说明,但本发明不局限于这些实施例。
实施例1
包载辛伐他汀plga-b-peg-tc纳米粒的制备,其中辛伐他汀2mg,plga-b-peg-tc20mg
具体的,包括以下步骤:
(1)plga-b-peg-cooh聚合物的合成
将plga-cooh、nhs和edc按照1mg,1mg,1.5mg的添加量共同溶于二氯甲烷中反应,生成具有活性末端的plga,再将生成的具有活性末端的plga滴入乙醚中沉淀,用冰的乙醚和甲醇混合液反复冲洗沉淀物,去除剩余的催化剂之后,沉淀物在真空干燥箱中干燥;后精确称量1g具有活性末端的plga溶于四氯甲烷中,之后再加入250mgnh2-peg-cooh和28mgn,n-diisopropylethylamine,磁力搅拌反应12小时后,将生成物逐渐滴入甲醇中沉淀,并用冰甲醇反复洗涤沉淀物3次,去除未反应的peg-cooh和催化剂。反应生成的聚合物,即plga-b-peg-cooh。
图1为plga-b-peg-cooh纳米粒粒度分布图,从图中可以看出粒径大约在200nm左右,pdi为0.998,说明粒径分散性良好。
(2)plga-b-peg-tc聚合物的合成
利用脱水剂(1-羟基苯并三唑hobt)催化plga-b-peg-cooh的末端羧基与四环素(telracycline,tc)(plga-b-peg-cooh、hobt、tc三者的投料摩尔比为1:1.5:1.3)的羟基之间的酯化脱水反应,得到四环素-peg-b-plga嫁接物。为提高反应活性,整个过程需要无水条件下进行,故利用无水dmf作为反应溶剂,同时添加氮气保护,减少空气中水分的介入。
图2为plga-b-peg-cooh与plga-b-peg-tc红外光谱图,从b图中可以看出δ=3255.21cm-1附近宽吸收峰为末端oh吸收峰,δ=2877.54cm-1为c-h的伸缩振动吸收峰,δ=1756.28cm-1为酯羰基c=0的伸缩振动吸收峰,δ=1455.63cm-1为c-c的一系列伸缩振动吸收峰,δ=1186.31cm-1为酯键的c-o伸缩振动吸收峰,说明已成功合成plga-b-peg-cooh;a图相较于b图,δ=3255.21cm-1附近宽吸收峰消失,说明已成功嫁接上四环素tc。
(3)载药纳米粒的制备
精密称取20mg的plga-b-peg-tc与2mg辛伐他汀混合,加入2ml二氯甲烷,待材料完全溶解,即作为乳化溶剂挥发法的油相。将聚乙烯醇(pva)配制成2%(w/v)的水溶液作为水相,在高速剪切力的作用下,将2ml二氯甲烷作为油相缓慢注入2%(w/v)的pva水溶液中,接着继续保持高速剪切力作用10-30min形成初乳液,将所得的初乳液探头超声20-30次,完成后转移至梨形瓶中,待二氯甲烷基本挥发完全,将梨形瓶取下,磁力搅拌过夜,挥干残余的二氯甲烷,同时使plga-b-peg-tc纳米粒固化。将所得悬液高速离心收集沉淀,用去离子水将纳米粒重新分散,即得载疏水性药物的plga-b-peg-tc纳米粒。
实施例2
包载辛伐他汀plga-b-peg-tc纳米粒的制备,其中辛伐他汀2.5mg,plga-b-peg-tc20mg
具体的,包括以下步骤:
(1)plga-b-peg-cooh聚合物的合成
将plga-cooh、nhs和edc按照1mg,1mg,1.5mg的添加量共同溶于二氯甲烷中反应,生成具有活性末端的plga,再将生成的具有活性末端的plga滴入乙醚中沉淀,用冰的乙醚和甲醇混合液反复冲洗沉淀物,去除剩余的催化剂,之后,沉淀物在真空干燥箱中干燥;后精确称量1g具有活性末端的plga溶于四氯甲烷中,之后再加入250mgnh2-peg-cooh和28mgn,n-diisopropylethylamine,磁力搅拌反应12小时后,将生成物逐渐滴入甲醇中沉淀,并用冰甲醇反复洗涤沉淀物3次,去除未反应的peg-cooh和催化剂。反应生成的聚合物,即plga-b-peg-cooh。
(2)plga-b-peg-tc聚合物的合成
利用脱水剂(1-羟基苯并三唑hobt)催化plga-b-peg-cooh的末端羧基与四环素(telracycline,tc)(plga-b-peg-cooh、hobt、tc三者的投料摩尔比为1:1.5:1.3)的羟基之间的酯化脱水反应,得到四环素-peg-b-plga嫁接物。为提高反应活性,整个过程需要无水条件下进行,故利用无水dmf作为反应溶剂,同时添加氮气保护,减少空气中水分的介入。
(3)载药纳米粒的制备
精密称取20mg的plga-b-peg-tc与2.5mg辛伐他汀混合,加入2.5ml二氯甲烷,待材料完全溶解,即作为乳化溶剂挥发法的油相。将聚乙烯醇(pva)配制成2%(w/v)的水溶液作为水相,在高速剪切力的作用下,将2.5ml二氯甲烷作为油相缓慢注入2%(w/v)的pva水溶液中,接着继续保持高速剪切力作用20-30min形成初乳液,将所得的初乳液探头超声20-30次,完成后转移至梨形瓶中,待二氯甲烷基本挥发完全,将梨形瓶取下,磁力搅拌过夜,挥干残余的二氯甲烷,同时使plga-b-peg-tc纳米粒固化。将所得悬液高速离心收集沉淀,用去离子水将纳米粒重新分散,即得载疏水性药物的plga-b-peg-tc纳米粒。
实施例3
包载辛伐他汀plga-b-peg-tc纳米粒的制备,其中辛伐他汀3mg,plga-b-peg-tc20mg
具体的,包括以下步骤:
(1)plga-b-peg-cooh聚合物的合成
将plga-cooh、nhs和edc按照1mg,1mg,1.5mg的添加量共同溶于二氯甲烷中反应,生成具有活性末端的plga,再将生成的具有活性末端的plga滴入乙醚中沉淀,用冰的乙醚和甲醇混合液反复冲洗沉淀物,去除剩余的催化剂,之后,沉淀物在真空干燥箱中干燥;后精确称量1g具有活性末端的plga溶于四氯甲烷中,之后再加入250mgnh2-peg-cooh和28mgn,n-diisopropylethylamine,磁力搅拌反应12小时后,将生成物逐渐滴入甲醇中沉淀,并用冰甲醇反复洗涤沉淀物3次,去除未反应的peg-cooh和催化剂。反应生成的聚合物,即plga-b-peg-cooh。
(2)plga-b-peg-tc聚合物的合成
利用脱水剂(1-羟基苯并三唑hobt)催化plga-b-peg-cooh的末端羧基与四环素(telracycline,tc)(plga-b-peg-cooh、hobt、tc三者的投料摩尔比为1:1.5:1.3)的羟基之间的酯化脱水反应,得到四环素-peg-b-plga嫁接物。为提高反应活性,整个过程需要无水条件下进行,故利用无水dmf作为反应溶剂,同时添加氮气保护,减少空气中水分的介入。
(3)载药纳米粒的制备
精密称取20mg的plga-b-peg-tc与3mg辛伐他汀混合,加入3ml二氯甲烷,待材料完全溶解,即作为乳化溶剂挥发法的油相。将聚乙烯醇(pva)配制成2%(w/v)的水溶液作为水相,在高速剪切力的作用下,将3ml二氯甲烷作为油相缓慢注入2%(w/v)的pva水溶液中,接着继续保持高速剪切力作用25-35min形成初乳液,将所得的初乳液探头超声20-30次,完成后转移至梨形瓶中,待二氯甲烷基本挥发完全,将梨形瓶取下,磁力搅拌过夜,挥干残余的二氯甲烷,同时使plga-b-peg-tc纳米粒固化。将所得悬液高速离心收集沉淀,用去离子水将纳米粒重新分散,即得载疏水性药物的plga-b-peg-tc纳米粒。
- 还没有人留言评论。精彩留言会获得点赞!