一种超声和辐射联用的治疗系统及其操作方法与流程
本发明涉及医疗设备领域,特别是涉及一种超声治疗与辐射治疗联用的超声和辐射联用的治疗系统及其使用方法。
背景技术
随着原子科学的发展,利用放射线(如co-60放射性核素、电子、光子、质子、重离子)进行癌症治疗已经是主要手段之一,其与手术、化学治疗,并称为3大癌症治疗方法。然而传统光子或电子治疗受到放射线本身物理条件的限制,对于肿瘤与正常组织并没有鉴别力,因此在杀死癌细胞的同时,也会对正常组织细胞造成伤害,现今往往透过多角度照射与分次治疗等模式,分散正常组织剂量,并将辐射剂量集中于肿瘤组织;此外,不同放射线对于肿瘤细胞会产生不同的生物效应,传统放射治疗使用的电子、光子之相对生物效应为质子、重带电粒子的1/3~1/20,亦即若需要达到相同的生物终点,电子、光子需要给予3倍~20倍的辐射剂量。也因此,电子、光子射线对于进入休眠状态或是厌氧区域的恶性肿瘤组织治疗效果往往不佳。
为了减少肿瘤周边正常组织的辐射伤害(normaltissuecomplicationprobability,ntcp)并提高肿瘤组织的治愈率(tumorcontrolprobability,tcp),化学治疗中的标靶治疗概念便被用于放射治疗中;而针对高抗辐射性的肿瘤细胞,目前也积极发展就有高相对生物效应的辐射源,如质子治疗、重离子治疗、中子俘获治疗等。其中中子俘获治疗便是结合上述两种概念,如硼中子俘获治疗(boronneutroncapturetherapy,bnct),将硼制剂与肿瘤组织代谢所需养分相结合,透过肿瘤组织摄取养分的过程,自动将硼制剂准确送达需治疗位置,即硼制剂富有亲肿瘤性质;再配合精准的中子射束调整,提供比传统放射线更好的癌症治疗选择。
然而,硼中子俘获治疗也存在一定的缺陷,导致其应用受到明显的限制。由于目前硼制剂在肿瘤组织(tumor)以及在正常组织(normaltissue)内的比例约为3:1(即t/n=3:1),亦即依然有部分的硼制剂聚积在正常组织中,造成中子辐射对正常组织的损伤。同时,由于硼制剂具有很大的中子作用截面(crosssection),一般靠近中子束方向的肿瘤获得最大的吸收剂量,但随着深度逐渐增加,可进入肿瘤组织的中子数量快速减少,造成剂量分布快速跌落的情形,对于较大体积的肿瘤往往存在剂量分布不均匀的情形,导致深部肿瘤由于中子剂量减少而不能进行有效治疗。即,硼中子俘获治疗对于小体积的肿瘤有良好的治愈效果,而对于大体积的肿瘤治愈效果较差。
因此,有必要设计一种能够有效解决较大体积的肿瘤的治愈效果问题的治疗系统和方法,以使硼中子俘获治疗得到更广泛的应用。
技术实现要素:
基于此,本发明的一个目的在于,提出一种超声和辐射联用的治疗系统,该治疗系统结合了高强度聚焦超声治疗技术(highintensityfocusedultrasound,hifu)与硼中子俘获治疗技术,其中先使用hifu治疗系统,利用聚焦超声波对大尺寸肿瘤进行消融后,再使用bnct治疗系统,利用中子与硼制剂作用后放出的带电粒子,自动侦测肿瘤边缘并予以清除残余小尺寸肿瘤,通过两种治疗技术的结合,可以提高肿瘤,尤其是大体积恶性肿瘤的治愈效果。
本发明的另一个目的在于,提出一种超声和辐射联用的治疗系统的操作方法,操作简单,便于实施,并可提高肿瘤的治愈效果。
为达此目的,本发明采用以下技术方案:
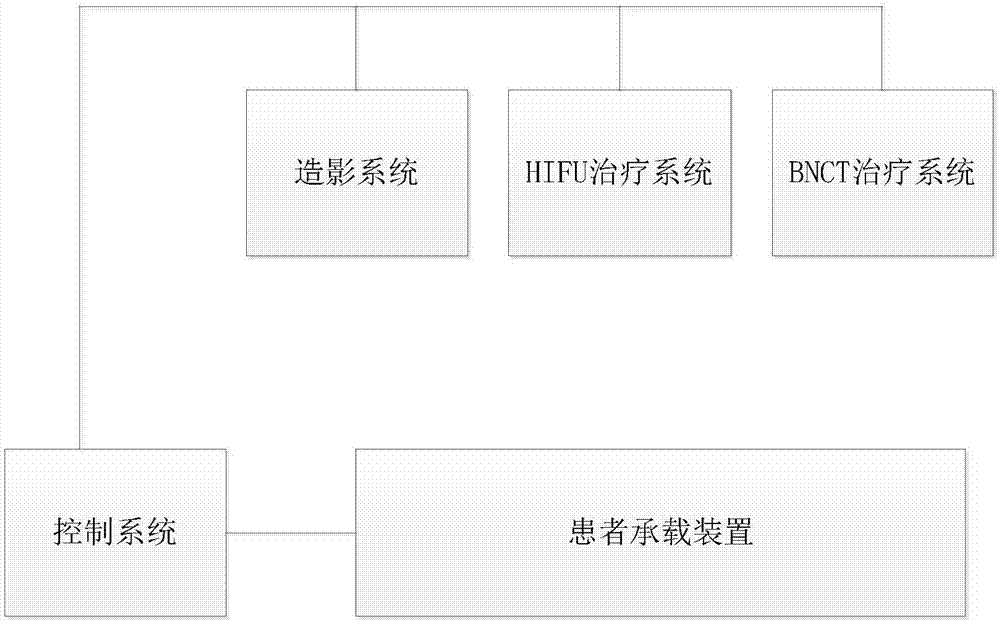
一种超声和辐射联用的治疗系统,包括:
造影系统,用于对病灶区进行造影,指示肿瘤的位置、大小和边界,并判断是否达到预设尺寸;
hifu治疗系统,用于病灶区进行超声治疗,消融大尺寸肿瘤;
bnct治疗系统,用于病灶区进行辐射治疗,清除小尺寸肿瘤;
患者承载装置,用于承载患者,并与所述造影系统、所述hifu治疗系统、所述bnct治疗系统相配合;
控制系统,分别与所述造影系统、所述hifu治疗系统、所述bnct治疗系统、所述患者承载装置连接,用于控制各部件的动作。
本发明中采用高强度聚焦超声治疗技术与硼中子俘获治疗技术的联用,可以先通过高强度聚焦超声治疗技术将大体积的恶性肿瘤消融变小,成为小体积的恶性肿瘤,再通过硼中子俘获治疗清除消融后的小体积的恶性肿瘤,从而有效提高大体积的恶性肿瘤治愈效果和治愈率。
优选的,所述预设尺寸为肿瘤直径小于4cm或肿瘤体积小于250cc。
具体的,当肿瘤的尺寸未达到预设尺寸时,称之为大尺寸肿瘤,此时,肿瘤的尺寸过大,使用硼中子俘获治疗时,由于照射深度的限制,无法达到良好的治疗效果,因此需要先经过高强度聚焦超声治疗将肿瘤消融变小;当肿瘤的尺寸达到预设尺寸时,称之为小尺寸肿瘤,此时,肿瘤的尺寸足够小,使用硼中子俘获治疗可以达到良好的治疗效果,而如果对小尺寸肿瘤选择高强度聚焦超声治疗,由于肿瘤边界处可能会存在肿瘤组织与正常组织交织存在的情况,高强度聚焦超声治疗时会将治疗区域内的肿瘤组织与正常组织整体“切除”,会对人体造成无谓的伤害。
优选的,所述造影系统用于在超声治疗前、治疗中、治疗后对患者病灶区进行造影。所述造影系统选自mri造影装置、ct造影装置、pet造影装置或其组合。
作为一种优选的技术方案,所述造影系统为mri造影装置,用于确定肿瘤的位置、大小和边界,并判断肿瘤大小是否达到预设尺寸。
优选的,所述mri造影装置对含有造影剂混合物的病灶区进行造影,以确定肿瘤的确切边界。
进一步优选的,所述造影剂混合物包括硼制剂和造影剂。当使用mri造影装置进行造影时,所述造影剂为mri造影剂。
具体的,在造影前给患者注入造影剂混合物,其中硼制剂与mri造影剂混合成为造影剂混合物,这样造影剂混合物既富有高肿瘤亲和力,会在人体肿瘤区域富集,同时造影剂混合物又可以被mri造影装置测得,因此在mri图像中,可通过调色将高硼制剂浓度肿瘤区域和低硼制剂浓度肿瘤区域,以及肿瘤区域和正常组织予以区分,即可根据颜色的差异勾画出确切的肿瘤区域,明确确定肿瘤的边界以及其中硼制剂的浓度分布,硼制剂的浓度可换算为硼浓度。
优选的,所述mri造影装置包括:磁体、波谱仪、mri屏蔽装置。
进一步优选的,所述磁体选自开放式磁体或环状式磁体。
具体的,所述开放式磁体的结构为上下各设置一个磁性材料,所产生的主恒定磁场垂直于地面;所述环状式磁体的结构为一个封闭的环形,在封闭的环形空间内产生主恒定磁场。
作为一种优选的技术方案,所述造影系统为ct造影装置和pet造影装置,所述ct造影装置用于确定肿瘤的位置和大小,所述pet造影装置用于确定肿瘤的确切边界。具体的,在pet造影前,向患者体内注入造影剂混合物,其中硼制剂与pet造影剂混合成为造影剂混合物,即使用pet造影装置进行造影时,造影剂为pet造影剂,这样造影剂混合物既富有高肿瘤亲和力,会在人体肿瘤区域富集,同时造影剂混合物又可以被pet造影装置测得,在pet图像中,同样可通过调色将高硼制剂浓度肿瘤区域和低硼制剂浓度肿瘤区域,以及肿瘤区域和正常组织予以区分,即可根据颜色的差异勾画出确切的肿瘤区域,明确确定肿瘤的边界以及其中硼制剂的浓度分布,硼制剂的浓度可换算为硼浓度。
作为一种优选的技术方案,所述造影系统为mri造影装置和pet造影装置,其中所述mri造影装置用于确定肿瘤的位置和大小,所述pet造影装置用于对含有造影剂混合物的病灶区进行造影,以确定肿瘤的确切边界。
进一步优选的,所述造影剂混合物包括硼制剂和造影剂。此时,造影前注入的所述造影剂混合物中包含pet造影剂。
优选的,所述hifu治疗系统包括信号发生器、功率放大器和换能器。
所述信号发生器用于产生超声信号源,所述功率放大器与所述信号发生器连接,用于将所述超声信号放大,所述换能器与所述功率放大器连接,所述功率放大器驱动所述换能器产生超声波,所述换能器将所述超声波传导至病灶区,利用超声波在病灶区聚焦,通过高强度聚焦超声波的热效应,使病灶区肿瘤温度瞬间上升至65℃以上,杀死肿瘤组织,达到了消融肿瘤,使肿瘤变小的目的。
优选的,所述bnct治疗系统包括:中子产生装置、中子慢化装置和中子束出口。所述中子产生装置用于产生高通量中子束,具体的,可利用核反应堆、加速器或核素提供中子束;所述中子慢化装置与所述中子产生装置连接,用于将所述中子产生装置产生的中子束的能量调整到适合硼中子俘获治疗使用的能量范围,所述中子束能量范围为0.5ev~40kev;所述中子束出口与所述中子慢化装置连接,用于将中子束导出并到达患者病灶区,利用此中子束对摄取硼制剂的患者肿瘤组织部位进行照射,达到消除肿瘤的目的。
优选的,所述患者承载装置包括治疗床和升降装置,所述升降装置与所述治疗床连接,并驱动所述治疗床进行上、下、左、右等方向的摆位。进一步优选的,所述患者承载装置需通过磁兼容测试,方可在强磁场环境下工作。
具体的,所述升降装置驱动所述治疗床移动至所述造影系统、所述hifu治疗系统和所述bnct治疗系统的相应位置,以使患者可以躺在治疗床上完成肿瘤造影、超声治疗和辐射治疗过程。
作为一种优选的技术方案,所述造影系统、所述hifu治疗系统和所述bnct治疗系统设置于同一治疗室中。
具体的,在治疗时,将患者安置在所述治疗床上,通过所述控制系统控制所述造影系统、所述hifu治疗系统和所述bnct治疗系统的切换,即可完成肿瘤造影、肿瘤消融、肿瘤清除过程,减少了患者的移动,可以更安全、更快速的完成肿瘤治疗过程。
作为一种优选的技术方案,所述造影系统和所述hifu治疗系统设置于同一治疗室中,所述bnct治疗系统设置于另一治疗室中。如,所述造影系统和所述hifu治疗系统设置于第一治疗室中,所述bnct治疗系统设置于第二治疗室中。
具体的,在治疗时,当患者通过第一治疗室中的所述造影系统和所述hifu治疗系统完成造影、超声治疗过程,达到肿瘤消融效果后,再将患者转移至第二治疗室中的所述bnct治疗系统进行辐射治疗过程,以达到肿瘤清除效果,同时,下一患者可以在第一治疗室中进行肿瘤造影、超声治疗过程。可见,本方案中,不同患者可以同时进行治疗,其中一个患者进行超声治疗,另一个患者进行辐射治疗,可以提高超声和辐射联用的治疗系统的利用率。
作为一种优选的技术方案,所述hifu治疗系统设置在所述治疗床上方,为上置式hifu治疗系统,所述上置式hifu治疗系统从上往下对患者进行照射,完成超声治疗过程。
作为一种优选的技术方案,所述hifu治疗系统设置在所述治疗床下方,为下置式hifu治疗系统,所述上置式hifu治疗系统从下往上对患者进行照射,完成超声治疗过程。
作为一种优选的技术方案,所述hifu治疗系统的数量为两组,分别为上置式hifu治疗系统和下置式hifu治疗系统,所述上置式hifu治疗系统设置在所述治疗床上方,从上往下对患者进行照射,所述下置式hifu治疗系统设置在所述治疗床下方,从下往上对患者进行照射,通过上、下两个方向的超声照射,完成超声治疗过程。
另一方面,提供一种超声和辐射联用的治疗系统的使用方法,包括以下步骤:
s1:在患者体内注入造影剂混合物;
s2:使用造影系统获取患者的造影图像,得到患者肿瘤的位置、大小和边界;
s3:判断肿瘤大小是否小于预设尺寸,当否时,执行s4,当是时,执行s5;
s4:使用hifu治疗系统进行超声治疗,消融大尺寸肿瘤,再执行s2步骤;
s5:使用bnct治疗系统进行辐射治疗,清除小尺寸肿瘤;
s6:结束。
优选的,所述造影剂混合物包括硼制剂和造影剂。
优选的,所述预设尺寸为肿瘤直径小于4cm或肿瘤体积小于250cc。
优选的,在进行辐射治疗,清除小尺寸肿瘤时,包括:
s51:根据肿瘤尺寸制定辐射治疗计划;
s52:检测患者体内硼浓度,并与辐射治疗计划中的硼浓度进行比对,当低于辐射治疗计划中的硼浓度时,需要调整治疗计划;
s53:开启bnct治疗系统,进行中子照射;
s54:当照射剂量达到辐射治疗计划的剂量时,停止中子照射。
本发明的有益效果为:
本发明提出一种超声和辐射联用的治疗系统,该治疗系统结合了高强度聚焦超声治疗技术与硼中子俘获治疗技术,先以hifu治疗系统进行肿瘤消融后,再使用bnct治疗系统,利用中子与硼制剂作用后放出的带电粒子,自动侦测肿瘤边缘并予以清除残余肿瘤,可以提高肿瘤,尤其是大体积恶性肿瘤的治愈效果。
同时本发明还提出一种超声和辐射联用的治疗系统的使用方法,本方法中通过造影系统对病灶区进行造影,并在造影剂中混合硼制剂,以使得造影系统可以确定病灶区肿瘤位置、大小和边界,再判断肿瘤的尺寸是否达到预设尺寸,以选择是进行超声治疗还是辐射治疗,使得高强度聚焦超声治疗技术和硼中子俘获治疗两种技术能有效结合,充分发挥各自技术的优点,达到更好的治疗肿瘤的效果。
附图说明
图1是本发明中超声和辐射联用的治疗系统的框架示意图;
图2是本发明中超声和辐射联用的治疗系统的结构示意图;
图3是现有技术中未有造影剂混合物的mri图像和其勾出边界的图像;
图4是本发明中含有造影剂混合物的mri图像和其勾出边界的图像;
图5是不同体积肿瘤内的剂量分布示意图;
图6是本发明中超声和辐射联用的治疗系统的使用方法的流程图;
图7是本发明中超声和辐射联用的治疗系统的使用方法的超声治疗步骤的流程图;
图8是本发明中超声和辐射联用的治疗系统的使用方法的辐射治疗步骤的流程图。
其中,造影系统100;hifu治疗系统200;bnct治疗系统300,中子产生装置310,中子慢化装置320,中子束出口330;患者承载装置400,治疗床410,升降装置420;患者500。
具体实施方式
为使对本发明的结构特征及所达成的功效有更进一步的了解和认识,用以较佳的实施例及附图配合详细的说明,说明如下:
实施例一
如图1、图2所示,一种超声和辐射联用的治疗系统,包括:造影系统100、hifu治疗系统200、bnct治疗系统300、患者承载装置400和控制系统。
本实施例中,造影系统100为mri造影装置,用于在超声治疗前、治疗中、治疗后对含有造影剂混合物的病灶区进行造影,指示肿瘤的位置、大小和确切边界,并判断肿瘤大小是否达到预设尺寸;包括:磁体、波谱仪、mri屏蔽装置。本实施例中磁体选自环状式磁体,环状式磁体的结构为一个封闭的环形,在封闭的环形空间内产生主恒定磁场。于其他实施例中,磁体可以选自开放式磁体,开放式磁体的结构为上下各设置一个磁性材料,所产生的主恒定磁场垂直于地面。
造影剂混合物包括硼制剂和造影剂。本实施例中,造影剂为mri造影剂。
具体的,为了进行高强度聚焦超声治疗技术与硼中子俘获治疗技术联用,判断肿瘤体积大小是一项关键的因素。常规的高强度聚焦超声治疗中也需要通过造影判断肿瘤边界,对于良性肿瘤来说,边界清晰,可以确定其边界,而对于存在高度侵犯性的恶性肿瘤来说,其边界是模糊的,无法明确勾勒出肿瘤边界亦无法彻底清除恶性肿瘤组织。
为了准确的判断人体肿瘤的位置、尺寸和确切边界,本实施例中采用了mri造影装置对病灶区进行造影,据以勾画出肿瘤区域的边界。但由于mri造影属于结构性造影而非功能性造影,因此对于恶性肿瘤的边界无法完全确认,亦无法辨识出已经侵犯周围的恶性组织。此外,临床上亦常使用钆对比剂(或称为造影剂)进行增强造影,钆对比剂是可以在mri造影上迅速变白的分子,透过比对注入钆对比剂前后的mri图像,可以看出某个部位的血管走行的样子,使病变区域更加明显,但无法区别出已遭肿瘤组织浸润但尚未形成明显肿瘤的组织。
当需要用mri造影装置得到肿瘤确切边界时,需要在造影前向患者体内注入mri造影剂混合物,造影剂混合物包括硼制剂与mri造影剂,则可利用硼制剂进行功能显影,并利用mri造影剂进行结构显影,利用该造影剂混合物明确肿瘤组织浸润范围,据此进行治疗区圈画以及后续治疗,来达到最佳的治疗效果。
图3、图4均为恶性肿瘤病灶区的mri图像和其勾出边界的图像,其中图3是现有技术中未含有造影剂混合物的图,图4中是本实施例中含有造影剂混合物的图。通过对比可知,在传统的mri图像中呈现出的肿瘤边界并非实际边界,通过在病灶区内聚集造影剂混合物,可以将肿瘤的真正边界呈现出来,可以准确的得出肿瘤边界及其大小。
本实施例中,在造影前给患者500注入造影剂混合物,其中硼制剂与mri造影剂混合成为造影剂混合物,这样造影剂混合物既富有高肿瘤亲和力,会在人体肿瘤区域富集,同时造影剂混合物又可以被造影系统100测得,因此在mri图像中,可通过调色将高硼制剂浓度肿瘤区域和低硼制剂浓度肿瘤区域,以及肿瘤区域和正常组织予以区分,即可根据颜色的差异勾画出确切的肿瘤区域,明确确定肿瘤的边界以及其中硼制剂的浓度分布,硼制剂的浓度可换算为硼浓度。
当然,在其他的一些实施例中,造影系统100可以为ct造影装置和pet造影装置,或者为mri造影装置和pet造影装置,用以确定肿瘤的位置、大小和边界。
hifu治疗系统200用于对病灶区进行超声治疗,消融大尺寸肿瘤;包括信号发生器、功率放大器和换能器。信号发生器用于产生超声信号源,功率放大器与所述信号发生器连接,用于将超声信号放大,换能器与功率放大器连接,功率放大器驱动换能器产生超声波,换能器将超声波传导至病灶区,利用超声波在病灶区聚焦,通过高强度聚焦超声波的热效应,使病灶区肿瘤消融,达到了消融肿瘤,使肿瘤变小的目的。
高强度聚焦超声治疗肿瘤的主要机制是:利用超声波可以穿透软组织并可以聚焦的物理性质,将体外低能量超声聚焦于体内肿瘤病灶区,在焦点处形成高能密度,使焦点处肿瘤组织迅速升温(≥65℃),使肿瘤组织发生不可逆之凝固性坏死,也叫消融,而病灶区外的组织没有损伤,达到“切除”肿瘤的目的,是无创治疗肿瘤的手段之一。同时,聚焦超声还可破坏2ml以下的肿瘤局部滋养小血管,使肿瘤组织发生继发性缺血性坏死;并可透过空化效应,实现诱发体内抗肿瘤免疫效应,达到与放疗、化学疗法结合时的增敏效应,扩大对肿瘤组织的杀伤能力;聚焦超声的热效应另可诱发肿瘤细胞合成热休克蛋白(heatshockprotrin,hsp),激发针对同源肿瘤细胞的特异性毒性t淋巴细胞,达到抑制肿瘤组织生长的目的。
然而,对于存在高度侵犯性的恶性肿瘤来说,一方面由于高强度聚焦超声治疗需要对肿瘤病灶区进行勾边确定肿瘤位置与大小,再根据勾边确定的位置进行超声波聚焦,而恶性肿瘤的边界模糊,无法被明确勾勒出,从而会导致治疗过程中恶性肿瘤边界处可能有遗漏的肿瘤区域,另一方面,由于高强度聚焦超声治疗的聚焦区直径仅为数毫米,点与点之间有时难以重叠,再加上病灶区内存在能量分布不均匀现象,治疗后的组织中会出现“残留癌细胞小岛”,这都是肿瘤复发的原因之一。因此,长久以来,高强度聚焦超声治疗能将恶性肿瘤消融变小却难以彻底清除恶性肿瘤组织。
bnct治疗系统300,用于对病灶区进行辐射治疗,清除小尺寸肿瘤;包括:中子产生装置310、中子慢化装置320和中子束出口330。中子产生装置310用于产生高通量中子束,具体的,可利用核反应堆、加速器、核素提供中子束;中子慢化装置320与所述中子产生装置310连接,用于将所述中子产生装置310产生的中子束的能量调整到适合硼中子俘获治疗使用的能量,所述中子束能量范围为0.5ev~40kev;中子束出口330与所述中子慢化装置320连接,用于中子束导出并到达患者500病灶区,利用此中子束对摄取硼制剂的患者500肿瘤组织部位进行照射,达到治疗消除肿瘤的目的。
硼中子俘获治疗的主要机制基于硼制剂(成分为99%以上的硼-10元素)对热中子具有高达3840barn的俘获截面,是人体组织(c、h、o、n)的数千倍以上。借由10b(n,α)7li中子俘获及核分裂反应产生0.85mev的4he和1.48mev的7li两个重荷电粒子,两个重荷电粒子的射程分别为9um与5um,两个重荷电粒子的总射程约相当于一个细胞大小,因此对于生物造成的辐射伤害能局限在细胞层级,同时硼制剂具有亲肿瘤性质,可高度富集于肿瘤区域,当硼制剂选择性地聚集在肿瘤细胞中,搭配适当的中子射源,便能在不对正常组织造成太大伤害的前提下,达到杀死肿瘤细胞的目的。
在中子照射前,通过体积-剂量直方图(dosevolumehistogram,dvh)统计不同体积肿瘤内的剂量分布,本实施例中dvh是利用蒙地卡罗计算器程序完成的辐射剂量计算,采用snyder头模作为计算模型,snyder头模块织成分参考icru-46号报告,并采用相应的kerma因子将热中子通量计数、快中子通量计数、光子通量计数评估结果转换为辐射剂量,剂量组成分为硼剂量、快中子剂量、热中子剂量、光子剂量等4类。其中,不同组织会有相对应的相对生物效应(relativebiologicaleffectiveness,rbe)与化合物生物效应(compoundbiologicaleffectiveness,cbe),因此等效剂量(equivalentdose)的计算公式如下:
deq=cbe×bcon×db+rbef×df+rbeth×dth+rbeγ×dγ
本实施例中计算采用的各项参数如下表所示:
利用蒙地卡罗计算器程序进行snyder头模的剂量-体积直方图评估结果,评估方法如前所述,将剂量组成分为硼剂量、快中子剂量、热中子剂量、光子剂量4类,考虑不同组织的辐射生物效应后获得之整体等效剂量。一般的,医师所给予的处方剂量为70gy-eq,亦即,组织剂量达到70gy-eq以上方可清除肿瘤组织,提高肿瘤控制率(tumorcontrolprobability);反之,若剂量不足,则可能由于肿瘤清除不完全而造成复发。
如图5所示,为两种不同种类尺寸肿瘤的体积-剂量直方图,可以看出当肿瘤直径为8cm时,只有40%体积的肿瘤组织接受到足够的处方剂量(70gy-eq),满足处方剂量的要求,其余60%体积的肿瘤组织不满足处方剂量的要求,大量剂量不足肿瘤组织将可能成为未来再复发隐患;当肿瘤直径为4cm时,100%体积肿瘤接受到高剂量辐照,满足处方剂量的要求。即,当肿瘤直径为8cm时,部分肿瘤区域未接受到处分剂量的治疗,不能达到良好的治疗效果,当肿瘤直径为4cm时,全部肿瘤区域可以接受到处分剂量的治疗,可以达到良好的治疗效果。
可见,硼中子俘获治疗对于小体积的恶性肿瘤具有良好的治愈效果,先通过高强度超声聚焦将肿瘤消融,使其尺寸缩小至直径4cm或以内,再采用硼中子俘获治疗可以将消融后变小以及残余的恶性肿瘤予以清除,此时100%的肿瘤均可接受超过处方剂量,可达到良好的肿瘤控制效果。
于本实施例中,所述预设尺寸为肿瘤直径小于4cm或肿瘤体积小于250cc。当肿瘤的尺寸为肿瘤直径小于4cm或肿瘤体积小于250cc时,称之为小尺寸肿瘤,此时,肿瘤的尺寸足够小,使用硼中子俘获治疗可以达到良好的治疗效果,而如果选择高强度聚焦超声治疗,由于肿瘤边界处可能会存在肿瘤组织与正常组织交织存在的情况,高强度聚焦超声治疗时会将治疗区域内的肿瘤组织与正常组织整体“切除”,会对人体造成无谓的伤害。
本发明中采用高强度聚焦超声治疗技术与硼中子俘获治疗技术的联用,可以先通过高强度聚焦超声治疗技术将大体积的恶性肿瘤消融变小,成为小体积的恶性肿瘤,再通过硼中子俘获治疗清除消融后的小体积的恶性肿瘤,从而有效提高大体积的恶性肿瘤治愈效果和治愈率。可见,本实施例中,造影过程和bnct治疗过程中都需要注入硼制剂。在治疗时,由于在mri造影前已经向患者体内注入了硼制剂,因此在bnct照射前,需要检测患者体内硼制剂的浓度,并与bnct的治疗方案进行比较,当满足治疗要求时,无需再次注入硼制剂。当不满足治疗要求时,需要调整治疗计划,其一可以选择补充硼制剂注入患者体内,待满足治疗要求后再进行bnct治疗;其二可以通过调整照射时间等参数以补足治疗所需处方剂量。
需要说明的是,检测患者体内硼制剂的浓度的方法可以是取患者体内血样进行检测,也可以是通过获取患者肿瘤区域发生的特定射线进行检测,如spect造影设备检测,也可以是通过mri或pet造影设备进行检测,本实施例中对于检测方法不做限定。
患者承载装置400,用于承载患者500,并与造影系统100、hifu治疗系统200、bnct治疗系统300相配合;包括治疗床410和升降装置420,升降装置420与治疗床410连接,并驱动治疗床410进行上、下、左、右等方向的摆位。患者承载装置400需通过磁兼容测试,方可在强磁场环境下工作。
具体的,升降装置420驱动治疗床410移动至造影系统100、hifu治疗系统200和bnct治疗系统300的相应位置,以使患者500可以躺在治疗床410上进行病灶区造影、超声治疗和辐射治疗过程。
控制系统,分别与造影系统100、hifu治疗系统200、bnct治疗系统300、患者承载装置400连接,用于控制各部件的动作。
控制系统用于控制各部件的动作、根据需求切换控制各部件,本领域的技术人员可以轻而易举的设计所需要的控制程序(计算机程序),控制系统属于现有技术,在此不再赘述。
于本实施例中,造影系统100、hifu治疗系统200和bnct治疗系统300设置于同一治疗室中。具体的,在治疗时,将患者500安置在治疗床410上,通过控制系统控制造影系统100、hifu治疗系统200和bnct治疗系统300的切换,即可完成肿瘤造影、肿瘤消融、肿瘤清除过程,减少了患者500的移动,可以更安全、更快速的完成肿瘤治疗过程。
于本实施例中,hifu治疗系统200设置在治疗床410上方,为上置式hifu治疗系统200,可以从上往下对患者500进行照射,完成超声治疗过程。
本实施例还提供上述超声和辐射联用的治疗系统的一种操作方法,如图6所示,包括:
s1:在患者500体内注入造影剂混合物;
s2:使用造影系统100获取患者500的造影图像,得到患者500肿瘤的位置、大小和边界;
s3:判断肿瘤大小是否小于预设尺寸,当否时,执行s4,当是时,执行s5;
s4:使用hifu治疗系统200进行超声治疗,消融大尺寸肿瘤,再执行s2步骤;
s5:使用bnct治疗系统300进行辐射治疗,清除小尺寸肿瘤;
s6:结束。
在步骤s1:在患者500体内注入的造影剂混合物,当造影系统为mri造影装置时,造影剂混合物为mri造影剂与硼制剂的混合物;当造影系统为ct造影装置和pet造影装置,或者为mri造影装置和pet造影装置时,造影剂混合物为pet造影剂与硼制剂的混合物。
在步骤s2:获取患者500的造影图像,得到患者500肿瘤的位置、大小和边界,可以是通过图像处理软件勾画出肿瘤边界得到患者500肿瘤的位置、大小和边界,也可以是通过有经验的医师勾画出肿瘤边界得到患者500肿瘤的位置、大小和边界,还可以是通过电脑人工智能(ai)方法自动判别肿瘤边界得到患者500肿瘤的位置、大小和边界。
在步骤s3:判断肿瘤大小是否达到预设尺寸,预设尺寸为肿瘤直径小于4cm或肿瘤体积小于250cc,判断过程由控制系统完成。
如图7所示,在步骤s4:进行超声治疗,消融大尺寸肿瘤,再执行s2步骤中,具体的超声步骤包括:
s41:根据肿瘤的造影图像,对肿瘤进行逐层勾边,确定肿瘤的精确位置;
s42:再根据肿瘤的位置和大小,设置高强度聚焦超声治疗参数,高强度聚焦超声治疗参数包括功率、聚焦温度等;
s43:开启信号发生器、功率放大器、换能器,产生超声波;
s44:透过换能器将超声波聚焦于肿瘤位置的其中一个区域,进行高强度聚焦超声治疗,再调整聚焦位置至肿瘤位置的其他区域,直至完成整个肿瘤区域的高强度聚焦超声治疗。
调整聚焦位置的方式可以是机械调整治疗头位置,或者是机械调整患者位置,或者是透过多阵元换能器自动跳转。
于本实施例中,在步骤s4中,还包括执行以下步骤:
s45:实时监控患者500的造影图像。
具体的,通过实时监控患者500的造影图像,医护人员可以随时观察患者500的生命体征,并可通过询问患者500的感受,确保安全。
如图8所示,在步骤s5:进行辐射治疗,清除小尺寸肿瘤中,包括:
s51:根据肿瘤尺寸制定辐射治疗计划;
s52:检测患者500体内硼浓度,并与辐射治疗计划中的硼浓度进行比对,当低于辐射治疗计划中的硼浓度时,需要调整治疗计划;
s53:开启bnct治疗系统,进行中子照射;
s54:当照射剂量达到辐射治疗计划的剂量时,停止中子照射。
需要调整治疗计划,可以选择补充硼制剂注入患者体内,待满足治疗要求后再进行bnct治疗;也可以通过调整照射时间等参数以补足治疗所需处方剂量。
于本实施例中,制定辐射治疗计划是先将中子特性输入蒙地卡罗计算器程序,并将患者500造影影像转换为蒙地卡罗计算器程序输入格式;再得到硼中子俘获治疗参数,包括治疗角度、时间、硼制剂浓度等;最后利用蒙地卡罗计算器程序计算硼中子俘获治疗治疗前的患者500体内剂量分布,将患者500体内剂量分布统计为剂量-体积直方图,直至100%体积肿瘤满足处方剂量的要求。
具体的,不同患者500或者不同种类的肿瘤所需的硼制剂浓度不尽相同,因此,每个患者500的治疗所需硼制剂浓度是不相同的。基于上述情况,患者500在注入硼制剂后,需要计算或检测出患者500体内剂量分布,确保100%体积肿瘤满足处方剂量的要求。
于本实施例中,检测患者500体内硼浓度的方式可以通过造影系统100得到的图像进行换算得到硼浓度,也可以是通过检测肿瘤区域放出的射线信号进行换算得到硼浓度。
于本实施例中,开启中子产生装置310,进行照射时,中子束经过中子慢化装置320后从中子束出口330射出,照射病灶区,直至辐射治疗完成。
具体的,整个肿瘤治疗过程包括肿瘤造影过程、超声治疗过程和辐射治疗过程,其中肿瘤造影过程和超声治疗过程可能会需要重复多次,直至肿瘤尺寸达到预设尺寸后,才可进行辐射治疗,当完成硼中子俘获治疗后,即可完成整个肿瘤治疗过程。
实施例二
本实施例与实施例一的不同在于:
于本实施例中,造影系统100和hifu治疗系统200设置于第一治疗室中,bnct治疗系统300设置于第二治疗室中。
具体的,在治疗时,当患者500通过第一治疗室中的造影系统100和hifu治疗系统200完成造影、超声治疗过程,达到肿瘤消融效果后,再将患者500转移至第二治疗室中的hifu治疗系统200进行辐射治疗过程,以达到肿瘤清除效果,同时,下一患者500可以在第一治疗室中进行肿瘤造影、超声治疗过程。可见,本方案中,不同患者500可以同时进行治疗,其中一个患者500进行超声治疗,另一个患者500进行辐射治疗,可以提高超声和辐射联用的治疗系统的利用率。
实施例三
本实施例与实施例一的不同在于:
于本实施例中,hifu治疗系统200的数量为一组,hifu治疗系统200设置在所述治疗床410下方,为下置式hifu治疗系统200,下置式hifu治疗系统200从下往上对患者500进行照射,完成超声治疗过程。
实施例四
本实施例与实施例一的不同在于:
于本实施例中,hifu治疗系统200的数量为两组,分别为上置式hifu治疗系统200和hifu治疗系统200,上置式hifu治疗系统200设置在所述治疗床410上方,从上往下对患者500进行照射,下置式hifu治疗系统200设置在所述治疗床410下方,从下往上对患者500进行照射,通过上、下两个方向的超声照射,完成超声治疗过程。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的技术人员应当理解,其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行同等替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神与范围。
- 还没有人留言评论。精彩留言会获得点赞!