一种具有近红外光响应性的纳米诊疗剂及其制备方法与流程
本发明涉及一种肿瘤靶向的纳米诊疗,其制备方法及其用途,属于纳米材料技术领域和生物医学材料领域。
背景技术:
化学药物治疗是临床上治疗癌症,尤其中晚期癌症的主要方法,是一种有效的全身性治疗手段。然而,目前多数化疗药物无特异性识别,易损伤正常细胞和组织,甚至引发全身性中毒,并且肿瘤细胞摄入药物效率低,反复给药易致肿瘤细胞产生耐药性等缺点。光热治疗是光热治疗法是利用具有较高光热转换效率的材料,将其注射入人体内部,利用靶向性识别技术聚集在肿瘤组织附近,并在外部光源(一般是近红外光)的照射下将光能转化为热能来杀死癌细胞的一种新型治疗方法。为了避免过强的激光对人体正常组织造成伤害,一般光热治疗所用近红外光强度较低,导致治疗效率变低。为了解决光热治疗无法完全杀死肿瘤细胞,一方面需要研发光热效率更高的纳米材料,以满足低光强下的高光热杀伤效果;另一方面则进行多模式联合治疗,比如光热-化疗结合,光热-气体治疗等,通过纳米光热材料的肿瘤靶向传输和多模式治疗联合来实现完全根除肿瘤细胞和组织。
气体治疗作为一种新兴的肿瘤治疗技术,主要利用具有治疗性的气体(一氧化氮(no)、一氧化碳(co)、硫化氢(h2s)、氢气(h2)等)取代传统的化疗药物。h2治疗性气体药物是在适当的浓度下,能够选择性地诱导肿瘤细胞的凋亡,同时又可以保护正常细胞,因而被视为一种“绿色”的治疗技术。然而,临床上的气体治疗的两种给药方式——直接吸入治疗性气体和注射含氢溶液,均难以控制气体的血药浓度和病灶区的有效浓度。目前还没有可控性释放氢气的纳米生物材料报道,因而开发这种智能响应氢气的前体药物结合光热治疗技术是一种极具科学创新性的研究和具有良好抗癌医用的应用前景。
技术实现要素:
本发明是为解决上述化疗和光热治疗在临床应用上的不足,提供一种特异性强、氢气可控释放、且合成工艺简单肿瘤靶向的纳米诊疗剂及其制备方法,旨在使其同时具有光热治疗和氢气治疗能力,使两种治疗方法优势互补。
所述的诊疗剂包括有纳米载体、担载在所述的纳米载体上的并能在光作用下释放出来的生物活性气体和用于照射所述的纳米载体的光。
优选的,所述的纳米载体为基于具有近红外(780-950nm)响应的纳米载体,通过化学键或吸附作用担载具有生物活性的气体,形成近红外光控气体释放的智能纳米诊疗剂。
优选的,所述的近红外光响应的纳米载体为贵金属纳米颗粒或有机类染料,贵金属纳米颗粒包括但不限于纳米立方钯、钯纳米片、纳米铂、纳米铑,有机类染料包括但不限于普鲁士蓝纳米颗粒、钯卟啉,所述贵金属纳米颗粒或有机类染料的颗粒尺寸优选为20-200nm。
进一步的,所述的生物活性气体为氢气、一氧化碳、一氧化氮、硫化氢,其中优选为氢气。
一种采用上述肿瘤靶向的纳米诊疗剂作为制备治疗肿瘤的制剂的应用。
所述治疗肿瘤的制剂是将合成的纳米诊疗剂制备成注射液体,浓度范围2mg/ml-10mg/ml,有效注射剂量为8mg/kg-50mg/kg治疗使用方法为尾静脉注射,通过静脉注射后,纳米诊疗剂能够1-2h后靶向聚集于肿瘤区域,且具有近红外响应性释放的活性气体的性能。因而治疗窗口时间约为药物注射后1-4h左右。治疗使用的光波长为近红外1区(780nm-960nm),光强在2.0w/cm2以下,光照时间控制在5-12min。
所述纳米诊疗制剂具有优异的光热性能,其中光热转化效率为20%-70%;所述的纳米诊疗剂在生物体内的肿瘤区域富集后具有光热成像(pti)和光声成像(pai)信号。
一种上述肿瘤靶向的纳米诊疗剂的制备方法,其包括如下步骤:
首先制备具有近红外吸收的纳米载体;然后采用鼓泡加压法,将治疗性气体通过化学键合或化学吸附作用装载于所述纳米载体中,以得到所述纳米诊疗剂。
相较于现有技术,本发明的纳米诊疗剂,通过采用生物相容性好且无毒的纳米颗粒为载体,并高效吸附具有生物学效应的气体,以构建一种集气体治疗和治疗监控于一体的纳米诊疗剂。本发明的纳米诊疗剂具有肿瘤部位近红外响应性的释放气体的特性,因此,采用上述纳米诊断剂治疗肿瘤是一种无创、绿色的治疗方式。本发明的纳米诊疗剂具有光热和光声成像信号,从而能够利用其特性来实时而有效地监控肿瘤中纳米药物的蓄积,以实现气体在体内可控释放和释放监控的一体化。此外,本发明的纳米诊疗剂合成工艺简单,且合成效率高。进一步地,由于药物合成的原料低廉,从而降低生产成本,因而适合大规模生产。
附图说明
图1是本发明的纳米诊疗剂的sem照片。
图2是本发明纳米诊疗剂的光热转化效率图。
图3是本发明的纳米诊疗剂通过近红外响应性释放h2的结果图。
图4是本发明的纳米诊疗剂通过作用不同细胞的毒性测试结果图.
图5是本发明的pdh纳米颗粒通过作用肿瘤细胞后的响应性释放h2的示踪图。图6是本发明的纳米诊疗剂通过作用正常细胞和肿瘤细胞后的ros示踪图。
图7是本发明的纳米诊疗剂在生物水平上的肿瘤治疗效果的评价图。
图8是本发明的纳米诊疗剂在生物体内光热成像效果和icp图。
图9是本发明的纳米诊疗剂在生物体内的的光声效果图。
图10是小鼠经过不同模式治疗22天后的主要的器官(心、肝、脾、肺、肾)的生理组织切片图。
具体实施方式
为详细说明本发明的结构特征、技术手段以及所实现的目的及效果,以下结合实施方式并配合附图进行详细说明。
请参阅图1至图2,本发明的一较佳实施方式的纳米诊疗剂的合成示意图及合成流程图。所述纳米诊疗剂的制备方法包括以下步骤:
步骤1,制备纳米立方钯。
具体的,将na2pdcl4,kbr,poly(vinylpyrrolidone)(pvp)和l-ascorbicacid(aa)在水溶液中混合,并在适当的温度反应一段时间。随后用100kda的超滤管超滤离心、清洗,以得到所述pd纳米颗粒。
所述na2pdcl4,brk,poly(vinylpyrrolidone)(pvp)和l-ascorbicacid(aa)为本领域制备pd纳米颗粒常用的化学原料,均可从试剂网上订购。
所述反应温度为60-90℃,反应时间为2-6h,优选的反应温度为70-80℃,反应时间为3-4h。经超滤离心后得到的产物用水洗。将清洗后得到的所述pd纳米颗粒溶解于去离子水中,以得到pd纳米颗粒的水溶液。
步骤2,在所述pd纳米颗粒中充入纯净的氢气鼓泡,以得到pdh纳米颗粒。
在本实施例中,所述pdh纳米颗粒包括pvp保护层和pdh纳米颗粒核心。
所述pd以及pdh纳米颗粒的粒径均为20-60nm。
所述纳米诊疗剂中的pd的载氢量h:pd(原子比)为0.1-0.5。
可以理解的,当通入氢气的压力越大,其pd负载氢气量越大,但是常温常压下h/pd是0.2-0.3,并具有很好的稳定性。
可以理解的,本发明的纳米诊疗剂具有被动靶向肿瘤输运,在肿瘤部位响应释放h2及pti和pai成像监测。本发明的pdh纳米颗粒能够在肿瘤部位蓄积并在近红外环境下响应性释放活性h2气体和产生热量,以杀死肿瘤细胞且抑制肿瘤细胞的生长。此外,pdh和pd纳米颗粒具备光热成像(pti)和光声成像(pai)功能,因此通过建立pti和pai信号强度和纳米药物在肿瘤部位蓄积的定量关系,从而实现通过pti和pai信号来实时而有效地监控纳米药物的肿瘤部位蓄积治疗。因此,本发明的纳米诊疗剂实现了h2气体的响应性可控释放,同时实现光热和光声成像监测h2的释放,进而实现肿瘤的精确定位和治疗。
可以理解的,上述制备得到的肿瘤靶向的纳米诊疗剂能够作为制备治疗肿瘤的制剂的应用。
所述治疗肿瘤的制剂为所述纳米诊疗制剂在所述肿瘤环境中近红外响应性释放的活性h2气体和产生热量。
可以理解的,所述h2气体够抑制癌细胞生长并杀死癌细胞,因此,本发明的纳米诊疗剂治疗肿瘤是一种无创、低毒、绿色的治疗方式。
所述纳米诊疗制剂作为pti和pai成像信号。
本发明肿瘤靶向的纳米诊疗剂的制备方法,其合成原料价格低廉易得,制备工艺简单、易于大规模生产。此外,利用本发明制备方法制得的纳米诊疗剂具有良好分散性和稳定性、良好生物相容性、粒径和优异封装稳定性、近红外响应性释放治疗性气体以及药物蓄积的影像监测功能。
下面通过具体实施例对本发明做进一步的说明。
实施例1
(1)制备pd纳米颗粒。
取11ml超纯水于圆底单口烧瓶中,加入pvp(106.4mg),aa(60mg),kbr(301mg)和na2pdcl4(56.31mg),在80℃油浴中回流加热并搅拌3小时。待冷却到室温后,用截留分子量100kda的的超滤管超滤清洗三四次,最后将得到的颗粒分散于去离子水中,即得到pd纳米颗粒的水溶液。避光密封保存。
(2)制备pdh纳米颗粒。
取两个20ml的西林瓶,一个里面加入一定量的pd纳米颗粒溶液,另一个加入一定量的硼氢化钠粉末和ph为5的pbs溶液后用橡胶塞封口。用毛细管将第二个瓶中产生的氢气导入第一个pd纳米颗粒溶液中鼓泡10分钟,此过程中可见到pd溶液颜色变深,即得到pdh纳米颗粒溶液。最后用橡胶塞将第一个瓶子密封后避光保存。
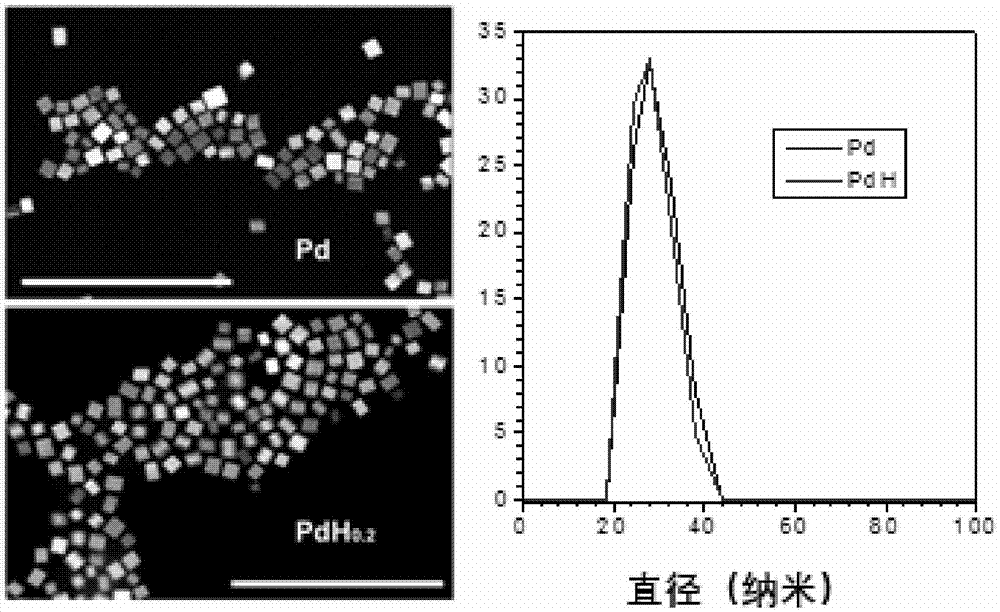
图1展示了制得的pd和pdh纳米颗粒sem照片。结果表明,两种纳米颗粒的分散性很好,而且尺寸均一,大小为20-40nm。
实施例2
(1)制备普鲁士蓝纳米颗粒
取330mg六氰合铁酸四钾(1mmol),9.6g聚乙烯吡咯烷酮(分子量为28000-55000),100ml稀盐酸(0.01mol/l)加入250ml的单口烧瓶中,超声分散均匀后,升温至80度,然后保温反应1h。待反应溶液冷却至室温后,离心得到产物,用乙醇清洗3次,即得所制备的普鲁士蓝纳米颗粒。
(2)制备羰基锰@普鲁士蓝纳米诊疗剂
取20mg所合成的普鲁士蓝纳米颗粒用无水乙醇分散成4mg/ml的溶液,然后向其中加入22mg羰基锰(mn2(co)10,作为co气体前药),将溶液避光并振荡搅拌分散至羰基锰完全溶解后,放置真空干燥箱中,减压除去大约一半体积的无水乙醇。最后将余下的溶液进行离心,用无水乙醇清洗一次,用去离子水清洗2次即得到羰基锰@普鲁士蓝纳米诊疗剂。
实施例3
一种具有近红外光响应性的纳米诊疗剂的近红外光热效率和气体释放性能:将实施例1制得的pdh纳米颗粒分散在水溶液中,在808激光功率照射下测量其升温降温曲线,由光热转化效率公式算出其光热转化效率,图2展示了光热转化效率测量曲线,算出转化下率较高,可以看出,在红外线的照射下,随着温度的上升,h2释放加速,而pdho2的释放效率明显大于pd的释放效率。
在808激光功率分别为1w/cm2,0.5w/cm2和0.2w/cm2条件下,测量溶液的uv随着时间的变化曲线,并根据其235nm处的吸收峰变化通过朗伯-比尔(lambert-beer)定律来检测h2的释放情。图3ab展示了实施例1制得的肿瘤靶向的纳米诊疗剂在近红外照射下通过自身的紫外吸收变化。将实施例1制得的pdh纳米颗粒水溶液,在808激光功率分别为1w/cm2,0.5w/cm2和0.2w/cm2条件下,用氢气检测电极测量随着时间的变化来检测h2的释放情况。图3cd展示了实施例1制得的肿瘤靶向的纳米诊疗剂在近红外照射下通过氢气电极测得氢气释放情况。将实施例1制得的pdh纳米颗粒浓溶液,在808激光功率分别为1w/cm2,0.5w/cm2和0.2w/cm2条件下,测量浓溶液的xrd随着时间的变化谱图,并根据其晶格大小变化通过布拉格方程和晶格间距方程来检测h2的释放情况。图3ef展示了实施例1制得的肿瘤靶向的纳米诊疗剂在近红外照射下通过xrd晶格间距变化响应性释放h2的结果图。
实施例4
一种具有近红外光响应性的纳米诊疗剂的细胞水平的抗癌性能:
将含有mb的dmem培养基在96孔板中培养肿瘤细胞将其染色,再将实施例1制备的pdh纳米颗粒在dmem培养基中配成一定的药物浓度,并于每孔中加入100ul。接着,96孔板的一部分用808激光器照射(1w/cm2),而另一部分在黑暗处作为对照。最后用酶标仪实时检测mb在664nm处的吸收变化,并根据亚甲基蓝664nm处在酶标仪上的标准曲线做出其随时间氢气的释放趋势。图5展示了实施例1制得的肿瘤靶向的纳米诊疗剂通过作用于经过mb染色过的肿瘤细胞后的响应性释放h2的变化曲线,从图中可以看出,在照射情况下,细胞内h2释放的效率明显的高于没有光照射的情况。
将hela和hek-293t分别细胞种植在96孔板中,并在培养箱中培养。在每孔100μl培养基中孵育24小时后,用含有pdh0.2纳米晶体的新鲜培养基替换培养基,终浓度为12.5-200μg/ml。温育1小时后,用1w/cm2的nir激光照射浓度为200μg/ml和100μg/ml的孔(作为实验组)。其余的保持在黑暗中(作为对照组)。然后,向每个孔中加入10μldcfh-da,并使用多模式酶标仪(488nm激发波长,525nm发射波长)监测。此外,没有pdh0.2纳米晶体的孔用作空白对照(背景)。实验组与背景的比值以获得归一化的ros值,用于指示细胞内ros水平的变化。图6展示了实施例1制得的肿瘤靶向的纳米诊疗剂通过作用肿瘤细胞和正常细胞后的清除ros的趋势图。
可以看出,本发明的纳米诊疗剂在不同功率的近红外照射下均能够响应性释放h2,并且随激光功率的增大,其释放h2的速率也加快。而且也证明了细胞内的氢气释放过程以及氢气清除ros的特性。因此,这种近红外响应性释放h2气体从而能够在肿瘤区域富集h2的特性作为本发明纳米诊疗剂的最大新颖点,从而实现肿瘤区域的定点响应性h2释放,进而有效地提高h2气体治疗的效率。
将实施例1制备的pdh调成不同浓度(12.5ug/ml、25ug/ml、50ug/ml、100ug/ml,200ug/ml),将不同浓度的pdh纳米药物分别与多种细胞共培养3h后,用不同功率的808纳米激光去照射,每孔10分钟。接着再继续培养24h。同时评价不同浓度材料对细胞的毒性实验。所述多种细胞包括正常细胞(hek-293tcell)和多种肿瘤细胞。所述肿瘤细胞采用鼠源黑色素瘤细胞(b16cell)、乳腺癌细胞(4t1cell)、以及人宫颈癌细胞(helacell)。图4a展示了实施例1制备的肿瘤靶向的纳米诊疗剂通过作用hela细胞的毒性测试结果图。图4b展示了实施例1制备的肿瘤靶向的纳米诊疗剂通过作用hek-293t细胞的毒性测试结果图。
实施例5
一种具有近红外光响应性的纳米诊疗剂在肿瘤模型小鼠中的联合治疗性能:首先建立4t1荷瘤小鼠模型,肿瘤的平均体积达到约100mm3后,将小鼠随机分成六组:模式一注射psb缓冲溶液(对照组),模式二注射psb缓冲溶液并加激光(对照组),模式三注射pd纳米药物(对照组),模式四注射pd纳米药物并加激光(实验组),模式五注射pdh纳米药物(实验组)以及模式六注射pdh纳米药物加激光(实验组)。将浓度为100ul2mg/ml的pbs、pd及pdh分别通过尾静脉注入肿瘤小鼠体内,在第1,2,3,8天的时候用808nm激光照射肿瘤部位,连续培养22天后,观测肿瘤小鼠肿瘤体积和小鼠体重的变化。从图7中可以看出,单独氢气治疗和光热治疗都有一定的效果,但是氢热联合治疗的效果异常明显。而且药物对小鼠基本没有毒副作用。
实施例6
一种具有近红外光响应性的纳米诊疗剂的肿瘤靶向性能和光热成像及光声信号性能:
建立4t1小鼠皮下瘤模型。在肿瘤的平均体积达到约100mm3后,给荷瘤小鼠注射pdh纳米晶体。选择18只小鼠,并在注射药物后1小时,2小时,4小时,12小时,24小时和48小时分别解剖三只小鼠。精确称量并记录每只小鼠的心脏,肝脏,脾脏,肺脏,肾脏和肿瘤的重量。然后将这些器官用王水消化,加热至干燥并用去离子水加入一定体积。通过电感耦合等离子体-原子发射光谱法测定pd元素的定量分析。从图8中可以看出,药物在肝脏量最多,其次是脾脏和肿瘤。说明了纳米药物在肿瘤部位有不错的蓄积。
建立4t1小鼠皮下瘤模型。并在肿瘤的平均体积达到约100mm3后,将小鼠随机分成三组。通过尾静脉向荷瘤小鼠注射100μlpbs(组1)或10mg/kgpd纳米晶体(组2)或10mg/kgpdh纳米晶体(组3)。注射2小时后,用1w/cm2的808nm激光照射小鼠肿瘤部位6分钟。在照射过程中,我们利用红外热像仪监测肿瘤部位的温度变化。从图8中可以看出,我们的纳米药物具有很好的光热效果,而且注射pdh纳米药物的光热强于pd纳米药物。
建立4t1小鼠皮下瘤模型。通过尾静脉注射pdh纳米药物(100μl,2mg/ml)。在注射前和注射后不同时间点(1小时,2小时,4小时,8小时,12小时,24小时,36小时和48小时)使用多光谱光声层析成像系统在波长680纳米下获取体内光声图像。并使用多光谱光声层析成像软件提取肿瘤区域的平均光声信号。从图9中可以看出,pdh纳米药物具有很好的肿瘤蓄积效果,而且在2小时的时候达到最大值,随着时间延长至48小时仍具有很好的蓄积。
实施例7
一种具有近红外光响应性的纳米诊疗剂的生物安全性:体外表征:记录模型小鼠治疗过程中体重变化曲线;体内表征:待模型小鼠治疗结束后解剖,取其主要器官(心、肝、脾、肺、肾)进行生理组织切片测试。注射实施例1制备的pd和pdh的小鼠的体重无明显变化,这表明本发明的纳米诊疗制剂对小鼠没明显的毒副作用。
图10展示了小鼠经过不同模式治疗22天后的主要的器官(心、肝、脾、肺、肾)的生理组织切片图。从切片测试结果中可以看出,注射实施例1制得的纳米诊疗制剂并没有对小鼠的主要器官(心、肝、脾、肺、肾)造成明显损伤,这表明本发明的纳米诊疗制剂对正常组织没有造成明显的毒副作用。
本发明提供的纳米诊疗剂通过以具有较强氢气吸附能力的钯纳米立方晶体为载体,并将过氢气鼓泡吸附于钯纳米颗粒中形成pdh纳米立方晶体。pdh纳米晶体显示出宽的uv-nir吸收光谱,具有更强的nir吸收,并且表现出增强的nir-光热效应,从而表现出pai引导的nir控制的氢气释放和热量产生。uv,xrd和pt微电极监测结果一致表明,nir辐照可以触发pdh0.2纳米晶体的氢释放,表现出显着更高的生物还原性和显着的稳态调节功能。pdh0.2纳米晶体在体外和体内表现出氢热疗法的选择性,协同性和保护作用。最后,本发明的纳米诊疗剂能够实现针对恶性肿瘤的无创气体治疗与成像监控,且具有高效低毒的诊疗效果。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,以上实施方式仅是用于解释权利要求书。然本发明的保护范围并不局限于说明书。任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可轻易想到的变化或者替换,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!