一种获取病变数据的方法、识别病变方法及计算机设备与流程
本发明属于消化道早癌检测的领域,尤其涉及一种获取病变数据的方法、识别病变方法及计算机设备。
背景技术:
早癌的识别是通过内镜筛出、检出可疑病变,最终以病理识别作为标准。胃肠镜等消化疫病的图像识别虽有了很大的发展,但要确定肿瘤的性质,仍然主要依赖病理学识别。病理检查是识别肿瘤最标准最可靠的一种方法。它是将患病器官的分泌物制成涂片,或直接取下病灶小块组织制成切片或印片,放置显微镜下观察其细胞形态、结构等,确定肿瘤的性质。
但是这样的识别时间可能会比较长,如果可以直接通过内镜镜下判断预测病理结果,那么可以提前识别病理结果,对早癌的诊治有深远的意义。但目前病理指导后续治疗过程中存在着如何将病理识别与内镜下病变进行位置对应的难题。
技术实现要素:
本发明所要解决的技术问题是:目前的早癌识别没有将病理识别与内镜下病变进行位置对应,使得没有办法提前精确地知道病变的位置。
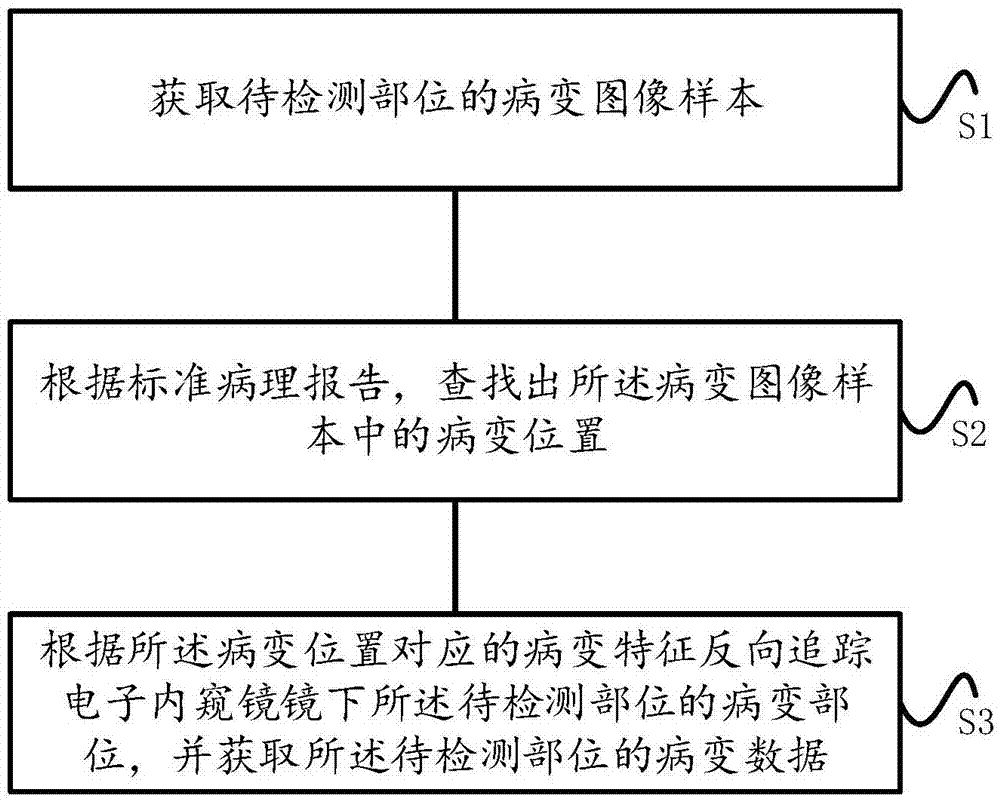
为解决上面的技术问题,本发明提供了一种获取病变数据的方法,该方法包括:
s1,获取待检测部位的病变图像样本;
s2,根据标准病理报告,查找出所述病变图像样本中的病变位置;
s3,根据所述病变位置对应的病变特征反向追踪电子内窥镜镜下所述待检测部位的病变部位,并获取所述待检测部位的病变数据。
本发明的有益效果:通过上述的方法,结合病变图像样本和标准病理报告,通过反向追踪的路径可以在电子内窥镜镜下可以精确地查找到病变的位置,从而可以大大地提高了提前检测出病变的概率。
进一步地,所述s1中包括:
s11,对所述待检测部位进行nbi高清内镜观测,并采集所述待检测部位的病变组织样本;
s12,对所述病变组织样本进行esd切除,得到离体病变组织;
s13,利用透光显像法采集所述离体病变组织的所述病变图像样本。
上述进一步地有益效果:通过对病变组织样本进行切除,采用透光显像法进行采集病变图像样本,这样可以提高采集到样本的精度,提高后期识别病变的精度。
进一步地,所述s3中包括:根据所述病变位置对应的病变特征,同时根据所述离体病变组织的血管走向或组织形态反向追踪电子内窥镜镜下所述待检测部位的病变精确位置,并根据所述病变精确位置所述待检测部位的病变数据。
上述进一步地有益效果:通过在离体样本中检测出病变组织位置,查找该位置对应的病变特征,根据这个病变特征,再反向追踪该病变特征在电子内窥镜镜下病变组织的病变数据。
进一步地,所述病变数据包括消化道病变数据、鼻病变数据、咽喉病变数据、肺部病变数据和肾部病变数据。
本发明还涉及一种基于智能识别模型的识别病变方法,该识别病变方法包括:
a1,获取至少1000个待检测部位的病变数据,根据所述病变数据对fasterrcnn网络进行训练,得到标准病变识别模型;
a2,利用所述标准病变识别模型对新的待检测部位的病变数据进行识别,根据识别结果判断出新的待检测部位的病变状况。
本发明的有益效果:通过多个检测到的病变数据,将这些数据进行fasterrcnn网络训练,得到标准病变识别模型,再用得到的这个识别模型进行前期检测,这样不但实现了人工智能的检测目的,提高了检测的效率和检测的准确率。
进一步地,所述步骤a1包括:
a11,获取至少1个待检测部位的病变数据,根据所述病变数据对fasterrcnn网络进行训练,得到病变识别模型;
a12,获取新的病变数据,利用所述新的病变数据对所述病变识别模型进行训练,并调整所述病变识别模型的模型参数;
a13,判断所述病变识别模型输出的识别结果与由标准病理报告得到的结果是否在预设误差阈值内;
a14,若在,则将所述病变识别模型设定为标准病变识别模型。
进一步地,当所述病变识别模型输出的识别结果与由标准病理报告得到的结果是否在预设误差阈值内时,则重复上述步骤a12-a13,直到所述病变识别模型输出的识别结果与由标准病理报告得到的结果在预设误差阈值内时,结束。
本发明还涉及一种计算机设备,该计算机设备包括:处理器、存储器及存储在所述存储器上并可在所述处理器上运行的计算机程序,其特征在于,所述处理器执行所述程序时实现上述各项基于智能识别模型的识别病变方法的步骤。
本发明的有益效果:通过多个检测到的病变数据,将这些数据进行fasterrcnn网络训练,得到标准病变识别模型,再用得到的这个识别模型进行前期检测,这样不但实现了人工智能的检测目的,提高了检测的效率和检测的准确率。
附图说明
图1为本发明的一种获取病变数据的方法的流程图;
图2为本发明的一种基于智能识别模型的识别病变方法的流程图;
图3为本发明的一种计算机设备的示意图。
具体实施方式
以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
如图1所示,本发明实施例1提供的是一种获取病变数据的方法,该方法包括:
s1,获取待检测部位的病变图像样本;
s2,根据标准病理报告,查找出所述病变图像样本中的病变位置;
s3,根据所述病变位置对应的病变特征反向追踪电子内窥镜镜下所述待检测部位的病变部位,并获取所述待检测部位的病变数据。
在本实施例1中是先对待检测部位进行高清内镜和nbi状态的病变检测,获取到一些病变图像样本,然后根据目前现有的标准病理报告,对这些病变图像样本进行分析,查找出病变位置,最后通过这些病变位置对应的病变特征,反向追踪出电子内窥镜镜下其待检测部位的病变部位,获取到这些病变数据。在本实施例1中结合病变图像样本和标准病理报告,通过反向追踪的路径可以在电子内窥镜镜下可以精确地查找到病变的位置,从而可以大大地提高了提前检测出病变的概率。
可选地,在另一实施例2中所述s1中包括:
s11,对所述待检测部位进行nbi高清内镜观测,并采集所述待检测部位的病变组织样本;
s12,对所述病变组织样本进行esd切除,得到离体病变组织;
s13,利用透光显像法采集所述离体病变组织的所述病变图像样本。
需要说明的是,在本实施例2中是在上述实施例1的基础上更进一步改进得到的,在上述实施例2中的步骤s1中是先对待检测部位进行nbi高清内镜观测,并采集该待检测部位的病变组织,再将病变组织进行esd切除,得到离体病变组织,然后利用离体组织标本“透光显像法”,协助肉眼定位,采集标本的图像,得到病变图像样本。
在本实施例2中通过对病变组织进行切除,采用透光显像法进行采集病变图像样本,这样可以提高采集到样本的精度,提高后期识别病变的精度。
可选地,在另一实施例3中所述s3中包括:根据所述病变位置对应的病变特征,同时根据所述离体病变组织的血管走向或组织形态反向追踪电子内窥镜镜下所述待检测部位的病变精确位置,并根据所述病变精确位置所述待检测部位的病变数据。
需要说明的是,本实施例3中是在上述实施例2的技术上进一步改进得到的,是将根据病变位置对应的病变特征,以及根据离体病变组织的血管走向或组织形态反向追踪电子内窥镜镜下该待检测部位的病变数据。
在本实施例3中是通过在离体样本中检测出病变组织位置,查找该位置对应的病变特征,根据这个病变特征,再反向追踪该病变特征在电子内窥镜镜下病变组织的病变数据。
可选地,在另一实施例4中所述病变数据包括消化道病变数据、鼻病变数据、咽喉病变数据、肺部病变数据和肾部病变数据。
如图2所示,本发明实施例5提供的是一种基于智能识别模型的识别病变方法,该识别病变方法包括:
a1,获取至少1000个待检测部位的病变数据,根据所述病变数据对fasterrcnn网络进行训练,得到标准病变识别模型;
a2,利用所述标准病变识别模型对新的待检测部位的病变数据进行识别,根据识别结果判断出新的待检测部位的病变状况。
需要说明的是,在本实施例5中是将前面实施例1-4中获取得到的待检测部位的病变数据,根据获取得到的这些病变数据使用人工智能深度学习网络进行训练,标准病变识别模型。在实施例5中人工智能深度学习网络,可以是fasterrcnn网络,包括候选窗口网络(regionproposalnetworks,rpn)和快速区域卷积神经网络(fastregion-basedconvolutionalneuralnetworks,frcn),该网络将rpn网络和fastrcnn网络结合到了一起,将rpn获取到的proposal直接连到roipooling层,是一个cnn网络实现端到端目标检测的框架。
fasterrcnn的主要贡献是设计了提取建议区域的网络regionproposalnetwork(rpn)。代替了费时的selectsearch,使检测速度大为提高。rpn的网络结构类似于fr-cnn,连接与最后卷基层输出的featuremap,具有一个roi层,两个输出层,一个输出滑窗为建议区域的概率,另一个输出bbox回归的offset。其训练方式也类似于fr-cnn。注意:rpn与fr-cnn共用卷积层。
应当理解的是,本发明实施例所称的病变,包括但不限于消化道病变、鼻病变、咽喉病变、肺部病变和肾部病变。相对应的,训练模型中使用的样本数据可以是消化道检测图像、鼻腔检测图像、咽喉检测图像、肺部检测图像和肾部检测图像等。为方便描述,在本发明的下述各实施例中,以消化道检测为例进行描述,但本领域技术人员可以理解,下述的各实施例也可以应用到其他病变中。
在本实施例5中通过多个检测到的病变数据,将这些数据进行fasterrcnn网络训练,得到标准病变识别模型,再用得到的这个识别模型进行前期检测,这样不但实现了人工智能的检测目的,提高了检测的效率和检测的准确率。
可选地,在另一实施例6中所述步骤a1包括:
a11,获取至少1000个待检测部位的病变数据,根据所述病变数据对fasterrcnn网络进行训练,得到病变识别模型;
a12,获取新的病变数据,利用所述新的病变数据对所述病变识别模型进行训练,并调整所述病变识别模型的模型参数;
a13,判断所述病变识别模型输出的识别结果与由标准病理报告得到的结果是否在预设误差阈值内;
a14,若在,则将所述病变识别模型设定为标准病变识别模型。
需要说明的是,在本实施例6中在上述实施例5的基础上进一步的改进,在本实施例6中是将病变数据对fasterrcnn网络进行训练,得到病变识别模型,再次获取其他的病变数据对这个模型进行训练,调整这个模型的参数,使得这个模型更加准确,再将这个模型识别结果和根据标准病理报告得到的结果进行参数的调整,使得这个模型检测更加精确。
可选地,在另一实施例7中所述a1中还包括:当所述病变识别模型输出的识别结果与由标准病理报告得到的结果是否在预设误差阈值内时,则重复上述步骤a12-a13,直到所述病变识别模型输出的识别结果与由标准病理报告得到的结果在预设误差阈值内时,结束。
如图3所示,本发明实施例8提供的是一种识别计算机设备,该计算机设备包括:处理器、存储器及存储在所述存储器上并可在所述处理器上运行的计算机程序,其特征在于,所述处理器执行所述程序时实现实施例5-7中所述方法的步骤。
利用本实施例8中提供的识别计算机设备识别病变的准确率,能够基本达到医生人工识别的准确率,以胃癌举例,医生判别癌症的准确率平均为84%,人工智能识别模型的准确率为82.5%,基本达到医生的水准。本发明实施例依靠深度学习建立的病变识别模型,为经验不足的医师提供辅助指导,更进一步为科研教学提供图像和数据支撑,尤其对内镜诊断技术在基层医疗的推广具有影响深远。
且在本实施例8中通过多个检测到的病变数据,将这些数据进行fasterrcnn网络训练,得到标准病变识别模型,再用得到的这个识别模型进行前期检测,这样不但实现了人工智能的检测目的,提高了检测的效率和检测的准确率。
在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!