AmurensinH衍生物在治疗和预防慢性阻塞性肺疾病中的应用的制作方法
本发明涉及生物医药领域,具体涉及一类amurensinh(7,8-脱氢葡萄藤戊素)衍生物或其医学上可接受的盐,及含有该衍生物或其医学上可接受的盐的药用组合物,在治疗和/或预防慢性阻塞性肺疾病中的应用。
背景技术:
慢性阻塞性肺疾病(chronicobstructivepulmonarydisease,copd)是一种以不完全可逆气流受限为特征的呼吸系统疾病,具有很高发病率、致残率和死亡率,全球40岁以上发病率已高达9%-10%,而且仍呈逐年增高趋势,已严重危害全球人类健康。
copd气流受限呈进行性发展,与气道和肺脏对有毒颗粒或气体的异常慢性炎性反应有关。慢性气道炎症是copd的重要特征,研究表明气道炎症与copd气流受限程度呈正相关,copd病理进程伴随着持续的慢性气道炎症,吸入有毒气体、颗粒物或继发性肺内细菌、病毒感染等多种易感因素可激活呼吸道内炎症反应级联,并产生大量炎性因子、趋化因子和酶类等,导致肺部组织的损伤和破坏。copd气道炎症涉及多种细胞和非细胞成分之间的相互作用,主要包括气道上皮细胞、中性粒细胞、嗜酸性粒细胞、巨噬细胞、淋巴细胞等。在炎症反应过程中,致炎因子引起局部血管扩张、毛细血管通透性增加,白细胞浸润,产生白三烯、细胞因子等炎症介质;炎症介质之间、炎症介质与炎性细胞之间以及炎性细胞之间相互作用,使组织或细胞进一步损伤,加重炎症反应,延长炎症过程。因此,控制气道炎症是copd临床治疗的必要手段之一,然而,迄今为止,仍没有理想的药物用于copd气道炎症的治疗。皮质激素类抗炎药的吸入疗法是当前临床一致推荐用于copd气道炎症治疗的用药方案,但是,研究发现,皮质激素吸入用于气道炎症治疗存在抗药性,70%-80%的患者吸入皮质激素治疗病情未见显著改善。皮质激素长期使用存在较多的问题,显著增加感染性肺炎等不良反应发生风险。而且,而临床上应用的非甾体类抗炎药也存在引发心脏病或全身凝血障碍性疾病等不良反应问题。因此,寻找更为安全有效的抗气道炎症药物仍是当前copd炎症治疗的重要任务。
amurensinh(7,8-脱氢葡萄藤戊素)衍生物是从民间药用植物山葡萄(vitisamurensis)根中分离得到的一个具有苯并呋喃环的白藜芦醇二聚体化合物。药理研究发现,其该化合物具有显著的抗炎活性以及显著的抗copd气道炎症、改善copd小鼠肺组织炎症病理损伤的作用,而且该天然产物活性强、毒性较小,是一个具有深入研究价值的活性先导化合物。因此,为获得更为安全有效的活性化合物,我们以amurensinh为先导化合物,对其结构进行优化改造,获得一系列衍生物。进一步系统的药理实验结果显示,该类衍生物具有显著的抗炎活性和治疗copd气道炎症的作用,进一步的研究发现,该衍生物在copd中的应用研究迄今未见文献报道。本专利涉及此类化合物在治疗和/或预防慢性阻塞性肺疾病中的应用。
技术实现要素:
为了克服现有技术的不足,本发明要解决的技术问题是提供一类amurensinh衍生物或其组合物在制备用于预防、治疗或辅助治疗慢性阻塞性肺疾病的药物和/或保健品中的应用。
本发明的目的之一在于提供一类如通式(i),(ia),(iaa),(iab),(ib)及(ii),(iia),(iiaa),(iiab),(iib),(iic)所示的amurensinh衍生物及其药效学上可接受的盐,在制备用于预防、治疗或辅助治疗慢性阻塞性肺疾病的药物和/或保健品中的应用。
本发明的另一个目的在于提供一种药物组合物,其中包括至少一个如通式(i),(ia),(iaa),(iab),(ib)及(ii),(iia),(iiaa),(iiab),(iib),(iic)所示的amurensinh衍生物及其药学上可接受的盐,在制备用于预防、治疗或辅助治疗慢性阻塞性肺疾病的药物和/或保健品中的应用。
本发明的第三方面是提供第一方面所述衍生物的制备方法。
为实现本发明上述目的,获得更好的药效学特征以及更小毒性的药物候选物,本发明以amurensinh为先导化合物,通过合成半合成及结构修饰方法合成了一系列amurensinh衍生物,并研究了该类化合物抗炎活性的构效关系,尤其是在治疗慢性阻塞性肺疾病方面的应用。
具体而言,本发明涉及一类amurensinh衍生物在制备治疗和/或预防慢性阻塞性肺疾病产品中的应用,其特征在于:所述结构如通式(i)和(ii)所示:
其中,r1选自h、
r9选自h、
r6、r7、r8、r14、r15、r16、r17、r18、r19、r20各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
r3、r4、r5、r11、r12、r13各自独立地选自氢、羟基、硝基、氰基、氨基、羧基、苯基、甲胺基、二甲胺基、c1-6的烷基、c1-6的烷氧基、c1-6的酰基、c1-6的酰氧基、c1-6烷氧酰基、c2-6不饱和烷基、c3-6环烷基、c1-6的烷硫基、f、cl、br、i、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(i)所示的化合物包括,但不限定于通式(ia)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(ia)所示:
其中,r4、r5各自独立地选自氢、羟基、硝基、氰基、氨基、羧基、苯基、甲胺基、二甲胺基、c1-6的烷基、c1-6的烷氧基、c1-6的酰基、c1-6的酰氧基、c1-6烷氧酰基、c2-6不饱和烷基、c3-6环烷基、c1-6的烷硫基、f、cl、br、i、glu、so3h、po3h2;
r6、r7、r8、r17、r18各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(ia)所示的化合物包括,但不限定于通式(iaa)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(iaa)所示:
其中,r6、r7、r8、r17、r18各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(ia)所示的化合物包括,但不限定于通式(iab)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(iab)所示:
其中,r6、r7、r8、r17、r18各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(i)所示的化合物包括,但不限定于通式(ib)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(ib)所示:
其中,r6、r7、r8、r19、r21各自独立地选自c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(ii)所示的化合物包括,但不限定于通式(iia)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(iia)所示:
其中,r12、r13各自独立地选自氢、羟基、硝基、氰基、氨基、羧基、苯基、甲胺基、二甲胺基、c1-6的烷基、c1-6的烷氧基、c1-6的酰基、c1-6的酰氧基、c1-6烷氧酰基、c2-6不饱和烷基、c3-6环烷基、c1-6的烷硫基、f、cl、br、i、glu、so3h、po3h2;
r14、r15、r16、r17、r18各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(iia)所示的化合物包括,但不限定于通式(iiaa)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(iiaa)所示:
r14、r15、r16、r17、r18各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(iia)所示的化合物包括,但不限定于通式(iiab)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(iiab)所示:
r14、r15、r16、r17、r18各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(ii)所示的化合物包括,但不限定于通式(iib)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(iib)所示:
其中,r14、r15、r16、r19、r22各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
根据本发明,优选的通式(ii)所示的化合物包括,但不限定于通式(iic)所示的化合物,及其药学上可接受的盐的应用,其特征在于,所述化合物如通式(iic)所示:
其中,r14、r15、r16、r20、r22各自独立地选自氢、c1-6的烷基、c1-6的酰基、c1-6的烷氧酰基、glu、so3h、po3h2;
glu表示β-d吡喃葡萄糖基;so3h表示磺酰基;po3h2表示磷酰基。
具体来说,通式(i),(ia),(iaa),(iab),(ib)及(ii),(iia),(iiaa),(iiab),(iib),(iic)所示的amurensinh衍生物及其药学上可接受的盐,其特征在于,所述的化合物选自如下群组(化合物代号对应于实施例中的化合物代号):
为了完成本发明的目的,本发明技术方案的第二方面是提供了一种含有药物有效剂量的如通式(i),(ia),(iaa),(iab),(ib)及(ii),(iia),(iiaa),(iiab),(iib),(iic)各情况所述的化合物和药学上可接受的载体的药物组合物在制备用于预防、治疗或辅助治疗慢性阻塞性肺疾病的药物和/或保健品中的应用。
根据本发明,本发明化合物可以以异构体的形式存在,而且通常所述的“本发明化合物”包括该化合物的异构体。
根据本发明的实施方案,所述的本发明化合物还包括其药学上可接受的盐、盐的水合物或前体药物。
本发明还涉及含有作为活性成分的本发明化合物和常规药物赋形剂或辅剂的药物组合物。通常本发明药物组合物含有0.1~95%重量的本发明化合物。在单元剂型中本发明化合物一般含量为0.1~100mg,优选的单元剂型含有4~50mg。
本发明化合物的药物组合物可根据本领域公知的方法制备。用于此目的时,如果需要,可将本发明化合物与一种或多种固体或液体药物赋形剂和/或辅剂结合,制成可作为人药或兽药使用的适当的施用形式或剂量形式。
炎症是慢性阻塞性肺疾病的基本病症之一,抗炎治疗是其临床治疗的重要手段。本发明采用lps诱导原代小鼠腹腔巨噬细胞炎症细胞模型,初步评价amurensinh衍生物的抗炎活性,研究结果显示,amurensinh衍生物10、12、13、8体外对lps诱导原代小鼠腹腔巨噬细胞炎症因子no的生成具有显著的抑制作用,其ic50分别为:8.6×10-6mol/l、6.1×10-6mol/l、9.5×10-6mol/l和9.2×10-6mol/l;进一步采用巴豆油诱导小鼠耳炎模型对活性化合物进行体内非特异性抗炎活性评价,在50mg/kg剂量下皮下单次给药,研究结果显示,衍生物10、12、13、8对巴豆油诱导小鼠耳炎具有显著抑制作用。
长期吸烟是最常见的人类copd致病因素,以lps+香烟诱导模拟小鼠的copd模型。选取显著抗炎活性的amurensinh衍生物10、12、13、8考察其对小鼠copd的治疗作用。研究结果显示,在100μmol//kg下连续灌胃给药14天,12、13、8可显著抑制copd小鼠肺泡灌洗液(balf)中白细胞总数、中性粒细胞和巨噬细胞的募集,抑制balf中炎性细胞因子tnf-α、il-6、il-1β的生成;13、8可显著减轻copd小鼠肺部炎症病理损伤程度。
本发明的优点在于:(1)本发明衍生物amurensinh结构基础上进行结构优化合成,具有更好的药效学特征,且相对较小毒副作用;(2)本发明amurensinh衍生物具有显著的抗炎活性;(3)本发明amurensinh衍生物能有效治疗copd气道炎症、减轻其炎症病理损伤;(4)本品原料易得,制备工艺简单,易于规范化生产。
根据本发明还涉及药物组合物的制备方法。用于此目的时,如果需要,可将活性成分与一种或多种固体或液体药物赋形剂和/或辅剂结合,制成可作为人药使用的适当施用形式或剂量形式。
本发明的药物组合物可以单位剂量形式给药,给药途径可为肠道或非肠道,如口服、肌肉、皮下、鼻腔、口腔粘膜、皮肤、腹膜或直肠等。
本发明的药物组合物的给药途径可为注射给药。注射包括静脉注射、肌肉注射、皮下注射、皮内注射和穴位注射等。给药剂型可以是液体剂型、固体剂型。如液体剂型可以是真溶液类、胶体类、微粒剂型、乳剂剂型、混悬剂型。其他剂型例如片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、栓剂、冻干粉针剂等。
本发明的组合物可以制成普通制剂、也可以是缓释制剂、控释制剂、靶向制剂及各种微粒给药系统。
为了将单位给药剂型制成片剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如淀粉、糊精、硫酸钙、乳糖、甘露醇、蔗糖、氯化钠、葡萄糖、尿素、碳酸钙、白陶土、微晶纤维素、硅酸铝等;湿润剂与粘合剂,如水、甘泊、聚乙二醇、乙醇、丙醇、淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、阿拉伯胶浆、明胶浆、羧甲基纤维素纳、紫胶、甲基纤维素、磷酸钾、聚乙烯吡咯烷酮等;崩解剂,例如干燥淀粉、海藻酸盐、琼脂粉、褐藻淀粉、碳酸氢纳与枸橼酸、碳酸钙、聚氧乙烯山梨糖醇脂肪酸酯、十二烷基磺酸钠、甲基纤维素、乙基纤维素等;崩解抑制剂,例如蔗糖、三硬脂酸甘油酯、可可脂、氢化油等;吸收促进剂,例如季铵盐、十二烷基硫酸纳等;润滑剂,例如滑石粉、二氧化硅、玉米淀粉、硬脂酸盐、硼酸、液体石蜡、聚乙二醇等。还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。
为了将给药单元制成丸剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如葡萄糖、乳糖、淀粉、可可脂、氢化植物油、聚乙烯吡咯烷酮、gelucire、高岭土、滑石粉等;粘合剂,如阿拉伯胶、黄蓍胶、明胶、乙醇、蜂蜜、液糖、米糊或面糊等;崩解剂,如琼脂粉、干燥淀粉、海藻酸盐、十二烷基磺酸钠、甲基纤维素、乙基纤维素等。
为了将给药单元制成栓剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如聚乙二醇、卵磷脂、可可脂、高级醇、高级醇的酶、明胶、半合成甘油酶等。
为了将给药单元制成胶囊,将有效成分与上述的各种载体混合,并将由此得到的混合物置于硬的明胶胶囊或软胶囊中。也可将有效成分制成微囊剂,混悬于水性介质中形成混悬剂,亦可装入硬胶囊中或制成注射剂应用。
例如,将本发明的组合物制成注射用制剂,如溶液剂、混悬剂溶液剂、乳剂、冻干粉针剂,这种制剂可以是含水或非水的,可含一种和/或多种药效学上可接受的载体、稀释剂、粘合剂、润滑剂、防腐剂、表面活性剂或分散剂。如稀释剂可选自水、乙醇、聚乙二醇、1,3-丙二醇、乙氧基化的异硬脂醇、多氧化的异硬脂醇、聚氧乙烯山梨醇脂肪酸酶等。另外,为了制备等渗注射液,可以向注射用制剂中添加适量的氯化钠、葡萄糖或甘油,此外,还可以添加常规的助溶剂、缓冲剂、ph调节剂等。这些辅料是本领域常用的。
此外如需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂、甜味剂或其它材料。
本发明药用组合物的给药剂量取决于许多因素,例如所要预防或治疗疾病的性质和严重程度,患者或动物的性别、年龄、体重、性格及个体反应,给药途径、给药次数等,因此本发明的治疗剂量可以有大范围的变化。一般来讲,本发明中药学成分的使用剂量是本领域技术人员公知的。可以根据本发明药用组合物中最后的制剂中所含有的实际有效药物数量,加以适当的调整,以达到其治疗有效量的要求,完成本发明的治疗炎症性疾病的目的。通常对体重约75公斤患者,所给提取物的日剂量为0.001mg/kg体重~500mg/kg体重,优选3mg/kg体重~30mg/kg体重。上述剂量可以单一剂量形式或分成几个,例如二、三或四个剂量形式给药,这受限于给药医生的临床经验以及给药方案。
本发明的第三方面是提供第一方面所述衍生物的制备方法。
用于制备本发明化合物的原料,白藜芦醇可通过商业购买获得,异丹叶大黄素可根据文献[j.asiannat.prod.res.,2014,16(5):511-521]的方法制备获得。
本发明中的化合物1-8的基本合成路线如下:
本发明中的化合物9-19的基本合成路线如下:
本发明所述化合物的基本合成方法包括如下步骤:
步骤一:白藜芦醇(或异丹叶大黄素)进行二聚反应合成含有苯乙烯双键的苯并二氢呋喃型二苯乙烯二聚体衍生物。
4-苯乙烯取代苯并二氢呋喃型白藜芦醇二聚体的合成:白藜芦醇在甲醇中以fecl3·6h2o为催化剂进行聚合反应,反应产物减压浓缩,所得固体经色谱分离纯化得目标产物4-苯乙烯取代苯并二氢呋喃型白藜芦醇二聚体(如化合物1)。
5-苯乙烯取代苯并二氢呋喃型白藜芦醇二聚体的合成:白藜芦醇在无水丙酮中以ag2o(或辣根过氧化物酶)为氧化剂进行氧化偶联反应,反应液过滤、减压浓缩至干所得粗产物经色谱分离纯化得目标产物5-苯乙烯取代苯并二氢呋喃型白藜芦醇二聚体(如化合物9)。
5-苯乙烯取代苯并二氢呋喃型异丹叶大黄素二聚体的合成:异丹叶大黄素单体在丙酮和水的混合溶液中以辣根过氧化物酶(hrp)和h2o2为氧化剂(或ag2o为氧化剂)进行氧化偶联反应,反应混合物进一步处理后减压浓缩,所得粗产物经色谱分离纯化得目标产物5-苯乙烯取代苯并二氢呋喃型异丹叶大黄素二聚体(如化合物14)。
步骤二:步骤一所得酚羟基二苯乙烯二聚体衍生物进行甲基化反应合成全甲基化的二苯乙烯二聚体衍生物。
酚羟基二苯乙烯二聚体衍生物的无水丙酮溶液在k2co3存在下,与ch3i(或(ch3)2so4或ch2n2)进行甲基化反应,反应产物经重结晶或色谱分离得酚羟基全甲基化的二苯乙烯二聚体衍生物。
步骤三:步骤一所得酚羟基二苯乙烯二聚体衍生物进行乙酰基化反应合成全乙酰化的二苯乙烯二聚体衍生物。
步骤一所得产物在干燥吡啶中与醋酐进行乙酰化反应,反应液除去吡啶后,减压浓缩得目标产物全乙酰化的二苯乙烯二聚体衍生物。
步骤四:全甲基化或全乙酰化的二氢呋喃型二苯乙烯二聚体衍生物通过ddq氧化合成呋喃型二苯乙烯二聚体衍生物。
步骤二和步骤三所得全甲基化或全乙酰化的二氢呋喃型二苯乙烯二聚体衍生物在无水二氧六环中以ddq进行氧化脱氢反应,反应产物经重结晶或色谱分离得全甲基化或全乙酰化的呋喃型二苯乙烯二聚体衍生物。
步骤五:含苯乙烯双键的二苯乙烯二聚体衍生物通过氢化还原合成相应的双键氢化衍生物。
以上步骤所得含苯乙烯双键的二苯乙烯二聚体衍生物在乙酸乙酯溶剂中,以pd/c(10%)为催化剂,在氢气气氛下进行双键还原反应。反应混合物过滤除去pd/c,滤液减压浓缩得苯乙烯双键氢化的苯并呋喃或苯并二氢呋喃型二苯乙烯二聚体衍生物。
步骤六:全乙酰化的二苯乙烯二聚体衍生物脱除乙酰基合成相应的酚羟基衍生物。
以上步骤所得全乙酰化的二苯乙烯二聚体衍生物在二氯甲烷和甲醇的混合溶液中与nh4oac进行反应。反应产物加入水以乙酸乙酯萃取,有机相减压蒸干得相应的酚羟基二苯乙烯二聚体衍生物。
有益技术效果
本发明的发明人在对山葡萄中分离得到的天然产物amurensinh的活性研究过程中,发现该化合物在动物模型上具有较强的抗氧化和抗炎活性。在此基础上,以amurensinh为先导化合物,通过合成半合成结合结构修饰的方法,合成制备了一系列的amurensinh,并对所得到的衍生物进行了体内外的炎症抑制活性评价,研究了该类化合物炎症抑制活性的构效关系,进一步确证了该类化合物的抗炎活性。实验结果表明,该类化合物对lps诱导原代小鼠腹腔巨噬细胞no的生成具有较强的抑制活性,对巴豆油致小鼠耳炎具有显著的抑制活性;进一步的动物实验表明,该类化合物对香烟诱导的小鼠慢性阻塞性肺疾病具有显著的抑制作用,具有进一步开发的潜在价值。
目前,除了本组报道的7,8-脱氢葡萄藤戊素(amurensinh)以外,对苯并呋喃或苯并二氢呋喃结构的二苯乙烯二聚体类化合物系统的抗炎活性构效关系研究尚未见文献报道。除7,8-脱氢葡萄藤戊素(amurensinh)以外,现有文献和技术中未见关于苯并呋喃或苯并二氢呋喃型二苯乙烯二聚体衍生物或其医学上可接受的盐,及该类化合物用于制备治疗和/或预防慢性阻塞性肺疾病的相关报道。
发明详述:
本发明使用的各种术语和短语具有本领域技术人员公知的一般含义,即便如此,本发明仍然希望在此对这些术语和短语作更详尽的说明和解释,提及的术语和短语如有与公知含义不一致的,以本发明所表述的含义为准。下面是本发明所用多种术语的定义,这些定义适用于本申请整个说明书中所用的术语,除非在具体情况中另作说明。
本发明所提及的术语“烷基”是指具有指定数目碳原子数的烷基,其可以为直链或支链的烷基,例如提及的“c3-6的环烷基”是指碳原子数为3、4、5、6的取代或未取代的环烷基,可以包括c3-5环烷基、c3-4环烷基、c4-6环烷基、c4-5环烷基、c5-6环烷基等表示的子范围的基团,以及优选的具体基团,例如环丙烷基、环戊烷基以及环己烷基。
本发明所提及的术语“c1-6的烷基”是指碳原子数为1、2、3、4、5、6的直链或支链烷基,可以包括c1-5烷基、c1-4烷基、c2-5烷基、c2-4烷基、c2-3烷基、c3-5烷基等表示的子范围的基团,以及优选的具体基团,例如甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基等。
本发明所提及的术语“c1-6烷氧基”是指碳原子数为1、2、3、4、5、6的烷氧基,包括c1-5烷氧基、c1-2烷氧基、c2-4烷氧基、c2-3烷氧基、c3-4烷氧基等表示的子范围的基团,以及优选的具体基团例如甲氧基、乙氧基、正丙基氧基、异丙基氧基、正丁基氧基、仲丁基氧基、叔丁基氧基等。
本发明所提及的术语“c2-6不饱和烷基”是指碳原子数为2、3、4、5、6的不饱和烷基,可以包括c1-5的不饱和烷基、c1-4的不饱和烷基、c2-5的不饱和烷基、c2-4的不饱和烷基等表示的子范围的基团,以及优选的具体基团,例如乙烯基、乙炔基、异丙烯基、异丙炔基、异丁烯基、异戊烯基、1,4-二丁烯基。
本发明所提及的术语“c1-6的酰基”是指碳原子数为1、2、3、4、5、6的酰基,可以包括c1-5酰基、c1-3酰基、c2-5酰基、c2-3酰基、c3-4酰基等表示的子范围的基团,以及优选的具体基团,例如甲酰基、乙酰基、丙酰基等。
本发明所提及的“c1-6的酰氧基”是指碳原子数为1、2、3、4、5、6的直链或支链酰氧基,可以包括c1-5酰氧基、c1-3酰氧基、c2-5酰氧基、c2-3酰氧基、c3-4酰氧基等表示的子范围的基团,以及优选的具体基团,例如甲酰氧基、乙酰氧基、丙酰氧基等。
本发明所提及的“c1-6的烷氧酰基”是指碳原子数为1、2、3、4、5、6的烷氧酰基,可以包括c1-5烷氧酰基、c1-3烷氧酰基、c2-5烷氧酰基、c2-3烷氧酰基、c3-4烷氧酰基等表示的子范围的基团,以及优选的具体基团,例如甲氧酰基、乙氧酰基等;
本发明所提及的术语“c1-6的烷硫基”是指碳原子数为1、2、3、4、5、6的直链或支链烷硫基,可以包括c1-5烷硫基、c1-3烷硫基、c2-5烷硫基、c2-3烷硫基、c3-4烷硫基等表示的子范围的基团,以及优选的具体基团,例如甲硫基、乙硫基等。
附图说明
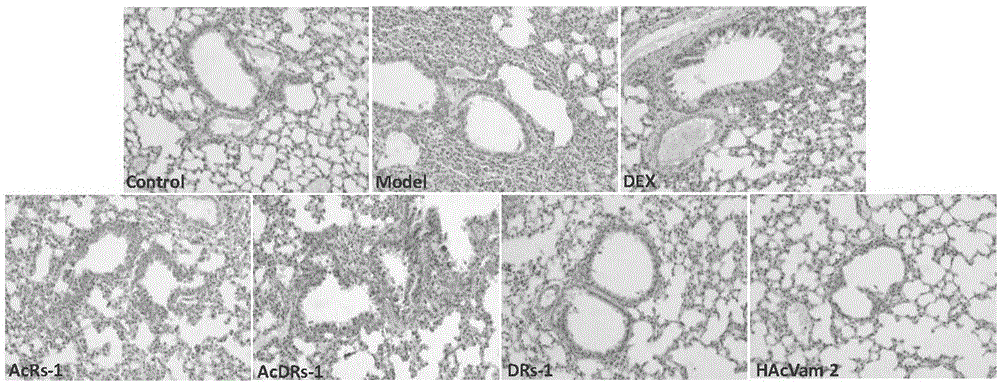
图1amurensinh抗炎活性衍生物对copd小鼠肺组织病理学改变的影响;
具体实施方式
为了进一步阐明本发明,下面给出一系列实施例。这些实施例完全是例证性的,它们仅用来对本发明进行具体描述,不应当理解为对本发明的限制。
本发明中的化合物1-8的基本合成路线如下(化合物代号对应于实施例中的化合物代号):
本发明中的化合物9-19的基本合成路线如下:
实施例1:
5-[2-(4-羟基苯基)-4-[2-(4-羟基苯基)乙烯基-6-羟基]-2,3-二氢-3-苯并呋喃基]-1,3-苯二酚(1)
化合物1的合成路线:
100g白藜芦醇(438.6mmol)以1000ml无水甲醇溶解,搅拌下滴加fecl3水溶液[116.7gfecl3·6h2o(432.619mmol)溶于67ml水中,加入100ml甲醇稀释]。反应液室温搅拌3d后停止反应。减压蒸去溶剂得黑色浸膏。该浸膏以石油醚:丙酮=6:3进行硅胶(100-200目)柱层析分离得到灰色固体化合物130.5g(67.181mmol),收率为10.2%。
化合物1,1hnmr(cd3cocd3,500mhz)δ:8.41(oh),8.38(oh),8.33(oh),8.17(2h,2×oh),7.20(2h,d,j=9.0hz,h-2a,6a),7.16(2h,d,j=8.5h,h-2b,6b),6.90(1h,d,j=16.0hz,h-7b),6.82(2h,d,j=9.0hz,h-3a,5a),6.73(2h,d,j=8.5hz,h-3b,5b),6.72(2h,d,j=2.0hz,h-10a,14a),6.70(1h,d,j=16.0hz,h-8b),6.32(1h,d,jj=2.0hz,h-12b),6.23(2h,brs,h-12a,14b),5.41(1h,d,j=5.5hz,h-7a),4.47(1h,d,j=5.5hz,h-8a)。
实施例2:
2-(4-甲氧基苯基)-3-(3,5-二甲氧基苯基)-4-[2-(4-甲氧基苯基)乙烯基]-6-甲氧基-2,3-二氢-苯并呋喃(2)
化合物2的合成路线:
500mg化合物1(1.10mmol)以10ml无水丙酮溶解,搅拌下分批加入1522mgk2co3固体(11.013mmol),室温搅拌30min后滴入3907mgch3i(27.525mmol),继续搅拌反应48h。反应液以水稀释,乙酸乙酯萃取,有机相合并,依次以饱和食盐水、水洗涤,无水硫酸钠干燥,减压浓缩至干得黄白色固体化合物2(489mg,0.933mmol),收率为84.7%,m.p.58-59℃。
化合物2:1hnmr(cd3cocd3,500mhz)δ:7.31(2h,d,j=9.0hz,h-2a,6a),7.26(2h,d,j=8.5hz,h-2b,6b),7.03(1h,d,j=16.5hz,h-7a),6.93(2h,d,j=8.5hz,h-3b,5b),6.82(2h,d,j=9.0hz,h-3a,5a),6.81(1h,brs,h-14b),6.78(1h,d,j=16.5hz,h-8a),6.47(2h,d,j=2.0hz,h-10a,14a),6.45(1h,d,j=1.5hz,h-12b),6.38(1h,t,j=2.0hz,h-12a),5.56(1h,d,j=6.0hz,h-7a),4.66(1h,d,j=6.0hz,h-8a),3.84(3h,s,och3),3.79(3h,s,och3),3.76(3h,s,och3),3.71(6h,s,och3);13cnmr(cd3cocd3,125mhz)δ:162.3(4×c),160.58,160.51,147.2,136.2,134.7,130.9,130.2,128.6(2×c),127.8(2×c),123.9,121.0,114.83(2×c),114.77(2×c),106.6(2×c),102.9,99.3,95.7,93.6,57.2,55.8(och3),55.5(4×och3),36.4,35.9;esi-msm/z:547.3[m+na]+.
实施例3:
5-[2-(4-乙酰氧基苯基)-4-[(1e)-2-(4-乙酰氧基苯基)乙烯基]-6-乙酰氧基-2,3-二氢-3-苯并呋喃基]-1,3-苯二酚二乙酸酯(3)
化合物2的合成路线:
10g化合物1(22.026mmol)以150ml干燥吡啶溶解,搅拌下缓慢加入醋酐56.2g(550.980mmol),室温搅拌过夜。反应完后,冰浴下缓慢滴入60ml水,反应液转移至1000ml分液漏斗中,以300ml水稀释,乙酸乙酯萃取三次,合并有机相,依次以饱和cuso4溶液洗、饱和食盐水、水洗涤后,减压蒸干得黄白色固体3(12.3g,18.524mmol),收率为84.1%,m.p.147-149℃。
化合物3:1hnmr(cd3cocd3,500mhz)δ:7.43(2h,d,j=8.5hz,h-2a,6a),7.36(2h,d,j=8.5hz,h-2b,6b),7.15(2h,d,j=8.5hz,h-3a,5a),7.09(1h,d,j=16.5hz,h-7b),7.07(1h,d,j=2.0hz,h-12b),7.02(2h,d,j=8.5hz,h-3b,5b),7.01(2h,d,j=2.0hz,h-10a,14a),6.91(1h,t,j=2.0hz,h-12a),6.81(1h,d,j=16.5hz,h-8b),6.70(1h,d,j=2.0hz,h-14b),5.71(1h,d,j=6.0hz,h-7a),4.93(1h,d,j=6.0hz,h-8a),2.29(3h,s,ococh3),2.28(3h,s,ococh3),2.24(15h,s,ococh3);esi-msm/z:687.3[m+na]+,703.2[m+k]+.
实施例4:
2-(4-甲氧基苯基)-3-(3,5-二甲氧基苯基)-4-[2-(4-甲氧基苯基)乙烯基]-6-甲氧基-苯并呋喃(4)
化合物4的合成路线:
350mg化合物2(0.668mmol)以15ml二氧六环溶解,加入227mgddq(1.00mmol),加热回流48h后停止反应,反应液减压浓缩,残余物以二氯甲烷为洗脱剂进行硅胶(200-300目)柱层析分离得浅黄色固体4(277.5mg,0.532mmol),收率为79.6%,m.p.61-62℃。
化合物4:1hnmr(cd3cocd3,500mhz)δ:7.54(2h,d,j=8.5hz,h-2a,6a),7.18(1h,d,j=2.0hz,h-14b),7.08(1h,d,j=2.0hz,h-12b),7.06(2h,d,j=8.5hz,h-3a,5a),7.05(1h,d,j=16.0hz,h-7b),6.89(2h,d,j=9.0hz,h-2b,6b),6.87(1h,d,j=16.0hz,h-8b),6.84(2h,d,j=9.0hz,h-3b,5b),6.75(1h,t,j=2.0hz,h-12a),6.67(2h,d,j=2.0hz,h-10a,14a),3.91(3h,s,och3),3.80(6h,s,och3),3.794(3h,s,och3),3.789(3h,s,och3);13cnmr(cd3cocd3,125mhz)δ:162.8(2×c),160.5,160.4,159.3,155.8,150.3,137.8,132.9,131.0,129.4,128.4(2×c),128.2(2×c),124.1,123.2,122.6,117.3,114.8(4×c),109.5(2×c),107.3,100.7,95.6,56.1(och3),55.9(2×och3),55.6(2×och3);m/z:545.3[m+na]+.
实施例5:
5-[2-(4-乙酰氧基苯基)-4-[(1e)-2-(4-乙酰氧基苯基)乙烯基]-6-乙酰氧基-3-苯并呋喃基]-1,3-苯二酚二乙酸酯(5)
化合物5的合成路线:
7.8g化合物3(11.76mmol)溶解于300ml干燥的二氯甲烷中,加入4.0gddq固体(17.621mmol),搅拌下加热回流48h。反应液减压蒸干,剩余混合物以二氯甲烷为溶剂进行硅胶柱层析(200-300目)分离得黄色粗产物。粗产物以丙酮重结晶得淡黄色晶体5(5.9g,8.912mmol),收率75.8%。
化合物5:m.p.107-109℃;1hnmr(cd3cocd3,500mhz)δ:7.61(2h,d,j=9.0hz,h-2a,6a),7.42(1h,d,j=2.0hz,h-14b),7.36(1h,d,j=2.0hz,h-12b),7.27(2h,d,j=2.0hz,h-10a,14a),7.26(1h,t,j=2.0hz,h-12a),7.23(2h,d,j=9.0hz,h-2b,6b),7.12(2h,d,j=9.0hz,h-3a,5a),7.15(1h,d,j=17.0hz,h-7b),7.02(2h,d,j=9.0hz,h-3b,5b),6.98(1h,d,j=17.0hz,h-8b),2.32(3h,s,ococh3),2.25(6h,s,ococh3),2.24(6h,s,ococh3);esi-msm/z:685.3[m+na]+,701.4[m+k]+.
实施例6:
5-[2-(4-羟基苯基)-4-[2-(4-羟基苯基)乙基]-2,3-二氢-3-苯并呋喃基]-1,3-苯二酚(6)
化合物6的合成路线:
100mg化合物1(0.220mmol)溶于7ml乙酸乙酯中,加入8.8mgpd/c(10%)。在氢气气氛下,常压室温搅拌4h,过滤除去pd/c,滤液减压浓缩得黄色固体6(98.0mg,0.215mmol),收率为97.7%,m.p.107-109℃。
化合物6:uvλmax(meoh,logε):227(4.67),282.8(4.25),351(3.90)nm;1hnmr(cd3cocd3,500mhz)δ:8.15(5h,brs,oh),7.08(2h,d,j=9.0hz,h-2a,6a),6.78(2h,d,j=8.5hz,h-2b,6b),6.76(2h,d,j=9.0hz,h-3a,5a),6.60(2h,d,j=8.5hz,h-3b,5b),6.23(2h,d,j=2.0hz,h-14b),6.21(1h,t,j=1.5hz,h-12a),6.20(1h,d,j=1.5hz,h-12b),6.13(2h,d,j=1.5hz,h-10a,12a),5.28(1h,d,j=6.0hz,h-7a),4.13(1h,d,j=6.0hz,h-8a),2.46-2.50(1h,m,h-7b×1),2.35-2.39(3h,m,h-7b×1,8b×2);13cnmr(cd3cocd3,125mhz)δ:162.0,159.8(2×c),159.5,158.1,156.3,147.4,141.0,133.8,133.4,130.2(2×c),128.1(2×c),120.2,116.1(2×c),115.7(2×c),109.2,107.0(2×c),102.0,95.5,94.0,57.1,36.5,36.1;esi-msm/z:457.3[m+h]+,479.2[m+na]+,485.5[m+k]+;hr-esi-msm/z:457.1653[m+h]+(calcd.forc28h25o6,457.1646).
实施例7:
2-(4-甲氧基苯基)-3-(3,5-二甲氧基苯基)-4-[2-(4-甲氧基苯基)乙基]-6-甲氧基-2,3-二氢苯并呋喃(7)
化合物7的合成路线:
100mg化合物2(0.191mmol)溶于6ml乙酸乙酯中,加入7.6mgpd/c(10%)固体,在氢气气氛下,中压室温搅拌1h,过滤除去pd/c,滤液减压浓缩,得98.1mg(0.187mmol)浅黄色黏稠状化合物7,收率97.6%。
化合物7:1hnmr(cd3cocd3,500mhz)δ:7.20(2h,d,j=9.0hz,h-2a,6a),6.90(2h,d,j=9.0hz,h-3a,5a),6.85(2h,d,j=8.5hz,h-2b,6b),6.72(2h,d,j=8.5hz,h-3b,5b),6.42(1h,brt,j=1.5hz,h-12a),6.36(4h,brs,h-10a,13a,12b,14b),5.43(1h,d,j=6.0hz,h-7a),4.25(1h,d,j=6.0hz,h-8a),3.79(3h,s,och3),3.74(6h,s,och3),3.71(6h,s,och3),2.58-2.61(1h,m,h-7b×1),2.43-2.48(3h,m,h-7b×1,8b×2);13cnmr(cd3cocd3,125mhz)δ:162.3(2×c),162.2,162.0,160.5,158.9,147.0,140.8,134.6,134.4,130.2(2×c),127.5(2×c)121.2,114.7(2×c),114.3(2×c),108.2,106.9(2×c),99.3,94.3,93.7,57.3,55.6(3×och3),55.4(2×och3),36.4,35.9;esi-msm/z:527.3[m+h]+,549.3[m+na]+,565.2[m+k]+.
实施例8:
5-[2-(4-乙酰氧基苯基)-4-[2-(4-乙酰氧基苯基)乙基]-6-乙酰氧基-3-苯并呋喃基]-1,3-苯二酚二乙酸酯(8)
化合物8的合成路线:
210mg化合物3(0.316mmol)溶于10ml乙酸乙酯中,加入12.7mgpd/c(10%)固体。在氢气气氛下,中压室温搅拌2h,过滤除去pd/c,滤液减压浓缩,得浅白色固体8(207mg,0.206mmol),收率98.2%,m.p.82-83℃。
化合物8:uvλmax(meoh,logε):279(4.22),348.8(4.02)nm;1hnmr(cd3cocd3,500mhz)δ:7.33(2h,d,j=8.5hz,h-2a,6a),7.13(2h,d,j=8.5hz,h-3a,5a),6.96(2h,d,j=8.5hz,h-2b,6b),6.95(1h,brs,h-12a),6.92(2h,d,j=2.0hz,h-10a,14a),6.89(2h,d,j=8.5hz,h-3b,5b),6.63(1h,d,j=1.5hz,h-14b),6.61(1h,brs,h-12b),5.58(1h,d,j=6.0hz,h-7a),4.48(1h,d,j=6.0hz,h-8a),2.62-2.65(1h,m,h-7b×1),2.51-2.56(3h,m,h-7b×1,8b×2);13cnmr(cd3cocd3,125mhz)δ:169.62(ococh3),169.59(ococh3),169.5(ococh3),169.5(2×c,ococh3),161.3,153.2,152.7(2×c),151.9,150.1,146.0,140.0,139.6,139.1,130.2(2×c),127.6(2×c),125.6,122.9(2×c),122.3(2×c),119.5(2×c),116.1,115.7,102.5,93.3,56.5,36.4,35.4,21.0(ococh3),20.94(2×c,ococh3),20.90(2×c,ococh3);esi-msm/z:689.3[m+na]+,705.2[m+k]+;hr-esi-msm/z:689.2004[m+na]+(calcd.forc38h34nao11,689.1993).
实施例9:
5-[2-[4-羟基苯基]-3-[3,5-二羟基苯基]-2,3-二氢-5-苯并呋喃基]乙烯基-1,3-苯二酚(9)
化合物9的合成路线:
60g白藜芦醇(263.158mmol)以1500ml无水丙酮溶解,加入67.8gag2o,加热回流3d,反应液以硅藻土过滤,滤液蒸干得反应混合物。该混合物以石油醚:丙酮=3:2进行硅胶(200-300目)柱层析分离,得黄色固体为化合物9(6.7g,14.758mmol),收率11.2%,m.p.154-156℃。
化合物9:1hnmr(cd3cocd3,500mhz)δ:8.42(1h,s,oh),8.18(2h,s,oh),8.14(2h,s,oh),7.42(1h,brd,j=8.5hz,h-6b),7.26(1h,brs,h-2b),7.23(2h,d,j=8.0hz,h-2a,6a),7.05(1h,d,j=16.0hz,h-7b),6.90(1h,d,j=16.0hz,h-8b),6.86(1h,d,8.5hz,h-5b),6.84(2h,d,j=8.0hz,h-3a,5a),6.53(2h,d,j=2.0hz,h-10b,14b),6.27(1h,t,j=2.0hz,h-12b),6.25(1h,t,j=2.0hz,h-12a),6.18(2h,d,j=2.0hz,h-10a,14a),5.44(1h,d,j=8.0hz,h-7a),4.46(1h,d,j=8.0hz,h-8a);esi-msm/z:455.1[m+h]+,477.2[m+na]+,493.1[m+k]+;
实施例10:
5-[2-(4-乙酰氧基苯基)-3-(3,5-二乙酰氧基苯基)-5-[(1e)-2-(4-乙酰氧基苯基)乙烯基]-2,3-二氢-3-苯并呋喃基]-1,3-苯二酚二乙酸酯(10)
化合物10的合成路线:
4g化合物9(8.810mmol)以57.2ml干燥吡啶溶解,加入22.5g醋酐(220.564mmol),室温搅拌过夜,tlc检测反应完全。反应液在冰浴下缓慢滴入冰水,继续加入3倍体积水稀释,以乙酸乙酯萃取三次,有机相合并,依次以饱和cuso4溶液、饱和食盐水、水洗涤后,减压蒸干得粗产物,该粗产物以石油醚:丙酮=3:1进行硅胶(200-300目)柱层析分离得白色固体为化合物10(5.6g,8.434mmol),收率95.7%,m.p.182-183℃。
化合物10:1hnmr(cd3cocd3,500mhz)δ:7.53(1h,brd,j=8.0hz,h-6b),7.43(2h,d,j=8.5hz,h-2a,6a),7.32(1h,brs,h-2b),7.25(1h,d,j=16.5hz,h-7b),7.19(2h,d,j=1.5hz,h-10b,14b),7.15(2h,d,j=8.5hz,h-3a,5a),7.05(1h,d,j=16.5h,h-8b),6.97(1h,d,j=8.0hz,h-5b),6.94(1h,t,j=1.5hz,h-12b),6.93(2h,d,j=2.0hz,h-10a,14a),6.73(1h,t,j=2.0hz,h-12a),5.67(1h,d,j=8.0hz,h-7a),4.72(1h,d,j=8.0hz,h-8a),2.252(6h,s,ococh3),2.248(6h,s,ococh3),2.23(3h,s,ococh3);13cnmr(cd3cocd3,125mhz)δ:169.6(ococh3),169.35(2×c,ococh3),169.30(2×c,ococh3),160.7,152.60(2×c),152.56(2×c),152.0,144.9,140.9,138.6,131.8,131.4,131.1,129.4,127.9(2×c),125.5,124.3,122.9(2×c),119.6(2×c),117.5(2×c),115.8.115.2,110.6,92.9,57.4,20.9(5×c,ococh3);esi-msm/z:687.1[m-h]-,703.1[m+na]+.
实施例11:
2-(4-甲氧基苯基)-3-(3,5-二甲氧基苯基)-5-[(1e)-2-(3,5-二甲氧基苯基)乙烯基]-苯并呋喃(11)
化合物11的合成路线:
250mg化合物9(0.551mmol)溶于6ml无水丙酮中,分批加入761mgk2co3(5.507mmol),搅拌30min后滴入1955mgch3i(13.775mmol),反应液室温搅拌52h,tlc检测反应完毕。反应液过滤,滤液以乙酸乙酯稀释,饱和食盐水、水洗涤,有机相减压蒸干得浅黄色固体231.9mg。取所得化合物150mg溶于8ml干燥的二氧六环中,加入97.3mgddq(0.429mmol),加热回流48h后停止反应。减压蒸除反应液,所得浸膏以二氯甲烷为洗脱剂进行硅胶(200-300目)柱层析分离得浅白色固体为化合物11(122.9mg,0.235mmol),收率82.3%,m.p.104-106℃。
化合物11:1hnmr(cd3cocd3,500mhz)δ:6.65(1h,dd,j=9.0hz,1.5hz,h-6b),7.63(2h,d,j=8.5hz,h-2a,6a),7.62(1h,brs,h-2b),7.57(1h,d,j=9.0hz,h-5b),7.38(1h,d,j=17.0hz,h-7b),7.15(1h,d,j=17.0hz,h-8b),6.96(2h,d,j=8.5h,h-3a,5a),6.79(2h,d,j=2.5hz,h-10b,14b),6.66(2h,d,2.5hz,h-10a,14a),6.60(1h,t,j=2.5hz,h-12b),6.39(1h,t,j=2.5hz,h-12a);13cnmr(cd3cocd3,125mhz)δ:162.5(2×c),162.1(2×c),161.1,154.3,152.2,140.6,135.5,133.9,131.6,130.1,129.2(2×c),128.5,123.9,123.6,118.9,116.9,114.9(2×c),111.9,108.4(2×c),105.2(2×c),100.6,100.5,55.7(och3),55.65(2×och3),55.58(2×och3);esi-msm/z:523.2[m+h]+,545.1[m+na]+.
实施例12:
5-[2-(4-乙酰氧基苯基)-5-[(1e)-2-(3,5-二乙酰氧基苯基)乙烯基]-3-苯并呋喃基]-1,3-苯二酚二乙酸酯(12)
化合物12的合成路线:
200mg化合物10(0.301mmol)溶于8ml干燥的二氧六环中,加入102.5mgddq(0.452mmol),反应液加热回流48h后停止反应,减压蒸除溶剂,以二氯甲烷为洗脱剂进行硅胶(200-300目)柱层析分离得浅白色固体为化合物12(161.4mg,0.244mmol),收率81.1%,m.p.173-174℃。
化合物12:uvλmax(meoh,logε):237.2(3.90),300.6(4.27)nm1hnmr(cd3cocd3,500mhz)δ:7.74(2h,d,j=9.0hz,h-2a,6a),7.70(1h,dd,j=9.0hz,1.5hz,h-6b),7.61(1h,d,j=9.0hz,h-5b),7.41(1h,d,j=16.5hz,h-7b),7.26(2h,d,j=2.0hz,h-10b,14b),7.24(2h,d,j=2.0hz,h-10a,14a),7.19(2h,d,j=16.5hz,h-8b),7.18(2h,d,j=9.0hz,h-3a,5a),7.08(1h,t,j=2.0hz,h-12b),6.84(1h,t,j=2.0hz,h-12a),2.27(15h,s,ococh3);13cnmr(cd3cocd3,125mhz)δ:169.43(ococh3),169.41(2×c,ococh3),169.38(2×c,ococh3),154.7,152.9(2×c),152.6(2×c),152.4,151.7,140.7,134.8,133.8,131.4,131.0,128.8(2×c),128.1,127.2,125.1,123.1(2×c),121.3(2×c),119.0,117.7,116.8(2×c),116.3,115.5,112.3,20.92-20.95(5×c,ococh3);esi-msm/z:685.1[m+na]+,701.1[m+k]+;hr-esi-msm/z:685.1684[m+na]+(calcd.forc38h3nao11,685.1680).
实施例13:
2-(4-羟基苯基)-3-(3,5-二羟基苯基)-5-[(1e)-2-(3,5-二羟基苯基)乙烯基]-苯并呋喃(13)
化合物13的合成路线:
100mg化合物12(0.151mmol)以3ml二氯甲烷溶解后加入3ml甲醇,再加入1861mgnh4oac(24.169mmol),室温搅拌4d,tlc检测反应完毕。反应液以水稀释,乙酸乙酯萃取,有机相合并,减压蒸干后得粗产物。粗产物以氯仿:甲醇=15:1进行硅胶(200-300目)柱层析分离得黄色固体为化合物13(57.1mg,0.126mmol),收率83.7%,m.p.97-99℃。
化合物13:uvλmax(meoh,logε):300.0(4.55)nm;1hnmr(cd3cocd3,500mhz)δ:8.28(5h,brs,h-oh),7.63(1h,brs,h-2b),7.58(1h,dd,j=8.5hz,h-6b),7.57(2h,d,j=9.0hz,h-2a,6a),7.52(1h,d,j=8.5hz,h-5b),7.22(1h,d,j=16.0hz,h-7b),7.05(1h,d,j=16.0hz,h-8b),6.86(2h,d,j=9.0hz,h-3a,5a),6.60(2h,d,j=2.0hz,h-10b,14b),6.51(2h,d,j=2.0hz,h-10b,14b).6.44(1h,t,j=2.0hz,h-12b),6.29(1h,t,j=2.0hz,h-12a);13cnmr(cd3cocd3,125mhz)δ:160.06(2×c),159.96(2×c),158.9,154.3,152.3,140.6,135.4,131.8,131.6,129.51,129.46(2×c),128.7,123.9,122.8,118.5,116.5,116.28(2×c),111.8,108.9(2×c),105.9(2×c),103.0,102.9;esi-msm/z:453.2[m+h]+;hr-esi-msm/z:453.1333[m+h]+(calcd.forc28h21o6,453.1333).
实施例14:
5-[2-(3-甲氧基-4-羟基苯基)-3-(3,5-二羟基苯基)-7-甲氧基-2,3-二氢-5-苯并呋喃基]乙烯基-1,3-苯二酚(14)
化合物14的合成路线:
在900mg异丹叶大黄素粉末(3.48mmol)与9.0mghrp的混合物中加入54ml丙酮与18ml水的混合溶剂,搅拌下分批滴入22.5ml3%h2o2水溶液,室温搅拌1h,反应液以乙酸乙酯萃取,有机相合并后以饱和食盐水、水洗涤,无水硫酸钠干燥,减压浓缩所得浸膏以氯仿:丙酮=3:1为洗脱剂进行硅胶柱层析分离,得到纯品灰色粉末为化合物14(490mg,0.953mmol),收率54.6%,m.p.161-163℃。
化合物14:1hnmr(cd3cocd3,500mhz)δ:7.16(1h,brs,h-2b),7.04(1h,brs,h-2a),7.03(1h,d,j=16.0hz,h-8b),6.92(1h,d,j=16.0hz,h-7b),6.84(1h,brd,j=9.5hz,h-6a),6.82(1h,brs,h-6b),6.81(1h,d,j=8.0hz,h-5a),6.52(2h,d,j=1.5hz,h-10b,14b),6.27(1h,t,j=1.5hz,h-12b),6.25(1h,t,j=1.5hz,h-12a),6.19(2h,d,j=1.5hz,h-10a,14a),5.44(1h,d,j=8.5hz,h-7a),4.51(1h,d,j=8.5hz,h-8a),3.96(3h,s,och3),3.92(3h,s,och3);esi-msm/z:515.2[m+h]+,537.2[m+na]+,553.2[m+k]+;
实施例15:
2-(3,4-二甲氧基苯基)-3-(3,5-二甲氧基苯基)-5-[2-(3,4-二甲氧基苯基)乙烯基]-7-甲氧基-2,3-二氢-苯并呋喃(15)
化合物15的合成路线:
130mg化合物14(0.246mmol)以2.6ml无水丙酮溶解,分批加入340.2mgk2co3固体(2.462mmol),搅拌30min后滴入873mgch3i(6.150mmol),室温搅拌48h。反应液以乙酸乙酯稀释,依次以饱和食盐水、水洗涤,有机相减压浓缩得浅黄色固体15(139mg,0.238mmol),收率96.7%,m.p.105-107℃。
化合物15:uvλmax(meoh,logε):235.6(3.75),285(sh,3.35),334.2(3.79)nm;1hnmr(cd3cocd3,500mhz)δ:7.20(1h,brs,h-2b),7.18(1h,d,16.0hz,h-8b),7.05(1h,d,j=1.5hz,h-2a),7.00(1h,d,j=16.0hz,h-7b),6.90-6.92(2h,m,h-5a,6a),6.81(1h,brs,h-6b),6.71(1h,d,j=2.0hz,h-10b,14b),6.43(3h,brs,h-12b,10a,14a),6.35(1h,t,h-12a),5.59(1h,d,j=8.5hz,h-7a),4.62(1h,d,j=8.5hz,h-8a),3.94(3h,s,och3),3.80(3h,s,och3),3.78(9h,s,och3),3.74(6h,s,och3).13cnmr(cd3cocd3,125mhz)δ:162.2(2×c),162.0(2×c),150.54,150.47,149.2,145.5,144.7,140.8,133.6,133.0,132.6,130.0,127.2,119.8,116.6,112.5,111.5,111.0,107.3(2×c),105.0(2×c),100.3,99.5,94.1,58.4,56.4(och3),56.10(och3),56.06(2×och3),55.6(2×och3),55.5(och3);esi-msm/z:607.1[m+na]+,623.2[m+k]+;hr-esi-msm/z:607.2309[m+na]+(calcd.forc35h36nao8,607.2302).
实施例16:
5-[2-(4-乙酰氧基-3-甲氧基)苯基-5-[2-(3,5-二乙酰氧基苯基)乙烯基]-7-甲氧基-2,3-二氢-3-苯并呋喃基]-1,3-苯二酚二乙酸酯(16)
化合物16的合成路线:
200mg化合物14(0.389mmol)以5ml干燥的吡啶溶解,搅拌下逐滴滴入0.9ml(9.7mmol)醋酐,室温搅拌过夜。反应完后,冰浴下缓慢滴入3ml水,待多余醋酐反应完毕后转移至50ml分液漏斗中,以15ml水稀释,乙酸乙酯萃取,有机相合并,依次以饱和cuso4水溶液、饱和食盐水、水洗涤,减压蒸干得浅白色固体16(250mg,0.345mmol),收率88.9%,m.p.111-112℃。
化合物16:1hnmr(cd3cocd3,500mhz)δ:7.26(1h,brs,h-2b),7.23(1h,d,j=16.0hz,h-8b),7.19(2h,d,j=2.0hz,h-10b,14b),7.15(1h,d,j=2.0hz,h-2a),7.08(1h,d,j=16.0hz,h-7b),7.05(1h,d,j=8.0hz,h-5a),6.96(1h,dd,j=8.0hz,2.0hz,h-6a),6.95(2h,d,j=2.0hz,h-10a,14a),6.94(1h,t,j=2.0hz,h-12b),6.88(1h,brs,h-6b),6.80(1h,t,j=2.0hz,h-12a),5.65(1h,d,j=8.0hz,h-7a),4.76(1h,d,j=8.0hz,h-8a),3.95(3h,s,och3),3.79(3h,s,och3),2.25(3h,s,ococh3),2.23(12h,s,ococh3);13cnmr(cd3cocd3,125mhz)δ:169.3(4×c,ococh3),168.9(ococh3),152.6(4×c),152.4,149.4,145.7,144.8,140.9(2×c),139.8,132.6,132.2,131.4,125.7,123.8,119.7(2×c),118.9,117.5(2×c),,116.9,115.8,115.1,112.1,111.2,93.5,57.8,56.5(och3),56.2(och3),20.9(4×c,ococh3),20.6(ococh3);esi-msm/z:747.3[m+na]+,763.2[m+k]+.
实施例17:
2-(3,4-二甲氧基苯基)-3-(3,5-二甲氧基苯基)-7-甲氧基-5-[2-(3,5-二甲氧基苯基)乙烯基]苯并呋喃(17)
化合物17的合成路线:
80mg化合物15(0.137mmol)以6ml干燥的二氧六环溶解,加入46.6mgddq(0.206mmol),加热回流8h后停止反应,减压蒸除溶剂,以二氯甲烷为洗脱剂进行硅胶(200-300目)柱层析分离得粗产物,粗产物以丙酮重结晶,得白色针状结晶(50mg,0.086mmol),收率62%,m.p.144-146℃。
化合物17:uvλmax(meoh,logε):222.4(4.38),278.8(3.69),312.4(3.84)nm;1hnmr(cd3cocd3,500mhz)δ:7.35(1h,d,j=16.5hz,h-7b),7.30(1h,dd,j=9.0hz,1.5hz,h-6a),7.29(1h,brs,h-2b),7.20(1h,d,j=1.5hz,h-2a),7.19(1h,brs,h-6b),7.17(1h,d,j=16.5hz,h-8b),6.98(1h,d,j=9.0hz,h-5a),6.78(2h,d,j=2.0hz,h-10b,14b,),6.67(2h,d,j=2.5hz,h-10a,14a),6.60(1h,t,j=2.0hz,h-12b),6.38(1h,t,j=2.5hz,h-12a),4.11(3h,s,och3),3.83(3h,s,och3),3.81(6h,s,och3),3.80(6h,s,och3),3.65(3h,s,och3);162.5(2×c),162.1(2×c),152.0,151.0,150.0,146.4,143.6,140.6,135.1,134.9,133.0,130.5,128.5,123.7,120.6,117.5,112.5,111.9,111.3,108.6(2×c),105.8,105.2(2×c),100.6(2×c),56.5(och3),56.0(och3),55.8(3×och3),55.6(2×och3);esi-msm/z:605.3[m+na]+,520.9[m+k]+;hr-esi-msm/z:605.2163[m+na]+(calcd.forc35h34nao8,605.2146).
实施例18:
5-[2-(3-甲氧基-4-乙酰氧基)苯基-5-[2-(3,5-二乙酰氧基苯基)乙烯基]-7-甲氧基-3-苯并呋喃基]-1,3-苯二酚二乙酸酯(18)
化合物18的合成路线:
100mg化合物15(0.138mmol)以5ml干燥的二氧六环溶解,加入47.6mgddq(0.207mmol),加热回流32h后停止反应,减压蒸除溶剂,以二氯甲烷为洗脱剂进行硅胶(200-300目)柱层析分离得浅白色固体18(83.3mg,0.115mmol),收率83.5%,m.p.223-224℃。
化合物18:1hnmr(cd3cocd3,500mhz)δ:7.38(1h,d,j=17.0hz,h-7a),7.37(1h,dd,j=8.5hz,1.5hz,h-6a),7.35(1h,brs,h-2b),7.25(1h,d,j=17.0hz,h-8a),7.25(3h,d,j=1.5hz,h-2a,10b,14b),7.22(2h,d,j=2.0hz,h-10a,14a),7.19(1h,brs,h-6b),7.12(1h,d,j=8.5hz,h-5a),7.08(1h,t,j=2.0hz,h-12a),6.83(1h,t,j=2.0hz,h-12b),4.11(3h,s,och3),3.65(3h,s,och3),2.272(6h,s,ococh3),2.266(6h,s,ococh3),2.24(3h,s,ococh3);13cnmr(cd3cocd3,125mhz)δ:169.5(2×c,ococh3),169.4(2×c,ococh3),168.8(ococh3),153.0(2×c),152.6(2×c),152.3,151.6,146.5,144.0,141.4,140.7,135.2,134.8,132.5,131.7,129.2,127.2,124.2,121.5(2×c),119.8,117.7(2×c),117.3,116.6,115.4,111.8,111.6,106.8,56.6(och3),56.0(och3),20.9(4×c,ococh3),20.5(ococh3);esi-msm/z:745.2[m+na]+,761.2[m+k]+.
实施例19:
5-[2-(3-甲氧基-4-羟基苯基)-3-(3,5-二羟基苯基)-7-甲氧基-2,3-二氢-5-苯并呋喃基]乙烯基-1,3-苯二酚(19)
化合物19的合成路线:
46mg化合物18(0.064mmol)以1.5ml二氯甲烷溶解,加入1.5ml甲醇稀释,再加入786mgnh4oac(6.116mmol),室温搅拌52h,停上反应。向反应液中加入4倍量的水,乙酸乙酯萃取,有机相水洗,减压浓缩。产物经硅胶(200-300目)柱层析,以氯仿:甲醇=20:1洗脱得淡黄绿色固体19(24mg,0.047mmol),收率74.1%,m.p.164-166℃。
化合物19:1hnmr(cd3cocd3,500mhz)δ:7.25-7.26(2h,m,h-2a,6a),7.24(1h,brs,h-2b),7.21(1h,brs,h-6b),7.19(1h,d,j=16.5hz,h-7b),7.06(1h,d,j=16.5hz,h-8b),6.86(1h,d,j=8.5hz,h-5a),6.59(2h,d,j=1.5hz,h-10b,14b),6.52(1h,d,j=1.5hz,h-10a,14a),6.43(1h,brs,h-12a),6.28(1h,brs,h-12b),4.10(3h,s,3b-och3),3.71(3h,s,3a-och3);13cnmr(cd3cocd3,125mhz)δ:162.4(2×c),159.5(2×c),152.1,148.2,148.1,146.3,143.6,140.6,135.5,134.8,132.9,129.8,128.8,122.9,121.2,117.1,116.0,111.6,111.3,108.9(2×c),106.0,105.8(2×c),102.9,102.8,56.5(och3),56.0(och3);esi-msm/z:513.2[m+h]+,535.2[m+na]+,551.1[m+k]+,511.6[m-h]-.
药理实验
实验例1:amurensinh衍生物对lps诱导的原代小鼠腹腔巨噬细胞炎症子no生成的抑制作用
巨噬细胞,执行机体非特异性免疫功能,在细菌脂多糖lps诱导下可产生no等炎性因子,参与并介导炎症反应,在多种炎症免疫过程初期与病理发展过程中均有较高的水平。通过检测原代培养的小鼠腹腔巨噬细胞的no生成量,可于体外初步观察化合物的抗炎活性。
实验方法:
取原代小鼠腹腔巨噬细胞接种于96孔板中,加入不同浓度化合物预保护1h;然后,加入lps使其终浓度为1μg/ml,于37℃、5%co2培养箱中培养24h后,收集上清液,采用griess法测定no的含量,计算
实验结果:
结果如表1所示,与amurensinh相比较,经结构改造后的amurensinh衍生物,在保持体外抗炎活性的同时,细胞毒性显著降低。
表1.amurensinh衍生物对lps诱导原代小鼠腹腔巨噬细胞no生成的影响
*浓度:10-5;治疗方向:抗炎。
实验例2:amurensinh衍生物对巴豆油诱导小鼠耳炎的影响
实验方法:
取18-20g的雄性昆明种小鼠,随机分组,各组动物分别于左耳两面涂巴豆油0.02ml;30分钟后,各组动物皮下注射给予100mg/kg体重受试化合物,模型对照组给予等体积溶媒;给药4h后,脱颈处死小鼠,沿耳廓基线剪下双耳,直径6mm打孔器分别取下左右耳相同位置的耳片,分析天平称重,计算耳肿胀度(耳肿胀度=左耳片重量-右耳片重量)和耳肿胀抑制率[耳肿胀抑制率(%)=(模型组平均耳肿胀度-给药组耳肿胀度)/模型组平均耳肿胀组×100%]。
实验结果:
实验结果如表2所示,amurensinh及其衍生物12、13、8均具有显著减轻巴豆油诱导小鼠耳炎的耳肿胀程度,而且衍生物12、13、8体内抗炎活性优于amurensinh。
表2.amurensinh衍生物对巴豆油诱导小鼠耳炎的影响(mean±std,n=10)
注:与模型组比较,“*”表示p<0.05,“**”表示p<0.01。
实验例3:amurensinh衍生物对lps+香烟诱导小鼠copd气道炎症的抑制作用
实验方法:spf级雄性balb/c小鼠,18-20g,随机分为正常对照组、模型对照组、阳性对照组(地塞米松,1μmol/kg,灌胃给药)、10药物处理组(100μmol/kg,灌胃给药)、12药物处理组(100μmol/kg,灌胃给药)、13药物处理组(100μmol/kg,灌胃给药)、8药物处理组(100μmol/kg,灌胃给药),每组15只。除空白对照组外,各组动物分别于实验第1天麻醉后气管滴入50μl/只含有40μglps的生理盐水溶液,第10天气管滴入30μl/只含有30μglps的生理盐水溶液;并于实验第2-9天和第11-21天,将小鼠置于小动物烟气吸入微环境制备系统(香烟烟雾:160-200ppm,温度22-28℃,氧气≥18.0%)中进行熏烟,1h/次,每天1次;同时,给药组于每日烟熏前1小时灌胃给药,空白对照组与模型对照组给予等体积的溶媒。小鼠于末次给药24小时后,取部分小鼠肺组织,进行组织病理学检测。其余各组小鼠用0.7ml预冷的生理盐水灌流,冲洗3次,吸出支气管肺泡灌洗液(balf),离心,上清用于分析tnf-α、il-6及il-1β的含量;pbs缓冲液重悬细胞,进行白细胞分类计数。
实验结果:
(1)amurensinh衍生物对copd小鼠肺组织炎性病理损伤的影响
如图1病理图片和表3.1炎症病理评分结果所示,模型组肺泡壁变宽,肺泡壁上皮细胞肿胀、变圆、部分脱落,肺泡腔可见巨噬细胞、小支气管和细支气管周围灶性炎性细胞浸润,肺组织边缘肺泡腔扩张。amurensinh衍生物10、13、8可显著改善copd小鼠肺组织的炎症病理改变。可见,amurensinh衍生物10、13、8在剂量100μmol/kg下灌胃给药,对copd小鼠肺组织炎症病理改变具有显著的治疗作用。
表3.1amurensinh衍生物对copd小鼠肺组织病理炎症评价的影响(mean±std,n=4)
备注:与空白对照组比较,#p<0.05,##p<0.01;与模型对照组比较,*p<0.05,**p<0.01
(2)amurensinh衍生物对copd小鼠肺泡灌洗液(balf)中炎性细胞募集的抑制作用
①amurensinh衍生物对copd小鼠balf中白细胞总数的影响
copd以遍及气道、肺实质和肺血管的慢性炎症为特征,这种炎症表现为中性粒细胞、t淋巴细胞和巨噬细胞在肺内增多。激活的炎症细胞释放一系列炎性介质破坏肺结构或维持中性粒细胞炎症的介质。本实验目的在于考察amurensinh衍生物10、12、13、8对copd小鼠balf中白细胞总数募集的影响,结果见表3.2。
结果:amurensinh衍生物10、12、13、8在剂量100μmol/kg下灌胃给药可降低copd小鼠balf中总炎性细胞募集,其中12、13、8给药组与模型组比较,差异具有显著性(p<0.01)。
表3.2amurensinh衍生物对copd小鼠balf中白细胞总数的影响(mean±std,n=10)
备注:与空白对照组比较,#p<0.05,##p<0.01;与模型对照组比较,*p<0.05,**p<0.01
②amurensinh衍生物对copd小鼠balf中中性粒细胞分类计数的影响
中性粒细胞在copd发病中具有重要作用,它可以释放丝氨酸蛋白酶并诱导动物产生人类肺气肿样的病理变化。中性粒细胞生命短暂,它循环招募到气道以及穿越间隙腔的过程十分迅速。病理研究证明有些copd患者支气管组织内中性粒细胞数目增加与气流阻塞得程度有关。吸烟的copd患者气道内中性粒细胞数目增加,特别是那些伴有慢性支气管炎的患者。本实验目的在于考察amurensinh衍生物10、12、13、8对copd小鼠balf中中性粒细胞募集的影响,结果见表3.3。
结果:amurensinh衍生物10、12、13、8在剂量100μmol/kg下灌胃给药可降低copd小鼠balf中中性粒细胞募集,其中12、13、8给药组与模型组比较,差异具有显著性(p<0.01)。表3.3amurensinh衍生物对copd小鼠balf中中性粒细胞分类计数的影响(mean±std,n=10)
备注:与空白对照组比较,#p<0.05,##p<0.01;与模型对照组比较,*p<0.05,**p<0.01
③amurensinh衍生物对copd小鼠balf中巨噬细胞分类计数的影响
吸烟者和copd患者肺内巨噬细胞较正常人群水平增加,多聚集在肺泡、细支气管和小气道。肺泡壁巨噬细胞数目和轻中度肺气肿以及copd患者的小气道疾病程度呈正相关。组织病变和损伤部位可见到copd缓慢进展和慢性病变与巨噬细胞长期增加平行。巨噬细胞可能通过释放基质金属蛋白酶导致弹性组织降解能力异常增高,诱发肺气肿的发生。本实验目的在于考察amurensinh衍生物10、12、13、8对copd小鼠balf中巨噬细胞募集的影响,结果见表3.4。
结果:amurensinh衍生物10、12、13、8在剂量100μmol/kg下灌胃给药可降低copd小鼠balf中巨噬细胞募集,其中12、13、8给药组与模型组比较,差异具有显著性(p<0.01或0.05)。表3.4amurensinh衍生物对copd小鼠balf中巨噬细胞分类计数的影响(mean±std,n=10)
备注:与空白对照组比较,#p<0.05,##p<0.01;与模型对照组比较,*p<0.05,**p<0.01
(3)amurensinh衍生物对copd小鼠肺泡灌洗液(balf)中炎症因子生成的抑制作用
①amurensinh衍生物对copd小鼠balf中tnf-α生成的影响
前炎性细胞因子tnf-α是copd的发病过程中的启动因子。copd患者的tnf-α水平高于正常人,培养的支气管上皮细胞与香烟的烟雾接触可分泌tnf-α。tnf-α可促使中性粒细胞脱颗粒,诱导起到粘膜细胞增生和高分泌,增加上皮细胞il-8生成,增加巨噬细胞基质金属蛋白酶生成,促进气道高反应性。本实验目的在于考察amurensinh衍生物10、12、13、8对copd小鼠balf中tnf-α生成的影响,结果见表3.5。
结果:amurensinh衍生物10、12、13、8在剂量100μmol/kg下灌胃给药可降低copd小鼠balf中tnf-α的生成水平,其中12、13、8给药组与模型组比较,差异具有显著性(p<0.01)。
表3.5amurensinh衍生物对copd小鼠balf中tnf-α生成的影响(mean±std,n=10)
备注:与空白对照组比较,#p<0.05,##p<0.01;与模型对照组比较,*p<0.05,**p<0.01
②amurensinh衍生物对copd小鼠balf中il-6生成的影响
il-6是参与copd气道炎症的重要细胞因子,高浓度的il-6可损伤血管内皮细胞、促进免疫粘附、微血栓形成,并可抑制内皮修复、使血管受损及高通透状态延迟,造成肺损伤。肺泡巨噬细胞在吞噬香烟烟雾中的颗粒物质后能被激活,产生il-6,放大炎症反应。同时吸烟促使支气管上皮细胞等表达和释放il-6增加,进一步加重气道炎症。本实验目的在于考察amurensinh衍生物10、12、13、8对copd小鼠balf中il-6生成的影响,结果见表3.6。
结果:amurensinh衍生物10、12、13、8在剂量100μmol/kg下灌胃给药可降低copd小鼠balf中il-6的生成水平,其中12、13、8给药组与模型组比较,差异具有显著性(p<0.05或0.01)。
表36amurensinh衍生物对copd小鼠balf中il-6生成的影响(mean±std,n=10)
备注:与空白对照组比较,#p<0.05,##p<0.01;与模型对照组比较,*p<0.05,**p<0.01
③amurensinh衍生物对copd小鼠balf中il-1β生成的影响
il-1β能激活巨噬细胞等炎症细胞释放炎症介质,在肺内可引起以巨噬细胞、粒细胞浸润为特征的肺部炎症。il-1β亦可诱导巨噬细胞产生基质金属蛋白酶-9,降解肺实质中细胞外基质成分,引起肺泡隔弹性纤维的破裂导致气道重塑及气道纤维化。本实验目的在于考察amurensinh衍生物10、12、13、8对copd小鼠balf中il-1β生成的影响,结果见表3.7。
结果:amurensinh衍生物10、12、13、8在剂量100μmol/kg下灌胃给药可降低copd小鼠balf中il-1β的生成水平,其中12、13给药组与模型组比较,差异具有显著性(p<0.05或0.01)。
表3.7amurensinh衍生物对copd小鼠balf中il-1β生成的影响(mean±std,n=10)
备注:与空白对照组比较,#p<0.05,##p<0.01;与模型对照组比较,*p<0.05,**p<0.01
综上研究结果显示,amurensinh衍生物10、12、13、8可以改善copd小鼠肺组织炎症病理改变,抑制balf中白细胞总数、中性粒细胞以及巨噬细胞分类计数,降低balf中炎症因子tnf-α、il-6、il-1β等的生成水平,其中,以12、13、8疗效更为显著。而且,amurensinh衍生物10、12、13、8尚未发现有任何毒副作用,可见其在copd的治疗中具有十分广阔的应用和开发前景。
- 还没有人留言评论。精彩留言会获得点赞!