靶向Hsp27抑制肠道病毒A71型感染的方法及相关应用与流程
本发明是关于小热休克蛋白hsp27的新应用,具体地说,本发明是关于靶向hsp27抑制肠道病毒a71型(ev-a71)感染的方法及相关应用。
背景技术:
手足口病(hfmd)是全球关注的问题,主要由肠道病毒a71型(ev-a71)和柯萨奇病毒a16(cva16)引起。手足口病通常是一种自限性疾病,临床表现较轻,但在某些情况下,它还会导致严重的神经系统并发症,甚至导致儿童尤其是5岁以下儿童死亡。并发症包括脊髓灰质炎样急性弛缓性麻痹(poliomyelitis-likeacuteflaccidparalysis)、无菌性脑膜炎、脑干脑炎和肺水肿。
ev-a71于1969年首次在加利福尼亚州分离得到,1973年被确定是引起日本手足口病的病原体。近几十年来,有ev-a71感染零星出现或爆发流行病的报道,特别是在亚太地区。虽然已经做了很多工作来开发治疗ev-a71感染的药物,确定了几种潜在的抗病毒药物,包括芦平曲韦(ag7088)、dtrip-22、山奈酚、nitd008、楝酰胺(roc-a)、oblongifolinm和ver-155008;遗憾的是,没有有效的抗ev-a71感染的预防或治疗剂。
ev-a71是一种无包膜的正链rna病毒,属于小核糖核酸病毒科、肠道病毒属。ev-a71rna基因组的长度约为7.4kb,包括一个侧翼为两个非翻译区(5'-utr和3'-utr)的开放阅读框(orf)。ev715'非翻译区(5'-utr)含有i型内部核糖体进入位点(ires)。初次感染后,ev-a71与宿主受体(scarb2、psgl1)结合并将其病毒rna释放到细胞质中。一旦病毒rna基因组释放到宿主细胞中,将通过ires介导的翻译合成单个多聚蛋白。该多聚蛋白被病毒蛋白酶2apro和3cpro酶解切割成各种结构和非结构病毒蛋白(vp1-vp4、2a-2c、3a-3d)。由于具有有限编码能力的小rna基因组,ev-a71利用宿主因子来支持病毒蛋白翻译和基因组复制。这些因子,也称为ires反式作用因子(itaf),是ires依赖性翻译所必需的。itaf可以帮助招募核糖体并与一些典型的翻译起始因子合作启动翻译。在过去几年中已经鉴定了许多itaf,例如,fbp1、fbp2、hnrnpa1、hnrnpk、auf1/hnrnpd、sam68、hur和ago2(lee,k.m.,chen,c.j.andshih,s.r.(2017)regulationmechanismsofviralires-driventranslation.trendsinmicrobiology,25,546-561)。小核糖核酸病毒能够切割宿主蛋白以促进其复制。2apro和3cpro切割真核启动因子4g(eif4g)和聚a结合蛋白(pabp),这些因子对于帽依赖性翻译是必需的。这些切割导致宿主mrna翻译的关闭,但有利于病毒蛋白质合成(kempf,b.j.andbarton,d.j.(2008)poliovirus2a(pro)increasesviralmrnaandpolysomestabilitycoordinatelyintimewithcleavageofeif4g.journalofvirology,82,5847-5859;joachims,m.,vanbreugel,p.c.andlloyd,r.e.(1999)cleavageofpoly(a)-bindingproteinbyenterovirusproteasesconcurrentwithinhibitionoftranslationinvitro.journalofvirology,73,718-727;borman,a.m.,kirchweger,r.,ziegler,e.,rhoads,r.e.,skern,t.andkean,k.m.(1997)elf4ganditsproteolyticcleavageproducts:effectoninitiationofproteinsynthesisfromcapped,uncapped,andires-containingmrnas.rna(newyork,n.y.),3,186-196)。2apro还切割fbp1,并且切割产物fbp11-371与全长fbp1配合以正向调节ires依赖性翻译(hung,c.t.,kung,y.a.,li,m.l.,brewer,g.,lee,k.m.,liu,s.t.andshih,s.r.(2016)additivepromotionofviralinternalribosomeentrysite-mediatedtranslationbyfarupstreamelement-bindingprotein1andanenterovirus71-inducedcleavageproduct.plospathogens,12,e1005959)。nlrp3炎性体保护小鼠免受ev-a71感染,然而,它被2apro和3cpro切割以促进病毒感染(wang,h.,lei,x.,xiao,x.,yang,c.,lu,w.,huang,z.,leng,q.,jin,q.,he,b.,meng,g.etal.(2015)reciprocalregulationbetweenenterovirus71andthenlrp3inflammasome.cellreports,12,42-48)。宿主-病毒相互作用的潜在机制非常复杂。
尽管宿主细胞蛋白在病毒生命周期中起着重要作用,但现有技术对宿主蛋白如何参与和调节ev-a71感染的了解仍然非常有限。此外,尽管已经做了很多努力,但是促进或限制ev-a71感染所涉及的宿主因子尚未完全确定。
技术实现要素:
本发明的一个目的在于揭示对ev-a71感染有反应的重要宿主因子,并进一步研究其在病毒感染中的作用。
本发明的研究发现,小热休克蛋白hsp27是一种响应ev-a71复制的宿主因子,本发明中通过功能激活和失去研究,剖析了hsp27在ev-a71感染中的重要作用,以及靶向hsp27的药剂显示出抗ev-a71感染的强效抗病毒作用。
具体而言,本发明的研究发现,hsp27的表达响应病毒复制而上调。本发明首次证明了hsp27通过增强由病毒ires元件驱动的病毒蛋白质翻译来支持ev-a71复制。hsp27通过增强2apro介导的eif4g切割和hnrnpa1从细胞核向细胞质的易位来上调病毒ires活性。更重要的是,hsp27抑制剂tdp对ev-a71感染具有强效抗病毒活性。
hsp27属于低分子量热休克蛋白(hsps)家族,其在从原核生物到真核生物的大多数生物体中是保守和普遍表达的。hsp作为分子伴侣起到保护细胞和抑制蛋白质聚集的作用,以应对热休克或其他细胞应激,如病原体入侵。
据报道,hsp27在hsv-1感染后被磷酸化,并且hsp27的耗尽减少了hsv-1的产生(mathew,s.s.,dellaselva,m.p.andburch,a.d.(2009)modificationandreorganizationofthecytoprotectivecellularchaperonehsp27duringherpessimplexvirustype1infection.journalofvirology,83,9304-9312)。sb203580治疗可在某种程度上通过调节hsp27的磷酸化减少denv感染引起的肝损伤(sreekanth,g.p.,chuncharunee,a.,sirimontaporn,a.,panaampon,j.,noisakran,s.,yenchitsomanus,p.t.andlimjindaporn,t.(2016)sb203580modulatesp38mapksignalinganddenguevirus-inducedliverinjurybyreducingmapkapk2,hsp27,andatf2phosphorylation.plosone,11,e0149486)。在hbv感染的情况下,hsp27通过诱导i型干扰素和下游抗病毒效应物(isg15、oas1、oas3、pkr和eif2a)作为抗病毒因子(tong,s.w.,yang,y.x.,hu,h.d.,an,x.,ye,f.,ren,h.,li,s.l.andzhang,d.z.(2013)hspb1isanintracellularantiviralfactoragainsthepatitisbvirus.journalofcellularbiochemistry,114,162-173)。这些研究表明,hsp27在不同病毒中发挥不同的作用。
本发明的研究显示,hsp27的表达在ev-a71病毒复制过程中显著上调(图2a,图2b),而uv失活的复制缺陷型ev-a71未能刺激hsp27表达。本发明的研究结果表明,hsp27响应ev-a71复制,而不是病毒入胞。本发明的研究还表明,敲除hsp27显著降低了ev-a71的复制(图5a~图5f);另外,hsp27的异位表达促进了ev-a71的复制(图7a~图7d)。
入胞和脱壳后,肠道病毒的病毒(+)rna通过5'ires介导的病毒蛋白翻译立即翻译成多肽,这是启动病毒复制的关键步骤(shih,s.r.,stollar,v.andli,m.l.(2011)hostfactorsinenterovirus71replication.journalofvirology,85,9658-9666;huang,p.n.andshih,s.r.(2014)updateonenterovirus71infection.currentopinioninvirology,5,98-104)。本发明的研究结果表明,hsp27的耗尽显著降低了病毒蛋白的表达。还发现hsp27的敲除显著降低了病毒ires活性(图8a),而hsp27的异位表达增加了病毒ires活性(图8b),表明hsp27在调节病毒ires活性中的重要功能。
众所周知,病毒蛋白2apro切割细胞翻译起始因子eif4g以关闭宿主帽依赖性翻译并促进ires介导的病毒rna翻译(thompson,s.r.andsarnow,p.(2003)enterovirus71containsatypeiireselementthatfunctionswheneukaryoticinitiationfactoreif4giscleaved.virology,315,259-266)。病毒蛋白2apro刺激ires介导的翻译,这取决于酶活性(ziegler,e.,borman,a.m.,deliat,f.g.,liebig,h.d.,jugovic,d.,kean,k.m.,skern,t.andkuechler,e.(1995)picornavirus2aproteinase-mediatedstimulationofinternalinitiationoftranslationisdependentonenzymaticactivityandthecleavageproductsofcellularproteins.virology,213,549-557;hunt,s.l.,skern,t.,liebig,h.d.,kuechler,e.andjackson,r.j.(1999)rhinovirus2aproteinasemediatedstimulationofrhinovirusrnatranslationisadditivetothestimulationeffectedbycellularrnabindingproteins.virusresearch,62,119-128)。在本发明的研究中,发现ires活性不受野生型和hsp27-ko细胞中酶活性缺陷的2apro突变体的影响。野生型细胞中病毒ires活性显著增加超过12倍;然而,在hsp27-ko细胞中,2apro引起ires活性的增加要少得多(图8c)。此外,2apro增强的ires活性与异位表达的hsp27的剂量正相关(图8d)。尽管hsp27不影响eif4g的表达水平(图8e),但hsp27以剂量依赖性方式显著增强2apro介导的eif4g切割(图8f)。一致地,hsp27的敲除明显阻断eif4g切割,无论细胞是否被ev-a71感染或与重组2apro一起温育(图8g和图8h)。病毒蛋白的产生被2apro强烈上调,这种正调节在hsp27-ko细胞中被消除(图8i)。
总之,ev-a71采用有效方式刺激hsp27表达(1)关闭宿主蛋白质合成和(2)通过增强eif4g切割促进病毒蛋白质翻译。本发明的研究结果也适用于含有ires序列的其他正链rna病毒,例如hcv、登革热病毒。
除了调节eif4g切割外,hsp27还采取其他方式来调节病毒ires活性。itaf对于ires依赖性翻译是不可或缺的。作为itaf的成员,hnrnpa1正向调节ev-a71,辛德毕斯病毒(sindbisvirus)、hcv和hiv的ires依赖性翻译(geuens,t.,bouhy,d.andtimmerman,v.(2016)thehnrnpfamily:insightsintotheirroleinhealthanddisease.humangenetics,135,851-867;piccolo,l.l.,corona,d.andonorati,m.c.(2014)emergingrolesforhnrnpsinpost-transcriptionalregulation:whatcanwelearnfromflies?chromosoma,123,515-527)。在被ev-a71、hiv或辛德毕斯病毒感染后,hnrnpa1从细胞核转移到细胞质(lin,j.y.,shih,s.r.,pan,m.,li,c.,lue,c.f.,stollar,v.andli,m.l.(2009)hnrnpa1interactswiththe5'untranslatedregionsofenterovirus71andsindbisvirusrnaandisrequiredforviralreplication.journalofvirology,83,6106-6114;chen,s.g.,cheng,m.l.,chen,k.h.,horng,j.t.,liu,c.c.,wang,s.m.,sakurai,h.,leu,y.l.,wang,s.d.andho,h.y.(2017)antiviralactivitiesofschizonepetatenuifoliabriq.againstenterovirus71invitroandinvivo.scientificreports,7,935;tolbert,m.,morgan,c.e.,pollum,m.,crespo-hernandez,c.e.,li,m.l.,brewer,g.andtolbert,b.s.(2017)hnrnpa1altersthestructureofaconservedenterovirusiresdomaintostimulateviraltranslation.journalofmolecularbiology,429,2841-2858;kim,c.s.,seol,s.k.,song,o.k.,park,j.h.andjang,s.k.(2007)anrna-bindingprotein,hnrnpa1,andascaffoldprotein,septin6,facilitatehepatitiscvirusreplication.journalofvirology,81,3852-3865;monette,a.,ajamian,l.,lopez-lastra,m.andmouland,a.j.(2009)humanimmunodeficiencyvirustype1(hiv-1)inducesthecytoplasmicretentionofheterogeneousnuclearribonucleoproteina1bydisruptingnuclearimport:implicationsforhiv-1geneexpression.thejournalofbiologicalchemistry,284,31350-31362)。在本发明的研究中,证明了在ev-a71感染后hnrnpa1重新分布到细胞质中,这与先前的研究一致。令人惊讶的是,敲除hsp27几乎完全阻断了hnrnpa1从细胞核向细胞质的易位(图9a)。更重要的是,本发明进一步证明了敲除hsp27显著降低了hnrnpa1和ev-a71之间的相互作用(图9b)。hnrnpa1的细胞质重新定位的减少也有助于降低hsp27敲除细胞中的病毒蛋白质翻译和复制。hsp27的抑制剂(例如tdp)通过ires活性的下调显示出有效的抗病毒作用(图10a~图10e)。
从而,一方面,本发明提供了hsp27作为靶点在开发、筛选和/或制备用于防治和/或抑制病毒感染的药物中的应用;其中,所述的病毒为含有ires序列的正链rna病毒,例如ev-a71、hcv或登革热病毒。
另一方面,本发明还提供了抑制、沉默和/或敲除hsp27的试剂在制备用于减免细胞病变效应、治疗和/或抑制病毒感染的药物中的应用;其中,所述的病毒为含有ires序列的正链rna病毒,例如ev-a71、hcv或登革热病毒。
根据本发明的具体实施方案,本发明的上述应用中,所述减免细胞病变效应、治疗和/或抑制病毒感染包括以下中的一种或多种:
抑制病毒复制、病毒蛋白质表达和/或病毒繁殖;
阻断hnrnpa1从细胞核转位到细胞质;
阻断eif4g切割;
降低病毒ires活性;
降低hnrnpa1和病毒之间的相互作用。
根据本发明的具体实施方案,所述抑制、沉默和/或敲除hsp27的试剂可以为现有技术的试剂,只要能实现所述的抑制、沉默和/或敲除hsp27的功能即可。在本发明的一些具体实施方案中,所述抑制hsp27的试剂为tdp。
另一方面,本发明还提供了检测hsp27的试剂在制备用于诊断病毒感染的诊断剂中的应用;其中,所述的病毒为含有ires序列的正链rna病毒,例如ev-a71、hcv或登革热病毒。
根据本发明的具体实施方案,hsp27的表达在ev-a71病毒复制过程中上调。即,如果检测到hsp27的表达上调,可以判断ev-a71病毒复制过程的存在。
根据本发明的具体实施方案,所述检测hsp27的试剂可以为现有技术的试剂(可以包括检测仪器设备等),只要能实现检测hsp27的表达和/或表达水平的功能即可。
另一方面,本发明还提供了hsp27和/或促进hsp27表达(本发明中,所述促进hsp27表达包括实现hsp27的异位表达)的试剂在制备用于制备病毒感染的模型的试剂中的应用;其中,所述的病毒为含有ires序列的正链rna病毒,例如ev-a71、hcv或登革热病毒。
根据本发明的具体实施方案,所述hsp27和/或促进hsp27表达的试剂通过增强由病毒ires元件驱动的病毒蛋白质翻译来支持病毒复制。
根据本发明的具体实施方案,所述hsp27和/或促进hsp27表达的试剂用于促进2apro介导的eif4g切割和/或增强hnrnpa1从细胞核向细胞质的易位来上调病毒ires活性。
总的来说,本发明的研究表明hsp27通过正调节ires活性促进ev-a71复制。这提供了对宿主因子和ev-a71之间相互作用的新见解,hsp27将可作为抗病毒制剂开发的新靶标。
附图说明
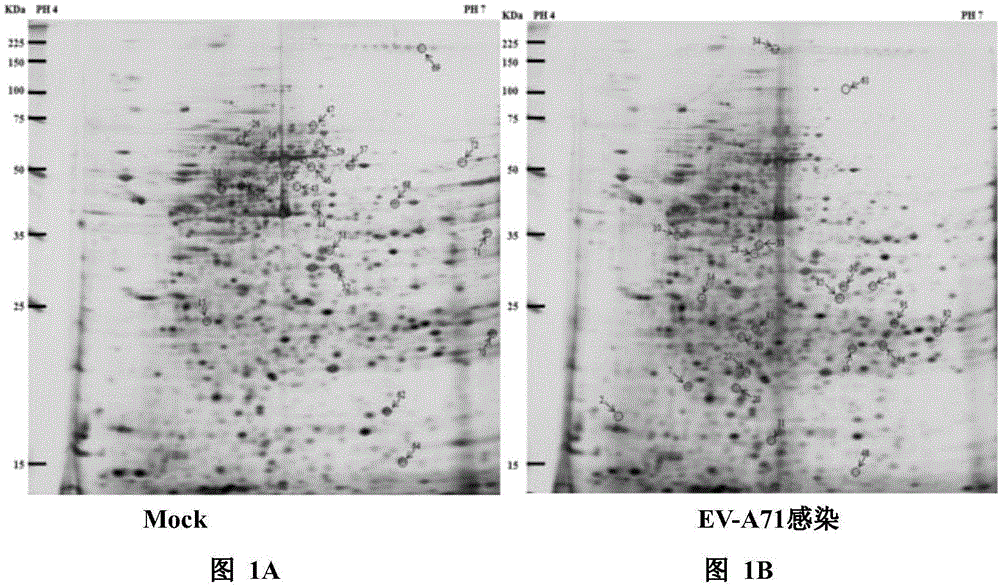
图1a~图1d:ev-a71感染和未感染rd细胞中的蛋白质图谱。图1a和图1b,来自ev-a71感染的(图1a)和未感染的(图1b)rd细胞的蛋白质的代表性银染2-de图谱(n=3)。通过maldi-tof-ms和ms/ms扫描成功鉴定的斑点用数字标记。图1c,2-de图谱的放大部分,显示ev-a71感染和未感染(假感染,mock)rd细胞之间斑点10(grp78)、斑点49(hsp27)和斑点7(phb)的不同表达。图1d,rd细胞假感染或感染ev-a71,moi为10,感染6h,蛋白质印迹分析用于检测grp78、phb和hsp27的表达。
图2a~图2c:显示在ev-a71感染的rd细胞中hsp27上调的实验结果。图2a,用或不用moi为10的ev-a71感染rd细胞,通过rt-qpcr测定hsp27的表达。图2b,用或不用moi为10的ev-a71感染rd细胞3小时、6小时、9小时、12小时,通过westernblot确认hsp27表达水平。扫描每个条带的密度,并首先用肌动蛋白标准化。靶蛋白条带的值在对照(control)中设定为1。图2c,rt细胞用感染性ev-a71或uv灭活的ev-a71以moi为1、10感染12小时,用rt-qpcr测定hsp27的表达水平。gapdh用作内部对照。实验设三个平行样并重复至少三次。使用student'st检验进行统计学分析。*:p<0.05,**:p<0.01。数据表示为三次实验的平均值±sd。
图3a~图3e:显示hsp27调节hela细胞中的ev-a71复制的实验结果。图3a,hela细胞中ev-a71感染后hsp27增加。将hela细胞用moi为10的ev-a71感染9小时、12小时。通过蛋白质印迹测定hsp27和vp1的病毒蛋白的表达水平。图3b和图3c,用nc或hsp27sirna转染hela细胞48h,然后用ev-a71感染细胞,通过蛋白质印迹和rt-qpcr分别测定vp1的病毒蛋白水平(图3b)和病毒rna水平(图3c)。图3d和图3e,用空载体和phsp27质粒转染hela细胞,转染后48h,细胞用moi为1的ev-a71感染9h、12h,通过蛋白质印迹和rt-qpcr分别测定vp1的病毒蛋白水平和病毒rna水平。gapdh用作内部对照。使用student'st检验进行统计学分析。*:p<0.0_5,**:p<0.01。数据表示为平均值±sd。
图4a~图4c:显示hsp27的敲低抑制rd细胞中的ev-a71复制的实验结果。hsp27被沉默。通过rt-qpcr评估细胞质(图4a)和上清液(图4b)中的ev-a71mrna水平。图4c,转染后48小时通过蛋白质印迹确认hsp27水平。gapdh用作内部对照。使用student'st检验进行统计学分析。*:p<0.0_5,**:p<0.01。数据表示为平均±sd。
图5a~图5f:显示hsp27的敲除抑制ev-a71复制的实验结果。图5a,crispr/cas9在hsp27的外显子i中设计的靶位点。图5b,hsp27在rd细胞中敲除并用moi为1的ev-a71感染6小时,通过蛋白质印迹和rt-qpcr分别测定病毒蛋白和病毒rna水平。图5c,rd野生型和hsp27-ko细胞用ev-a71以0.01的moi感染,图片为感染后48小时(p.i.)所拍摄。将rd野生型和hsp27敲除细胞用ev-a71以1的moi感染6、9、12h。图5d,通过蛋白质印迹测定病毒蛋白质水平。图5e,通过rt-qpcr检查细胞内病毒rna水平。图5f,通过tcid50测定法测定上清液中的病毒滴度。gapdh用作内部对照。使用student'st检验进行统计学分析。*:p<0.05,**:p<0.01。数据表示为平均值±sd。
图6a~图6d:显示在敲除hsp27细胞中恢复hsp27促进ev-a71复制的实验结果。用空载体和phsp27质粒转染hsp27-ko细胞,转染后48小时,细胞用ev-a71感染。通过rt-qpcr、蛋白质印迹和tcid50测定分别测定细胞内和细胞外的病毒rna水平(图6a,图6b)、病毒蛋白水平(图6c)和上清液中的病毒滴度(图6d)。gapdh用作内部对照。使用student'st检验进行统计学分析。*:p<0.0_5,**:p<0.01。数据表示为平均值sd
图7a~图7d:显示hsp27的异位表达促进ev-a71感染的实验结果。用hsp27表达质粒转染hek293t细胞48小时。图7a,然后用以moi为1的ev-a71感染细胞12小时。蛋白质印迹检测hsp27和vp1病毒蛋白的表达水平。图7b-图7c,用moi为1的ev-a71感染细胞6小时、9小时、12小时,通过rt-qpcr检查细胞内(图7b)和细胞外(图7c)病毒rna水平。图7d,通过tcid50测定法测定上清液中的病毒滴度。gapdh用作内部对照。使用student'st检验进行统计学分析。*:p<0.05,**:p<0.01。数据表示为平均值±sd。
图8a~图8i:显示hsp27对病毒ires活性的上调的实验结果。图8a,用pires报告质粒转染rd野生型和hsp27敲除细胞。在转染后48小时测定荧光素酶活性。图8b,用phsp27和pires报告质粒共转染hek293t细胞48小时,测量荧光素酶活性。图8c,用2apro表达质粒和pires报告质粒共转染rd野生型和hsp27-ko细胞48小时,设control对照,然后测量荧光素酶活性。图8d,用phsp27、pires报告质粒和2apro表达质粒或空载体共转染hek293t细胞48小时,然后测量荧光素酶活性。图8e,用phsp27转染hek293t细胞48h,用蛋白质印迹检测eif4g和hsp27的表达水平。图8f,用phsp27和2apro表达质粒或空载体共转染hek293t细胞48小时,通过蛋白质印迹测定切割的eif4g。图8g,rd野生型和hsp27-ko细胞用moi为1或5的ev-a71感染6小时,通过蛋白质印迹测定切割的eif4g。图8h,收集rd野生型和hsp27-ko细胞裂解物,并与重组2apro在裂解缓冲液中37℃孵育4小时,通过蛋白质印迹测定裂解的eif4g。图8i,用2apro表达质粒或空载体转染rd野生型和hsp27-ko细胞24h,然后用moi为1的ev7-a71感染细胞12h,通过蛋白质印迹测定vp1病毒蛋白水平和hsp27表达水平。使用student'st检验进行统计学分析。*:p<0.05,**:p<0.01。数据表示为平均值±sd。
图9a~图9b:显示hsp27的敲除抑制了ev-a71诱导的hnrnpa1易位的实验结果。图9a,rd野生型和hsp27-ko细胞用moi为20、40的ev-a71感染6小时。固定细胞,间接免疫荧光法检测hnrnpa1的亚细胞定位。图9b,rd野生型和hsp27-ko细胞用moi为10的ev-a71感染6小时。细胞提取物同抗hnrnpa1抗体或正常抗igg一起用于rna免疫沉淀测定。经洗涤和解离后,使用trizol试剂提取rna,并使用对ev715'-utr或核糖体蛋白s16(rps16)特异的引物进行rt-pcr。使用student'st检验进行统计学分析。*:p<0.05,**:p<0.01。数据表示为平均值±sd。
图10a~图10e:显示hsp27的小分子抑制剂减少ev-a71感染的实验结果。图10a,将rd细胞用指定浓度的tdp预处理2小时,然后用moi为0.01的ev-a71感染。图片为感染后48小时(p.i.)所拍摄。rd细胞用指定浓度的tdp预处理2小时,然后用moi为1的ev-a71感染12h。图10b,用rt-qpcr检测细胞内病毒rna水平。图10c,通过蛋白质印迹测定eif4g表达水平和vp1的病毒蛋白水平。图10d,通过tcid50测定法测定上清液中的病毒滴度。图10e,将pires报告质粒转染到用tdp预处理2小时的细胞中,在转染后48小时检测ires活性。使用student'st检验进行统计学分析。*:p<0.05,**:p<0.01。数据表示为平均值±sd。
具体实施方式
为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现结合具体实施例及附图对本发明的技术方案进行以下详细说明,应理解这些实例仅用于说明本发明而不用于限制本发明的范围。实施例中,未注明具体条件的实验方法为所属领域熟知的常规方法和常规条件,或按照仪器制造商所建议的条件操作。
各实施例中所用材料和方法:
1.细胞和病毒
人肌肉横纹肌肉瘤细胞(rd细胞,atccno.ccl-136)培养于含10%胎牛血清(fbs)和100u/ml青霉素和100μg/ml链霉素的dmem培养基中。
ev-a71:shzh98菌株,genbank登录号af302996。
病毒滴度通过tcid50分析套组测定。
2.蛋白质组学分析
感染后6小时收获大约4×107个rd细胞,并将假感染(mock感染)的细胞作为对照。2-de的操作如现有技术“glucose-regulatedprotein78isanintracellularantiviralfactoragainsthepatitisbvirus”(ma,y.,yu,j.,chan,h.l.,chen,y.c.,wang,h.,chen,y.,chan,c.y.,go,m.y.,tsai,s.n.,ngai,s.m.etal.(2009)molecular&cellularproteomics:mcp,8,2582-2594)中所述进行。简言之,用pbs洗涤细胞,在裂解缓冲液(8m尿素,2m硫脲,2%chaps,1%np-40,2mmtbp,1×罗氏蛋白酶抑制剂混合物)中裂解。根据制造商的说明,在ettanipgphoriiiefsystem(amersham,usa)中进行第一向ief电泳。用250μl复水溶液(8m尿素,2%chaps,0.4%dtt,0.5%ipg缓冲液,0.002%溴酚蓝)稀释150μg蛋白质样品,并应用于ipg胶条(ph4-7,线性;gehealthcare)。在ief之后,将ipg胶条在平衡溶液[6m尿素,2%sds,30%甘油,50mmol/ltris-hcl(ph6.8)和1%dtt]中平衡15分钟,然后转移至另一平衡液。使用12.5%sds-page凝胶以每凝胶15ma进行第二向电泳30分钟。每个实验设三个平行样。在2-de后,通过改良银染法染色凝胶。应用pdquest2-d分析软件(8.0版,bio-rad)进行进一步分析,包括斑点检测、背景消减、斑点匹配、体积归一化处理和定量强度分析。通过计算每个凝胶上总密度标准化后的斑点体积来定量每种蛋白质的强度。通过student'st检验分析数据。选择在斑点强度中具有至少2倍增加/减少(ev-a71感染的rd细胞对mock处理的对照细胞)的显著不同的表达蛋白质斑点(p<0.05)并且通过ms进行鉴定。从制备凝胶中切下选择的蛋白质斑点,使用活检穿孔器提取并用milliporeziptiptmc18柱纯化。最后,将一体积(1μl)的肽样品点在不锈钢板上,用4700蛋白质组学分析仪(tof/toftm)(appliedbiosystems,usa)进行质谱分析(ms)。
3.数据库分析
通过组合ms(肽-质量-指纹谱)和ms/ms(denovo测序法)分析,用肽质量指纹谱鉴定蛋白质。为了使理想的同位素分布适合实验数据,mascotdistiller应用于峰检测。在数据库搜索之前,首先从光谱中除去对应于人角蛋白和胰蛋白酶自溶肽的已知污染物离子。将原始数据提交给mascot搜索引擎(版本1.9.05;matrixscience)并针对swissprot20100723(518415序列;182829264残基)进行搜索。来自webgestalt(基于web的genesetanalysis工具包,http://bioinfo.vanderbilt.edu/wg2/)的geneontologyslimclassification用于分配geneontology(go)术语,并使用同一网站上的directedacyclicgraphs发现具有丰富基因数的go类别,每个类别中至少有两个基因(p<0.01)。
4.rna干扰
设计了两种小干扰rna(sirna)寡核苷酸双链(genbank登录号nm_001540)(sihsp27-1:正义链,5'-ggauggcgugguggagauc-3',seqidno.1;sihsp27-2:正义链,5'-aggaguggucgcagugguu-3',seqidno.2),然后由genepharma(中国上海)靶向人类hsp27mrna。应用蛋白质印迹法来测量两种sirna的敲低效率。使用与人基因组没有同源性的非特异性sirna作为阴性对照。
5.hsp27敲除细胞
人hsp27crispr/cas9敲除质粒购自genscript。hsp27的靶sgrna序列为5'-gcauagccgccucuucgacc-3'(seqidno.3)。使用
6.荧光素酶测定
在转染前一天,将hek293t细胞接种于24孔中。转染hsp27表达质粒或相应的sirna。24小时后,用pires或prf报告质粒转染细胞。第一轮转染后两天,在被动裂解液(promega,usa)中制备细胞提取物,并使用双荧光素酶报告基因测定法在lumatlb9507生物发光计中测定海肾荧光素酶(rluc)和萤火虫荧光素酶(fluc)活性(promega),操作按照制造商的说明书进行。
7.蛋白质印迹
用pbs洗涤培养的细胞,通过在冰冷的蛋白质裂解缓冲液(50mmtris-hcl,ph值7.4,150mmnacl,1%triton-x100,0.1%sds)补充蛋白酶抑制剂混合物中将细胞在冰上孵育30分钟来收集总细胞裂解物。在4℃以13,000rpm离心20分钟后,收集上清液。使用bradford方法(bio-radlaboratories,ca,usa)测量蛋白质浓度,并通过10%sds-聚丙烯酰胺凝胶电泳分离30μg蛋白质,然后转移到聚偏二氟乙烯膜(pvdf)(ge,ma,美国)。含有蛋白质的膜在室温下用tris缓冲盐水tween-20缓冲液(tbst,20mmtris-hcl,ph7.4,150mmnacl和0.1%tween-20)中的5%bsa封闭。然后将膜与抗ev-a71抗体vp1(1:2000,merckmillipore,ma,usa)、hsp27(sc-13132,1:1000)、eif4g(sc-11373,1:1000)、β-肌动蛋白(sc-81178,1:1000)一起温育。用化学发光试剂(perkinelmer,ma,usa)显现靶蛋白。
8.rna提取和实时pcr
用trizol试剂(ambion,life,technologies)分离总rna,并使用2μg总rna根据制造商的说明书使用improm-iitm逆转录酶(promega)合成cdna。使用sybrgreenmix(lifetechnologies)在appliedbiosystemsquantstudiotm3实时pcr系统上进行定量实时pcr(rt-qpcr)。rt-qpcr中用到以下引物对:gapdh,5'-gattccacccatggcaaattcca-3'(正向,seqidno.4)和5'-tggtgatgggatttccattgatga-3'(反向,seqidno.5);ev71,5'-gcagcccaaaagaacttcac-3'(正向,seqidno.6)和5'-atttcagcagcttggagtgc-3'(反向,seqidno.7);hsp27,5'-cacgaggagcggcaggac-3'(正向,seqidno.8)和5'-ggacagggaggaggaaacttgg-3'(反向,seqidno.9)。每个样品设三个平行样测定,gapdh用作参考基因。使用2-δδct方法分析每个基因的相对定量。
9.rna免疫沉淀
将野生型rd和hsp27敲除(hsp27-ko)细胞用ev-a71以10的moi感染6小时,并用裂解缓冲液(50mmtris-hcl,ph7.4,含150mmnacl,1mmedta和1%np-40)收集。将细胞提取物用蛋白质-g-琼脂糖在4℃预清除1小时以除去非特异性复合物。然后将经预清除的细胞提取物与hnrnpa1抗体和正常igg作为阴性对照在4℃温育过夜。通过在4℃下以1000×g离心5分钟沉淀免疫沉淀复合物,并用裂解缓冲液洗涤8次。将沉淀重悬于400μl蛋白酶k缓冲液(100mmtris-hcl[ph7.5],12.5mmedta,150mmnacl和1%sds)中,并与100μg预消化的蛋白酶k一起在37℃孵育30分钟。用trizol试剂提取结合rna并通过qrt-pcr评估。将pcr产物置于琼脂糖凝胶上。
10.免疫荧光分析
参照“hnrnpa1interactswiththe5'untranslatedregionsofenterovirus71andsindbisvirusrnaandisrequiredforviralreplication”(lin,j.y.,shih,s.r.,pan,m.,li,c.,lue,c.f.,stollar,v.andli,m.l.(2009)journalofvirology,83,6106-6114)和“anti-enterovirus71activitiesofmelissaofficinalisextractanditsbiologicallyactiveconstituentrosmarinicacid”(chen,s.g.,leu,y.l.,cheng,m.l.,ting,s.c.,liu,c.c.,wang,s.d.,yang,c.h.,hung,c.y.andsakurai,h.(2017)7,12264)的方案来研究hnrnpa1分布。简而言之,野生型rd和hsp27-ko细胞被ev-a71以20或40的moi感染6小时。将细胞用4%多聚甲醛在室温下固定20分钟,然后用含0.3%tritonx-100的pbs透化。将细胞用pbs中的5%bsa封闭2小时,并通过与抗hnrnpa1抗体(sc-32301)孵育,然后与alexafluor488缀合的抗小鼠抗体一起染色。将细胞核用dapi染色5分钟。使用airyscan(德国)在zeiss激光扫描显微镜lsm880nlo上捕获图像。
11.统计分析
结果表示为平均值±标准偏差(sd)。所有统计分析均使用spss14.0软件(spssinc.)进行。双尾student’st检验用于两组比较。p值<0.05被认为具有统计学意义。
实施例1、ev-a71感染和未感染rd细胞的2-de分析
已广泛用于研究肠道病毒感染机制的rd细胞用于本实施例中的蛋白质组学分析。现有技术关于ev-a71感染动力学的研究表明,在感染复数(moi)1或10感染细胞时,病毒rna合成和蛋白质翻译在感染后6至9小时(p.i.)的噬菌体中具有高活性;此外,后代病毒体也在同一时期逐渐包装和释放(lu,j.,he,y.q.,yi,l.n.,zan,h.,kung,h.f.andhe,m.l.(2011)viralkineticsofenterovirus71inhumanabdomyosarcomacells.worldjournalofgastroenterology,17,4135-4142)。本发明中,为了鉴定响应早期病毒复制的宿主因子,提取蛋白质并在6小时后p.i.应用于蛋白质组学分析。此时,ev-a71感染以高速率的病毒rna复制和病毒蛋白表达建立。通过2-de分析来自ev-a71感染和未感染的rd细胞的提取物。在比较ev-a71感染和未感染rd细胞的重复2-de凝胶(n=3)后,发现73个蛋白质斑点一致地改变(>2倍变化,p<0.05),其中36个表达水平增加,37个表达受感染细胞表达水平降低(图1a,图1b)。其中,选择37个斑点进行maldi-tofms和ms/ms分析。除去重复片段(例如前体蛋白质)后,鉴定出24种蛋白质。在ev-a71感染的细胞中,一半蛋白质上调。所鉴定的蛋白质的特征,包括蛋白质名称、登录号、倍数变化、蛋白质评分、匹配/搜索的质量数值、理论分子量/pi和预期值列于表1中。为了表征细胞反应在ev-a71感染期间,使用geneontology(go)数据库筛选这些显著改变的蛋白质的功能。发现参与细胞应激反应的蛋白质在ev-a71感染后变化最大。
表1.通过ev-a71感染和未感染的rd细胞之间的2-de和ms分析鉴定差异表达蛋白质。
a斑点号数字显示在图1a和图1b中;
b使用pdquest软件(bio-rad)量化斑点强度。从三个独立实验(ev-a71感染与未感染)计算每种蛋白质的斑点强度的平均倍数变化;'-',减少。
实施例2、蛋白质印迹分析蛋白质
使用rd细胞的全蛋白质提取物进行蛋白质印迹分析,所述rd细胞是假感染(mock)或ev-a71-感染,moi为10,感染后第6小时。选择与细胞应激反应相关的三种改变的伴侣蛋白(grp78,phb和hsp27)进行验证。与2-de分析中的观察结果一致,发现所有三种蛋白质都被上调(图1c、图1d)。
实施例3、在ev-a71感染的细胞中hsp27表达上调
为了揭示hsp27在ev-a71感染中的动态变化,本实施例分析了hsp27在病毒感染过程中的mrna和蛋白水平。在不同时间点从ev-a71感染的细胞中提取细胞mrna以及蛋白质。如图2a所示,hsp27的mrna水平在p.i.6小时和9小时时显著上调,6小时上调约100%。同样地,当病毒蛋白vp1以相对高的水平表达时,hsp27蛋白质水平在p.i.的6、9和12小时也增加40%至50%(图2b)。
在hela细胞中进一步证实了这些结果(图3a),表明ev-a71感染诱导了hsp27表达。
此外,病毒蛋白的新合成首先在p.i.第6小时检测到。同时在同一时间点也发现了hsp27的显著增加(图2b)。
进一步,本实施例中用uv灭活的ev-a71处理rd细胞,与感染性ev-a71不同,uv灭活的ev-a71不能促进hsp27的表达(图2c)。该结果表明ev-a71复制对于hsp27的上调是必不可少的。
实施例4、hsp27的敲除减少了ev-a71的复制
前述实施例的结果显示,ev-a71感染导致hsp27表达上调,hsp27可能在感染的反应中发挥作用。为了评估hsp27在ev-a71复制中的潜在功能,本实施例首先使用sirna敲除rd和hela细胞中的hsp27。结果表明,hsp27的敲低显著抑制病毒复制(图4a~图4c,图3b,图3c)。
进一步,本实施例使用crispr/cas9介导的缺失策略构建了hsp27敲除(hsp27-ko)细胞。选择hsp27的外显子1(图5a)作为产生敲除细胞系的靶位点。用人hsp27crispr/cas9敲除质粒转染rd细胞,然后用嘌呤霉素选择。通过蛋白质印迹测定进一步确定选择的集落。如图5b所示,hsp27在rd细胞中完全被敲除。两个hsp27-ko克隆(ko-1#、ko-2#)用于测试hsp27在ev-a71复制中的功能。如图5b所示,与rd野生型细胞相比,在ko-1#和ko-2#中病毒rna水平分别降低了31%和60%,而在hsp27-ko细胞中vp1蛋白分别降低了接近60%至80%。由ev-a71感染引起的细胞病变效应(cpe)也受到hsp27敲除的保护(图5c)。由于克隆ko-2#对于限制病毒复制显示出更强的效果,所以选择该克隆用于以下实验。hsp27在ev-a71感染中的作用以时间依赖性方式进一步证实。将野生型细胞以及hsp27-ko细胞用ev-a71以1的moi感染6、9、12h。分别用蛋白质印迹法和rt-qpcr测定法测定病毒蛋白质水平和rna水平。如图5d所示,在6小时的时间点,在hsp27-ko细胞中几乎不能检测到病毒蛋白vp1,而在该时间点在野生型细胞中已经明显检测到。在9和12小时时,hsp27-ko细胞中的vp1水平也显著降低了50%。与vp1水平降低一致,hsp27-ko细胞中细胞内病毒rna水平也降低了60-70%(图5e)。令人惊讶的是,野生型细胞培养基中的病毒产量比hsp27-ko细胞高500%(图5f)。此外,当恢复hsp27-ko细胞时,hsp27显著增强病毒rna和蛋白质水平(图6a~图6c)。在敲除细胞中恢复hsp27后,上清液中的病毒粒子也增加约4倍(图6d)。
实施例5、hsp27的异位表达促进ev-a71的增殖
为了进一步证明hsp27在ev-a71感染中的作用,本实施例用不同剂量的hsp27表达质粒转染hek293t细胞。转染后48小时,用ev-a71以1的moi感染细胞12小时。通过蛋白质印迹试验证实hsp27和病毒vp1蛋白水平。
如图7a所示,hsp27和病毒vp1蛋白水平均以剂量依赖性方式在细胞中显著增加。更重要的是,vp1水平的增加与hsp27的异位表达水平正相关。例如,当hsp27的表达水平增加约6倍时,相应的vp1水平显著增加3~4倍。与vp1和hsp27水平的增加一致,当用400nghsp27表达质粒转染细胞时,细胞内病毒rna和分泌的病毒粒子rna水平在6和12小时的时间点几乎加倍或甚至三倍(图7b~图7c)。在异位表达hsp27后,上清液中的病毒滴度也显著增加3~4倍(图7d)。从hela细胞也获得了类似的结果(图3d~图3e)。
实施例6、hsp27上调ev-a71ires活性
本实施例测定hsp27对ev-a71ires活性的影响,其中使用双顺反子报告质粒(wang,m.,dong,q.,wang,h.,he,y.,chen,y.,zhang,h.,wu,r.,chen,x.,zhou,b.,he,j.etal.(2016)oblongifolinm,anactivecompoundisolatedfromachinesemedicalherbgarciniaoblongifolia,potentlyinhibitsenterovirus71reproductionthroughdownregulationoferp57.oncotarget,7,8797-8808)。将双顺反子报告质粒转染到野生型细胞和hsp27-ko细胞中。培养48小时后,用双荧光素酶测定试剂盒测定rluc和fuc活性。fluc与rluc的归一化比率表示ires活性。
如图8a所示,敲除hsp27导致ev-a71ires活性降低40%。另一方面,hsp27的异位表达导致ires活性增加约30%(图8b)。病毒2apro负责切割eif4g以启动ires介导的翻译。在将2apro表达质粒转染到rd细胞中后,ires活性被刺激超过12倍,而蛋白酶缺陷突变体对刺激ires活性没有影响。引人注目的是,ires活性使hsp27-ko细胞中的基线ires活性降低了40%以上;当2apro异位表达时,与野生型细胞的结果相比,hsp27-ko细胞中的ires活性也降低了约40%-50%(图8c)。
在hek293t细胞中,hsp27的异位表达以剂量依赖性方式增加2apro介导的ires活性(图8d)。为了测试hsp27是否可以影响2apro蛋白酶活性,首先检测hsp27是否上调eif4g的表达水平。结果显示eif4g水平不受异位表达的hsp27的干扰(图8e)。然后检查了hsp27是否影响了2apro蛋白酶活性。如图8f所示,令人惊讶的是,无论在这些实验中使用或多或少的2apro-表达质粒,hsp27强烈增强2apro蛋白酶活性。在hsp27-ko细胞中,当细胞用moi为1的ev-a71感染时,eif4g的切割在6小时时显著降低至接近基础水平(图8g)。当重组2apro与rd野生型和hsp27-ko细胞裂解物在37°温育4小时时观察到几乎相同的结果(图8h)。进一步,发现2apro的异位表达促进了野生型rd细胞中的病毒vp1表达(图8i,泳道3与泳道1相比较),而hsp27的敲除几乎消减了病毒vp1表达,无论是否有2apro促进(图8i,泳道4与泳道3和泳道1相比较)。
实施例7、hsp27的敲除抑制ev-a71诱导的hnrnpa1易位
hnrnpa1,一种ires反式作用因子(itafs),据报道在ires依赖性翻译中发挥重要作用。在ev-a71感染后,hnrnpa1将从细胞核易位至细胞质并与ev-a715'utr相互作用。本实施例中,将野生型rd和hsp27-ko细胞用20或40moi的ev-a71感染6小时,然后通过免疫荧光染色观察细胞内hnrnpa1蛋白分布。结果发现hnrnpa1通常位于假感染细胞的细胞核中(图9a,上面的图片),并且在ev-a71感染后从细胞核转移到细胞质(图9a,左边的中间图片和下图片)。然而,hnrnpa1的易位在hsp27-ko细胞中几乎完全被阻断(图9a,右边的中间图片和下图片)。进一步进行rna免疫沉淀(rip)测定以剖析hnrnpa1与病毒5'-utr的结合活性。如图9b所示,敲除hsp27导致病毒rna与hnrnpa1结合的显著减少。
实施例8、hsp27抑制剂tdp抑制ev-a71感染
1,3,5-三羟基-13,13-二甲基-2h-吡喃[7,6-b]氧杂蒽酮(tdp),一种从中草药藤黄(garciniaoblongifolia)中分离出来的天然产物,已证明是hsp27的抑制剂(fu,w.m.,zhang,j.f.,wang,h.,xi,z.c.,wang,w.m.,zhuang,p.,zhu,x.,chen,s.c.,chan,t.m.,leung,k.s.etal.(2012)heatshockprotein27mediatestheeffectof1,3,5-trihydroxy-13,13-dimethyl-2h-pyran[7,6-b]xanthoneonmitochondrialapoptosisinhepatocellularcarcinoma.journalofproteomics,75,4833-4843)。本实施例中,通过cpe测定在rd细胞中测试tdp的抗病毒作用。将细胞用tdp预处理2小时,然后用moi为0.01的ev-a71感染。感染后8小时,使用相差显微镜检测cpe。
如图10a所示,在ev-a71感染后细胞变圆并从培养皿上脱离。tdp处理保护细胞免受ev-a71感染,并以剂量依赖性方式显著降低cpe。与cpe降低一致,tdp显著抑制ev-a71复制,表现为细胞内病毒rna和病毒蛋白的水平大大降低(图10b和图10c)。tdp也抑制病毒诱导的eif4g切割(图10c)。此外,在tdp处理后,上清液中的病毒产量显著降低(图10d)。而且,与对照组(control)相比,tdp抑制了ires活性(图10e)。
sequencelisting
<110>香港城市大学深圳研究院
<120>靶向hsp27抑制肠道病毒a71型感染的方法及相关应用
<130>gai18cn5229
<160>9
<170>patentinversion3.5
<210>1
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>小干扰rna
<400>1
ggauggcgugguggagauc19
<210>2
<211>19
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>小干扰rna
<400>2
aggaguggucgcagugguu19
<210>3
<211>20
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>hsp27的靶sgrna
<400>3
gcauagccgccucuucgacc20
<210>4
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>引物
<400>4
gattccacccatggcaaattcca23
<210>5
<211>24
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>引物
<400>5
tggtgatgggatttccattgatga24
<210>6
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>引物
<400>6
gcagcccaaaagaacttcac20
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>引物
<400>7
atttcagcagcttggagtgc20
<210>8
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>引物
<400>8
cacgaggagcggcaggac18
<210>9
<211>22
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>引物
<400>9
ggacagggaggaggaaacttgg22
- 还没有人留言评论。精彩留言会获得点赞!