一种抑制淀粉样蛋白聚集的化合物及其应用的制作方法
本发明属于生物医药技术领域,具体涉及一种抑制淀粉样蛋白聚集的化合物及其应用。
背景技术:
阿尔兹海默症(alzheimer’sdisease,ad)是老年痴呆症的一种,主要发病于老年以及老年前期,是以进行性认知障碍以及行为损害为特征的神经退行性疾病。在我国,ad呈现出高发态势,随着老龄化社会的到来,ad将严重影响人民生命健康,同时将带给社会以及家庭带来严重负担。
阿尔兹海默症患者脑部出现淀粉样斑块沉积,是ad的一个重要组织病理学特征。其中淀粉样斑块主要为β-淀粉样蛋白(β-amyloid,aβ)及其聚集体沉积。淀粉样蛋白级联假说认为,脑内aβ的产生以及清除失衡,导致aβ含量不断增多,由于aβ自身的易聚集性质,其不断聚集形成寡聚体以及纤维,最终形成斑块,并对神经元造成损伤,导致神经元功能失衡,出现认知障碍以及行为损害。
脑内的aβ由淀粉样前体蛋白(app)经过β-分泌酶以及γ-分泌酶水解产生。aβ的一个重要特征是在体内能够自发聚集,形成不同程度的聚集态。大量研究表明,aβ在聚集形成纤维的过程中形成的寡聚体毒性最大。在生理条件下,aβ单体构象发生改变,相互之间互相靠近形成寡聚体,寡聚体则会进一步聚集形成原纤维。原纤维为含有β-sheet结构,可以被相应的荧光染料所识别检测。原纤维通过aβc端疏水区相互作用,最终形成具有稳定构象的aβ纤维,纤维不断增多,最终形成淀粉样斑块在脑内沉积,导致ad的病理过程。
β在γ-分泌酶作用下主要产生aβ1-40或者aβ1-42。研究表明,在体内aβ1-40含量是aβ1-42的10倍,但是aβ1-42的疏水性更强,更容易发生聚集,毒性更大。
研究表明,靶向aβ1-42n端利于化合物抑制aβ1-42聚集,以及在一定程度上,促进已聚集的aβ1-42聚集体解聚,降低aβ1-42毒性。
迄今为止,尚无有效治疗ad的药物。目前临床上主要使用的是乙酰胆碱酯酶抑制剂以及n-甲基-d-天冬氨酸受体拮抗剂,但是这类药物不能有效治愈阿尔兹海默症。
综上,在治疗ad的领域,有必要研究能够有效抑制aβ聚集同时具有解聚aβ聚集体活性的小分子药物,以期应用于ad疾病的治疗。
技术实现要素:
本发明旨在克服上述现有技术的至少一种缺陷,提供一种抑制淀粉样蛋白聚集的化合物及其应用,以达到治疗ad疾病,有效抑制aβ蛋白的聚集。
本发明采取的技术方案是,提供一种具有抑制淀粉样蛋白聚集的化合物,所述化合物为酒石酸麦角胺。
本发明所提供的酒石酸麦角胺,目前主要用于偏头痛的治疗。对于已上市药物其药物的吸收、分布、代谢、排泄以及毒副作用均已明确,临床禁忌已知,临床前期数据已完备;且酒石酸麦角胺用于偏头痛治疗,易于透过血脑屏障,为开发酒石酸麦角胺的老药新用功能奠定基础,具有潜在应用于阿尔兹海默症的治疗。
进一步的,所述酒石酸麦角胺作用于aβn端,抑制aβ聚集,同时降低aβ所导致的细胞毒性。
进一步的,本发明的另有目的在于所述酒石酸麦角胺在治疗阿尔兹海默病中的应用。
本发明所提供的酒石酸麦角胺具有选择性作用于aβ1-42n端,抑制aβ1-42聚集,解聚aβ1-42聚集体活性。
与现有技术相比,本发明的有益效果为:
本发明所述的酒石酸麦角胺能够选择性作用于aβ1-42n端,抑制aβ1-42聚集,解聚aβ1-42聚集体活性,且能够在一定程度上,促进已聚集的aβ1-42聚集体解聚,降低aβ1-42毒性,具有治疗阿尔兹海默病的作用,能够应用于阿尔兹海默症的治疗。
附图说明
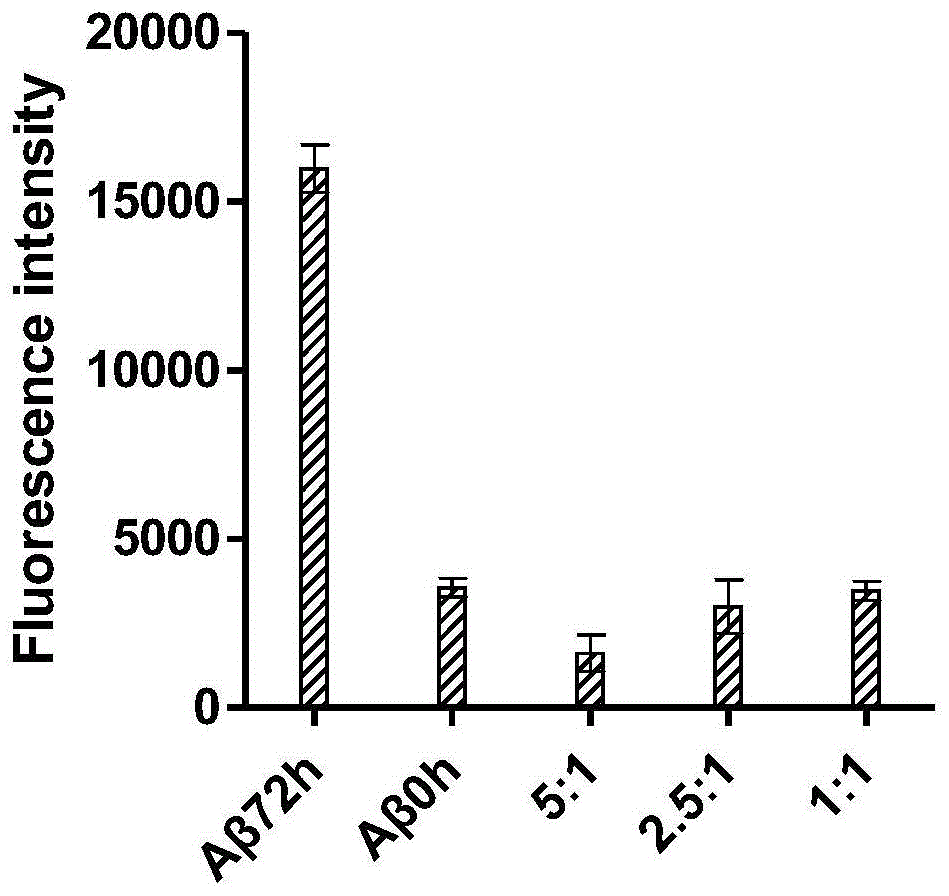
图1为采用硫磺素t荧光法评价酒石酸麦角胺抑制aβ1-42聚集能力实验结果图。
图2为采用硫磺素t荧光法考察酒石酸麦角胺抑制aβ1-42聚集能力的半数抑制浓度ic50实验结果图。
图3为酒石酸麦角胺作用于aβ1-42时,对aβ1-42的作用位点区域选择性实验结果图。
图4为采用spr方法考察酒石酸麦角胺与aβ1-42的亲和力大小实验结果图。
图5为酒石酸麦角胺降低aβ1-42对pc12的细胞毒性实验结果图。
具体实施方式
本发明附图仅用于示例性说明,不能理解为对本发明的限制。为了更好说明以下实施例,附图某些部件会有省略、放大或缩小,并不代表实际产品的尺寸;对于本领域技术人员来说,附图中某些公知结构及其说明可能省略是可以理解的。
实施例1
本实施例采用硫磺素t荧光法评价酒石酸麦角胺抑制aβ1-42聚集能力。
硫磺素t(thioflavint,tht)是一种苯并噻唑类染料,其在溶液中的荧光很弱,但是结合在β-sheet丰富的淀粉样蛋白纤维后,自身结构中的来自苯并噻唑环和苯胺环连接的碳碳单键的转动自由能受到限制,苯并噻唑环和苯胺环成共平面,可以在444nm的光激发下,在484nm处产生荧光。
本实施例aβ1-42(ag970,milliporemeck)用50mmpbs配置成40μm工作液,酒石酸麦角胺依次配置成200μm,100μm,40μm与aβ1-42对半稀释,37℃孵育72h,aβ1-42蛋白溶液与5μm硫磺素t混合反应5min,酶标仪测定蛋白溶液在激发波长444nm,发射波长484nm处的荧光强度。
根据图1的结果显示,在0h处,由于单体化未聚集的aβ1-42与硫磺素t结合较少,因此,该时间点的荧光很弱。但是经过72小时的反应和孵育之后,由于聚集的aβ1-42与硫磺素t的结合,使得荧光强度最强。而加入不同比例的酒石酸麦角胺后,荧光强度低于0h的水平,可见其对aβ1-42的聚集有明显的抑制作用,且呈现一定的量效关系,即酒石酸麦角胺的比例越大,则荧光越弱,说明对aβ1-42聚集的抑制作用越强。
因此,从实施例1可知,酒石酸麦角胺具有抑制aβ1-42聚集的能力,且呈现了一定的量效关系。
实施例2
本实施例采用硫磺素t荧光法考察酒石酸麦角胺抑制aβ1-42聚集能力的半数抑制浓度ic50。
(halfmaximalinhibitoryconcentration)是指被测量的拮抗剂的半抑制浓度。它能指示某一药物或者物质(抑制剂)在抑制某些生物程序(或者是包含在此程序中的某些物质,比如酶,细胞受体或是微生物)的半量。
本实施例将aβ1-42用50mmpbs配置成40μm工作液,酒石酸麦角胺按照与aβ1-42比例10:1,5:1,2.5:1,1.125:1,0.625:1,0.3125:1当量比依次配置工作液,按照实施例1的方法孵育aβ1-42蛋白溶液,使用硫磺素t检测荧光强度,求得酒石酸麦角胺ic50值为0.887μm。
因此,结合图2所示,说明酒石酸麦角胺的灵敏度高,特异性强。
实施例3
本实施例为酒石酸麦角胺作用于aβ1-42时,对aβ1-42的作用位点区域选择性的实验。
β1-42抗体6e10特异性识别其1-16位氨基酸,4g8抗体识别其17-24位氨基酸,2235抗体识别其22-35位氨基酸,三段抗体分别代表了aβ1-42n端,中端,c端三个区段。
β1-42与酒石酸麦角胺按照5:1,2.5:1,1:1当量比37℃孵育3h,dotblot分析酒石酸麦角胺对aβ1-42作用位点的选择性。
结合图3所示,说明酒石酸麦角胺能选择性作用在aβ1-42蛋白的1-16位氨基酸和22-35位氨基酸,特别针对1-16位氨基酸,呈现明显的量效关系。
实施例4
本实施例采用spr方法考察酒石酸麦角胺与aβ1-42的亲和力大小。
当入射光以临界角入射到两种不同折射率的介质界面时,可引起金属自由电子的共振,即表面等离子体共振(surfaceplasmonresonance,spr),由于共振致使电子吸收了光能量,使反射光在一定角度内明显减弱。其中,使反射光在一定角度内完全消失的入射角称为spr角。spr角随表面折射率的变化而发生变化,而折射率的变化又与结合在金属表面的生物分子质量成正比。因此,可以通过生物反应过程中spr角的动态变化,得到生物分子之间相互作用的特异性信号,当分析物流经生物大分子发生结合作用时,光密度值发生改变,结合越多,临界角的改变越大,结合的强弱使用ru来表征。
本实施例将aβ1-42蛋白用10mm的醋酸缓冲盐(ph5.0)溶解成50μg/ml,以25μl/min的流速标记活化后的glh芯片,将配制好的系列浓度的环肽溶液以30μl/min的速度流过glh芯片,持续时间为240s,此阶段为酒石酸麦角胺与aβ1-42的结合期。使用pbst缓冲液以30μl/min的流速流过芯片,持续时间为360s,此阶段为酒石酸麦角胺与aβ1-42的解离期。解离后,用0.42%的磷酸以100μl/min的流速再生芯片18s。
样品测试结束后,使用proteonmanager软件,通过双背景扣除法获得最终的spr数据,并选择合适的结合模型根据匹配拟合曲线获得亲和常数kd值,如图4所示,经过拟合,酒石酸麦角胺与aβ1-42的亲和常数kd值为1.02×10-5m。
因此,亲和常数kd值越小,配体对于其目标的结合亲和力就越大。从本实施例的数据可知,酒石酸麦角胺与aβ1-42的亲和力很强,因此便于二者的结合,从而有效抑制aβ1-42的聚集。
实施例5
本实施例为酒石酸麦角胺降低aβ1-42对pc12的细胞毒性实验。
细胞是从大鼠肾上腺嗜铬细胞瘤克隆的细胞株,主要分泌产物为儿茶酚胺类递质包括多巴胺、去甲肾上腺素等。膜上有ngf受体,受生理水平ngf诱导后,它们停止分裂,长出神经突起,分化为具有交感神经元特性的细胞,常被用于分析神经元分化和ngf作用分子机制的研究,也被用于研究生长因子调节神经细胞基因表达改变的机制。由于aβ1-42的聚集对pc12有一定的毒性作用,因此,通过酒石酸麦角胺抑制aβ1-42的聚集,从而降低aβ1-42对pc12的毒性作用。
体外培养的pc12细胞按照2x104细胞每孔接种到96孔板中,贴壁12小时后,如图5所示,本实施例设置空白对照组、10μmaβ1-42蛋白组、10μmaβ1-42蛋白+10μm酒石酸麦角胺组、10μmaβ1-42蛋白+15μm酒石酸麦角胺组、15μm酒石酸麦角胺组,加入相应浓度的aβ1-42以及酒石酸麦角胺,18h后采用mtt方法检测细胞存活率。
如图5所示,可知,空白对照组和15μm酒石酸麦角胺组的细胞成活率最高,说明酒石酸麦角胺对细胞没有表现出明显的毒性,而10μmaβ1-42蛋白组的细胞活性只有约50%的存活率,说明aβ1-42蛋白对细胞有明显的毒性,而通过分别加入10μm和15μm的酒石酸麦角胺后,由于酒石酸麦角胺抑制aβ1-42蛋白的聚集和细胞毒性,因此能够明显提高细胞活性。
显然,本发明的上述实施例仅仅是为清楚地说明本发明技术方案所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!