抑制Crif1与PKA相互作用的化合物的应用的制作方法
本发明涉及分子生物技术领域,具体而言,涉及一种抑制crif1与pka相互作用的化合物的应用。
背景技术:
机体在受到中剂量的照射后会产生严重的骨髓抑制,造血功能受损。造血微环境结构和功能异常致造血抑制是骨髓型急性放射病的主要病理机制。而骨髓间充质干细胞(bm-mscs)成骨、成脂定向分化失衡是其造血支持功能缺失的关键环节。研究表明放射可致其成骨(减弱)、成脂(增强)定向分化失衡,脂肪细胞对造血具有抑制作用,氨磷汀(wr-2721)是唯一通过美国食品药品管理局核准上市用于放射治疗的辐射防护剂。
放射损伤后,骨形成显著减弱而骨吸收增强进而导致严重的骨质疏松。此外,脂肪细胞也是骨髓腔内破骨细胞分化关键因子rankl的主要来源。成骨分化减少而破骨分化增强是放射致骨质疏松的主要病理机制。骨质疏松是一种全身性骨代谢疾病,其主要特征是骨形成减少而骨吸收增强,骨组织微结构被破坏以致骨折风险增加。目前治疗该类疾病的药物主要分为三类:骨吸收抑制剂是当前的主要药物,如双膦酸盐类药物,主要通过抑制骨的重吸收来提高骨密度;骨形成促进剂可以直接刺激骨形成,并且有重建骨组织的效应,其中特立帕肽(teriparatide)属于pth类似物,是目前唯一批准上市的一类骨形成促进剂;骨矿化物是防治骨质疏松的基础药物,如钙和维生素d。然而,随着科学研究的不断深入,靶向治疗成为未来药物的发展趋势。
rankl由于其在破骨细胞形成中的关键作用而成为骨质疏松疾病治疗的主要靶点。其中迪诺塞麦(denosumab)是rankl的完全人源化单克隆抗体,对rankl具有高度的特异性及亲和力,其可抑制rankl与rank的结合,减少破骨细胞的形成,进而降低骨吸收,增加骨量。
目前,氨磷汀最理想的细胞防护剂量为400mg/kg,但在此剂量下,通常会产生明显的不良反应。而迪诺塞麦主要适用于较高骨折风险的绝经后骨质疏松症。但是迪诺塞麦存在某些不良反应,其主要不良反应包括:低钙血症、严重感染、皮疹、皮肤瘙痒、肌肉或骨痛、下颌骨坏死、非典型性股骨骨折等,且此药国内暂未上市。
技术实现要素:
本发明的目的在于提供一种化合物在制备抑制crif1蛋白与pka结合的抑制剂中的应用,该化合物能够结合crif1蛋白,有效防止或减少crif1对pka活性的增强,降低pka的信号传递。
本发明的另一目的在于提供一种化合物在制备促进骨髓损伤修复药物中的应用,通过调控pka信号通路,以降低rankl的表达,从而减少破骨细胞的形成,促进骨髓损伤修复。
本发明是这样实现的:
本发明提供了一种化合物在制备抑制crif1蛋白与pka(激酶a)结合的抑制剂中的应用,该化合物为噻唑胺类化合物或烷二胺类化合物。
具体地,上述噻唑胺类化合物包括:如式1所示的第一化合物,式2所示的第二化合物。
式1:
式2:
烷二胺类化合物包括有如式3所示的第三化合物,如式4所示的第四化合物以及如式5所示的第五化合物。
式3:
式4:
式5:
具体地,式1中的r1、r2、r3或r4均为卤素,卤素包括有氟(f)、氯(cl)、溴(br)、碘(i)、砹(at)以及钿(ts),优选地,r1、r2、r3或r4均为cl,请参照化合物1的结构式:
式2中的r1和r2均为烷基,优选地,式2中的r1和r2均为支链烷基或直链烷基,进一步优选地,式2中的r1和r2均为c1-c8支链烷基或直链烷基,更进一步的优选地,r1和r2均为甲基、乙基或正丙基。当r1和r2为甲基时,式2的结构式如化合物2的结构式所示:
式4中的r1、r2和r3均为烷基,优选地,式4中的r1、r2和r3均为支链烷基或直链烷基,进一步优选地,式4中的r1、r2和r3均为c1-c8支链烷基或直链烷基,更进一步的优选地,式4中的r1、r2和r3均为甲基、乙基或正丙基。当式4中的r1、r2、r3均为甲基时,式4的结构式如化合物4所示:
式5中的r1为烷基,优选地,式5中的r1为支链烷基或直链烷基,进一步优选地,式5中的r1为c1-c8支链烷基或直链烷基,更进一步的优选地,式5中的r1为甲基、乙基或正丙基。当式5中的r1为甲基时,式5如化合物5的结构式所示:
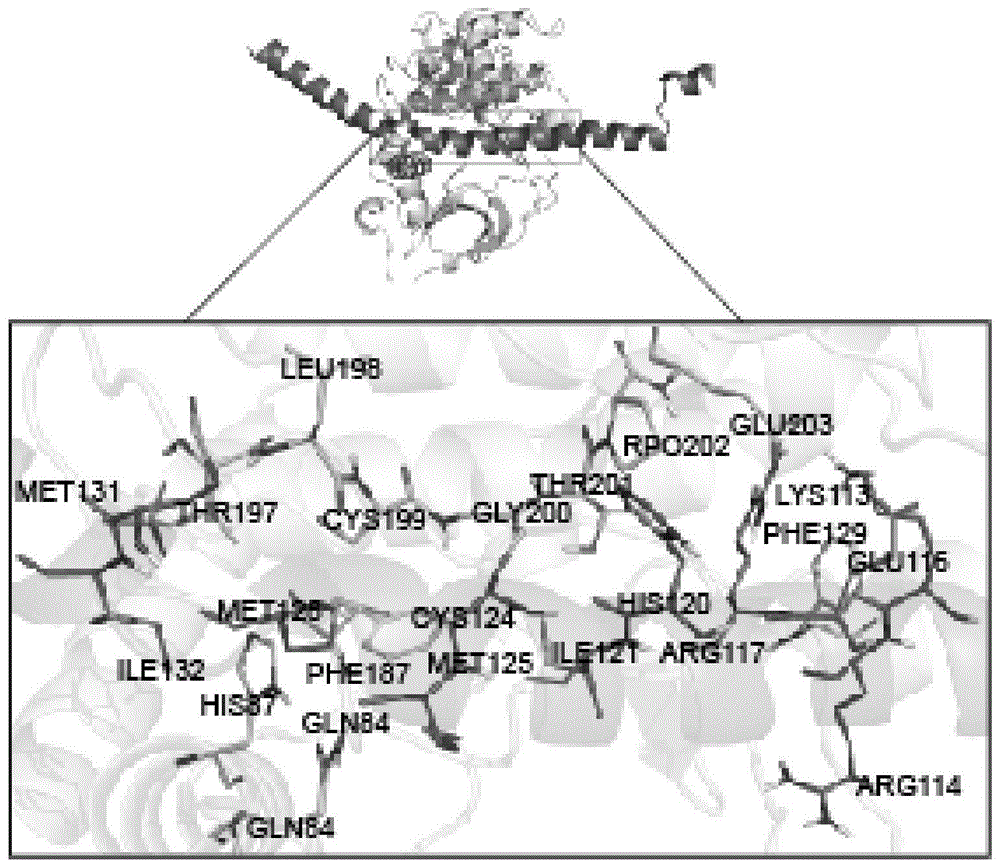
具体地,正常情况下,crif1蛋白能与pka相互结合,结合后可促进增强pka的活性,从而增加creb的磷酸化。crif1蛋白能与pka相结合的示意图如附图1所示。
crif1蛋白能够与噻唑胺类化合物或烷二胺类化合物相结合。具体地,上述化合物1~化合物5的结构式所示的化合物与crif1蛋白相结合的示意图如图2所示。因此,在加入了噻唑胺类化合物或烷二胺类化合物之后,crif1蛋白与pka的结合受到了抑制。
具体地,该化合物具有与crif1蛋白相结合的第一位点,且所述第一位点与crif1与pka相结合的第二位点相同或具有相同的部分。该化合物与crif1结合后,能够抑制crif1与pka的结合,从而避免或减少crif1对pka的激活。
进一步地,在本实施例中,化合物与所述crif1蛋白的结合自由能小于-7.0kcal/mol,对接效率le大于0.27。优选地,化合物与所述crif1蛋白的结合自由能小于-10.0kcal/mol;更进一步优选地,化合物与所述crif1蛋白的结合自由能小于-12.0kcal/mol。
进一步地,上述化合物无细胞毒性,或上述化合物在其浓度不超过100μm时对细胞无毒性。
进一步地,抑制crif1蛋白与pka结合可以用于抑制rankl的表达。具体地,crif1蛋白与化合物相结合后,crif1蛋白与pka的结合受到抑制。因此,有化合物存在的情况,pka的活性显著低于没有化合物存在的情况,pka的信号通路受到影响,而pka能够调控rankl的表达,因此,pka的活性降低,rankl表达水平也降低。
进一步地,抑制crif1蛋白与pka结合用于抑制成脂分化。具体地,在有化合物存在的情况下,pka的活性受到抑制,从而使由激活pka促进骨髓间充质干细胞的成脂分化的效果显著降低。
进一步地,抑制crif1蛋白与pka结合用于抑制creb磷酸化,特别是由forskolin刺激引起的creb磷酸化。
具体地,同上述机理,crif1蛋白与化合物相结合后,crif1蛋白与pka的结合受到抑制,pka的活性降低,因此,由活性pka促进的creb磷酸化也被降低。
进一步地,抑制crif1蛋白与pka结合用于抑制pka活性。
此外,本发明实施例还提供了一种化合物在制备促进骨髓损伤修复药物中的应用,化合物为噻唑胺类化合物或烷二胺类化合物。该2类化合物的具体信息如上述应用,在此不再赘述。
具体地,上述化合物能够降低rankl的表达水平和成脂分化,降低破骨细胞的生成,从而促进骨髓损伤修复。
本发明具有以下有益效果:
本发明实施例提供了一种化合物在制备抑制crif1蛋白与pka结合的抑制剂中的应用,该化合物能够结合crif1蛋白,有效防止或减少crif1对pka活性的增强,以降低pka的信号传递。
此外,本发明还提供了一种化合物在制备促进骨髓损伤修复药物中的应用,该化合物通过结合crif1,降低crif1对pka的激活,从而降低creb磷酸化,以降低rankl的表达水平,rankl减少会导致破骨细胞的减少,从而促进骨髓损伤修复,同时该化合物能够有效降低细胞的成脂分化,有助于骨质疏松的早期治疗以及造血恢复。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明实施例发明内容中crif1蛋白能与pka相结合的示意图;
图2为本发明实施例发明内容中化合物与crif1蛋白相结合的示意图;
图3为本发明实施例1中化合物1的毒性实验结果图;
图4为本发明实施例1中化合物2的毒性实验结果图;
图5为本发明实施例1中化合物3的毒性实验结果图;
图6为本发明实施例1中化合物4的毒性实验结果图;
图7为本发明实施例1中化合物5的毒性实验结果图;
图8为本发明实施例1中的5个化合物对细胞成脂分化的影响结果图;
图9为本发明实施1中,9gy剂量辐射后,化合物对细胞成脂分化的影响结果图;
图10为本发明实施例1中化合物抑制rankl表达水平的检测图;
图11为本发明实施例1中化合物对opg表达水平的影响结果图;
图12为本发明实施例1中化合物对rankl/opg的影响图;
图13为本发明实施例1中化合物对creb以及p-creb的表达结果的影响结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供的抑制crif1与pka相互作用的化合物的筛选方法。
1.以crif1为靶点的lifechemicals化合物库的生物信息学筛选
1.1life化合物库小分子的分割和预处理
使用python编程,对life化合物库的mol2大文件进行分割,将每个小分子单独分割出来,一共得到462608个小分子。
1.2.基于ledock的大规模虚拟筛选
使用ledock中的受体处理程序,将crif1蛋白处理为合适的pdb受体文件,设定对接盒子中心位于120残基上,盒子边长为30ⅹ35ⅹ30,覆盖112-128区域。使用ledock中的分子对接程序,将life库中的小分子分为15组,分别与受体蛋白质进行并行分子对接,计算结合自由能energy和对接效率le。使用python编程,提取对接效率和结合自由能均较高的结果,作为第二轮筛选的候选小分子。
1.3.基于ledock的虚拟筛选结果
基于ledock对接算法,分别计算了462608个小分子和crif1蛋白(靶蛋白)的对接,其中,结合自由能<-7.0kcal/mol的小分子有12490个,对接效率le>0.27的小分子有5874个。而同时满足这两个条件的小分子有384个。
1.4.基于autodockvina的第二轮筛选
将步骤1.3中得到的384个小分子化合物,使用经典分子对接软件autodockvina进行计算机虚拟筛选。首先,使用adttools工具,将受体蛋白质结构处理为pdbqt格式,对接盒子的大小与步骤1.2中相同,盒子中心位于120残基上,盒子边长为30x35x30。使用raccoon程序,将mol2格式的384个小分子,分别处理为pdbqt格式。使用vina1.1.2,在shell环境下进行批量分子对接。使用shell编程,提取每个小分子最优结合位置(最低自由能)的对接数据。
1.5.基于autodockvina的第二轮筛选
vina的第二轮对接结果显示,384个小分子中,在vina的计算方法下,结合自由能<-7.0kcal/mol的小分子还有320个。这一结果强烈提示,384个小分子中的大部分,在vina与ledock的分别评价中均具有很高的亲和力。详细结果见all_results.xlsx文件。其中,结合自由能<-10.0kcal/mol的小分子有58个,如表1所示。
表1两轮筛选过后得到的58个高亲和力的小分子
2.化合物细胞毒性实验
从步骤1.5中得到的58个小分子中,选取亲和力前13位的化合物进行细胞毒性实验。最终筛选出5个细胞毒性较低的化合物:f0382-0033(c32h18cl4n4o3s2),f3408-0031(c27h37n3o4),f3408-0076(c30h31n3o5),f1430-0134(c22h17n3s3),f1430-0130(c20h22n6o2)。
具体地,f0382-0033(c32h18cl4n4o3s2)的结构式如化合物1的结构式所示:
f3408-0031(c27h37n3o4)的结构式如化合物2的结构式所示;
f3408-0076(c30h31n3o5)的结构式如化合物3的结构式所示;
f1430-0134(c22h17n3s3)的结构式如化合物4的结构式所示;
f1430-0130(c20h22n6o2)的结构式如化合物5的结构式所示;
上述5个化合物与crif1蛋白结合的模拟图如图2所示。
化合物毒性实验的实验方法
2.1.hbm-mscs,verocells分别以3000个/孔细胞接种96孔板,100ul/孔培养基,培养24小时(在37℃,5%co2条件下)。
2.2.向培养板中分别加入10μl化合物,化合物终浓度梯度设置(μm):400,200,100,50,25,12.5,6.25,3.125,0。同时每种化合物的每种浓度均设置3个复孔。
2.3.3d后cck-8检测细胞增殖率:向每孔加入10μlcck-8溶液,将培养板在培养箱内孵育4小时,用酶标仪测定在450nm出的吸光度。
实验结果
化合物毒性实验结果请参照附图3~7,在附图3~7中,横坐标为化合物浓度(μm),纵坐标为600nm的吸光值。
结果显示,f0382-0033,f1430-0134对hbm-mscs,verocells几乎无毒性,f3408-0076,f3408-0031,f1430-0130在浓度不超过100μm时对两种细胞几乎无毒性。故选取25μm的浓度进行后续实验。
3.化合物抑制骨髓间充质干细胞成脂分化的研究
实验方法
3.1.骨髓间质干细胞以2×104cells/cm2的密度接种在六孔板中,每孔加入2ml完全培养基。将细胞置于37℃,5%co2的培养箱中进行培养。每隔三天换液,直到细胞融合度达到100%或者过融合。
3.2.小心地将间质干细胞完全培养基吸走,向六孔板中加入2ml成人骨髓间质干细胞成脂诱导分化培养基a液。
3.3.诱导3天后,吸走六孔板中的a液,加入2ml成人骨髓间质干细胞成脂诱导分化培养基b液。
3.4.24h后,吸走b液,换回a液进行诱导。a液和b液交替作用3-5次后(12-20天),继续用b液维持培养4-7天直到脂滴变得足够大、圆。b液维持培养期间,每隔2-3天需要换用新鲜的b液。
3.5.成脂诱导分化结束后,吸走六孔板中的间质干细胞成脂诱导分化培养基,用1×pbs冲洗1-2次。每孔加入2ml4%中性甲醛溶液,固定30min。
3.6.吸走中性甲醛溶液,用1×pbs冲洗2次。每孔中加入1ml油红o染料工作液染色30min。
3.7.吸走油红o染液,用1×pbs冲洗2-3次。将培养板置于显微镜下拍照观察成脂染色效果。
3.8.每孔细胞用异丙醇洗脱油红o,在510nm波长下测定od值,该od值即为成脂分化的定量结果。
实验结果
5个化合物分别以25μm的终浓度加入成脂诱导分化培养液中,21d诱导分化结束后,油红o染色,结果请参照附图8,图8显示,加入化合物各组成脂分化的细胞显著少于对照组细胞(p<0.01,以**标记)。
9gy剂量辐射后,再将各组细胞成脂诱导21d。油红o染色,结果请参照附图9,结果显示,加入化合物的各组成脂分化的细胞显著少于对照组细胞(p<0.01)。
4.化合物抑制rankl表达水平的检测
实验方法
4.1.hbm-mscs以1×105个/孔接种24孔板,1ml/孔培养基,培养24小时(在37℃,5%co2条件下)。
4.2.向培养板中分别加入10μl化合物,化合物终浓度25μm,同时每个化合物均设置3个复孔。培养3小时(在37℃,5%co2条件下)。
4.3.向培养板中分别加入forskolin,终浓度25μm。在37℃,5%co2条件下继续培养。
4.4.3d后吸取细胞培养上清,分别应用rnakl、opgelisa试剂盒检测细胞分泌rnakl及opg的水平。
实验结果
5个化合物以25μm的终浓度首先处理细胞3小时后,加入终浓度25μm的forskolin刺激rankl的表达,处理3d后,提取细胞培养上清elisa检测rnakl,opg的表达情况,结果如附图10~12。
结果显示,5个化合物均可显著抑制rankl的表达(p<0.01),且除f1430-0134可显著促进opg表达外,其余4个化合物对opg表达无明显影响;与单独加入forskolin处理的对照组相比,5个化合物均可显著降低rankl/opg比值(p<0.01),以上结果提示5个化合物可显著抑制破骨分化关键调控因子rankl的表达。
5.化合物抑制rankl表达以及成脂分化的作用机制
实验方法
5.1.hbm-mscs以5×105个/孔接种6孔板,2ml/孔培养基,培养24小时(在37℃,5%co2条件下)。
5.2.向培养板中分别加入10μl化合物,化合物终浓度25μm,同时每个化合物均设置3个复孔。培养3小时(在37℃,5%co2条件下)。
5.3.向培养板中分别加入forskolin,终浓度25μm。在37℃,5%co2条件下继续培养。
5.4.30min后提取各组细胞总蛋白,wb检测各组creb,p-creb的表达情况。
实验结果
5个化合物以25μm的终浓度首先处理细胞3小时后,加入终浓度25μm的pka激动剂(forskolin),处理30min后提取各组细胞总蛋白,wb检测各组creb,p-creb的表达情况。
表达结果如附图13所示。提前将5个化合物处理细胞3小时后再加入forskolin,可显著抑制由forskolin刺激引起的creb磷酸化(p-creb),结果提示5个小分子化合物通过抑制pka-creb信号通路进而抑制下游rankl的表达及成脂分化。
综上所述,本发明实施例提供了一种化合物在制备抑制crif1蛋白与pka结合的抑制剂中的应用,该化合物能够结合crif1蛋白,有效防止或减少crif1对pka活性的增强,以降低pka的信号传递。
此外,本发明还提供了一种化合物在制备促进骨髓损伤修复药物中的应用,该化合物通过结合crif1,降低crif1对pka的激活,从而降低creb磷酸化,以降低rankl的表达水平,rankl减少会导致破骨细胞的减少,从而促进骨髓损伤修复,同时该化合物能够有效降低细胞的成脂分化,有助于骨质疏松的早期治疗及造血恢复。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!