一种格列美脲片组合物制剂及其制备方法与流程
本发明属于医药
技术领域:
,涉及一种格列美脲片组合物制剂及其制备方法。
背景技术:
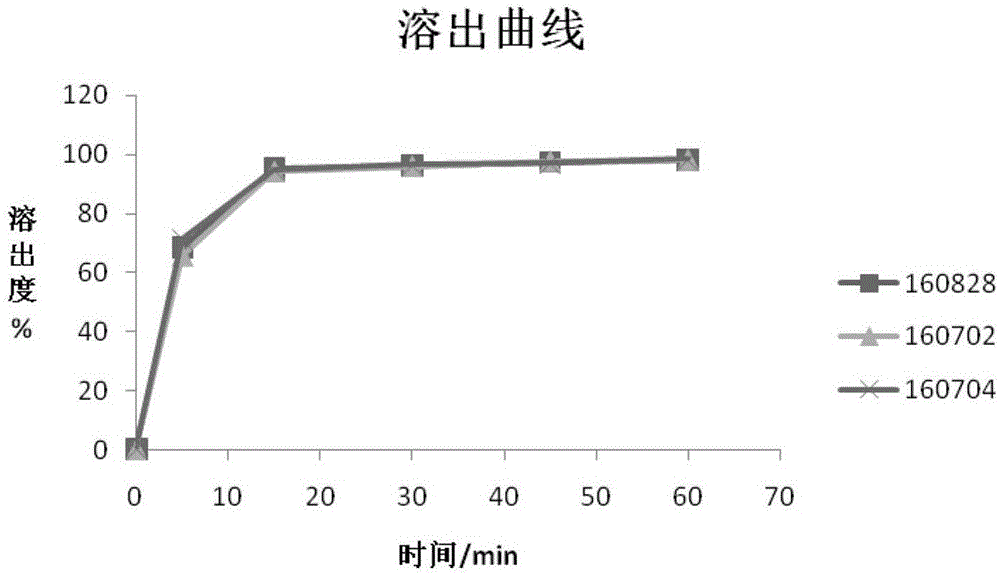
:格列美脲为一种可与胰岛素同时使用的磺酰脲类药物,它通过刺激胰岛素分泌降低血糖,结构式如下所示:由美国sanofi-aventis公司开发,于1995年9月首次在瑞典上市,同年11月经fda批准进入美国市场,用于治疗采取节食和运动而未能控制的ⅱ型糖尿病。鉴于其降糖作用平稳有效,且不良反应少,临床应用日益广泛。但格列美脲为bcsⅱ类药物,即低溶高渗药物,保证其溶解度是确保药物达到有效血液浓度的关键所在。中国专利cn102488667b公开了一种格列美脲片及其制备方法,为提高体外溶出度,将api的粒径粉碎至不大于2um,然后与辅料递增混合研磨,采用湿法制粒工艺制备;中国专利cn102755301b公开了一种格列美脲组合物片及其制备方法,该专利将api与甘露醇共同研磨后微粉化,然后加入其它辅料采用干法制粒工艺制备。上述两种格列美脲片组合物及其制备方法虽然能够提高格列美脲片溶出度,但原料药均需经气流粉碎,收率低、能耗大、增加了生产成本,且在粉碎过程中api的比表面能增大,活性增强,降解杂质增大,对产品质量及稳定性产生一定的风险。中国专利cn104027316a公开了一种格列美脲片剂及制备方法,该专利将格列美脲溶解在氯仿中,加入表面活性剂,混合均匀。经干燥去除氯仿,加入微粉硅胶,充分搅拌,再与其他辅料压制成片剂。该制备方法虽然提高了格列美脲片溶出度,但是采用了二类溶剂(氯仿),增加了潜在安全风险;中国专利201510056193.7公开了一种格列美脲片,是将格列美脲、羟丙基纤维素溶解在二乙二醇单乙基醚中,加入气相二氧化硅吸附,然后和药学上可接受的辅料混合均匀,采用直接压片工艺压制而成,采用了毒性较低的二乙二醇单乙基醚为溶剂,但是该溶剂沸点较高,难以去除,且该溶剂经动物实验表明具有麻醉作用及肾脏损害。经试验发现格列美脲在湿法制粒高温烘干时易产生降解杂质,且片剂在存放过程中有吸湿现象,导致体外溶出度下降;药物的溶解与结晶互为一对可逆反应,由于难溶性药物的结晶速度快,在较少量药物溶解时两个反应就达到了平衡,从而难溶性药物表现为溶出度低。提高难溶性药物溶出度可以从两个方面入手,一方面提高药物溶解速率,一方面降低结晶速率。通过氢键的相互作用能抑制难溶性药物重结晶,维持其过饱和状态,即降低药物的结晶速率,提高药物溶出度。共聚维酮是由乙烯吡咯烷酮与乙烯醋酸酯按一定比例形成的聚合物,其结构式如下所示:交联聚维酮及共聚维酮含有吡咯烷酮环以及乙烯醋酸酯基团,均为氢键受体,格列美脲含有酰胺基团,为氢键给体。两者通过氢键的相互作用,能够提高格列美脲的溶出度。针对上述不足,经大量实验研究,本发明的格列美脲片组合物在处方中加入交联聚维酮及共聚维酮,且制备工艺采用干法直压,api不需要微粉化,能够显著提升格列美脲体外溶出度,并且避免了制备和储存过程中降解杂质增大的风险。技术实现要素:为了克服以上现有技术中存在的问题,对格列美脲片的处方工艺进行了大量实验探索,api不需要微粉化,且能够保证格列美脲体外溶出度;避免了湿法制粒过程中降解杂质增大的风险,产品质量稳定性好。本发明提供一种格列美脲片组合物制剂,其特征在于该制剂由格列美脲、乳糖、微晶纤维素、交联聚维酮、共聚维酮以及硬脂酸镁组成。所述的格列美脲片组合物制剂采用粉末直接压片法压制而成。所述的格列美脲片组合物制剂每片含格列美脲的重量为1-3mg,优选2mg。所述的格列美脲原料药采用万能粉碎处理,其粒径d90为20um~40um;所述的乳糖选择直压性乳糖,用量为格列美脲的25~35重量份;优选meggle的80;所述的微晶纤维素选择可压性纤维素,用量为格列美脲的9~21重量份;优选fmc的avicelph-112;所述的交联聚维酮用量为格列美脲的2~3重量份;优选ashland的polyplasdonexl-10;所述的共聚维酮用量为格列美脲的2~3重量份;优选ashland的plasdones-630tm;所述的硬脂酸镁用量为格列美脲的0.1~1重量份。本发明提供一种上述格列美脲片组合物制剂的制备方法,包括以下步骤:格列美脲与乳糖混合;将上述混合物与剩余的乳糖、微晶纤维素、交联聚维酮、共聚维酮加入湿法制粒机中混合;将得到的混合物以及硬脂酸镁一起加入提升式立柱混合机中混合;将得到的混合物在高速压片机中进行压片。一种格列美脲片组合物制剂的制备方法,包括以下步骤:1)原料药采用万能粉碎处理,得到粒径d90为20μm~40μm的格列美脲;2)将步骤1)得到的格列美脲与3~50%处方量的乳糖采用等量递加法逐步混合;将上述混合物与剩余的乳糖、微晶纤维素、交联聚维酮、共聚维酮加入湿法制粒机中以200~400rpm搅拌转速、1500~2100rpm切碎转速,进行混合60s~120s;;3)将步骤2)得到的混合物以及硬脂酸镁一起加入提升式立柱混合机中,以8~15rpm的速度混合8min~15min;4)将将步骤3)得到的混合物在高速压片机中进行压片。一种格列美脲片组合物制剂的制备方法,其特征在于包括以下步骤:1)原料药采用万能粉碎处理,得到粒径d90为20μm~40μm的格列美脲;2)将步骤1)得到的格列美脲与3~50%处方量的乳糖采用等量递加法逐步混合;将上述混合物与剩余的乳糖、微晶纤维素、交联聚维酮、共聚维酮加入湿法制粒机中以300rpm搅拌转速,1800rpm切碎转速,混合90s;3)将步骤2)得到的混合物以及硬脂酸镁一起加入提升式立柱混合机中,以12rpm的速度混合10min;4)将将步骤3)得到的混合物在高速压片机中进行压片;5)制得格列美脲片剂采用铝塑包装。所述的格列美脲片组合物制剂,格列美脲与乳糖的重量比为1:25~35,优选重量比为1:30。优选meggle生产80直压乳糖。所述的格列美脲片组合物制剂,格列美脲与微晶纤维素的重量比为1:9~21,优选重量比为1:15。优选fmc生产的ph112可用于直接压片工艺的微晶纤维素。所述的格列美脲片组合物制剂,格列美脲与交联聚维酮的重量比为1:2~3,优选重量比为1:2.5。优选ashland生产polyplasdonexl-10。所述的格列美脲片组合物制剂,格列美脲与共聚维酮的重量比为1:2~3,优选重量比为1:2.5。优选ashland生产的plasdones-630tm。所述的格列美脲片组合物制剂,格列美脲与硬脂酸镁的重量比为1:0.1~1,优选重量比为1:0.25。分析表明,采用本方案制备出格列美脲片,平均溶出度均在93%以上,杂质ⅲ含量均小于0.1%,符合2015年版中国药典标准规定,且6个月的加速试验结果稳定。本发明基于交联聚维酮、共聚维酮与主药之间的氢键作用,采用粉末直接压片技术,不需要对api微粉化,保证了格列美脲片体外释放度,同时采用粉末直压技术克服了湿法制粒工艺高温干燥导致降解杂质增大的风险。该处方组成及制备工艺简单易,所得产品质量稳定性好,既能提高生物利用度,又能节约成本,为临床用药提供更好的选择,具有较高的经济及社会意义。附图说明图1.样品在ph7.8缓冲液中溶出曲线图2样品色谱图具体实施方式为了更好理解本发明的技术方案和优点,以下通过具体实施方式对本发明做进一步说明。实施例1处方组成:制备工艺:将格列美脲原料药经万能粉碎处理,要求粒径分布d90为20μm~40μm,按照以上处方称取格列美脲原料药及各种辅料。将格列美脲与6kg乳糖在hlsg20b湿法混合制粒机内以200rpm搅拌转速,1500rpm切碎转速,采用等量递加法逐步混合,得混合物a。将混合物a与剩余的乳糖、微晶纤维素、交联聚维酮、共聚维酮加入hlsg110c湿法制粒机中以200rpm搅拌转速,1500rpm切碎转速,混合60s,得混合物b。混合物b以及硬脂酸镁一起加入提升式立柱混合机中,以8rpm的速度混合15min,得混合物c。混合物c在高速压片机中进行压片,制得20万片的格列美脲片。制得格列美脲片剂采用铝塑包装。实施例2处方组成:制备工艺:将格列美脲原料药经万能粉碎处理,要求粒径分布d90为20μm~40μm,按照以上处方称取格列美脲原料药及各种辅料。将格列美脲与6kg乳糖在hlsg20b湿法混合制粒机内以300rpm搅拌转速,1800rpm切碎转速,采用等量递加法逐步混合,得混合物a。将混合物a与剩余的乳糖、微晶纤维素、交联聚维酮、共聚维酮加入hlsg110c湿法制粒机中以300rpm搅拌转速,1800rpm切碎转速,混合90s,得混合物b。混合物b以及硬脂酸镁一起加入提升式立柱混合机中,以12rpm的速度混合10min,得混合物c。混合物c在高速压片机中进行压片,制得20万片的格列美脲片。制得格列美脲片剂采用铝塑包装。实施例3处方组成:制备工艺:将格列美脲原料药经万能粉碎处理,要求粒径分布d90为20μm~40μm,按照以上处方称取格列美脲原料药及各种辅料。将格列美脲与6kg乳糖在hlsg20b湿法混合制粒机内以400rpm搅拌转速,2100rpm切碎转速,采用等量递加法逐步混合,得混合物a。将混合物a与剩余的乳糖、微晶纤维素、交联聚维酮、共聚维酮加入hlsg110c湿法制粒机中以400rpm搅拌转速,2100rpm切碎转速,混合120s,得混合物b。混合物b以及硬脂酸镁一起加入提升式立柱混合机中,以15rpm的速度混合8min,得混合物c。混合物c在高速压片机中进行压片,制得20万片的格列美脲片。制得格列美脲片剂采用铝塑包装。试验例1格列美脲片含量均匀度试验按照实施例2所述方法,制得160628批、160702批、160704批样品,进行含量均匀度测定。含量均匀度采用2015年版中国药典的测定方法:取本品1片,置50ml量瓶中,加水1~2ml,超声使崩解,加80%乙腈溶液适量,超声使格列美脲溶解,放冷,用80%乙腈溶液稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液,照含量测定项下方法测定含量,应符合规定a+2.2s≤15.0。具体结果见表1表1制备样品含量均匀度测定结果批次160628160702160704含量均匀度5.73.95.4由上表可知采用本发明专利公布方法制备的样品含量均匀度符合药典标准。试验例2格列美脲片溶出度试验按照实施例2所述方法,制得160628批、160702批、160704批样品,进行溶出度测定。溶出度采用2015年版中国药典的测定方法:取本品,照溶出度与释放度测定法(中国药典2015年版通则0931第二法),以磷酸盐缓冲液(取磷酸二氢钾0.58g与磷酸氢二钠22.34g,加水1000ml,振摇使溶解,用10%磷酸溶液或1mol/l氢氧化钠溶液调节ph值至7.80±0.05)900ml为溶出介质,转速为每分钟75转,依法操作,经15分钟时,取溶液5ml,以每分钟4000转离心10分钟,取上清液作为供试品溶液;另取格列美脲对照品约10mg,精密称定,置100ml量瓶中,加乙腈适量使溶解并稀释至刻度,摇匀;精密量取1ml,置50ml量瓶中,用溶出介质稀释至刻度,摇匀,作为对照品溶液。照含量测定项下的色谱条件,精密量取供试品溶液与对照品溶液各50μl,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算每片的溶出量。限度为标示量的80%,应符合规定。具体结果见表2。表2制备样品溶出度测定结果(%)批次160628160702160704溶出度(%)95.394.194.7采用本发明专利公布方法得到的样品的溶出度均大于93%,符合2015年版中国药典标准的要求。试验例3格列美脲片有关物质试验按照实施例2所述方法,制得160628批、160702批、160704批样品,进行有关物质测定。有关物质采用2015年版中国药典的测定方法:取本品的细粉适量(约相当于格列美脲2mg),置10ml量瓶中,加80%乙腈溶液适量,超声使格列美脲溶解,放冷,用80%乙腈溶液稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;精密量取1ml,置100ml量瓶中,用80%乙腈溶液稀释至刻度,摇匀,作为对照溶液;精密量取对照溶液1ml,置20ml量瓶中,用80%乙腈溶液稀释至刻度,摇匀,作为灵敏度溶液。照含量测定项下的色谱条件,取灵敏度溶液20μl,注入液相色谱仪,记录色谱图,格列美脲峰信噪比应不小于10。精密量取供试品溶液与对照溶液各10μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。供试品溶液的色谱图中如有与杂质ⅲ峰保留时间一致的色谱峰,其峰面积乘以校正因子0.77后不得大于对照溶液主峰面积(1.0%),其他单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),其他杂质峰面积的和不得大于对照溶液主峰面积(1.0%)。供试品溶液色谱图中小于灵敏度溶液色谱图中主成分峰面积的峰忽略不计(0.05%)。具体结果见表3。表3制备样品降解杂质含量(%)批次160628160702160704杂质ⅲ※(%)0.060.060.04※注:杂质ⅲ是格列美脲片剂中主要降解杂质,其受高温氧化条件影响较大,因此作为格列美脲片有关物质中关键考察项目。杂质iii详见图2.采用本发明专利公布方法制备样品的降解杂质含量均较低,符合2015年版中国药典标准的要求。试验例4格列美脲片溶出曲线试验按照实施例2所述方法,制得160628、160702、160704三批样品,进行溶出曲线测定,见图1。取本品,照溶出度与释放度测定法(中国药典2015年版通则0931第二法),以ph7.8磷酸盐缓冲液900ml为溶出介质,转速为每分钟50转,依法操作,分别在5min、15min、30min、45min、60min取溶液5ml(并及时在操作容器中补充溶出介质5ml),滤过,取续滤液作为供试品溶液。照含量测定项下的色谱条件,精密量取供试品溶液50μl,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算每片的溶出量。具体结果见表4。由试验结果可得,采用本发明专利的方法得到的样品具有较高的溶出度。表4制备样品溶出曲线(%)试验例5格列美脲片稳定性加速试验用实施例2制得的格列美脲片样品,置温度(40±2)℃、相对湿度(75±5)%的条件下贮藏6个月,根据试验例2-3的方法测定其有关物质、15分钟溶出度,结果见表5。表5稳定性加速实验结果※注:杂质ⅲ是格列美脲片剂中主要降解杂质,其受高温氧化条件影响较大,因此作为格列美脲片有关物质中关键考察项目。从表5可以看出,采用本发明提供的方法制备的产品稳定性好。本发明采用常规的干法直压技术,并基于交联聚维酮、共聚维酮与主药之间的氢键协同作用,保证本发明的格列美脲片体外释放行为及质量稳定性,采用本发明制备方法,格列美脲平均溶出度均在93%以上,降解杂质含量较低,符合2015年版中国药典标准规定值并且6个月的加速试验结果稳定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1