基于灌注成像的动静脉分离方法及装置和计算机装置与流程
本发明涉及图像处理技术领域,特别涉及一种基于灌注成像的动静脉分离方法及装置和计算机装置。
背景技术:
近年来灌注在肿瘤特别是脑肿瘤的诊断、预后以及疗效评价等方面的研究和应用越来越广泛。灌注成像可用于定量分析组织的微血管分布情况和血流灌注状态,为脑灌注异常疾病(如脑卒中等)提供诊断依据,同时为治疗决策的制定提供有效的参考。
例如,脑卒中疾病临床上通常还需要结合平扫ct(computedtomography,电子计算机断层扫描)以及血管造影(ctangiography,cta)等影像进行脑卒中的诊断,但是有较大的辐射剂量。ct灌注成像(ctperfusion,ctp)为对选定区域采集多个时间点的动态图像,以记录该区域组织中造影剂浓度随时间的变化情况。理论上ctp中包含了cta的信息,可以通过分析ctp分割得到血管区域(包括动脉和静脉)。这样为诊断提供血管信息的同时可在一定程度上降低病人的辐射剂量。
但是,现有技术中提出的动静脉分离方法,分离动静脉的准确性低,而且结果鲁棒性差。
技术实现要素:
以下给出一个或多个方面的简要概述以提供对这些方面的基本理解。此概述不是所有构想到的方面的详尽综览,并且既非旨在指认出所有方面的关键性或决定性要素亦非试图界定任何或所有方面的范围。其唯一的目的是要以简化形式给出一个或多个方面的一些概念以为稍后给出的更加详细的描述之序。
本发明要解决的技术问题是为了克服现有技术中动静脉分离方法的分离动静脉的准确性低,而且结果鲁棒性差的缺陷,提供一种基于灌注成像的动静脉分离方法及装置和计算机装置。
本发明是通过下述技术方案来解决所述技术问题:
一种基于灌注成像的动静脉分离方法,其包括:
获取一选定对象的灌注图像数据及血管图像掩模;
利用造影剂浓度时间曲线,从所述灌注图像数据中提取用于区分动静脉的多个特征;
利用多个特征的聚类方法对所述血管图像掩模进行图像分离,以分别获取动脉图像掩模及静脉图像掩模。
可选地,多个特征包括bat(造影剂到达时间,bolusarrivetime)、ttp(峰值到达时间,timetopeak)、hpw(halfofpeakwidth,半峰宽)或2/3峰宽处的时间长度中的任意一种或几种。
可选地,所述聚类方法包括kmeans(聚类方法的一种)聚类方法。
可选地,所述从所述灌注图像数据中提取用于区分动静脉的多个特征的步骤之前,所述动静脉分离方法还包括:
对所述血管图像掩模中每一个体素的造影剂浓度时间曲线进行曲线平滑处理。
可选地,所述分别获取动脉图像掩模及静脉图像掩模的步骤之后,所述动静脉分离方法还包括:
通过形态学方法及连通域判断分别去除所述动脉图像掩模及所述静脉图像掩模中的噪点,以获得完整的动脉图像掩模及静脉图像掩模。
一种基于灌注成像的动静脉分离装置,其包括:
获取模块,配置为获取一选定对象的灌注图像数据及如上述的血管图像掩模;
特征提取模块,配置为利用造影剂浓度时间曲线,从所述灌注图像数据中提取用于区分动静脉的多个特征;
分离模块,配置为利用多个特征的聚类方法对所述血管图像掩模进行图像分离,以分别获取动脉图像掩模及静脉图像掩模。
可选地,多个特征包括bat、ttp、hpw或2/3峰宽处的时间长度中的任意一种或几种;和/或,
所述聚类方法包括kmeans聚类方法。
可选地,所述动静脉分离装置还包括平滑处理模块;
所述平滑处理模块配置为对所述血管图像掩模中每一个体素的造影剂浓度时间曲线进行曲线平滑处理。
可选地,所述分离模块还配置为:
通过形态学方法及连通域判断分别去除所述动脉图像掩模及所述静脉图像掩模中的噪点,以获得完整的动脉图像掩模及静脉图像掩模。
一种计算机装置,包括存储器、处理器以及存储在存储器上的计算机程序,其特征在于,所述处理器配置为执行存储在所述存储器上的计算机程序时实现如上述的基于灌注成像的动静脉分离方法的步骤。
可选地,一种基于灌注成像的血管分割方法,其包括:
获取一选定对象的灌注图像数据;
基于血管内造影剂浓度变化信息和/或血管空间管状结构信息对所述灌注图像数据进行血管增强,以获得血管增强体图像数据;
利用预设阈值对所述血管增强体图像数据进行图像分割,以分别提取大血管图像数据及小血管图像数据;
融合所述大血管图像数据及所述小血管图像数据,以获得血管图像掩模。
所述血管图像掩模可用于如上述的基于灌注成像的动静脉分离方法。
可选地,所述基于血管内造影剂浓度变化信息和/或血管空间管状结构信息对所述灌注图像数据进行血管增强,以获得血管增强体图像数据的步骤包括:
确定所述灌注图像数据中各像素的组织时间浓度曲线的峰下面积,以获得血管增强体图像数据。
可选地,所述基于血管内造影剂浓度变化信息和/或血管空间管状结构信息对所述灌注图像数据进行血管增强,以获得血管增强体图像数据的步骤包括:
确定所述灌注图像数据中各像素的组织时间浓度曲线的高斯一阶偏导信息;
对所述偏导曲线取绝对值,确定绝对值曲线的峰下面积,以获得血管增强体图像数据。
可选地,所述选定对象包括脑部;
所述利用预设阈值对所述血管增强体图像数据进行图像分割,以分别提取大血管图像数据及小血管图像数据的步骤包括并列执行的第一步骤及第二步骤;
所述第一步骤包括:
在脑部软组织范围内,利用第一预设阈值对所述血管增强体图像数据进行图像分割,以提取第一大血管图像数据;
所述第二步骤包括:
利用平扫期的图像对所述血管增强体图像数据进行脑实质的分割;
在所述脑实质内进行空间管状增强,以获得脑实质内血管增强体图像数据;
利用第二预设阈值脑实质内血管增强体图像数据进行图像分割,以提取第二大血管图像数据及所述小血管图像数据。
可选地,所述基于血管内造影剂浓度变化信息和/或血管空间管状结构信息对所述灌注图像数据进行血管增强的步骤之前,所述分割方法还包括:
对所述灌注图像数据进行刚性配准,以校正不同时相所述选定对象的运动,并且获得校正后的所述灌注图像数据。
可选地,所述基于血管内造影剂浓度变化信息和/或血管空间管状结构信息对所述灌注图像数据进行血管增强的步骤之前,所述分割方法还包括:
利用预设骨头阈值及预设空气阈值分别对所述灌注图像数据进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的灌注图像数据。
可选地,所述利用预设骨头阈值及预设空气阈值分别对所述灌注图像数据进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的灌注图像数据的步骤包括:
确定所述灌注图像数据中各像素的组织时间浓度曲线在时间上的均值投影及最小值投影,以分别获得均值投影图及最小值投影图;
利用所述预设骨头阈值及所述预设空气阈值分别对所述均值投影图及所述最小值投影图进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的灌注图像数据。
可选地,融合所述大血管图像数据及所述小血管图像数据,以获得血管图像掩模的步骤之后,所述血管分割方法还包括:
通过形态学方法及连通域判断去除所述血管图像掩模中的噪点,以获得完整的血管图像掩模。
一种基于灌注成像的血管分割装置,所述血管分割装置利用如上述的血管分割方法,所述血管分割装置包括:
获取模块,配置为获取一选定对象的灌注图像数据;
增强模块,与所述获取模块通信连接,并且配置为基于血管内造影剂浓度变化信息和/或血管空间管状结构信息对所述灌注图像数据进行血管增强,以获得血管增强体图像数据;
分割模块,与所述增强模块通信连接,并且配置为利用预设阈值对所述血管增强体图像数据进行图像分割,以分别提取大血管图像数据及小血管图像数据;
融合模块,与所述分割模块通信连接,并且配置为融合所述大血管图像数据及所述小血管图像数据,以获得血管图像掩模。
可选地,所述增强模块配置为:
确定所述灌注图像数据中各像素的组织时间浓度曲线的峰下面积,以获得血管增强体图像数据。
可选地,所述增强模块配置为:
确定所述灌注图像数据中各像素的组织时间浓度曲线的高斯一阶偏导信息;
对所述偏导曲线取绝对值,确定绝对值曲线的峰下面积,以获得血管增强体图像数据。
可选地,所述选定对象包括脑部;
所述分割模块配置为:
在脑部软组织范围内,利用第一预设阈值对所述血管增强体图像数据进行图像分割,以提取第一大血管图像数据;
所述分割模块还配置为:
利用平扫期的图像对所述血管增强体图像数据进行脑实质的分割;
在所述脑实质内进行空间管状增强,以获得脑实质内血管增强体图像数据;
利用第二预设阈值所述脑实质内血管增强体图像数据进行图像分割,以提取第二大血管图像数据及所述小血管图像数据。
可选地,所述血管分割装置还包括校正模块,所述校正模块与所述获取模块通信连接;
所述校正模块配置为对所述灌注图像数据进行刚性配准,以校正不同时相所述选定对象的运动,并且获得校正后的所述灌注图像数据。
可选地,所述血管分割装置还包括去除模块,所述去除模块分别与所述校正模块及所述增强模块通信连接;
所述去除模块配置为利用预设骨头阈值及预设空气阈值分别对所述灌注图像数据进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的灌注图像数据,并且发送至所述增强模块。
可选地,所述去除模块配置为:
确定所述灌注图像数据中各像素的组织时间浓度曲线在时间上的均值投影及最小值投影,以分别获得均值投影图及最小值投影图;
利用所述预设骨头阈值及所述预设空气阈值分别对所述均值投影图及所述最小值投影图进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的灌注图像数据。
可选地,所述融合模块还配置为:
通过形态学方法及连通域判断去除所述血管图像掩模中的噪点,以获得完整的血管图像掩模。
一种计算机装置,包括存储器、处理器以及存储在存储器上的计算机程序,所述处理器配置为执行存储在所述存储器上的计算机程序时实现如上述的血管分割方法的步骤。
在符合本领域常识的基础上,所述各优选条件,可任意组合,即得本发明各较佳实施例。
本发明的积极进步效果在于:
本发明结合血管图像掩模以及动静脉血管内造影剂浓度变化的不同进行特征提取来区分动静脉,并且利用平滑技术,对浓度线性进行有效的平滑处理,以使得特征的计算更为准确,消除噪声后聚类方法更加具有自适应性,从而提升了分离动静脉的准确性,提升了结果鲁棒性。
附图说明
在结合以下附图阅读本公开的实施例的详细描述之后,能够更好地理解本发明的所述特征和优点。在附图中,各组件不一定是按比例绘制,并且具有类似的相关特性或特征的组件可能具有相同或相近的附图标记。
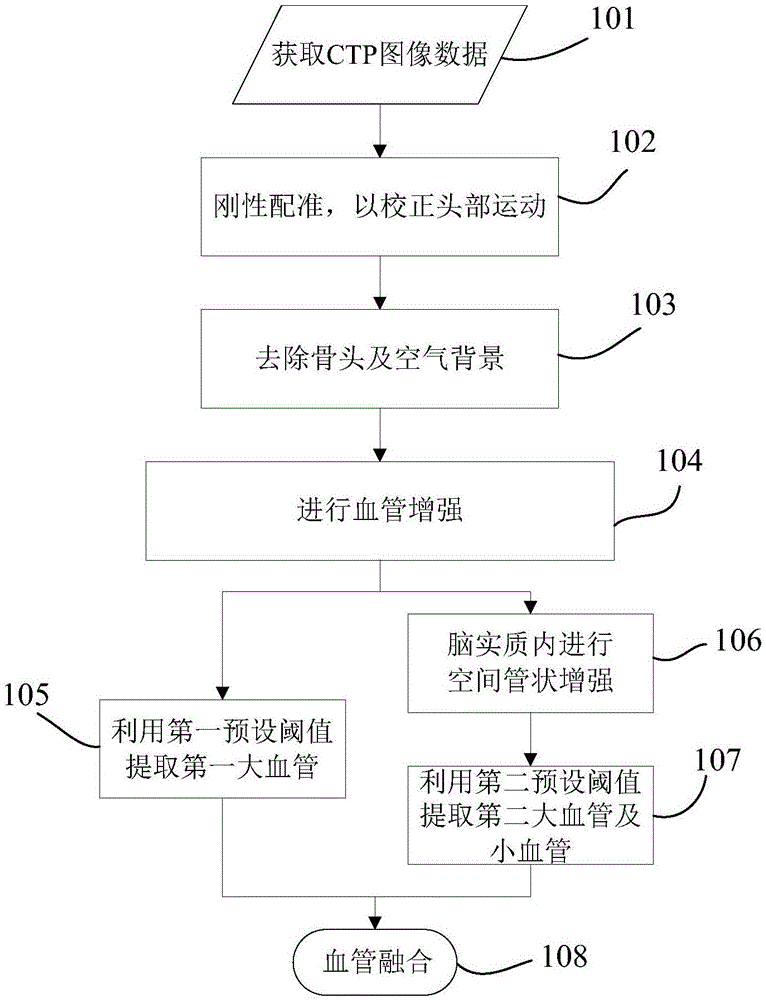
图1为本发明较佳实施例的基于灌注成像的血管分割方法的流程图。
图2为本发明较佳实施例的基于灌注成像的动静脉分离方法的流程图。
图3为本发明较佳实施例的基于灌注成像的血管分割装置的结构示意图。
图4为本发明较佳实施例的基于灌注成像的动静脉分离装置的结构示意图。
图5a为本发明较佳实施例的去骨后动脉时相的原始示意图。
图5b为本发明较佳实施例的全脑提取大血管的结果示意图。
图5c为本发明较佳实施例的脑实质提取小血管的结果示意图。
图5d为本发明较佳实施例的血管融合的结果示意图。
图6a为本发明较佳实施例的原始数据动脉期vr(虚拟现实)显示的示意图。
图6b为本发明较佳实施例的提取动脉血管的结果示意图。
图6c为本发明较佳实施例的提取静脉血管的结果示意图。
附图标记说明:
101步骤;
102步骤;
103步骤;
104步骤;
105步骤;
106步骤;
107步骤;
108步骤;
201步骤;
202步骤;
203步骤;
204步骤;
205步骤;
11第一获取模块;
12校正模块;
13去除模块;
14增强模块;
15分割模块;
16融合模块;
21第二获取模块;
22平滑处理模块;
23特征提取模块;
24分离模块。
具体实施方式
以下结合附图和具体实施例对本发明作详细描述。注意,以下结合附图和具体实施例描述的诸方面仅是示例性的,而不应被理解为对本发明的保护范围进行任何限制。
给出以下描述以使得本领域技术人员能够实施和使用本发明并将其结合到具体应用背景中。各种变型、以及在不同应用中的各种使用对于本领域技术人员将是容易显见的,并且本文定义的一般性原理可适用于较宽范围的实施例。由此,本发明并不限于本文中给出的实施例,而是应被授予与本文中公开的原理和新颖性特征相一致的最广义的范围。
在以下详细描述中,阐述了许多特定细节以提供对本发明的更透彻理解。然而,对于本领域技术人员显而易见的是,本发明的实践可不必局限于这些具体细节。换言之,公知的结构和器件以框图形式示出而没有详细显示,以避免模糊本发明。
注意,在使用到的情况下,标志左、右、前、后、顶、底、正、反、顺时针和逆时针仅仅是出于方便的目的所使用的,而并不暗示任何具体的固定方向。事实上,它们被用于反映对象的各个部分之间的相对位置和/或方向。
本实施例提供一种基于灌注成像的血管分割方法,尤其是基于4d(四维)灌注成像的血管分割方法,但并不具体限定为4d灌注成像,也可根据实际情况进行相应的选择。
在本实施例中,所述血管分割方法基于ct灌注成像,但并不具体限定为ct领域,也可根据实际情况采用mr(磁共振成像)灌注成像等其他灌注成像技术。
具体地,如图1所示,所述血管分割方法包括以下步骤:
步骤101、获取ctp图像数据。
在本步骤中,获取一选定对象的ctp图像数据。
在本实施例中,灌注图像数据为ctp图像数据,但并不具体限定其图像数据类型。
在本实施例中,所述选定对象为脑部,但并不具体限定所述选定对象,可根据实际情况进行相应的选择。
执行步骤101之后,执行步骤102。
步骤102、刚性配准,以校正头部运动。
在本步骤中,对获取的所述ctp图像数据进行刚性配准,以校正不同时相所述选定对象的运动,并且获得校正后的所述ctp图像数据。
执行步骤102之后,执行步骤103。
步骤103、去除骨头及空气背景。
在本步骤中,参考图5a所示,利用预设骨头阈值及预设空气阈值分别对所述ctp图像数据进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的ctp图像数据。
具体地,所述利用预设骨头阈值及预设空气阈值分别对所述ctp图像数据进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的ctp图像数据的步骤包括:
确定所述ctp图像数据中各像素的组织时间浓度曲线在时间上的均值投影及最小值投影,以分别获得均值投影图及最小值投影图;
利用所述预设骨头阈值及所述预设空气阈值分别对所述均值投影图及所述最小值投影图进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的ctp图像数据。
在本实施例中,根据骨头和空气背景的ct值,使用阈值方法对均值投影图和最小值投影图分别进行处理以去除骨头和空气背景,得到脑部软组织的掩模。对两个图提取的骨头和空气掩模同时运用于原始图中,目的是获取原始图的骨头和空气背景区域。
例如,在均值投影图中,高于350hu(ct值)的区域为骨头,低于-200hu的区域为空气。在最小值投影图中,高于350hu的区域也为骨头,低于-200hu的区域也为空气。
当然,本实施例并不具体限定所述预设骨头阈值及所述预设空气阈值,均可根据实际情况进行相应的设定。
执行步骤103之后,执行步骤104。
步骤104、进行血管增强。
在本步骤中,基于血管内造影剂浓度变化信息和/或血管空间管状结构信息对所述灌注图像数据进行血管增强,以获得血管增强体图像数据。
具体地,对脑部软组织掩模内的像素,基于血管内造影剂浓度变化信息对所述ctp图像数据进行血管增强,以获得血管增强体图像数据。
以下说明两种增强方式。
第一种增强方式为:所述基于血管内造影剂浓度变化信息对所述ctp图像数据进行血管增强,以获得血管增强体图像数据的步骤包括:
确定所述ctp图像数据中各像素的组织时间浓度曲线的峰下面积,以获得血管增强体图像数据。
具体地,利用组织时间浓度曲线的峰下面积,即计算各像素的组织时间浓度曲线的峰下面积。由于血管内造影剂浓度相对脑组织中高,通过峰下面积的计算可提高血管和脑组织间的对比度,有利于血管的分割。
每一个体素都有一条动态变化的曲线以反映这个体素中造影剂的变化,获取这个曲线的的线下面积,即这个体素会有一个值的输出,每一个体素都以此操作,就可以获得血管增强的体数据。
第二种增强方式为:所述基于血管内造影剂浓度变化信息对所述ctp图像数据进行血管增强,以获得血管增强体图像数据的步骤包括:
确定所述ctp图像数据中各像素的组织时间浓度曲线的高斯一阶偏导信息;
对所述偏导曲线取绝对值,确定绝对值曲线的峰下面积,以获得血管增强体图像数据。
具体地,利用组织时间浓度曲线的高斯一阶偏导信息,首先计算各像素的组织时间浓度曲线的高斯一阶偏导曲线,然后对偏导曲线取绝对值,计算绝对值曲线的峰下面积。
由于血管内造影剂浓度相对脑组织高,且变化较剧烈,因此计算得到的高斯一阶偏导曲线绝对值的峰下面积可较大的提高血管和脑组织间的对比度。
另外,高斯一阶偏导的计算对曲线有一定程度的平滑作用,可抑制部分噪声的影响。
执行步骤104之后,参考图5b及图5c所示,执行利用预设阈值对所述血管增强体图像数据进行图像分割,以分别提取大血管图像数据及小血管图像数据的步骤。
所述利用预设阈值对所述血管增强体图像数据进行图像分割,以分别提取大血管图像数据及小血管图像数据的步骤包括并列执行的第一步骤及第二步骤。
其中,所述第一步骤为步骤105,所述第二步骤为步骤106及107。
步骤105、利用第一预设阈值提取第一大血管。
在本步骤中,在脑部软组织范围内,利用第一预设阈值对所述血管增强体图像数据进行图像分割,以提取第一大血管图像数据。
具体地,基于血管增强体图像数据,利用阈值法在脑部软组织范围内进行处理以分割得到大血管,包括体积较大的动脉和静脉。
鼻腔等部位由于呼吸等因素存在非刚性形变,所以该部位在经过了刚性配准后仍存在一定的运动位移。该运动位移在某些情况下会导致相应部位的组织时间浓度曲线存在较大的变化,从而会在步骤104中被增强。因此该步骤中使用较大的阈值提取大血管的同时抑制了鼻腔等部位的影响。
执行步骤105之后,执行步骤108。
步骤106、脑实质内进行空间管状增强。
在本步骤中,利用平扫期的图像对所述血管增强体图像数据进行脑实质的分割。
具体地,利用平扫期的图像进行脑实质的分割得到脑实质掩模。脑实质主要包括脑灰质、脑白质以及脑室等颅骨内的脑实质。
在所述脑实质内进行空间管状增强,以获得脑实质内血管增强体图像数据。
执行步骤106之后,执行步骤107。
步骤107、利用第二预设阈值提取第二大血管及小血管。
在本步骤中,利用第二预设阈值脑实质内血管增强体图像数据进行图像分割,以提取第二大血管图像数据及所述小血管图像数据。
具体地,利用阈值法在脑实质范围内进行处理以分割得到脑实质内血管,包括第二大血管和小血管。所述第二大血管与所述第一大血管会存在部分重叠,本步骤主要是血管空间结构更接近管状的会被增强。
执行步骤107之后,执行步骤108。
步骤108、血管融合。
在本步骤中,参考图5d所示,融合所述大血管图像数据及所述小血管图像数据,以获得血管图像掩模。
在获得所述血管图像掩模之后,再通过形态学方法及连通域判断去除所述血管图像掩模中的噪点,以获得完整的血管图像掩模。
本实施例提供的基于灌注成像的血管分割方法结合血管内造影剂浓度变化和血管的管状结构等时间和空间信息对血管进行增强,分别提取大血管及小血管,有效地避免了鼻腔等非刚性形变部位对血管分割的影响,同时也可提取到更丰富的血管结构供临床诊断参考,进而极大地提高了血管分割的准确性。这样灌注成像在提供灌注参数的同时也可提供血管信息。
本实施例提供一种基于灌注成像的动静脉分离方法,尤其是基于4d(四维)灌注成像的动静脉分离方法,但并不具体限定为4d灌注成像,也可根据实际情况进行相应的选择。
在本实施例中,所述动静脉分离方法采用ct灌注成像,但并不具体限定为ct领域,也可根据实际情况采用mr灌注成像等其他灌注成像技术。
具体地,如图2所示,所述动静脉分离方法包括以下步骤:
步骤201、获取ctp图像数据及血管图像掩模。
在本步骤中,获取一选定对象的经过运动校正后的ctp图像数据以及血管图像掩模。
在本步骤中,所述血管图像掩模可以是利用如上述的血管分割方法获得的血管图像掩模,当然,也可以是利用其他方法获得的血管图像掩模。
在本实施例中,灌注图像数据为ctp图像数据,但并不具体限定其图像数据类型。
执行步骤201之后,执行步骤202。
步骤202、平滑血管内造影剂浓度时间曲线。
在本步骤中,对所述血管图像掩模中每一个体素的造影剂浓度时间曲线进行曲线平滑处理。
具体地,ct图像存在明显噪声,体素造影剂浓度时间曲线出现波动情况,可利用平滑方案进行平滑处理,以减少噪声带来的影响,可通过常用的均值滤波、中值滤波、高斯核滤波、低通滤波器或者一些回归类方法,比如高斯过程回归,高斯过程回归问题假设如下:
y=f(t)+ε;
其中,t={t1,t2,…,tn}是输入时间向量,y={y1,y2,…,yn}是观察到的随时间变化的造影剂浓度向量(曲线:采样到的离散值),f是待回归的方程,ε是符合正太分布的噪声向量。
对给定观察数据y和时间向量t后,回归方程f可按如下公式计算:
f(t)=k(tt,t)k(t,t)-1yt;
k(tt,t)=[k(t,t1)k(t,t2)...k(t,tn)];
μf、μn以及l均为超参数,需根据具体情况设置。
得到回归方程后,对于时刻t对应的平滑结果,可以通过领域回归值取平均(或加权平均)的方式获得,比如:
那么,
执行步骤202之后,执行步骤203。
步骤203、提取区分动静脉的特征。
在本步骤中,利用造影剂浓度时间曲线,从所述ctp图像数据中提取用于区分动静脉的多个特征。
在本实施例中,多个特征包括bat、ttp、hpw或2/3峰宽处的时间长度中的任意一种或几种。
以下具体说明上述几个特征。
(1)bat
bat,即造影剂从没有到开始有的时间,造影剂先从动脉流入,进组织流出静脉,所以动脉的bat小于静脉的bat,可通过对造影剂浓度时间曲线进行gamma-variate函数拟合或者分段线性拟合获得。
比如gamma-variate函数拟合,假设造影剂浓度时间曲线与gamma-variate函数相似,可以通过拟合得到bat,即待拟合曲线方程为:
求解以下最优化问题:
即可得到拟合bat。
(2)ttp
ttp是造影剂浓度的达峰时间,表示的是造影剂浓度值达到最大值的时间,动脉的ttp早于静脉的ttp,可通过对造影剂浓度时间曲线进行高斯一阶导,确定过零点,即为ttp。
直接根据离散的体素曲线的最大值对应时刻作为ttp,一些动静脉体素实际ttp相近时,由于采样有时间间隔,离散的时间点会错过真实的峰值,这些动静脉不易区分。为此,可以通过一阶导数过零点的方式,即
得到一阶导数曲线后,找到一阶导数曲线的最大值,从最大值处往右寻找当前导数为负,前一时刻导数为正的时刻点,利用这两点确定一条直线,将直线过零点的时刻作为ttp。
为了进一步抑制噪声的影响,一阶导数曲线可以通过造影剂浓度时间曲线与高斯一阶导数核函数卷积求得。
(3)hpw或2/3峰宽处的时间长度
造影剂从动脉流入组织再流出到静脉时,会有弥散现象,动脉的峰宽比静脉的要窄。
执行步骤203之后,执行步骤204。
步骤204、进行图像分离。
参考图6a、图6b及图6c所示,利用多个特征的聚类方法对所述血管图像掩模进行图像分离。
在本实施例中,所述聚类方法为kmeans聚类方法,但并不具体限定所述聚类方法,还可采用其他聚类方法。
具体地,提取用于区分动静脉的多个特征构建成一个特征向量,利用kmeans算法将所有带区分动静脉体素进行2个簇类别的聚类,将类别中平均ttp较小的簇作为动脉,另外一簇类即为静脉。
当然,也可利用单个特征的阈值方法对所述血管图像掩模进行图像分离。
下面以ttp为例说明。
ttp是一个相对比较明显的区分动静脉的特征,可以利用这一单一特征和阈值方法进行分离动静脉,具体操作为:
1、对血管模板进行一圈腐蚀,利用腐蚀后的掩模中的像素,统计ttp直方图;
2、为了阈值方法的稳定性,获取直方图的主体部分,去掉两端的噪声;
3、对截取出来的直方图,利用自适应迭代阈值法获取阈值;
自适迭代方法选择阈值,计算方法如下:
(1)选择ttp的平均值作为初始阈值t0;
(2)计算小于或等于t0的平均值t1,以及大于t0的平均值t2;
(3)新的阈值为t=(t1+t2)/2;
(4)比较t和t0,若相等,则返回t,即为迭代阈值;否则t0=t,重复(1)~(3)。
4、利用该阈值进行动静脉的分离。
在本实施例中,针对每一个特征,可以采用单个特征的阈值方法分别进行图像分离,并且选取效果最佳的动静脉掩模。
执行步骤204之后,执行步骤205。
步骤205、分别获取动静脉掩模。
在本步骤中,分别获取动静脉掩模之后,再通过形态学方法及连通域判断分别去除动脉图像掩模及静脉图像掩模中的噪点,以获得完整的动脉图像掩模及静脉图像掩模。
本实施例提供的基于灌注成像的动静脉分离方法结合血管图像掩模以及动静脉血管内造影剂浓度变化的不同进行特征提取来区分动静脉,并且利用平滑技术,对浓度线性进行有效的平滑处理,以使得特征的计算更为准确,消除噪声后聚类方法及迭代阈值更加具有自适应性,从而提升了分离动静脉的准确性,提升了结果鲁棒性。结合ctp图像数据,可以分别观察动脉和静脉血管的造影剂流动情况。
本实施例还提供一种基于灌注成像的血管分割装置,尤其是基于4d灌注成像的血管分割装置,但并不具体限定为4d灌注成像,也可根据实际情况进行相应的选择。
如图3所示,所述血管分割装置包括第一获取模块11、校正模块12、去除模块13、增强模块14、分割模块15及融合模块16,所述血管分割装置利用如上述的血管分割方法。
校正模块12分别与第一获取模块11及去除模块13通信连接,增强模块14分别与去除模块13及分割模块15通信连接,融合模块16与分割模块15通信连接。
第一获取模块11配置为获取一选定对象的ctp图像数据。
在本实施例中,所述选定对象为脑部,但并不具体限定所述选定对象,可根据实际情况进行相应的选择。
校正模块12配置为对获取的所述ctp图像数据进行刚性配准,以校正不同时相所述选定对象的运动,并且获得校正后的所述ctp图像数据。
去除模块13配置为利用预设骨头阈值及预设空气阈值分别对所述ctp图像数据进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的ctp图像数据。
具体地,去除模块13配置为:
确定所述ctp图像数据中各像素的组织时间浓度曲线在时间上的均值投影及最小值投影,以分别获得均值投影图及最小值投影图;
利用所述预设骨头阈值及所述预设空气阈值分别对所述均值投影图及所述最小值投影图进行图像处理,以获得从所述选定对象中分别去除骨头及空气背景后的ctp图像数据。
在本实施例中,根据骨头和空气背景的ct值,使用阈值方法对均值投影图和最小值投影图分别进行处理以去除骨头和空气背景,得到脑部软组织的掩模。对两个图提取的骨头和空气掩模同时运用于原始图中,目的是获取原始图的骨头和空气背景区域。
例如,在均值投影图中,高于350hu(ct值)的区域为骨头,低于-200hu的区域为空气。在最小值投影图中,高于350hu的区域也为骨头,低于-200hu的区域也为空气。
当然,本实施例并不具体限定所述预设骨头阈值及所述预设空气阈值,均可根据实际情况进行相应的设定。
增强模块14配置为基于血管内造影剂浓度变化信息和/或血管空间管状结构信息对所述ctp图像数据进行血管增强,以获得血管增强体图像数据。
以下说明两种增强方式。
第一种增强方式为:增强模块14配置为确定所述ctp图像数据中各像素的组织时间浓度曲线的峰下面积,以获得血管增强体图像数据。
具体地,利用组织时间浓度曲线的峰下面积,即计算各像素的组织时间浓度曲线的峰下面积。由于血管内造影剂浓度相对脑组织中高,通过峰下面积的计算可提高血管和脑组织间的对比度,有利于血管的分割。
每一个体素都有一条动态变化的曲线以反映这个体素中造影剂的变化,获取这个曲线的的线下面积,即这个体素会有一个值的输出,每一个体素都以此操作,就可以获得血管增强的体数据。
第二种增强方式为:增强模块14配置为确定所述ctp图像数据中各像素的组织时间浓度曲线的高斯一阶偏导信息;
对所述偏导曲线取绝对值,确定绝对值曲线的峰下面积,以获得血管增强体图像数据。
具体地,利用组织时间浓度曲线的高斯一阶偏导信息,首先计算各像素的组织时间浓度曲线的高斯一阶偏导曲线,然后对偏导曲线取绝对值,计算绝对值曲线的峰下面积。
由于血管内造影剂浓度相对脑组织高,且变化较剧烈,因此计算得到的高斯一阶偏导曲线绝对值的峰下面积可较大的提高血管和脑组织间的对比度。
另外,高斯一阶偏导的计算对曲线有一定程度的平滑作用,可抑制部分噪声的影响。
分割模块15配置为利用预设阈值对所述血管增强体图像数据进行图像分割,以分别提取大血管图像数据及小血管图像数据。
具体地,分割模块15配置为:在脑部软组织范围内,利用第一预设阈值对所述血管增强体图像数据进行图像分割,以提取第一大血管图像数据。
基于血管增强体图像数据,利用阈值法在脑部软组织范围内进行处理以分割得到大血管,包括体积较大的动脉和静脉。
鼻腔等部位由于呼吸等因素存在非刚性形变,所以该部位在经过了刚性配准后仍存在一定的运动位移。该运动位移在某些情况下会导致相应部位的组织时间浓度曲线存在较大的变化,从而会在增强模块14中被增强。因此,分割模块15配置为使用较大的阈值提取大血管的同时抑制了鼻腔等部位的影响。
分割模块15还配置为:利用平扫期的图像对所述血管增强体图像数据进行脑实质的分割。
具体地,利用平扫期的图像进行脑实质的分割得到脑实质掩模。脑实质主要包括脑灰质、脑白质以及脑室等颅骨内的脑实质。
分割模块15还配置为:在所述脑实质内进行空间管状增强,以获得脑实质内血管增强体图像数据。
分割模块15还配置为:利用第二预设阈值脑实质内血管增强体图像数据进行图像分割,以提取第二大血管图像数据及所述小血管图像数据。
具体地,利用阈值法在脑实质范围内进行处理以分割得到脑实质内血管,包括第二大血管和小血管。所述第二大血管与所述第一大血管会存在部分重叠,此处主要是血管空间结构更接近管状的会被增强。
融合模块16配置为融合所述大血管图像数据及所述小血管图像数据,以获得血管图像掩模。
融合模块16还配置为在获得所述血管图像掩模之后,通过形态学方法及连通域判断去除所述血管图像掩模中的噪点,以获得完整的血管图像掩模。
本实施例提供的基于灌注成像的血管分割装置结合血管内造影剂浓度变化和血管的管状结构等时间和空间信息对血管进行增强,分别提取大血管及小血管,有效地避免了鼻腔等非刚性形变部位对血管分割的影响,同时也可提取到更丰富的血管结构供临床诊断参考,进而极大地提高了血管分割的准确性。这样灌注成像在提供灌注参数的同时也可提供血管信息。
本实施例还提供一种计算机装置(图中未示出),所述计算机装置包括存储器、处理器以及存储在存储器上的计算机程序,所述处理器配置为执行存储在所述存储器上的计算机程序时实现如上述的基于灌注成像的血管分割方法的步骤。
本实施例还提供一种基于灌注成像的动静脉分离装置,尤其是基于4d灌注成像的动静脉分离装置,但并不具体限定为4d灌注成像,也可根据实际情况进行相应的选择。
如图4所示,所述动静脉分离装置包括第二获取模块21、平滑处理模块22、特征提取模块23及分离模块24,所述动静脉分离装置利用如上述的动静脉分离方法。
平滑处理模块22分别与第二获取模块21及特征提取模块23通信连接,分离模块24与特征提取模块23通信连接。
第二获取模块21配置为获取一选定对象的经过运动校正后的ctp图像数据以及血管图像掩模。
在本实施例中,所述血管图像掩模可以是利用如上述的血管分割装置输出的血管图像掩模,当然,也可以是利用其他方式获得的血管图像掩模。
平滑处理模块22配置为对所述血管图像掩模中每一个体素的造影剂浓度时间曲线进行曲线平滑处理。
具体地,ct图像存在明显噪声,体素造影剂浓度时间曲线出现波动情况,可利用平滑方案进行平滑处理,以减少噪声带来的影响,可通过常用的均值滤波、中值滤波、高斯核滤波、低通滤波器或者一些回归类方法,比如高斯过程回归。
特征提取模块23配置为利用造影剂浓度时间曲线,从所述ctp图像数据中提取用于区分动静脉的多个特征。
在本实施例中,多个特征包括bat、ttp、hpw或2/3峰宽处的时间长度中的任意一种或几种。
分离模块24配置为利用多个特征的聚类方法对所述血管图像掩模进行图像分离,以分别获取动静脉掩模。
在本实施例中,所述聚类方法为kmeans聚类方法,但并不具体限定所述聚类方法,还可采用其他聚类方法。
具体地,提取用于区分动静脉的多个特征构建成一个特征向量,利用kmeans算法将所有带区分动静脉体素进行2个簇类别的聚类,将类别中平均ttp较小的簇作为动脉,另外一簇类即为静脉。
当然,也可利用单个特征的阈值方法对所述血管图像掩模进行图像分离。
下面以ttp为例说明。
ttp是一个相对比较明显的区分动静脉的特征,可以利用这一单一特征和阈值方法进行分离动静脉,具体操作为:
1、对血管模板进行一圈腐蚀,利用腐蚀后的掩模中的像素,统计ttp直方图;
2、为了阈值方法的稳定性,获取直方图的主体部分,去掉两端的噪声;
3、对截取出来的直方图,利用自适应迭代阈值法获取阈值;
自适迭代方法选择阈值,计算方法如下:
(1)选择ttp的平均值作为初始阈值t0;
(2)计算小于或等于t0的平均值t1,以及大于t0的平均值t2;
(3)新的阈值为t=(t1+t2)/2;
(4)比较t和t0,若相等,则返回t,即为迭代阈值;否则t0=t,重复(1)~(3)。
4、利用该阈值进行动静脉的分离。
在本实施例中,针对每一个特征,可以采用单个特征的阈值方法分别进行图像分离,并且选取效果最佳的动静脉掩模。
分离模块24还配置为分别获取动静脉掩模之后,通过形态学方法及连通域判断分别去除动脉图像掩模及静脉图像掩模中的噪点,以获得完整的动脉图像掩模及静脉图像掩模。
本实施例提供的基于灌注成像的动静脉分离装置结合血管图像掩模以及动静脉血管内造影剂浓度变化的不同进行特征提取来区分动静脉,并且利用平滑技术,对浓度线性进行有效的平滑处理,以使得特征的计算更为准确,消除噪声后聚类方法及迭代阈值更加具有自适应性,从而提升了分离动静脉的准确性,提升了结果鲁棒性。结合ctp图像数据,可以分别观察动脉和静脉血管的造影剂流动情况。
本实施例还提供一种计算机装置(图中未示出),所述计算机装置包括存储器、处理器以及存储在存储器上的计算机程序,所述处理器配置为执行存储在所述存储器上的计算机程序时实现如上述的基于灌注成像的动静脉分离方法的步骤。
尽管为使解释简单化将所述方法图示并描述为一系列动作,但是应理解并领会,这些方法不受动作的次序所限,因为根据一个或多个实施例,一些动作可按不同次序发生和/或与来自本文中图示和描述或本文中未图示和描述但本领域技术人员可以理解的其他动作并发地发生。
提供对本公开的先前描述是为使得本领域任何技术人员皆能够制作或使用本公开。对本公开的各种修改对本领域技术人员来说都将是显而易见的,且本文中所定义的普适原理可被应用到其他变体而不会脱离本公开的精神或范围。由此,本公开并非旨在被限定于本文中所描述的示例和设计,而是应被授予与本文中所公开的原理和新颖性特征相一致的最广范围。
- 还没有人留言评论。精彩留言会获得点赞!