PD1分子抑制剂在T淋巴细胞白血病治疗中的应用的制作方法
本发明属于生物技术领域,具体涉及pd1分子抑制剂在t淋巴细胞白血病治疗中的应用。
背景技术:
急性t淋巴细胞白血病(t-cellacutelymphoblasticleukemia,t-all)是一种高度侵袭性的血液肿瘤,是由t细胞祖细胞无序增殖而形成的。约占15%的儿童病例和25%的成人病例。t-all目前的化疗治疗方案并不理想,在儿童病例中的缓解率能达到85%,而在成人病例中的缓解率不超过50%。
免疫检验点immunecheckpoint主要指t细胞上的共抑制性分子和共刺激性分子,在生理上起到维持自我耐受的作用,在肿瘤微环境中能帮助肿瘤逃逸。其中,程序性细胞死亡受体-1(pd-1)是一种重要的免疫检验点。pd-1信号通路会抑制细胞周期,促进细胞凋亡,以及损伤t细胞抗肿瘤功能。当遭受慢性感染等抗原持续低剂量刺激,t细胞会处于一种功能性耗竭的状态,并且高表达多种抑制性受体,如pd-1。
在临床上,多种pd-1/pdl1抑制性抗体被fda批准上市,已经用于治疗黑色素瘤、非小细胞肺癌等固体瘤,以及b细胞淋巴瘤、急性髓系白血病等血液肿瘤,有持续性的治疗效果和一定的安全性。但是现在有报导显示,在pd-1/pdl1治疗期间,在某些病人身上会出现耐药甚至疾病加重,比如肺腺癌、头颈鳞状细胞癌、成人t细胞白血病-淋巴瘤。
因此,本领域迫切需要开发一种更有效果的、毒性更少的治疗方法。
技术实现要素:
本发明的目的就是提供一种pd1分子抑制剂在t淋巴细胞白血病治疗中的应用。
在本发明的第一方面,提供了一种pd-1的抑制剂的用途,用于制备(i)抑制t-all细胞分化与增殖、和/或(ii)治疗急性t淋巴细胞白血病的药物组合物。
在另一优选例中,所述t-all细胞为表达pd-1的阳性t-all细胞。
在另一优选例中,所述pd-1来源于哺乳动物;优选地,来源于人、小鼠、大鼠、或兔;更优选地,来源于人。
在另一优选例中,所述pd-1包括pd-1的蛋白、编码核酸、活性片段或其衍生物。
在另一优选例中,所述活性片段和/或衍生物与pd-1的同源性至少为90%,优选为95%,更优选为98%、99%。
在另一优选例中,所述活性片段和/或衍生物至少具有80%、85%、90%、95%、100%的pd-1活性。
在另一优选例中,所述pd-1蛋白如seqidno.:2所示。
mqipqapwpvvwavlqlgwrpgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvvgvvggllgslvllvwvlavicsraargtigarrtgqplkedpsavpvfsvdygeldfqwrektpeppvpcvpeqteyativfpsgmgtssparrgsadgprsaqplrpedghcswpl
在另一优选例中,所述pd-1蛋白的编码核酸如seqidno.:1所示。
在另一优选例中,所述pd-1的抑制剂包括pd-1抗体、或pd-1的活性抑制剂。
在另一优选例中,所述pd-1的抑制剂抑制pd-1的活性和/或表达量。
在另一优选例中,所述pd-1的抑制剂选自下组:pd1抗体。
在本发明的第二方面,提供了一种体外非治疗性的抑制t-all细胞增殖的方法,其特征在于,包括步骤:
在pd-1抑制剂的存在下,培养t-all细胞,从而抑制t-all细胞增殖。
在本发明的第三方面,提供了一种体外促进细胞内igfbp3和sult1a3表达的方法,其特征在于,包括步骤:
在pd-1抑制剂的存在下,培养t-all细胞,从而促进细胞内igfbp3和sult1a3表达。
在另一优选例中,所述方法还包括检测细胞内igfbp3和sult1a3的表达量。
在本发明的第四方面,提供了一种筛选pd-1调节剂的候选组合物的方法,包括步骤:
(a)在测试组中,在培养体系中添加候选组合物,并观察所述测试组t-all细胞的表达量和/或活性;在对照组中,在相同培养体系中不添加所述的候选组合物,并观察所述对照组中t-all细胞的表达量和/或活性;
其中,如果测试组培养体系中t-all细胞的表达量和/或活性p1显著高于对照组p0,则说明所述候选组合物为pd-1的抑制剂;
如果测试组培养体系中t-all细胞的表达量和/或活性p1显著低于对照组p0,则说明所述候选组合物为pd-1激动剂。
在本发明的第五方面,提供了一种抑制t-all细胞分化及增殖和/或治疗急性t淋巴细胞白血病的方法,包括步骤:给需要的对象施用安全有效量的pd-1抑制剂或含有pd-1抑制剂的药物组合物。
在另一优选例中,所述需要的对象包括患有肿瘤的哺乳动物,优选地为人、小鼠或大鼠。
在另一优选例中,所述的施用包括将pd-1抑制剂直接输入到有需要的对象体内,例如静脉、肌肉或胃肠途径。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
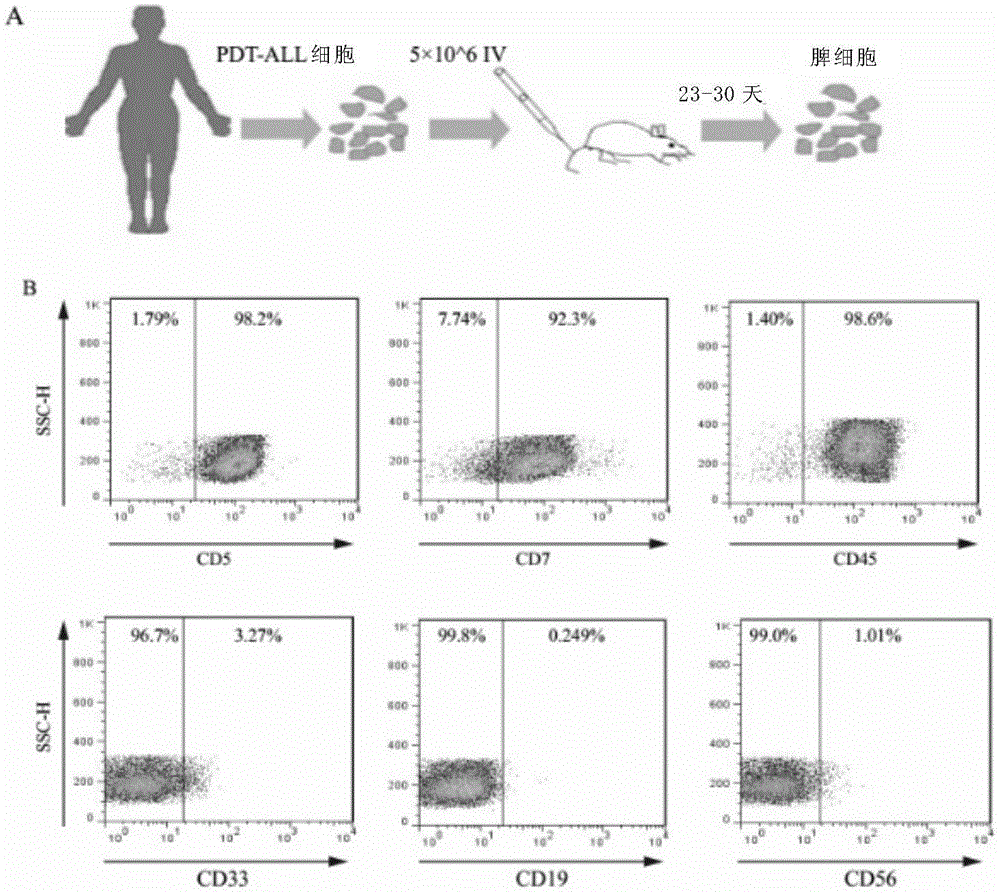
图1显示了原代t-all异种移植模型的构建和特征。(a)t-all异种移植模型的构建。将病人来源的t-all细胞尾静脉注射到b-ndg小鼠体内(n=6小鼠),5×106个细胞/鼠,在24-30天收获小鼠的脾脏细胞。(b)用流式细胞术检测人t-all纯度。在获取小鼠脾脏细胞后,用抗人的cd5、cd7、cd45、cd33、cd19、cd56抗体进行表面染色,用cd3抗体和igg2a,κ同型对照抗体进行胞内染色,由此确认从小鼠身上获得的脾脏细胞主要是t-all细胞。
图2显示了流式检测在原代t-all细胞和健康人外周血cd3+t细胞上的各个免疫检验点(pd-1,cd28,ctla-4,icos,4-1bb,btla,lag-3,ox40,cd40l,gitr,tigit,tim-3,vista,cd200)的表达(a)和平均荧光强度(mfi)(b)。健康人n=4。在四次独立实验中以mean±sd形式展现数据。两组样品的统计学差异已经显示(*p<0.05,**p<0.01,***p<0.001)。“t”代表健康人外周血cd3+t细胞。
图3显示了在原代t-all细胞和健康人t细胞上的免疫检验点的mrna表达水平。(a)用q-pcr检测在原代t-all细胞和健康人外周血cd3+t细胞上的icos、pd-1、btla、cd200的mrna表达差异。健康人n=4。在四次独立实验中以mean±sd形式展现数据。两组样品的统计学差异已经显示(*p<0.05,***p<0.001)。(b)用rt-pcr检测pd-1的mrna表达。分别以在t-all细胞中的mrna逆转成cdna时的无rna逆转录酶和无模板rna为2个阴性对照,以构建了pd-1稳定表达的293t细胞株作为阳性对照,检测到了t-all细胞和健康人pbmc上的pd-1的转录本。“t”代表健康人外周血cd3+t细胞。“pbmc”代表健康人外周血单核细胞。
图4显示了t-all细胞上pd-1基因的snp单核苷酸多态性测序。结果显示在pd-1基因胞内区第5个外显子上的单等位基因的胞嘧啶c突变成胸腺嘧啶t,突变位点在pd-1功能基序itim、itsm之外。
图5显示了用q-pcr检测在原代t-all细胞和健康人外周血cd3+t细胞上的调节pd-1表达的转录因子(t-bet、blimp-1、irf9、stat3、stat4、cfos、foxo1、notch1、nfatc1)的mrna表达水平。健康人n=4。在四次独立实验中以mean±sd形式展现数据。两组样品的统计学差异已经显示(***p<0.001)。“t”代表健康人外周血cd3+t细胞。
图6显示了用q-pcr检测在体外抗pd-1抗体对t-all细胞上一些分子的mrna表达水平的影响。将t-all细胞种植在12孔板里(2.5×106/孔),同时加入终浓度为50ug/ml的抗pd-1抗体(bioxcel,be0188)或者同型对照抗体(ctrlab)(bioxcel,be0083),共孵育48小时。在大于或等于3次的独立实验中以mean±sd形式展现数据。两组样品的统计学差异已经显示(*p<0.05,**p<0.01,***p<0.001)。
图7显示了抗pd-1抗体阻断在t-all异种移植模型中的效果。(a)用抗pd-1抗体(本实验室制备)或者同型对照抗体(ctrlab)(bioxcel,be0086)进行治疗的概述。b-ndg小鼠(n=6小鼠/组)在尾静脉注射原代t-all细胞(5×106个细胞/小鼠)的前一天开始,每两天腹腔注射抗pd-1抗体或者ctrlab(每次注射200ug)。(b)在处死时用流式对脾脏内cd45+白血病细胞进行定量。(c)在抗pd-1抗体治疗的小鼠的脾脏中的t-all细胞进行cd45和ki67染色后,用流式评估白血病细胞的增殖。(d)在抗pd-1抗体治疗的小鼠的脾脏中的t-all细胞进行cd45、annexinv和7-aad染色后,用流式检测白血病细胞的凋亡水平。数据以mean±sem形式展现。两组样品的统计学差异已经显示(**p<0.01)。
图8显示了人t-all细胞表达pd-1。(a)数百名t-all病人的转录组测序数据。在饼图的黑色部分中显示表达pd-1转录本的t-all病人的相对百分比。(b)在饼图的黑色部分中显示表达pd-1转录本的人t-all细胞系的相对百分比。
图9显示了用流式检测在体外抗pd-1抗体对t-all细胞的增殖和凋亡的影响。(a)将细胞用cfse染色后,铺板,并加入50ug/ml的抗pd-1抗体(bioxcel,be0188)或者同型对照抗体(ctrlab)(bioxcel,be0083),分别在0h、12h、24h、48h、72h用流式检测cfse荧光强度。(b)将t-all细胞种植在孔板里,并加入50ug/ml的抗pd-1抗体(bioxcel,be0188)或者同型对照抗体(ctrlab)(bioxcel,be0083),共孵育48小时后,进行annexinv和7-aad染色并用流式检测其凋亡水平。两组之间无明显的统计学差异。
图10显示了在体外在t-all细胞上抗pd-1抗体(bioxcel,be0188)阻断后的转录组测序结果如图所示。(a-c)分别用venn图(a)、火山图(b)、热图(c)表现抗pd-1抗体阻断(实验组)和同型对照抗体(ctrlab)(bioxcel,be0083)处理(对照组)两组之间的差异表达基因。(d)热图代表了两组之间差异倍数排在前30个且已经有功能报导的差异表达基因。生物重复次数是每组3次。
图11显示了用q-pcr检测在体外抗pd-1抗体对t-all细胞上一些分子的mrna表达水平的影响。将t-all细胞种植在12孔板里(2.5×106/孔),同时加入终浓度为50ug/ml的抗pd-1抗体(bioxcel,be0188)或者同型对照抗体(ctrlab)(bioxcel,be0083),共孵育48小时。在大于或等于次的独立实验中以mean±sd形式展现数据。两组样品的统计学差异已经显示(*p<0.05,**p<0.01,***p<0.001)。
图12显示了抗pd-1抗体阻断在t-all异种移植模型中的效果。(a)在处死时用流式对骨髓内cd45+白血病细胞进行定量。(b)在抗pd-1抗体治疗的小鼠的骨髓中的t-all细胞进行cd45和ki67染色后,用流式评估白血病细胞的增殖。(c)在抗pd-1抗体治疗的小鼠的骨髓中的t-all细胞进行cd45、annexinv和7-aad染色后,用流式检测白血病细胞的凋亡水平。n=6小鼠/组。数据以mean±sem形式展现。两组样品之间并无明显的统计学差异。抗pd-1抗体(本实验室制备),同型对照抗体(ctrlab)(bioxcel,be0086)。
图13显示了抗pd-1抗体阻断在t-all异种移植模型中的效果。用流式对骨髓(a)和脾脏(b)内的cd5+白血病细胞(左)和cd7+白血病细胞(右)进行定量。n=6小鼠/组。数据以mean±sem形式展现。两组样品的统计学差异已经显示(*p<0.05,**p<0.01)。抗pd-1抗体(本实验室制备)或者同型对照抗体(ctrlab)(bioxcel,be0086)。
具体实施方式
本发明人经过广泛而深入的研究,首次开发了一种pd1分子抑制剂在t淋巴细胞白血病治疗中的应用。实验结果表明抗pd-1抗体影响t-all细胞内的igfbp3和sult1a3的表达水平,体内实验的结果进一步表明抗pd-1抗体治疗抑制了t-all细胞在脾脏内的增殖。pd-1在t-all细胞上有表达,并起到一定的促瘤作用,这为使用抗pd-1抗体在临床上治疗t-all提供了一定的实验依据。在此基础上完成了本发明。
本发明的主要优点包括:
1.本发明首次报道了pd1分子在病人来源的急性t淋巴细胞白血病细胞t-all的表达情况。
2.本发明首次报道了pd1分子在t淋巴细胞白血病细胞上的调控功能.
3.本发明首次报道了t-all细胞上的转录因子t-bet、blimp-1和notch1的表达变化可能和pd-1的异常表达相关。
4.本发明首次报道了用pd-1抗体治疗抑制了t-all细胞在脾脏内的增殖。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
方法
病人数据和t-all异种移植模型
此类病人被确诊为急性t淋巴细胞白血病,在单倍体异基因造血干细胞移植后半年复发,多次化疗不能缓解,供者淋巴细胞输注失败,目前为疾病终末期,病情难以控制,预后极差。t-all病人样品细胞是由江苏省中医院血液科提供,这获得江苏省中医院伦理委员会的批准。在实验前病人已签署书面知情同意书。
t-all初发患者免疫表型:cd4、cd5、cd7、cd3、cd2、ccd3阳性,cd13、cd117、cd22、cd19、cd56、cd33、cd34、hla-dr、cd8、cd10、cd20、cd79a、mpo阴性。
5周龄的雌性nod-prkdcscidil2rg/bcgen小鼠(成熟t淋巴细胞,b淋巴细胞和nk细胞缺陷)(b-ndg小鼠,biocytogen,北京,中国)被尾静脉注射入100ulpbs重悬的5×106病人来源的t-all细胞(小鼠n=6)。在第24-30天左右,将小鼠的脾脏细胞进行研磨,红细胞裂解,并用流式检测其纯度,用抗人的cd5、cd7、cd45抗体染色结果显示t-all细胞将近100%。
细胞和细胞培养
从每个健康人身上取得40ml外周血,用ficoll-paqueplus(ge,上海,中国)梯度分离出pbmc,直接进行流式分析,或者将pbmc用人cd3阳性选择试剂盒(stemcell)分选出cd3+t细胞后提取rna(健康人n大于等于3)。
将原代t-all细胞用含有10%fbs(gibco),2.5%supergrow的mem-α细胞培养基培养,含有100ng/ml的il-2,的人scf,10ng/ml的人il-7,20nm的胰岛素,20ng/ml的人flt3配体(novoprotein),37℃,5%co2的培养箱中培养
本发明生产的人pd-1稳定表达的293t细胞株(atcc),用加了10%fbs的dulbecco的改良eagle的培养基(dmem)(hyclone)培养。
流式细胞术
获得的单细胞悬液用pd1-apc(miltenyi,130-100-440),cd28-apc,ctla-4-pe,icos-pe,4-1bb-pe,btla-apc,lag-3-pe,ox40-pecy7,cd40l-pe,gitr-apc,tigit-apc,tim-3-pecy7,vista-apc,cd200-pecy7,cd3-fitc,cd45-fitc,cd45-apc,cd5-fitc,cd7-pe,cd7-pecy5,cd33-apc,cd19-fitc,cd56-apc(bd,r&d,biolegend)孵育。测定胞浆内ccd3抗原表达用cytofix/cytoperm固定/permeablization试剂盒(bd),用cd45-apc进行表面染色并用纯化的抗cd3抗体(bd)阻断表面cd3抗原后,固定、破膜,分别用cd3-fitc和igg2a,κ-fitc(bd)进行胞内染色。所有数据用facscalibur(bd)收集,用flowjo软件(treestar,inc.)分析。
在体内和在体外抗pd-1抗体阻断
在体外,提前一天将t-all细胞复苏,一天后,将t-all细胞种植在12孔板里(2.5×106/孔),并加入50ug/ml的抗pd-1抗体(bioxcel,be0188)或者igg1对照抗体(bioxcel,be0083),共孵育48小时,然后收集细胞提取蛋白或者rna,用于做wb、qpcr或者rnasequencing。
在体内,用抗pd-1抗体(本实验室制备)或者igg2b对照抗体(bioxcel,be0086)给b-ndg小鼠进行腹腔注射(每次每只鼠注射用200ulpbs稀释的200ug抗体),每2天注射一次,注射抗体是从t-all细胞接种(每只鼠尾静脉注射5×106细胞,100ulpbs重悬)的前一天开始。当对照组小鼠表现出临床白血病特征时,所有小鼠被处死(6小鼠/组)。
动物研究由苏州大学动物护理和使用委员会批准。所有动物实验均按照美国国立卫生研究院实验动物护理和使用指南(nih,第8版,2011)进行。经苏州大学伦理委员会批准。
rt-pcr和qpcr
关于rt-pcr,用microelute总rna试剂盒(omega)将总rna提取出来,再用revertaidfirststrandcdna合成试剂盒(thermoscientific)逆转成cdna。荧光定量pcr用powersybrgreenpcrmastermix(abi)在quantstudiotm6flexreal-timepcrsystem(abi)上进行(引物序列列于si表2)。热循环在94℃下进行2分钟,然后在94℃下进行40个循环15秒,在60℃下进行20秒,在68℃下进行1分钟。所有样品每次是3个复孔,生物重复次数3次。基因表达相对β-actin,用2(-δδct)方法计算。
检测细胞增殖和凋亡
用转录因子缓冲液组(bd)检测增殖时,用cd45-fitc表面染色,固定、破核膜,用ki67-647或者igg1,κ-647(bd)核内染色。
用celltracetmcfse细胞增殖试剂盒(invitrogen)检测细胞增殖,按照手册将细胞用cfse染色后,计数铺板,并加入抗pd-1抗体(bioxcel)或者igg1抗体(bioxcel)(50ug/ml),分别在0h、12h、24h、48h、72h用流式检测cfse荧光强度。
用fitcannexinv凋亡检测试剂盒(bd)和7-aad抗体(bd)检测细胞凋亡,分别在细胞和抗pd-1抗体(bioxcel)或者igg1抗体(bioxcel)孵育24h,48h,72h后检测,用100ul1×buffer将细胞重悬后,加入5ul7-aad和5ulannexinv,室温避光孵育15-20分钟,再补加300-400ul1×buffer,直接上流式。
rnaseq
将和抗pd-1抗体或igg抗体(bioxcel)共孵育48小时的t-all细胞收集,提取出rna。建立了文库,并由北京基因组学(bgi)用bgiseq-500进行测序。用过滤软件soapnuke进行数据过滤,读取未知碱基超过5%,低质量读数。获得的清晰数据(清晰数据(cleanreads))存储为fastq格式。用hisat将清晰数据(cleanreads)比对到参考基因组序列,使用bowtie2将清晰数据(cleanreads)比对到参考序列,这些序列是从ncbi的grch38.p11(hg38)中获得。用软件rsem计算基因和转录本的表达水平。degseq方法用于筛选两组间差异表达的基因。
数据分析
用graphpadprism6分析数据。组间比较用学生t-检验。p值<0.05被认为是统计学上显著的。
实施例1.
来自白血病病人的t-all异种移植模型的构建和特征
因为在体外培养无法使原代t-all细胞生长,为了扩增t-all细胞以供后续实验,在b-b-ndg小鼠上构建了白血病异种移植模型。将病人来源的t-all细胞尾静脉注射后(每只鼠5×106细胞,6只鼠),收获小鼠的脾脏细胞(图1a)。为了验证从小鼠身上获得的脾脏细胞是t-all细胞,结合前述中病人初发t-all的免疫表型,用流式细胞术的方法进行细胞表面标志染色和胞内染色。如图1b所示,细胞是人cd33、cd19、cd56阴性,排除了这个肿瘤细胞是髓系细胞、b细胞、nk细胞来源的可能,细胞是表面标志人cd5、cd7表达高达90%以上,胞内分子人ccd3同样高表达,因此确定了这例疾病是t-all,从小鼠身上获得的脾脏细胞主要是t-all细胞。
实施例2.
在t-all细胞和健康人t细胞上的免疫检验点的表达差异
对t-all细胞和多例健康人来源的外周血t细胞进行流式细胞术分析,检测各个免疫检验点的表达差异。由图2a可知,相比健康人cd3+t细胞,t-all细胞上pd-1、cd28、cd200的表达是明显上调的,而btla表达是明显下调的,icos的表达是略微升高,tigit的表达是略微减少。当用mfi对这些免疫检验点的表达进行分析时,结果也是一致的(图2b)。
实施例3.
在t-all细胞和健康人t细胞上的icos、pd-1、btla、cd200的mrna表达差异
以上结果表明在此例t-all细胞上icos、pd-1、btla、cd200是表达异常的,接下来用qpcr和rt-pcr的方法在mrna的水平上进一步验证它们的表达情况。如图3a所示,相比健康人,在t-all细胞上icos、pd-1的mrna表达水平更高,且差异有统计学意义,cd200在mrna水平上表达是大幅度升高的,而btla在mrna水平上表达几乎是缺失的。同时构建pd-1稳定表达的293t细胞株作为阳性对照,应用rt-pcr的方法检测到了t-all和正常人pbmc上的pd-1的转录本(图3b)。因此,icos、pd-1、cd200在病人来源的t-all细胞上是有表达的。
实施例4.
在人t-all中pd-1表达
对数百名t-all病人进行基因组测序,测序结果显示80.7%t-all病人肿瘤细胞内部检测(>0.5fpkm)到pd-1转录本(213/264),表达量高至146fpkm(图8a)。本发明人在embl-ebi表达图谱上查阅人t-all细胞系,获取了4个rna测序数据集,发现35.1%人t-all细胞系有pd-1转录本表达(13/37)(图8b)。
实施例5.
t-all细胞snp单核苷酸多态性测序
对t-all细胞进行snp单核苷酸多态性测序,发现pd-1基因的第5个外显子的一个碱基发生单等位基因突变,由胞嘧啶c突变成胸腺嘧啶t(图4)。
实施例6.
调控pd-1表达的转录因子的表达情况
在图3有表达差异的免疫检验点中,进一步研究在t-all细胞上pd-1表达的调控因素,因此用qpcr的方法检测了相关转录因子的mrna表达水平。如图5所示,相比健康人t细胞,在t-all细胞上调控pd-1表达的诱导蛋白中,irf9、stat3、stat4、cfos、foxo1的mrna表达是明显下调的,notch1的mrna表达是明显上调的,而nfatc1的mrna表达没有明显差异;在调控pd-1表达的抑制蛋白中,t-bet和blimp-1的mrna表达是显著下调的。因此,对于pd-1在t-all细胞上的表达异常升高,本发明人认为这和调控pd-1表达的抑制蛋白t-bet和blimp-1的mrna表达下调以及诱导蛋白notch1的mrna表达上调相关。
实施例7.
抗pd-1抗体阻断对t-all细胞内分子表达水平的影响
为了探索pd-1在t-all细胞中的功能,用抗pd-1抗体阻断t-all细胞的pd-1后分别用cfse和annexinv/7-aad染色检测,结果显示pd-1阻断组和igg对照组的细胞增殖和凋亡都没有差异(图9)。于是把抗pd-1抗体和igg抗体分别和t-all细胞共孵育后,提取rna,进行转录组测序。测序结果显示生物学重复样品之间相关性达98%以上,两组间的差异基因数有236个(图10)。然后从中选取了组间差异结果比较显著、已经有功能报导的基因进行下一步研究分析,并用qpcr验证。qpcr结果显示,抗pd-1抗体阻断诱导了cd151、igfbp3、clu的mrna表达,降低了tiaf1、mtpn、sult1a3的mrna表达,而对cd302、hhipl2、mmp2、sult1a4、igfbp7的mrna表达没有影响(图6,图11,表1)。
表1
实施例8.
抗pd-1抗体阻断在t-all异种移植模型中的作用
为了研究pd-1封闭抗体在小鼠体内肿瘤生长中的作用,将t-all细胞尾静脉注射入b-ndg小鼠,(每只鼠5×106细胞,4只鼠),每两天腹腔注射一次200ug的抗pd-1抗体(实验组)或igg2b对照抗体(对照组),注射抗体从i.v.注射t-all的前一天开始一直到处死小鼠,也就是t-all注射后的20-30天(图7a)。两组的脾脏和骨髓中人cd45+细胞比率没有明显差别,说明了pd-1阻断对t-all在脾脏和骨髓中的浸润没有明显影响(图7b,图12a)。对两组的骨髓和脾脏中人cd5+细胞和人cd7+细胞的检测也证实了这个结果(图13)。ki67染色结果显示实验组的脾脏t-all细胞增殖明显减少,然而两组的骨髓t-all细胞增殖没有明显差异(图7c,图12b)。另外,annexinv/7-aad表达分析结果显示两组的脾脏和骨髓t-all细胞的凋亡并无统计学差异(图7d,图12c)。这些结果显示抗pd-1抗体治疗仅仅抑制了t-all细胞在脾脏内的增殖,却对t-all的器官浸润和凋亡并无影响。
讨论
本发明人对此例t-all细胞进行snp单核苷酸多态性测序,发现pd-1基因的第5个外显子的单等位基因的胞嘧啶c突变成胸腺嘧啶t,可能导致此处的蛋白质序列由甘氨酸突变成了缬氨酸,二者都属于非极性氨基酸,且突变位点在pd-1胞内区域的功能基序itim、itsm之外,所以这个突变可能对蛋白的结构和功能没有影响。
现在在不同免疫细胞中对pd-1表达调控的转录因子,包括抑制蛋白t-bet和blimp-1,诱导蛋白isgf3、stat3、stat4、cfos/ap-1、foxo1、notch、nfatc1、nf-kb。在慢性lcmv感染中,体内体外t-bet的过表达和体内t-bet的的基因删除实验都表明,t-bet能抑制pd-1表达。从急性感染lcmv的blimp-1敲除小鼠中分离出的t细胞研究发现,在急性感染后blimp-1缺乏的t细胞有更高的pd-1表达。在体外实验中特异地抑制notch信号通路,活化t细胞上的pd-1转录和蛋白表达都减少了。因此本发明人认为t急淋细胞上抑制蛋白t-bet和blimp-1的表达下调以及诱导蛋白notch1的表达上调可能是pd-1表达升高的原因。
sult1a3属于sult细胞溶质磺基转移酶超家族,这个家族催化各种外源性物质、激素和神经递质的硫酸盐化作用。据报导,在肝癌细胞上sult1a3/4能刺激肿瘤细胞的迁移、侵袭、上皮-间质转化,以及促进癌症干细胞的活化,可能是肝癌的潜在治疗靶标和生物标志。igfbp3是胰岛素样生长因子结合蛋白3insulin-likegrowthfactor-bindingprotein3,据报导,在一些肿瘤细胞中,igfbp3通过调节细胞的增殖、凋亡、迁移来发挥肿瘤抑制作用,比如肺癌,t-all和b-all,乳腺癌,其中,研究发现在all病人的的骨髓和外周血中igfbp3表达是下调的。在本发明人的体外实验中pd-1阻断抗体导致t-all细胞中的sult1a3的mrna表达下降,igfbp3的mrna表达升高,本发明人认为pd-1在t-all细胞上可能通过上调促癌蛋白sult1a3、下调抑癌蛋白igfbp3,促进了t-all细胞生长。
在b-ndg小鼠体内,抗pd-1抗体的使用并没有使t-all在脾脏和骨髓中的浸润和凋亡发生变化,本发明人认为pd-1对此例t-all细胞的移植和凋亡并无明显影响;但是抗pd-1抗体使脾脏内的t-all细胞增殖减少了,本发明人认为pd-1有促进t-all细胞的增殖的功能,即能加快肿瘤生长,而这不依赖于适应性免疫系统。据报导,在黑色素瘤和肝细胞癌细胞内部的pd-1也有促瘤作用,这和本发明人的研究结果相符合。本发明人认为,临床上抗pd-1抗体治疗不仅可以靶向肿瘤微环境中的高表达pd-1的功能耗竭性t细胞,使它们重新活化,产生抗肿瘤免疫反应,可以靶向表达有pd-1的其他免疫细胞,还可以靶向肿瘤细胞上的pd-1,抑制pd-1对肿瘤细胞的促瘤作用,减少肿瘤细胞本身的增殖,这样就多方面的提高了抗pd-1抗体治疗的效果。实际上,本发明人的t-all异种移植小鼠模型的实验中,抗pd-1抗体抑制了脾脏内t-all细胞的增值,揭示了pd-1在t-all治疗中的潜在作用。
总结
本发明成功构建了t-all异种移植模型,应用流式细胞术确定了从小鼠脾脏获得的细胞主要是pdt-all细胞。应用流式细胞术、q-pcr和rt-pcr检测在pdt-all细胞和健康人cd3+t细胞上免疫检验点的表达,结果显示icos、pd-1、cd200在pdt-all细胞上是有表达的。和健康人cd3+t细胞相比,pdt-all细胞上抑制蛋白t-bet和blimp-1的表达下调以及诱导蛋白notch1的表达上调可能是pd-1表达升高的原因。在体外,pd-1阻断抗体导致pdt-all细胞中的sult1a3的mrna表达下降,igfbp3的mrna表达升高。在pdt-all细胞上pd-1可能通过上调促癌蛋白sult1a3、下调抑癌蛋白igfbp3,促进了pdt-all细胞生长。在t-all异种移植模型中,抗pd-1抗体治疗抑制了pdt-all细胞在脾脏内的增殖,但是对pdt-all细胞的器官浸润和凋亡并无影响。pd-1有促进pdt-all细胞增殖的功能,即能加快肿瘤生长,而这不依赖于适应性免疫系统。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>博生吉医药科技(苏州)有限公司
<120>pd1分子抑制剂在t淋巴细胞白血病治疗中的应用
<130>p2018-2423
<160>2
<170>siposequencelisting1.0
<210>1
<211>867
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgcagatcccacaggcgccctggccagtcgtctgggcggtgctacaactgggctggcgg60
ccaggatggttcttagactccccagacaggccctggaacccccccaccttctccccagcc120
ctgctcgtggtgaccgaaggggacaacgccaccttcacctgcagcttctccaacacatcg180
gagagcttcgtgctaaactggtaccgcatgagccccagcaaccagacggacaagctggcc240
gccttccccgaggaccgcagccagcccggccaggactgccgcttccgtgtcacacaactg300
cccaacgggcgtgacttccacatgagcgtggtcagggcccggcgcaatgacagcggcacc360
tacctctgtggggccatctccctggcccccaaggcgcagatcaaagagagcctgcgggca420
gagctcagggtgacagagagaagggcagaagtgcccacagcccaccccagcccctcaccc480
aggccagccggccagttccaaaccctggtggttggtgtcgtgggcggcctgctgggcagc540
ctggtgctgctagtctgggtcctggccgtcatctgctcccgggccgcacgagggacaata600
ggagccaggcgcaccggccagcccctgaaggaggacccctcagccgtgcctgtgttctct660
gtggactatggggagctggatttccagtggcgagagaagaccccggagccccccgtgccc720
tgtgtccctgagcagacggagtatgccaccattgtctttcctagcggaatgggcacctca780
tcccccgcccgcaggggctcagctgacggccctcggagtgcccagccactgaggcctgag840
gatggacactgctcttggcccctctga867
<210>2
<211>288
<212>prt
<213>人工序列(artificialsequence)
<400>2
metglnileproglnalaprotrpprovalvaltrpalavalleugln
151015
leuglytrpargproglytrppheleuaspserproaspargprotrp
202530
asnproprothrpheserproalaleuleuvalvalthrgluglyasp
354045
asnalathrphethrcysserpheserasnthrsergluserpheval
505560
leuasntrptyrargmetserproserasnglnthrasplysleuala
65707580
alapheprogluaspargserglnproglyglnaspcysargphearg
859095
valthrglnleuproasnglyargaspphehismetservalvalarg
100105110
alaargargasnaspserglythrtyrleucysglyalaileserleu
115120125
alaprolysalaglnilelysgluserleuargalagluleuargval
130135140
thrgluargargalagluvalprothralahisproserproserpro
145150155160
argproalaglyglnpheglnthrleuvalvalglyvalvalglygly
165170175
leuleuglyserleuvalleuleuvaltrpvalleualavalilecys
180185190
serargalaalaargglythrileglyalaargargthrglyglnpro
195200205
leulysgluaspproseralavalprovalpheservalasptyrgly
210215220
gluleuasppheglntrpargglulysthrprogluproprovalpro
225230235240
cysvalprogluglnthrglutyralathrilevalpheprosergly
245250255
metglythrserserproalaargargglyseralaaspglyproarg
260265270
seralaglnproleuargprogluaspglyhiscyssertrpproleu
275280285
- 还没有人留言评论。精彩留言会获得点赞!