一种脱氧胆酸修饰的纳米复合物及其制备与应用的制作方法
本发明涉及一种中药难溶性活性成分的负载方法,特别涉及一种脱氧胆酸-低分子壳聚糖/羧甲基壳聚糖纳米复合物及其在提高小肠上皮细胞摄取效率,增加药物口服吸收中的应用。
(二)
背景技术:
低分子壳聚糖(lowmolecularweightchitosan,lmwc)是一种广泛用于纳米粒制备的生物可降解材料。然而lmwc作为一种阳离子聚合物,用于口服递送极易受到胃酸环境的破坏而导致药物突释及漏释。羧甲基壳聚糖(cmcs)为一种阴离子聚合物,可以与低分子壳聚糖通过静电吸附自组装形成具有ph响应特性的纳米复合物,从而能够避免胃酸低ph环境的降解,维持纳米粒在胃肠道中的稳定性。并且纳米复合物还可更好地控制所负载药物的释放。但由于亲水性的纳米复合物与细胞膜的亲和力较差,故仍在一定程度上限制了其用于药物的口服递送。
小肠顶端钠依赖性胆汁酸转运蛋白(asbt)能够将内源性小分子胆汁酸从肠细胞顶侧转移到细胞质,以维持肠肝胆汁酸循环。研究报道,脱氧胆酸(doca)及其衍生物与纳米复合物结合后,能够在一定程度上增强其疏水性,从而改善纳米复合物在肠壁上的通透性,并能有效地与asbt相互作用,从而增加药物的口服吸收。
本发明首先将脱氧胆酸与低分子壳聚糖进行结合,再与羧甲基壳聚糖通过静电吸附自组装形成纳米复合物(nanocomplex,ncs),包裹大黄酸(rh)后形成大黄酸:脱氧胆酸-低分子壳聚糖/羧甲基壳聚糖纳米复合物(rh:doca-lmwc/cmcsncs),用于大黄酸的口服递送。
(三)
技术实现要素:
本发明的目的是构建一种新型的脱氧胆酸修饰的低分子壳聚糖/羧甲基壳聚糖纳米复合物(doca-lmwc/cmcsncs),利用脱氧胆酸(doca)与小肠顶端钠依赖性胆汁酸转运蛋白(asbt)结合的特性,实现纳米复合物从小肠上皮顶侧向基底侧的转运,从而促进中药难溶性活性成分大黄酸(rh)的口服吸收。
本发明采用的技术方案为:
本发明提供一种脱氧胆酸修饰的纳米复合物,即脱氧胆酸修饰的低分子壳聚糖/羧甲基壳聚糖纳米复合物(doca-lmwc/cmcsncs),所述纳米复合物按如下方法制备:
(1)脱氧胆酸的活化:在搅拌条件下,将脱氧胆酸(doca)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和n-羟基琥珀酰亚胺(nhs)溶于二甲基亚砜(dmso)中,室温(25-30℃)下搅拌反应2~4h(优选2h),获得活化的脱氧胆酸;所述doca与edc、nhs的物质的量之比为1:2:2;所述二甲基亚砜的体积用量以脱氧胆酸重量计为3ml/31mg;
(2)脱氧胆酸-低分子壳聚糖共轭物(doca-lmwc)的合成:在搅拌条件下,向低分子壳聚糖(lmwc)溶液中加入步骤(1)活化后的脱氧胆酸,室温(25-30℃)反应20~30h(优选24h)后于去离子水中透析2~5天(优选3天,透析袋的截留分子量为3500da),取截留液冻干(优选-50℃冷冻干燥48h)后,得白色的doca-lmwc共轭物;所述低分子壳聚糖溶液是将低分子壳聚糖溶于体积浓度90%dmso水溶液制成浓度为12g/l的溶液;所述活化后的脱氧胆酸用量以脱氧胆酸羧基物质的量计,所述低分子壳聚糖用量以低分子壳聚糖氨基物质的量计,所述脱氧胆酸羧基与低分子壳聚糖氨基物质的量之比为1:2~4;
(3)脱氧胆酸修饰的纳米复合物的制备:在搅拌条件下,将羧甲基壳聚糖(cmcs)水溶液滴入步骤(2)制备的doca-lmwc醋酸溶液中,室温反应0.5~1h(优选25℃反应0.5h),至溶液出现蓝色乳光,停止反应,获得脱氧胆酸修饰的纳米复合物(doca-lmwc/cmcs);所述羧甲基壳聚糖(cmcs)水溶液浓度为3-6g/l(优选3g/l);所述doca-lmwc醋酸溶液是将doca-lmwc溶于体积浓度0.2%醋酸水溶液制成浓度为3-6g/l(优选3g/l)的溶液;所述doca-lmwc与cmcs的质量比为1:0.5-3,优选1:1。
进一步,步骤(1)所述脱氧胆酸的活化按如下步骤进行:在搅拌条件下,将脱氧胆酸溶于二甲基亚砜,再加入1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐和n-羟基琥珀酰亚胺的二甲基亚砜溶液中,室温下搅拌反应2~4h,获得活化的脱氧胆酸;其中二甲基亚砜总的用量以脱氧胆酸重量计为3ml/31mg,优选用于溶解脱氧胆酸的二甲基亚砜与溶解edc和nhs的二甲基亚砜体积比为2:1。
本发明还提供一种所述脱氧胆酸修饰的纳米复合物在制备药物载体中的应用,所述的应用方法为:将大黄酸(rh)溶于0.01mnaoh水溶液中,于搅拌下滴入脱氧胆酸修饰的纳米复合物中,室温反应0.5~1h,获得载有大黄酸的纳米复合物;所述脱氧胆酸修饰的纳米复合物体积用量以大黄酸质量比为4~6l/g。所述naoh水溶液中大黄酸浓度为0.5g/l。
与现有技术相比,本发明的有益效果主要体现在:本发明首先采用碳二亚胺缩合反应制备脱氧胆酸-低分子壳聚糖共轭物(doca-lmwc),然后通过离子交联法制备脱氧胆酸修饰的低分子壳聚糖/羧甲基壳聚糖纳米复合物。该纳米复合物包封率和载药量较高,分别为(90.7±0.73)%和(6.5±0.29)%;体外释药具有ph敏感性,且可通过转运体-配体的相互作用显著提高caco-2细胞的摄取率(提高2倍);药动学实验表明该纳米复合物可显著提高rh的口服吸收,有效实现大黄酸的口服递送。本发明纳米复合物的制备方法简单易行,doca的修饰可使该纳米复合物与小肠胆酸转运体有效结合而被上皮细胞高效摄取,有利于提高药物的口服吸收。
(四)附图说明
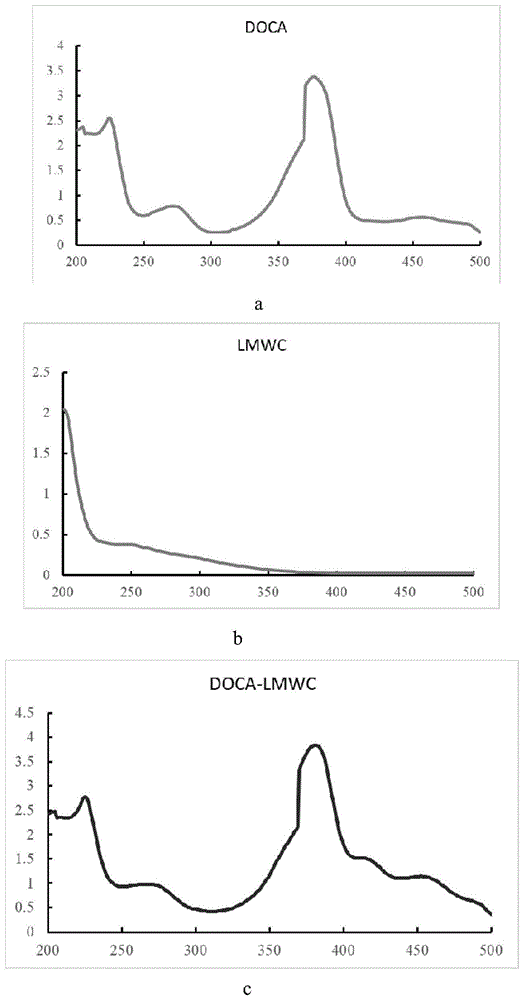
图1为doca(a)、lmwc(b)、doca-lmwc(c)的紫外光谱图。
图2为doca、lmwc、doca-lmwc的红外光谱图。
图3为doca、lmwc、doca-lmwc的1h-nmr图。
图4为rh:lmwc/cmcsncs(1)和rh:doca-lmwc/cmcsncs(2)的粒径分布图(1a,2a),zeta电位图(1b,2b)和tem图(1c,2c)。
图5为rh:lmwc/cmcsncs(a)和rh:doca-lmwc/cmcsncs(b)的体外释放图。
图6为空白载体与caco-2细胞孵育共48h后的细胞存活率示意图(n=3)。
图7为caco-2细胞对纳米复合物的细胞摄取特性图;(a)caco-2细胞与fitc标记的纳米复合物共孵育2h后的激光共聚焦图。蓝色:dapi染色的细胞核,绿色:fitc。(b)caco-2细胞与fitc标记的纳米复合物共孵育2h后的流式分析图(n=3)(**p<0.01vslmwc/fitc-cmcsncs)。(c)牛磺胆酸(tca)预孵育后caco-2细胞对纳米复合物摄取的流式分析图(n=3)(##p<0.01vs100μmtca,**p<0.01vs50μmtca)。
图8为大鼠灌胃给予rh、rh:lmwc/cmcsncs和rh:doca-lmwc/cmcsncs后血药浓度-时间曲线(n=6)。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
本发明室温是指25-30℃。本发明所用低分子壳聚糖的分子量为5000da。
实施例1:
1.doca-lmwc共轭物的合成和表征
(1)称取脱氧胆酸(doca)31mg(0.078mmol)溶于2ml二甲基亚砜(dmso)中制成doca溶液。将1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)30mg(0.156mmol)、n-羟基琥珀酰亚胺(nhs)18mg(0.156mmol)分别溶于1mldmso中制成edc/nhs溶液。将edc/nhs溶液与doca溶液全部混合,室温(25-30℃)反应2h,获得活化后的doca。
(2)低分子壳聚糖(lmwc)60mg溶于5ml体积浓度90%dmso水溶液中制成lmwc溶液。将步骤(1)获得的活化后的doca(以羧基计0.078mmol)于搅拌下缓慢滴至lmwc溶液(以氨基计0.312mmol)中,室温反应24h,去离子水透析(截留分子量3500da)3d,取截留液,经-50℃冷冻干燥48h后,得白色海绵状产物约70mg,即为doca-lmwc共轭物。采用uv-vis、ft-ir及1h-nmr法分别对doca、lmwc及产物doca-lmwc共轭物进行表征。
doca、lmwc及doca-lmwc共轭物的紫外光谱图见图1。对比lmwc和doca-lmwc共轭物的紫外光谱图,可知前者在200~500nm基本无吸收,而后者在378nm处出现了一吸收峰。与doca的紫外光谱图对比可知,该吸收峰系doca的特征吸收峰,证明doca成功的键合在lmwc上。
doca、lmwc及doca-lmwc共轭物的ft-ir图谱见图2。lmwc的ft-ir图谱中1617cm-1和1606cm-1处的吸收峰分别归属于c=o的伸缩振动峰(酰胺i带峰)和n-h的面内弯曲振动峰(酰胺ii带峰);与lmwc的红外光谱图相比,doca-lmwc的ft-ir图谱中1655cm-1处酰胺i带的特征吸收峰增加,酰胺ⅱ带在1607cm-1处出现一新的吸收峰,表明lmwc与doca之间形成了酰胺键,进一步证实了doca-lmwc的成功合成。
doca、lmwc及doca-lmwc共轭物的1h-nmr图谱见图3。与lmwc的1h-nmr谱图对比,doca-lmwc的1h-nmr谱图中,在δ=0.6-1.9出现新的峰,归属为doca上的甲基和亚甲基质子的化学位移峰,进一步证明doca成功地接枝到lmwc上。
2.doca-lmwc共轭物取代度的测定
采用紫外分光光度法测定doca-lmwc共轭物的取代度。称取样品2mg置于含有0.5mldmso、0.5ml体积浓度60%醋酸水溶液及9ml水/硫酸混合物(65/50,v/v)的试管中,摇匀,70℃加热30min,冷却至室温后于378nm波长处测定其紫外吸光度值。同法制备系列浓度的脱氧胆酸溶液,绘制标准曲线,所得回归方程为:y=0.0165x+0.0157(r2=0.9991),按式1计算取代度(ds):
m1是按标准曲线计算出的样品中脱氧胆酸的含量,m0是doca-lmwc的质量,mdoca是脱氧胆酸的分子量,mlmwc是低分子壳聚糖的分子量,分子量为5000da。
紫外分光光度法测得doca-lmwc的取代度为2.5%。
3.脱氧胆酸修饰的纳米复合物的制备
采用离子交联法制备纳米复合物:称取6mgdoca-lmwc共轭物溶于2ml体积浓度0.2%ch3cooh水溶液中制成doca-lmwc醋酸溶液;将6mgcmcs溶于2ml去离子水中制成cmcs溶液。于搅拌下将cmcs溶液滴加至doca-lmwc醋酸溶液中,25℃下反应30min至溶液出现蓝色乳光,停止反应,即得脱氧胆酸修饰的纳米复合物(doca-lmwc/cmcsncs)约4ml。同法制备未偶联doca的纳米复合物lmwc/cmcsncs。
4.纳米复合物包裹大黄酸的应用
将1mg大黄酸(rh)溶于2ml0.01mnaoh水溶液中,于搅拌下滴入步骤3方法制备的脱氧胆酸修饰的纳米复合物4ml中,25℃反应30min,即得带有黄色乳光的载药脱氧胆酸纳米复合物(rh:doca-lmwc/cmcsncs)约6ml,rh含量为0.17mg/ml。
5.对制备的载药纳米复合物进行表征:
(1)粒度、粒度分布和zeta电位测定:分别取rh:doca-lmwc/cmcsncs1ml及rh:lmwc/cmcsncs1ml用4ml蒸馏水稀释,采用malvern粒度测定仪分别测定其平均粒径、粒径分布及zeta电位。测得rh:lmwc/cmcsncs与rh:doca-lmwc/cmcsncs的平均粒径、pdi及zeta电位分别为(189.8±2.8)nm、(191.6±0.8)nm;(0.24±0.01)、(0.16±0.02);(34.8±0.8)mv、(32.5±0.4)mv,见图4;doca修饰前后的纳米复合物的粒径几无差异,说明与doca共轭连接不会影响纳米复合物的粒径;doca修饰的纳米复合物zeta电位略低于未修饰的纳米复合物,主要原因在于修饰后doca取代了低分子壳聚糖中的部分氨基,使纳米复合物表面所带正电荷减小,间接表明了doca的成功键合。
(2)透射电镜观察:将rh:doca-lmwc/cmcsncs1ml及rh:lmwc/cmcsncs1ml分别用4ml蒸馏水稀释后滴加于铜网上,用体积浓度2%磷钨酸水溶液负染,自然风干后在室温下采用透射电子显微镜(tem)对其形态进行观察。由透射电镜(tem)图(图4)可知,两种纳米复合物外观均呈类球形,且呈缠绕状,大小及分布较均匀,粒径约200nm左右,与激光粒度仪所测大小一致,粒子间未见黏连和聚集现象。
(3)包封率和载药量的测定:分别精密量取rh:lmwc/cmcsncs和rh:doca-lmwc/cmcsncs各1.0ml,置于超滤管中,离心10min(4000r·min-1,常温)后取滤液采用hplc方法测定rh含量,得游离药物含量,记作w0;另分别精密量取rh:lmwc/cmcsncs和rh:doca-lmwc/cmcsncs各1.0ml,置于10ml容量瓶中加甲醇稀释至刻度,超声(40khz,室温,30min)破乳后采用hplc法测定纳米粒中总的药物含量,记作w1;另取rh:lmwc/cmcncs和rh:doca-lmwc/cmcsncs各1.0ml于-50℃冻干称重,记作w2。按式2计算纳米复合物的包封率和载药量:
包封率(ee%)=(w1-w0)/w1×100%
载药量(dl%)=(w1-w0)/(w2-w0)×100%(式2)
测得rh:lmwc/cmcsncs和rh:doca-lmwc/cmcsncs的包封率分别为(90.4±0.64)%(n=3),(90.7±0.73)%(n=3);载药量分别为(6.9±0.21)%(n=3),(6.5±0.29)%(n=3)。
6.体外释放度测定
分别选取含体积浓度2%聚山梨酯80(吐温80)的ph1.2盐酸水溶液(模拟胃环境),含体积浓度2%吐温80的ph6.8pbs缓冲液(模拟肠环境)和含体积浓度2%吐温80的ph7.4pbs缓冲液(模拟血液环境)作为释放介质,采用透析法考察载药纳米复合物的体外释药特性。
分别取rh:lmwc/cmcsncs和rh:doca-lmwc/cmcsncs各4ml(折合rh质量为0.8mg)置于一端密封的透析袋(截留分子量3500da)中,扎紧封口后将透析袋放入200ml不同的释放介质中,于37℃恒温水浴中振荡(75r·min-1)。分别于0、0.1、0.25、0.5、0.75、1、1.25、1.5、1、2、4、6、8、12、24、48h取样1ml,同时立即补加等量同温新鲜释放介质,样品用0.22μm微孔滤膜过滤后经hplc测定rh含量,按式3计算累积释放百分度,并绘制释放曲线。
式3中mn,qn,cn,v0,vi,ci分别代表每个时间点的累积释放量,每个时间点累积释放百分比,tn时的药物浓度,释放介质的体积,每次取出的样品体积,ti时的药物浓度。
rh:lmwc/cmcsncs及rh:doca-lmwc/cmcsncs在不同ph介质中的释药曲线见图5。两种载药纳米复合物的释药特征基本相似:在ph1.2(模拟胃液)盐酸介质中基本不释放(48h累积释药量均低于10%);在ph6.8pbs中释放较慢,rh:lmwc/cmcsncs48h累积释放量约为60%,rh:doca-lmwc/cmcsncs约为70%;在ph7.4pbs中的释放呈现双相性,即开始4h内的快速释放(rh:lmwc/cmcsncs及rh:doca-lmwc/cmcsncs4小时累积释放量均约为50%),及紧随其后的缓慢释放(rh:lmwc/cmcsncs48h累积释放量可达80%,rh:doca-lmwc/cmcsncs可达90%)。结果表明脱氧胆酸修饰的纳米复合物具有良好的ph敏感特性,在胃酸环境中较稳定,能够有效地将药物递送至肠环境后转运吸收。
7.空白载体的细胞毒性
采用mtt法考察空白载体的安全性。取对数生长期caco-2细胞以1×104个/孔的密度接种于加有含10%胎牛血清和1%双抗的dmem完全培养基的96孔板,置于37℃、5%co2培养箱中培养24h。细胞贴壁生长后,弃去培养液,每孔分别加入100μl含不同终浓度空白载体的无血清的dmem培养基(lmwc/cmcsncs及doca-lmwc/cmcsncs,浓度分别为100、200、400、600、800、1000、1200μg/ml)继续培养,每组设4个复孔,同时设置阴性对照孔(不加空白载体,加入细胞和等体积无血清dmem培养基)和空白调零孔(不加细胞和空白载体,加入等体积无血清dmem培养基)。细胞在常规培养条件(37℃,5%co2)下培养48h后,每孔加入5mg/mlmtt溶液10ul,37℃继续培养4h后弃培养液,每孔加入100ul二甲基亚砜(dmso)后,避光条件下充分震荡后用酶标仪测定570nm波长处的吸光度值a,记录每孔测量结果,计算细胞存活率。
细胞存活率=(a实验组-a空白组)/(a对照组-a空白组)×100%。
如图6所示,doca偶联前后纳米复合物对caco-2细胞均表现出低的细胞毒性和良好的生物相容性,细胞的存活率均大于90%。
8.细胞摄取实验
(1)fitc标记纳米复合物的制备:将24mgcmcs溶于4ml去离子水中(ph9)制成cmcs溶液。2mg异硫氰酸荧光素(fitc)溶于4ml甲醇中制成fitc甲醇溶液。将fitc甲醇溶液于搅拌下缓慢滴入cmcs溶液中,25℃避光反应24h,用去离子水透析(透析袋截留分子量3500da)3d至上清中无荧光检出,取截留液-50℃冷冻干燥后,即得fitc标记的cmcs。同步骤3,用fitc标记的cmcs代替cmcs制备fitc标记的纳米复合物(lmwc/fitc-cmcsncs和doca-lmwc/fitc-cmcsncs)。
(2)采用激光共聚焦显微镜考察荧光标记的纳米复合物(lmwc/fitc-cmcsncs和doca-lmwc/fitc-cmcsncs)的细胞摄取情况以及胞内定位情况。将caco-2细胞以1×105个/孔的密度接种于加有dmem完全培养基的共聚焦专用的四室小皿中,待细胞融合80%~90%后,分别加入fitc标记的两种纳米复合物于37℃孵育2h。弃去培养液,用pbs漂洗三次,每孔用0.5ml4%(v/v)多聚甲醛固定10min,吸去,pbs漂洗三次;分别加入0.3ml的dapi染液,孵育10min,吸去,pbs漂洗三次。置于激光共聚焦显微镜下观察,结果见图7中(a)。
(3)流式细胞仪检测:将处于对数期的caco-2细胞以5×105个/孔的密度接种于加有dmem完全培养基的6孔板中,待细胞融合至80%~90%后,去除培养基,每孔分别加入2ml步骤(1)所制备的fitc标记的纳米复合物(lmwc/fitc-cmcsncs和doca-lmwc/fitc-cmcsncs)(fitc浓度10μg/ml),37℃培养2h后用4℃的pbs(ph7.4)清洗3次,加入胰酶消化,800r·min-1离心5min,弃去上清,pbs离心洗涤3次,最后将细胞分散于适量pbs中形成单细胞混悬液,流式细胞仪分析,结果见图7中(b),以不加纳米复合物的细胞为对照。
为了评价asbt在细胞摄取中的作用,采用牛磺胆酸钠(tca)为竞争抑制剂进行细胞摄取实验。caco-2细胞培养至融合80%~90%后,去除培养基,分别加入2ml含终浓度25,50,100μm的tca的无血清的dmem培养基,37℃下预孵育30min,pbs洗涤三次,然后加入2mldoca-lmwc/fitc-cmcsncs,37℃培养2h后用pbs洗涤,胰酶消化后同上进行流式细胞术分析,结果见图7中(c)。
激光共聚焦显微镜观察结果(见图7中(a))显示,纳米复合物主要分布在细胞浆,细胞核内几未见绿色荧光;且doca修饰的纳米复合物孵育的细胞内荧光强度明显高于未经修饰的纳米复合物组。流式细胞术定量测定结果见图7中(b),doca修饰的纳米复合物组细胞摄取量约为未修饰组的3倍,表明doca修饰能够显著提高caco-2对纳米复合物的摄取,与激光共聚焦结果一致。图7中(c)为经不同浓度tca预孵育后的caco-2细胞对doca-lmwc/fitc-cmcsncs摄取的流式细胞图,结果表明:随着抑制剂tca浓度的增加,其摄取率显著降低,且浓度为50μm和100μm时无显著性差异,说明50μm的tca接近与asbt结合的饱和浓度。
9.大鼠体内药动学实验
健康sd大鼠18只,禁食12h,自由饮水,随机分为3组,每组6只。按rh35mg·kg-1单剂量分别灌胃给予rh混悬液(含40%peg400的生理盐水为分散介质,浓度为2mg/ml)、rh:lmwc/cmcsncs混悬液(生理盐水为分散介质,浓度为2mg/ml)和rh:doca-lmwc/cmcsncs混悬液(生理盐水为分散介质,浓度为2mg/ml),给药后分别于0.067、0.1333、0.2、0.267、0.417、0.75、1、2、4、6、8、12、24h经眼眶取血0.5ml于肝素化试管中。5000r·min-1离心10min,取血浆100ul用于hplc分析。每次取血后立即用微量注射器给予等量的0.9%生理盐水。
血浆样品的处理方法:取血浆100ul,精密加入内标液(内标:1,8-二羟基蒽醌,50μg/ml)10ul,涡旋30s混匀,加入体积浓度20%三氟乙酸(tfa)水溶液20ul,涡旋混匀,再加入0.5ml乙酸乙酯,涡旋混合3min后,13000r/min离心10min,取上清液置于离心管中,挥干有机溶剂,残渣加入100ul甲醇溶解,涡旋2min,13000r/min离心10min,离心后取上清液用于hplc分析。
大鼠灌胃给予rh混悬液、rh:lmwc/cmcsncs混悬液和rh:doca-lmwc/cmcsncs混悬液后,平均血药浓度-时间曲线见图8,药动学参数见表1。从结果可知,灌胃给予三种不同制剂后,大黄酸在大鼠体内呈现不同的药动学特征。三组制剂均在灌胃给药15min左右血药浓度便达峰,rh组药物随着时间的变化在血中快速消除;两种纳米复合物组药物随着时间的变化在血中缓慢消除。在给药2h内,两种纳米复合物组的血药浓度均高于rh,rh组在给药8h后血药浓度便低于定量限,而两种纳米复合物组给药24h均可检测到药物,说明纳米复合物能够在较长的时间内维持较高的血药浓度;两种纳米复合物组的cmax均显著高于rh组(p<0.001);消除半衰期(t1/2)和平均滞留时间(mrt)与rh组相比均显著提高而体内清除率(cl)显著降低,提示纳米复合物较原药rh消除变慢,在体内的滞留和循环时间延长;药时曲线下面积(auc0-inf)增加提示纳米复合物较原药rh口服生物利用度显著提高。另外,与rh:lmwc/cmcsncs组相比,偶联doca的rh:doca-lmwc/cmcsncs组cmax和药时曲线下面积(auc0-inf)均显著提高,证明通过doca与胆酸转运体的结合作用可进一步提高纳米复合物的口服生物利用度,从而使rh的口服吸收显著增加。
表1.大鼠灌胃rh,rh:lmwc/cmcsncs和rh:doca-lmwc/cmcsncs后药动学参数(n=6)
**p<0.01vsrh,***p<0.001vsrh
☆☆p<0.01vsrh:lmwc/cmcsncs,
☆☆☆p<0.001vsrh:doca-lmwc/cmcsncs
实施例2
doca-lmwc共轭物的制备同实施例1,脱氧胆酸修饰纳米复合物的制备如下:称取6mgdoca-lmwc共轭物溶于2ml体积浓度0.2%ch3cooh水溶液中制成doca-lmwc醋酸溶液;将12mgcmcs溶于2ml去离子水中制成cmcs溶液。于搅拌下将cmcs溶液滴加至doca-lmwc醋酸溶液中,25℃下反应30min至溶液出现蓝色乳光,停止反应,即得脱氧胆酸修饰的纳米复合物(doca-lmwc/cmcsncs)约4ml。所得纳米复合物粒径为230.4±1.5nm,pdi为0.29±0.01,zeta:为32.5±0.5mv。纳米复合物包裹大黄酸的制备同实施例1。
实施例3
doca-lmwc共轭物的制备同实施例1,脱氧胆酸修饰纳米复合物的制备如下:称取12mgdoca-lmwc共轭物溶于2ml体积浓度0.2%ch3cooh水溶液中制成doca-lmwc醋酸溶液;将6mgcmcs溶于2ml去离子水中制成cmcs溶液。于搅拌下将cmcs溶液滴加至doca-lmwc醋酸溶液中,25℃下反应30min至溶液出现蓝色乳光,停止反应,即得脱氧胆酸修饰的纳米复合物(doca-lmwc/cmcsncs)约4ml。所得纳米复合物粒径为166.3±1.0nm,pdi为0.15±0.02,zeta:为42.3±0.7mv。纳米复合物包裹大黄酸的制备同实施例1。
实施例4
doca-lmwc共轭物的制备同实施例1,脱氧胆酸修饰纳米复合物的制备如下:称取12mgdoca-lmwc共轭物溶于2ml体积浓度0.2%ch3cooh水溶液中制成doca-lmwc醋酸溶液;将12mgcmcs溶于2ml去离子水中制成cmcs溶液。于搅拌下将cmcs溶液滴加至doca-lmwc醋酸溶液中,25℃下反应30min至溶液出现蓝色乳光,停止反应,即得脱氧胆酸修饰的纳米复合物(doca-lmwc/cmcsncs)约4ml。所得纳米复合物粒径为237.2±6nmpdi为0.3±0.01,zeta为35.8±0.5mv。纳米复合物包裹大黄酸的制备同实施例1。
实施例5
doca-lmwc共轭物及脱氧胆酸修饰纳米复合物的制备同实施例1。纳米复合物包裹大黄酸的应用:将2mg大黄酸(rh)溶于2ml0.01mnaoh水溶液中,于搅拌下滴入按实施例1方法制备的脱氧胆酸修饰的纳米复合物4ml中,25℃反应30min,即得带有黄色乳光的载药脱氧胆酸纳米复合物(rh:doca-lmwc/cmcsncs)约6ml,rh含量为0.34mg/ml。所得到载药纳米复合物粒径为268.2±16.0nm,pdi为0.49±0.03,zeta:为30.5±0.4mv。
实施例6
doca-lmwc共轭物及脱氧胆酸修饰纳米复合物的制备同实施例1。
纳米复合物包裹大黄酸的应用:将4mg大黄酸(rh)溶于2ml0.01mnaoh水溶液中,于搅拌下滴入按实施例1方法制备的脱氧胆酸修饰的纳米复合物4ml中,25℃反应30min,即得带有黄色乳光的载药脱氧胆酸纳米复合物(rh:doca-lmwc/cmcsncs)约6ml,rh含量为0.68mg/ml。得到载药纳米复合物粒径为262.4±14.5nm,pdi为0.5±0.03,zeta:为27.3±1.3mv。
- 还没有人留言评论。精彩留言会获得点赞!