医药原料药载体及其制造方法与流程
本发明涉及将医药原料药(药物原料药)担载于二氧化硅而得到的医药原料药载体及其制造方法。
背景技术:
药品中有水难溶性的物质,为了有效地表现出期望的药效,提高水难溶性药物的溶解性成为问题。作为提高水难溶性药物的溶解性的方法,提出了将晶型制成高溶解性的方法、将药品担载于多孔的无机材料而提高溶解性的方法等(参见专利文献1~2)。
例如,专利文献1中提出了一种片剂,其包含将二氧化硅和溶解度为1mg/ml以下的水难溶性药物复合化而得到的复合化颗粒。
另外,专利文献2中提出了使用主要由氧化硅构成且包含中孔和微孔的无机颗粒状物质作为载体,显示担载于该无机颗粒状物质的伊曲康唑的溶出速度得到提高。
现有技术文献
专利文献
专利文献1:日本特开2006-248922号公报
专利文献2:日本特开2014-522363号公报
技术实现要素:
发明要解决的问题
然而,判明的是,使用上述片剂、或使用应用了上述载体而得到的药物载体进行与生物环境下类似的条件下的药物的溶解性试验时,虽然确认到药物的溶解性的提高,但不能说有充分的溶解性,有进一步改善的余地。另外判明的是,将上述载体刚添加到生物环境等水介质中后,药物的溶解性虽然提高,但随时间经过溶解性下降,因此从药效的持续性的观点看也有改善的余地。进而,专利文献2记载的包含中孔和微孔的无机颗粒状物质的制造条件复杂且昂贵,因此在该载体的制造成本方面也有改善的余地。
因此,本发明的一个实施方式提供一种医药原料药载体,其医药原料药的溶解性和缓释性优异。
用于解决问题的方案
本发明人等针对上述问题进行了深入的研究发现,根据以下的构成例可解决上述问题,从而完成了本发明。
即,本发明的一个实施方式涉及的医药原料药载体(药物载体)为将医药原料药担载于二氧化硅而得到的医药原料药载体,所述二氧化硅的孔半径1~100nm的孔的容积为3.0~5.0ml/g、并且孔半径的峰位于10~50nm,所述孔半径是基于bjh法测定的。
上述本发明的一个实施方式涉及的医药原料药载体可适宜地采用接下来的方式。
1)上述二氧化硅中孔半径在10~50nm的范围的孔的容积为总孔容积中的60%以上。
2)上述二氧化硅是亲水性的。
3)担载于医药原料药载体的医药原料药是无定形的。
另外,本发明的一个实施方式提供一种医药原料药载体的制造方法,其包括将医药原料药溶解于有机溶剂后添加二氧化硅并去除有机溶剂的工序,该二氧化硅的孔半径1~100nm的孔的容积为3.0~5.0ml/g、并且基于bjh法的孔半径的峰位于10~50nm,所述孔半径是基于bjh法测定的。
发明的效果
根据本发明的一个实施方式,通过使医药原料药担载于具有特定的孔容积和孔半径的二氧化硅,不仅医药原料药、特别是水难溶性医药原料药的溶解度飞跃性地提高,且令人惊讶的是,可使医药原料药的溶解性长时间地以恒定的比例持续(缓释性优异)。
本发明的一个实施方式涉及的医药原料药载体(以下也称为“本医药原料药载体”。)具有上述效果的具体理由尚不清楚,但本发明人等推测如下。
即,推测用于本医药原料药载体的二氧化硅具有特定的孔容积和孔半径,所要担载的医药原料药以无定形的状态包含在二氧化硅的孔径内。推测尤其是在利用本发明的一个实施方式的制造方法(以下也称为“本制造方法”。)来制造医药原料药载体时,医药原料药以无定形的状态存在并包含在二氧化硅的孔径内。推测通常无定形物质与晶体相比对水的溶解性高,因此,将上述医药原料药载体添加到生物环境等水介质中时,医药原料药的溶解度会飞跃性地提高。另外,推测此时由于会表现出与二氧化硅的亲水度相应的溶解性,因此可以推测,如果使用亲水的二氧化硅作为二氧化硅,则医药原料药对上述水介质中的溶解度会进一步提高。
另外,推测在使本医药原料药载体接触上述水介质时,通过作为溶剂的水润湿二氧化硅内部,会缓缓地与孔内的医药原料药接触,因此医药原料药的溶解性会长时间地持续。
如上所述,通过本医药原料药载体,医药原料药、特别是水难溶性医药原料药对水的溶解性飞跃性地提高,进而该溶解性长时间地持续,因此,本医药原料药载体作为各种医药原料药、特别是水难溶性医药原料药的载体是有益的。
附图说明
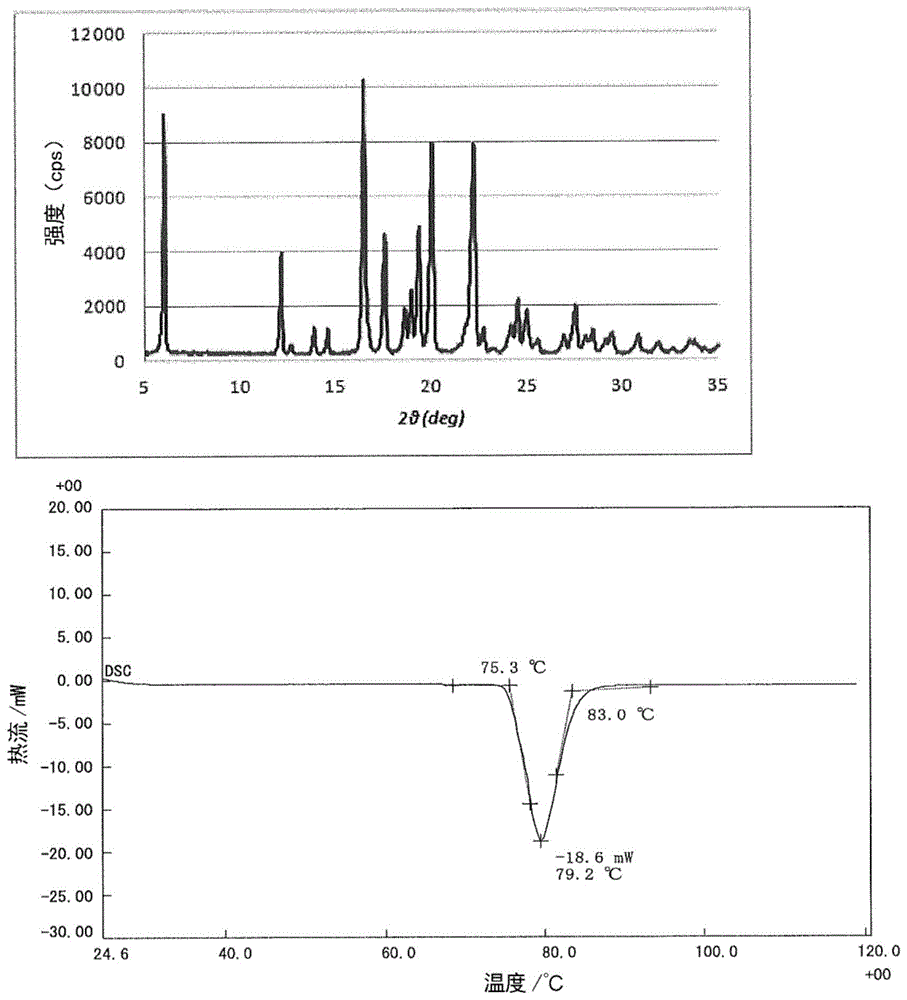
图1为布洛芬的x射线晶体衍射峰(上图)及dsc图(下图)。
图2为担载布洛芬的本医药原料药载体的x射线晶体衍射峰(上图)及dsc图(下图)。
图3为将布洛芬担载于二氧化硅b而得到的载体的x射线晶体衍射峰(上图)及dsc图(下图)。
图4为示出担载布洛芬的本医药原料药载体、将布洛芬担载于二氧化硅b而得到的载体、以及布洛芬晶体(布洛芬)的溶出试验第一液(ph1.2)的溶出试验的结果的图。
图5为示出担载依泽替米贝的本医药原料药载体、以及依泽替米贝晶体(依泽替米贝)的溶出试验第一液(ph1.2)的溶出试验的结果的图。
图6为示出担载依泽替米贝的本医药原料药载体、以及依泽替米贝的溶出试验第二液(ph6.8)的溶出试验的结果的图。
图7为担载塞来昔布的本医药原料药载体、以及塞来昔布晶体(塞来昔布)的溶出试验第一液(ph1.2)的溶出试验的结果的图。
图8为示出担载塞来昔布的本医药原料药载体、以及塞来昔布的溶出试验第二液(ph6.8)的溶出试验的结果的图。
图9为担载阿齐沙坦的本医药原料药载体、以及阿齐沙坦晶体(阿齐沙坦)的溶出试验第一液(ph1.2)的溶出试验的结果的图。
具体实施方式
《医药原料药载体》
本医药原料药载体的特征在于,其是将医药原料药担载于二氧化硅而得到的医药原料药载体,上述二氧化硅的孔半径1~100nm的孔的容积为3.0~5.0ml/g、并且基于bjh法的孔半径的峰位于10~50nm,所述孔半径是基于bjh法测定的。根据这种医药原料药载体,不仅医药原料药、特别是水难溶性医药原料药的溶解度飞跃性地提高,而且令人惊讶的是,可使医药原料药的溶解性长时间以恒定的比例持续。
图2示出担载有作为解热阵痛消炎药的布洛芬(ibp)的本医药原料药载体的x射线晶体衍射峰及dsc图。与图1的ibp晶体的x射线晶体衍射峰及dsc图比较后可以明显看出,本医药原料药载体的x射线晶体衍射峰中没有检测出针对ibp晶体的特征的衍射峰。由此推测,在本医药原料药载体中,作为医药原料药的ibp没有被担载于二氧化硅表面,而是被包含于二氧化硅的孔径内。另外,从与dsc图的比较以明显看出,本医药原料药载体中,没有检测出在ibp晶体中观察到的吸热峰,可以推测本医药原料药载体中的ibp以无定形的状态存在。
另一方面,图3示出将ibp担载于孔半径1~100nm的孔的容积为1.1ml/g、孔半径的峰值为13nm的二氧化硅b而得到的医药原料药载体的x射线晶体衍射峰和dsc图。图3中存在与ibp晶体相同的x射线晶体衍射峰和dsc图中的吸热峰,因此,可以推测担载于该二氧化硅b的ibp以晶体状态担载于二氧化硅表面。
图4示出医药原料药及医药原料药载体的溶出试验第一液的溶出试验的结果。溶出试验第一液为ph1.2的水溶液,为再现胃液中的状态的溶液。图中纵轴示出ibp的溶出率,横轴示出将在该水溶液中添加医药原料药或医药原料药载体之时作为0分钟的情况下的经过时间。
上述溶出试验法依据第十七修订日本药典的浆法来进行。具体而言,将试验液设定为日本药典的溶出试验液第一液900ml,将温度设定为37±0.5℃,将转速设定为75rpm,投入被试验样品后,每隔一定时间采样约1ml,使用针筒式过滤器过滤后进行hplc分析,求得医药原料药的峰面积。将得到的面积与溶出率100%时的医药原料药的峰面积进行比较,从而计算溶出率(%)。
需要说明的是,溶出率是如下得到的值:在将ibp晶体200mg完全溶解于试验液900ml的状态下进行hplc分析,将得到的面积设定为溶出率100%,向溶出液中添加医药原料药、医药原料药载体之后,随时间进行采样、过滤,然后进行hplc分析而计算出的面积与溶出率100%的数值比较而计算出的值。
从图4的结果以明显获知,本医药原料药载体与ibp晶体相比,医药原料药的溶解性飞跃性地提高,并且医药原料药的溶解性长时间地持续。另一方面可知,即便是将ibp担载于二氧化硅b而得到的载体,与ibp晶体相比虽然确认到医药原料药的溶解性的提高效果,但是与本医药原料药载体相比时,医药原料药的溶解性低,本医药原料药载体具有高的医药原料药溶解性提高效果。
如上所述,本医药原料药载体与医药原料药相比在上述溶出试验液中表现出高溶解性和缓释性的具体理由尚不清楚,但本发明人等推测其理由如下。
即,推测本医药原料药载体中的医药原料药如上述x射线晶体衍射峰和dsc图所清楚地示出地那样以无定形的状态存在。通常,对于医药原料药单体而言,无定形的状态比晶体性的状态对水介质(例如:水、上述水溶液等体液或体液类似液)的溶解性高,因此推测本医药原料药载体也会表现出医药原料药的高溶解性。另外,推测本医药原料药载体中的担载介质为具有特定的孔容积和孔半径的二氧化硅,在二氧化硅内部的孔内包含医药原料药,通过该医药原料药与水介质的接触而缓缓地溶解。推测基于上述效果,本医药原料药载体表现出高的缓释性。
<二氧化硅>
上述二氧化硅基于bjh法的孔半径1~100nm的孔的容积为3.0~5.0ml/g、并且基于bjh法的孔半径的峰位于10~50nm。由于使用具有上述特定的孔容积和孔半径的二氧化硅,因此会表现出上述效果。
本发明中的“基于bjh法的孔半径1~100nm的孔的容积”是指:将作为测定对象的样品在1kpa以下的真空下以200℃的温度干燥3小时以上,其后,测定在液氮温度下仅氮的吸附侧的吸附等温线,基于bjh法分析该吸附等温线而得到的孔半径1nm以上且100nm以下的孔的容积。
“基于bjh法的孔半径的峰”是指:基于bjh法分析与上述相同得到的吸附侧的吸附等温线,将基于孔半径的对数的累积孔容的微分作为纵轴、将孔半径作为横轴,取绘制的孔分布曲线(体积分布曲线)的最大的峰值的孔半径的值。
从提高医药原料药的担载量的观点、以无定形的状态包含医药原料药的观点等出发,上述孔半径1~100nm的孔的容积优选为3.0~4.0ml/g。另外,从能够经时地维持医药原料药的溶解性提高效果的观点等出发,上述孔半径的峰优选为10~40nm,更优选为10~30nm的范围。
关于上述二氧化硅,从可将医药原料药担载于孔内的观点、以及使本医药原料药载体与水介质接触时的医药原料药的缓释性的观点等出发,孔半径在10~50nm的范围的孔的容积相对于总孔容积100%优选为60%以上、更优选为70%以上、特别优选为75%以上。
关于上述孔半径在10~50nm的范围的孔容积的比例,具体而言,可使用下述实施例记载的方法测定。
上述二氧化硅的粒径可以考虑包含本医药原料药载体的药剂的形状(例如片剂、颗粒状、胶囊状)等来适宜地决定,然而从高效地表达药效的观点、以及成为对水介质的分散性优异的医药原料药载体的观点等出发,基于库尔特计数法或激光衍射法的粒度分布测定中的体积基准的d50值优选为1~100μm,更优选为1~50μm。
关于上述二氧化硅的堆积密度,从用于药剂时的处理性、与在形成药剂时使用的其他的成分(例:溶剂)的亲和性的观点等出发,优选为20~200g/l,更优选为50~120g/l的范围,吸油量优选为400~600ml/100g,更优选为450~600ml/100g。
上述堆积密度和吸油量具体可通过下述实施例记载的方法来测定。
关于上述二氧化硅,从医药原料药载体在水介质中的分散性的观点、医药原料药的溶解性的观点等出发,优选为亲水性。
二氧化硅是否为亲水性可通过使二氧化硅与水接触时的分散性来判断,亲水性的二氧化硅在水中分散,而疏水性的二氧化硅在水上漂浮。另外,二氧化硅是否为亲水性可通过m值来判断。
作为上述二氧化硅,可列举出二氧化硅气凝胶等。二氧化硅气凝胶通常可以通过如下方式获得:在利用碱金属硅酸盐、烷氧基硅烷的水解制作硅凝胶后,使用超临界干燥等方法使其干燥,从而得到。
作为具有上述物性的二氧化硅的制造方法,例如可列举出国际公开第2012/057086号记载的方法。具体而言,优选依次包括下述工序的气凝胶的制造方法:(1)制备水性硅溶胶的工序;(2)使该水性硅溶胶在疏水性溶剂中分散而形成w/o型乳液的工序;(3)使上述硅溶胶凝胶化,将上述w/o型乳液向凝胶体的分散液转换的工序;(4)将上述凝胶化体中的水分替换为20℃下的表面张力为30mn/m以下的溶剂的工序;(5)使用疏水剂对上述凝胶体进行处理的工序;以及,(6)去除上述替换的溶剂的工序。
通过这些方法得到的二氧化硅为疏水性,但在使用电炉等于空气气氛下以500~700℃保持约3小时的情况下,由于表面的疏水基燃烧,因此可以制成为亲水性。
<医药原料药>
用于本医药原料药载体的医药原料药没有特别限制,可根据期望的用途使用公知的医药原料药。
关于上述医药原料药,根据前述推测,优选能够担载于二氧化硅的孔中的医药原料药,特别是从上述效果的方面来看,适宜的是使用属于分子量为100~1000左右的较低分子的有机医药原料药。
另外,根据本医药原料药载体,能够提高医药原料药对水介质的溶解性,因此,从能够进一步发挥本发明的效果的观点等出发,作为上述医药原料药,优选水难溶性的医药原料药,特别优选使用对水的25℃溶解度为1mg/ml以下的水难溶性的医药原料药。作为该医药原料药,可列举出:布洛芬、对乙酰氨基酚、阿齐沙坦、普罗布考、依泽替米贝、塞来昔布、伊曲康唑、莫沙必利酸盐、硝苯地平、酮康唑、萘哌地尔等。
特别是具有羟基的医药原料药被认为可以利用与作为担载介质的二氧化硅的孔内的羟基的化学作用(例如氢键)而牢固地固定,从而提高医药原料药的缓释性,因此,作为需要缓释性更优异的本医药原料药载体时的医药原料药是适宜的。
另一方面,关于本医药原料药载体,从能够使医药原料药的溶解性长时间地以恒定的比例持续的观点出发,也可以通过担载对水的溶解性高的医药原料药而使其溶解性长时间地以恒定的比例持续。
担载于医药原料药载体的医药原料药的状态没有特别限制,但是从考虑能够由医药原料药的溶解性得到优异的医药原料药载体等方面来看,优选为无定形的状态。
关于医药原料药相对于二氧化硅的担载量,优选医药原料药能够以无定形的状态担载、进而在载体中能够长时间地维持无定形的状态的范围,医药原料药的担载量相对于载体总量为10~80重量%、进一步优选为20~50重量%。
[医药原料药载体的制造方法]
作为本制造方法,只要将医药原料药担载于二氧化硅就没有特别限制,可使用公知的方法。具体而言,可列举出如下方法等:(i)在溶剂中添加医药原料药和二氧化硅,将医药原料药担载于二氧化硅后,包括通过滤取等进行分离、使溶剂干燥等去除溶剂的工序的方法;(ii)在有机溶剂等中溶解医药原料药后,添加二氧化硅,将医药原料药担载于二氧化硅,然后包括通过滤取等进行分离、使有机溶剂等干燥等去除有机溶剂等的工序的方法;(iii)将在有机溶剂等中溶解有医药原料药的溶液滴加至预先分散有二氧化硅的分散液中,并包括使有机溶剂等干燥等去除的有机溶剂等的工序的方法。
上述担载时可进行使用超声波的分散。
尤其是在上述(ii)的方法中,可将医药原料药以无定形的状态担载于二氧化硅,从提高医药原料药对水介质的溶解性的效果方面来看是最适宜的。
作为上述有机溶剂等,只要为能够使医药原料药溶解的溶剂就无特别限制。作为这样的有机溶剂,可列举出丙酮等。
另外,作为有机溶剂等的用量,只要为足够溶解医药原料药的量就没有特别限制,通常而言,平均每1质量份医药原料药、有机溶剂等处于10~200质量份的范围。
在有机溶剂等中溶解医药原料药后,对于添加二氧化硅、将医药原料药担载于二氧化硅时的温度没有特别限制,通常而言以20~60℃的范围适宜设定即可。另外,对于担载的时间也没有特别限制,通常而言只要为1分钟~1小时左右即足够。
进而,从能够将医药原料药高效地担载于二氧化硅等方面出发,可以边进行基于超声波的分散、基于搅拌机的搅拌边进行担载。得到的医药原料药载体也可以不干燥而直接用于湿式法的片剂化等,但还可以在干燥后用于期望的目的。
作为将医药原料药担载于二氧化硅后使其干燥的方法,只要为能够去除有机溶剂等的方法即可,例如可列举出:基于蒸发器的减压浓缩、加热条件下的减压干燥。干燥后的医药原料药载体可以直接使用,也可以根据需要进行粉碎或破碎处理。
[医药原料药载体的使用方式]
本医药原料药载体直接使用亦可,但还可以配混赋形剂等而以片剂的形式使用。另外,也可以以贴剂、吸入剂的形式使用。
另外,对于本医药原料药载体,通常通过与水介质、特别是体液接触来释放担载的医药原料药。因此,作为自本医药原料药载体的医药原料药的释放性,使用下述的溶出试验液第一液、第二液。
实施例
以下列举实施例并详细地对本发明进行说明,但本发明不限定于这些实施例。
本实施例和比较例中使用下述表1所示的亲水性二氧化硅a~c。
需要说明的是,二氧化硅a基于国际公开第2012/057086号记载的方法合成,二氧化硅b为基于以往公知的干式法合成者。另外,二氧化硅c使用了市售品。
这些二氧化硅的各物性值的测定方法如下所示。
[表1]
·粒径(体积基准粒径d50)
对于将乙醇40ml和二氧化硅0.01g混合并使用日本艾默生株式会社制的超声波洗涤机b1510j-mt分散3分钟而得到的物质,使用beckmancoulter,inc制multisizeriii、且使用50μm口管(aperturetube)进行粒度分布的测定。求出得到的体积基准的粒度分布中的d50(μm)的值。
·比表面积
将测定对象的样品在1kpa以下的真空下以200℃的温度干燥3小时以上,其后,测定液氮温度下的仅氮吸附侧的吸附等温线,根据bet法分析该吸附等温线。此时的分析中使用的压力范围为相对压0.1~0.25的范围。
·孔容积和孔半径的峰值
上述表1的孔容积(ml/g)为通过基于bjh法(barrett,e.p.;joyner,l.g.;halenda,p.p.,j.am.chem.soc.73,373(1951))分析对上述比表面积进行测定时取得的吸附侧的吸附等温线而得到的、源自孔半径1nm以上且100nm以下的孔的容积。
孔半径的峰值(nm)为如下值:基于bjh法分析上述吸附等温线,取以根据孔半径的对数的累积孔容的微分为纵轴、以孔半径为横轴绘制的孔分布曲线(体积分布曲线)的最大的峰值为孔半径的值。
另外,表1中的孔半径为10~50nm的比例(%)为基于下述式算出的。需要说明的是,下述式中的孔半径在10~50nm的范围的孔的容积和二氧化硅所具有的总孔容积通过与上述(孔半径1~100nm的)孔容积相同的方法测定。
孔半径为10~50nm的比例(%)=孔半径在10~50nm的范围的孔的容积×100/二氧化硅所具有的总孔容积
·吸油量
通过基于jisk5600-13-1的方法测定吸油量。具体而言,将测定对象的样品0.4g在玻璃板上展开,一边滴加油酸一边揉捏。以糊剂变为滑润的硬度的时间点为终点。该糊剂能不破裂、不烂地展开并且为轻轻地附着于玻璃板的程度。将滴加的油酸的体积换算为每100g二氧化硅的数值而得到的值为吸油量(ml/100g)。
·堆积密度
根据日本药典记载的堆积密度测定法第一法进行测定。为了将二氧化硅的聚集体破碎,测定前,使测定对象的二氧化硅通过具有2mm的网眼的筛网。将通过筛网的二氧化硅约5g(将使用的二氧化硅的量(g)设为mg)不压实地轻轻地放入干燥的100ml量筒。根据需要,不压实地、小心地将粉体层的上表面平整,读取松弛堆积体积(v)到最小刻度单位。通过m/v计算堆积密度(g/l)。
[实施例1]
在200ml的茄型烧瓶中加入布洛芬1.0g和丙酮50ml,在室温下均匀地使之溶解。接着,添加亲水性二氧化硅a2.3g,在室温下振荡而使之均匀地分散。使得到的分散液在40℃的旋转蒸发器中浓缩,从而得到医药原料药载体的湿体。将该湿体在50℃下减压干燥,从而以回收率92%得到医药原料药载体。
[实施例2]
代替实施例1中的振荡,将茄型烧瓶浸渍于超声波浴、在20~50℃下进行基于20分钟超声波照射的分散,除此以外,进行与实施例1相同的操作,从而以回收率85%得到医药原料药载体。
[实施例3]
在具备顶置式搅拌器的200ml的三口烧瓶中加入亲水性二氧化硅a2.3g,在60℃下加热。将布洛芬1.0g溶解于50ml的丙酮来制备布洛芬溶液,倒入100ml的滴液漏斗,在搅拌下,一边以氮气使丙酮蒸发一边滴加布洛芬溶液,从而得到医药原料药载体的湿体。将得到的湿体在50℃下减压干燥,从而以回收率87%得到医药原料药载体。
[比较例1~2]
代替亲水性二氧化硅a,使用亲水性二氧化硅b(比较例1)或亲水性二氧化硅c(比较例2),除此以外,进行与实施例1相同的操作来制备医药原料药载体。比较例1的回收率为93%,比较例2的回收率为88%。
<溶出试验>
称量医药原料药载体0.66g(相当于医药原料药200mg),依据日本药典溶出试验法的浆法,使用溶出试验液第一液(ph1.2)来进行溶出试验。试验液的温度设定为37±0.5℃,转速设定为75rpm。在添加医药原料药载体5分钟、10分钟、15分钟、30分钟后,进一步于其后每隔15分钟进行1次采样直到120分钟为止,将得到的样品立刻用针筒式过滤器过滤,通过使用uv检测器的高效液相色谱仪(hplc)由医药原料药的峰面积如前述计算出溶出率(%)。
另外,代替上述医药原料药载体而使用布洛芬原料药(ibp晶体),除此以外,与上述同样地进行ibp晶体的溶出试验。
将结果示于表2。另外,将使用实施例1或比较例1中得到的医药原料药载体、或ibp晶体(布洛芬)的情况下的溶出试验的结果示于图4。
[表2]
由上述结果可以清楚地获知,本医药原料药载体与ibp晶体相比飞跃性地提高了溶解性、且溶解性长时间地持续。另一方面可知,尽管使ibp担载于二氧化硅b、c而得到的载体与ibp晶体相比也确认到了溶解性提高效果,然而与本医药原料药载体相比时,医药原料药的溶解性低,本医药原料药载体与使用二氧化硅b、c时相比具有医药原料药的高的溶解性提高效果。
<x射线晶体衍射峰>
使用株式会社理学制、x射线衍射分析装置smartlab,在管电压-电流:40kv-30ma,测定角:5~35deg的条件下对ibp晶体或者在实施例1或比较例1中得到的医药原料药载体的x射线晶体衍射峰进行了测定。
将ibp晶体的峰作为图1的上图示出,将实施例1中得到的医药原料药载体的峰作为图2的上图示出,将比较例1中得到的医药原料药载体的峰作为图3的上图示出。
<dsc图>
使用株式会社理学制、差示扫描量热计dsc8230,在升温速度10℃/分钟下对ibp晶体、或实施例1或比较例1中得到的医药原料药载体的dsc图进行了测定。
将ibp晶体的dsc图作为图1的下图示出,将实施例1中得到的医药原料药载体的dsc图作为图2的下图示出,将比较例1中得到的医药原料药载体的dsc图作为图3的下图示出。
[实施例4]
在200ml的茄型烧瓶中加入依泽替米贝(etb)1.0g和丙酮50ml,在室温下使其均匀地溶解。接着,添加亲水性二氧化硅a2.3g。将茄型烧瓶浸渍于超声波浴中,在20~50℃下通过20分钟的超声波照射使其分散。使得到的分散液在40℃的旋转蒸发器中浓缩,从而得到医药原料药载体的湿体。对上述湿体以50℃进行减压干燥,以回收率97%得到医药原料药载体。
以与上述相同的方式进行得到的医药原料药载体的x射线晶体衍射和dsc测定,确认到担载于该医药原料药载体的etb为无定形体、etb担载于孔内。
<溶出试验>
与上述溶出试验同样地进行得到的医药原料药载体或依泽替米贝原料药(etb晶体)的溶出试验。需要说明的是,在上述试验中,进行了使用与上述相同的溶出试验液第一液(ph1.2)的情形、以及使用溶出试验液第二液(ph6.8)的情形的试验。
将结果示于表3。另外,将使用溶出试验液第一液时的溶出试验结果示于图5,将使用溶出试验液第二液时的溶出试验的结果示于图6。
[表3]
[实施例5]
在200ml的茄型烧瓶中加入塞来昔布(cxb)1.0g和丙酮50ml,在室温下使之均匀地溶解。接着,添加亲水性二氧化硅a2.3g。将茄型烧瓶浸渍于超声波浴中,在20~50℃下20分钟的超声波照射使其分散。使得到的分散液在40℃的旋转蒸发器中浓缩,从而得到医药原料药载体的湿体。将上述湿体在50℃下减压干燥,以回收率88%得到医药原料药载体。
以与上述相同的方式进行得到的医药原料药载体进行x射线晶体衍射和dsc测定,确认到担载于该医药原料药载体的cxb为无定形体、cxb担载于孔内。
<溶出试验>
以与上述相同的方式进行得到的医药原料药载体或塞来昔布原料药(cxb晶体)的、使用溶出试验液第一液(ph1.2)或溶出试验液第二液(ph6.8)的溶出试验。
将结果示于表4。另外,将使用溶出试验液第一液时的溶出试验结果示于图7,将使用溶出试验液第二液时的溶出试验的结果示于图8。
[表4]
[实施例6]
在200ml的茄型烧瓶中加入阿齐沙坦(azl)1.0g、丙酮40ml和二甲基亚砜10ml,在室温下使之均匀地溶解。接着,添加亲水性二氧化硅a2.3g。将茄型烧瓶浸渍于超声波浴中,在20~50℃下,通过20分钟的超声波照射使之分散。使分散液在40℃的旋转蒸发器中浓缩,从而得到医药原料药载体的湿体。将湿体在60℃下减压干燥,以回收率98%得到医药原料药载体。
以与上述相同的方式进行得到的医药原料药载体的x射线晶体衍射和dsc测定,确认到担载于该医药原料药载体的azl为无定形体、azl担载于孔内。
<溶出试验>
以与上述相同的方式进行得到的医药原料药载体或阿齐沙坦原料药(azl晶体)的、使用溶出试验液第一液(ph1.2)的溶出试验。
将结果示于表5和图9。
[表5]
- 还没有人留言评论。精彩留言会获得点赞!