用于治疗癌症的方法和组合物与流程
相关申请的交叉引用
本申请要求2017年6月15日提交的美国临时专利申请第62/520325号和2017年12月27日提交的美国临时专利申请第62/610711号的优先权,在此将其全部内容通过引用并入本文。
一些实施方案通常涉及生物学、医学和癌症治疗。一些方面涉及具有对多种癌细胞有毒的蛋白或多肽组分的蛋白组合物。其他方面涉及具有或递送降解cd95的蛋白或多肽组分的蛋白组合物。
背景技术:
精准医疗是旨在通过使用基因或分子谱分析来优化特定患者群体的效率或治疗效益的医学护理,已经在治疗癌症方面获得了巨大的吸引力。鉴定(i)产生发生癌症的风险、(ii)影响肿瘤的生长、和(iii)调节转移的特异性基因组异常,限定了如何诊断癌症、确定如何开发和实施靶向疗法并制定癌症预防策略。
对癌症精准医疗的需求主要是基于未能鉴定出将肿瘤细胞与健康的非癌细胞区别开来的肿瘤细胞可靶向特性。实际上,尽管放射疗法和/或化学疗法具有有效杀伤许多(即使不是大多数)癌细胞的能力,但其功效却受到对非癌细胞的细胞毒性作用的严重限制。这些发现表明,作为放射疗法和化学疗法所靶向的特性的快速细胞分裂不足以使癌细胞达到限制大量副作用所需的特异性。
cd95(fas/apo-1/tnfrsf6)是一种细胞表面受体,可通过多种机制触发细胞凋亡。通过常规机制,与cd95结合的fas配体(fasl/cd95l)诱导其死亡结构域(dd)募集许多因子,包括衔接分子fadd、胱天蛋白酶原-8/10和胱天蛋白酶-8/10调节物c-flip。死亡诱导信号传导复合体(disc)的形成导致胱天蛋白酶-8的自蛋白水解过程,并激活胱天蛋白酶-8,其直接或间接激活胱天蛋白酶-3以诱导凋亡(peter和krammer,celldeathdiffer.,2003)。
尽管使用fasl触发cd95介导的细胞凋亡来治疗癌症已经引起了人们的极大兴趣,但是这种方法遇到了两个重要的障碍。首先,cd95在全身表达,特别是在胸腺、肝脏、心脏和肾脏中大量表达。因此,通过递送fasl杀伤癌细胞的尝试已经被阻止,因为会诱导健康的非癌细胞例如肝细胞中的细胞凋亡,从而导致急性肝坏死(bidere等人,annu.rev.immunol.,2006)。其次,肿瘤细胞具有对cd95/cd95l介导的细胞凋亡产生耐受的多种途径(algeciras-schimnich等人,procnatlacadsciusa.,2003;ivanov等人,molcellbiol.,2003,ivanov等人,jbiolchem.,2006)。另外,这些耐受的肿瘤细胞实际上可以过表达fasl来杀伤浸润的t细胞,以逃避免疫系统(o’connell等人j.exp.med.,1996)。
最近的研究表明,cd95还可以通过独立于fasl介导途径的第二种机制触发癌细胞凋亡(chen等人,nature.,2010;hadji等人,cellrep.,2014)。这些研究表明,通过称为“cd95r/l消除诱导的致死”(dice)的途径,sirna或shrna的cd95敲低诱导多种癌细胞系的肿瘤细胞凋亡。dice通过涉及细胞肿胀、活性氧(ros)产生的途径,随后发生dna损伤、胱天蛋白酶激活和线粒体外膜通透性(momp)丧失来诱导癌细胞凋亡。肝脏或卵巢癌细胞中cd95的基因缺失诱导小鼠中的细胞凋亡,从而导致免疫细胞浸润并大大减缓了癌症进展。相比之下,除了t细胞耗尽外,cd95基因敲除(cd95-/-)小鼠在正常的非荷瘤小鼠中没有显示细胞死亡或生长缺陷的迹象,这表明dice优先影响癌细胞,而对正常细胞(免疫系统之外)的影响很小(adachi等人,nat.genet.,1995;karray等人,j.immunol.,2004)。
这些发现表明,将sirna或shrna递送至肿瘤细胞中以产生较低的cd95水平可能是治疗癌症的可行方法。但是,该方案存在两个重要问题。首先,实施用于癌症疗法的sirna药物仍然存在重大障碍,包括细胞吸收差、在生理条件下不稳定、脱靶效应以及可能的免疫原性(dominska和dykxhoorn,jcellsci.,2010;jackson和linsley等人,natrevdrugdiscov.,2010;moschos等人,bioconjugchem.,2007)。其次,由于cd95对于t细胞的存活、增殖和激活至关重要,因此t细胞中缺失cd95会导致小鼠淋巴细胞减少(hao等人,j.exp.med.,2004;krammer.,nature,2000),这种方法可能会耗尽t细胞并抑制抗肿瘤免疫力,从而产生不良副作用。
需要用于具有广泛基础癌症特异性疗法的其他方法和组合物,其对非癌细胞和组织的毒性最小并且具有最小的或没有长期的负面的副作用。
技术实现要素:
癌症疗法脱靶毒性问题的一种解决方案是开发靶向癌症疗法,其具有通过鉴定癌细胞中与健康细胞不同的靶点而杀伤癌细胞从而保留健康细胞的能力。靶向疗法的一种方法是使用能够靶向癌细胞的抗癌分子。这些分子可以从细胞中分离和/或合成制备。这些抗癌分子也可以与放射疗法、化学疗法、免疫疗法、靶向疗法或抗激素疗法结合使用,以提高抗癌效果。这类靶向的抗癌分子的来源之一是嗜中性粒细胞。发明人发现了具有杀伤多种癌细胞的能力的嗜中性粒细胞分泌因子。在一些方面,这些因子最小程度地影响非癌细胞的活力,并且具有最小或没有负面的副作用。
实施方案使用治疗性多肽(抗癌剂)组合物代替基于细胞的治疗。由于至少以下三个原因,本文所述的治疗组合物优于嗜中性粒细胞和/或嗜中性粒细胞刺激剂或嗜中性粒细胞募集剂:(1)通过递送本文所述的抗癌剂(即本文所述的多肽组合物),可以更好地控制给药方案,因此可以更好地调节治疗剂的功效和潜在毒性。(2)大量证据表明肿瘤可以将早期癌症中的抗肿瘤嗜中性粒细胞重编程为促肿瘤表型,从而促进转移(eruslanov等人,2014;mishalian等人,2013;coffelt等人,2016)。因此,肿瘤有可能阻断所递送的嗜中性粒细胞释放抗癌剂的能力,或者甚至更糟地刺激促肿瘤发生因子的产生。(3)白细胞输注前保持嗜中性粒细胞存活以及输注后的移植物抗宿主病是目前的挑战(kopolovic等人,2015;fox等人,2010)。
发明人已经鉴定出两种嗜中性粒细胞分泌因子:(1)嗜酸性粒细胞阳离子蛋白(ecp)和(2)嗜中性粒细胞弹性蛋白酶(elane)。发明人已经确定这些成分及其变体具有特异性杀伤癌症的能力,可以通过这些因子的各种组合来增强其特异性杀伤癌症的能力。
在一些方面,嗜酸性粒细胞阳离子蛋白(ecp)或其变体的氨基酸序列与mvpklftsqiclllllglmgvegslharppqftraqwfaiqhislnpprctiamrainnyrwrcknqntflrttfanvvnvcgnqsircphnrtlnnchrsrfrvpllhcdlinpgaqnisnctyadrpgrrfyvvacdnrdprdsprypvvpvhldtti(seqidno:1)在50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、或155个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及ecp多肽或其变体,所述变体具有ecp多肽的50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个或155个连续氨基酸,所述ecp多肽与seqidno:1是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个或155个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、或155,并终止于氨基酸5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、或160。优选地,所述区段是维持对癌细胞的细胞毒性的功能性区段。在其他方面,可以通过对氨基酸侧链进行化学修饰(例如,交联、糖基化等),或通过在肽的氨基或羧基末端包括异源肽序列来修饰ecp多肽。在一些实施方案中,ecp多肽被糖基化。
在一些方面,嗜中性粒细胞弹性蛋白酶(elane)或其变体的氨基酸序列与mtlgrrlaclflacvlpalllggtalaseivggrrarphawpfmvslqlrgghfcgatliapnfvmsaahcvanvnvravrvvlgahnlsrreptrqvfavqrifengydpvnllndivilqlngsatinanvqvaqlpaqgrrlgngvqclamgwgllgrnrgiasvlqelnvtvvtslcrrsnvctlvrgrqagvcfgdsgsplvcnglihgiasfvrggcasglypdafapvaqfvnwidsiiqrsednpcphprdpdpasrth(seqidno:2)在50个、75个、100个、125个、150个、175个、200个、225个、250个、或260个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及elane多肽或其变体,所述变体具有elane的50个、75个、100个、125个、150个、175个、200个、225个、250个或260个连续氨基酸,所述elane与seqidno:2是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或260个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、或262,并终止于氨基酸6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、或267。优选地,所述区段是维持对癌细胞的细胞毒性的功能性区段。由于发明人已经确定,催化活性对于elane的细胞毒性不是必需的,因此该组合物和方法还可以包括修饰的elane,其保持对癌细胞的细胞毒性,但不保留elane的丝氨酸蛋白酶活性。例如,elane变体可以在形成该丝氨酸蛋白酶的催化三联体的氨基酸h70、d117和s202中的一个或多于一个处具有氨基置换,以及抑制酶活性的其他突变。在其他方面,可以通过对氨基酸侧链进行化学修饰(例如,交联、糖基化等),或通过在肽的氨基或羧基末端包括异源肽序列来修饰elane多肽。在一些实施方案中,elane多肽被糖基化。
一些实施方案涉及包含两种嗜中性粒细胞分泌因子或其变体的各种组合的治疗或抗癌组合物。在一些方面,多肽组合物可以包含(1)elane或(2)elane和ecp。在一些方面,抗癌组合物可以包含有效量的elane多肽。在特定的实施方案中,组合物包含elane和ecp。多肽可以以0份、1份、2份、3份、4份或5份elane比0份、1份、2份、3份、4份或5份ecp的比例存在于组合物中,其中组合物中存在至少1种或2种多肽。多肽可以以1μg/ml、50μg/ml、100μg/ml、150μg/ml、200μg/ml、250μg/ml、300μg/ml、350μg/ml、400μg/ml、450μg/ml至500μg/ml、550μg/ml、600μg/ml、650μg/ml、700μg/ml、750μg/ml、800μg/ml、850μg/ml、900μg/ml、950μg/ml;或1mg/ml、10mg/ml、20mg/ml、30mg/ml、40mg/ml、50mg/ml、60mg/ml、70mg/ml、80mg/ml、90mg/ml至100mg/ml、110mg/ml、120mg/ml、130mg/ml、140mg/ml、150mg/ml、160mg/ml、170mg/ml、180mg/ml、190mg/ml、200mg/ml(包括其间的所有值和范围)的浓度存在于组合物中或单独存在。在一些方面,组合物的任何一种多肽可以但不一定与另一种多肽缔合或复合。如果缔合或复合,则多肽可以共价或非共价缔合。在其他方面,治疗组合物可包含一种或多于一种elane激活物,例如抑制elane抑制剂的化合物或成分,或与一种或多于一种elane激活物组合使用。elane的激活物包括但不限于α-1-抗胰蛋白酶(a1at)、分泌型白细胞肽酶抑制剂(slpi)、丝酶抑制蛋白家族b成员1(serpinb1)、纤溶酶原激活物抑制剂1(pai1)、抗凝血酶(atiii)等。
本文描述的组合物可以杀伤各种癌细胞,而与癌细胞遗传学无关。因此,本文所述的组合物可以治疗各种类型的癌症。在一些方面,癌症是膀胱癌、血癌、骨癌(例如,骨肉瘤)、骨髓癌(例如,白血病)、脑/神经系统癌(例如,神经母细胞瘤、成胶质细胞瘤)、乳腺癌、结直肠癌(例如,结肠癌)、食管癌、胃肠癌、头癌、肾癌、肝癌(例如,肝细胞癌)、肺癌(例如,非小细胞肺癌)、鼻咽癌、颈癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌(例如、黑色素瘤)、胃癌、睾丸癌、舌癌、或子宫癌。本文所述的组合物对癌细胞有毒,但对非癌细胞无毒或毒性有限。
一些实施方案涉及治疗癌症的方法,其包括向患有癌症的患者施用有效量的治疗组合物。在一些方面,癌症是膀胱癌、血癌、骨癌、骨髓癌、脑癌、乳腺癌、结直肠癌、食管癌、胃肠癌、头癌、肾癌、肝癌、肺癌、鼻咽癌、颈癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、胃癌、睾丸癌、舌癌或子宫癌。在一些方面,多肽组合物还可以包含另外的抗癌剂以增强多肽组合物的效力。在一些方面,可以在施用多肽组合物之前;期间;之后;之前和期间;之前和之后;期间和之后;或之前、期间和之后施用这些另外的抗癌剂。在一些方面,本文所述的组合物可以在施用免疫疗法、化学疗法、放射疗法或靶向疗法(例如抗激素疗法等)之前;期间;之后;之前和期间;之前和之后;期间和之后;或之前、期间和之后施用。一些例子包括治疗癌症的方法,该方法包括本文所述的组合物与信号转导抑制剂、基因表达调节物、细胞凋亡诱导物、血管生成抑制剂、抗癌抗体(例如单克隆抗体)等组合施用。在一些方面,本文所述的多肽组合物与化学疗法例如阿霉素和/或紫杉醇联合施用。
在其他方面,蛋白组合物可以用作抗菌剂。在一些方面,本文所述的多肽组合物可用于减轻或治疗铜绿假单胞菌(p.aeruginosa)、鲍曼不动杆菌(a.baumannii)、铜绿假单胞菌(p.aeruginosa)或肺炎克雷白氏杆菌(k.pneumonia)感染。
消除fasl相关癌症疗法的脱靶毒性的一种解决方案是开发靶向cd95使其降解,从而杀伤癌细胞,同时保持健康细胞完整的癌症疗法。这种靶向治疗的一种方法是使用降解cd95并诱导癌细胞特异性凋亡的蛋白酶组合物。可以将降解cd95的蛋白酶组合物与放射疗法、化学疗法、免疫疗法或抗激素疗法组合使用,以提高杀死癌症的效力。发明人发现,一些蛋白酶具有杀伤多种癌细胞的能力。在一些方面,这些蛋白酶最小程度地影响非癌细胞的活力,并且可具有最小甚至没有负面的副作用。
发明人已鉴定出五种降解cd95的多肽:(1)组织蛋白酶g(ctsg),(2)蛋白酶3(prtn3),(3)鼠嗜中性粒细胞弹性蛋白酶(melane),(4)猪胰弹性蛋白酶(ppe/pela1)、大鼠胰弹性蛋白酶(rpe/rela1)和(5)人嗜中性粒细胞弹性蛋白酶(elane)。发明人已经确定这些成分及其变体具有癌症特异性杀伤能力。
组织蛋白酶g(ctsg)是肽酶s1蛋白家族的成员,存在于嗜中性多形核白细胞的嗜天青颗粒中。该蛋白酶具有与胰凝乳蛋白酶c相似的特异性,并且可参与被吞噬的病原体的杀伤和消化,并参与炎症部位的结缔组织重塑。genpept登录号np_001902.1描述了智人的组织蛋白酶g前蛋白。ctsg前蛋白的氨基酸序列为mqplllllafllptgaeageiiggresrphsrpymaylqiqspagqsrcggflvredfvltaahcwgsninvtlgahniqrrentqqhitarrairhpqynqrtiqndimllqlsrrvrrnrnvnpvalpraqeglrpgtlctvagwgrvsmrrgtdtlrevqlrvqrdrqclrifgsydprrqicvgdrrerkaafkgdsggpllcnnvahgivsygkssgvppevftrvssflpwirttmrsfklldqmetpl(seqidno:3)。在一些方面,ctsg多肽或其变体的氨基酸序列与seqidno:3在50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或255个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、或250个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249或250,并终止于氨基酸6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254或255。在一些方面,ctsg多肽可以是维持降解cd95和诱导癌细胞死亡的能力的功能性多肽区段。在一些方面,多肽区段包含seqidno:3的50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个或250个连续氨基酸,包括其间的所有值和范围。在特定方面,ctsg多肽可包含seqidno:3的氨基酸21至241(胰蛋白酶样蛋白酶结构域)。在其他方面,可以通过对氨基酸侧链进行化学修饰(例如,交联、糖基化等),或通过在肽的氨基或羧基末端包括异源肽序列来修饰ctsg多肽。
蛋白酶3(prtn3)是一种主要在嗜中性粒细胞中表达的丝氨酸蛋白酶。尚不清楚其在嗜中性粒细胞功能中的确切作用,但在人嗜中性粒细胞中,蛋白酶3有助于抗菌肽的蛋白水解生成。它也是c-anca(细胞质亚型)类抗嗜中性粒细胞细胞质抗体(anca)的靶标,该抗体是一种在具有多血管炎的肉芽肿病(以前称为“韦格纳肉芽肿病”)中常见的抗体类型。genpept登录号np_002768.3描述了智人的prtn3。prnt3蛋白的氨基酸序列为mahrppspalasvllalllsgaaraaeivggheaqphsrpymaslqmrgnpgshfcggtlihpsfvltaahclrdipqrlvnvvlgahnvrtqeptqqhfsvaqvflnnydaenklndvlliqlsspanlsasvatvqlpqqdqpvphgtqclamgwgrvgahdppaqvlqelnvtvvtffcrphnictfvprrkagicfgdsggplicdgiiqgidsfviwgcatrlfpdfftrvalyvdwirstlrrveakgrp(seqidno:4)。在一些方面,prnt3多肽或其变体的氨基酸序列与seqidno:4在50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或256个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、或250个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250或251,并终止于氨基酸6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255或256。在一些方面,prtn3多肽可以是维持降解cd95和诱导癌细胞死亡的能力的功能性多肽区段。在一些方面,多肽区段包含seqidno:4的50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个或250个连续氨基酸,包括其间的所有值和范围。在特定方面,prtn3多肽可包含seqidno:4的氨基酸28至246(胰蛋白酶样蛋白酶结构域)。在其他方面,可以通过对氨基酸侧链进行化学修饰(例如,交联、糖基化等),或通过在肽的氨基或羧基末端包括异源肽序列来修饰prtn3多肽。
在一些方面,嗜中性粒细胞弹性蛋白酶(elane)或其变体的氨基酸序列与mtlgrrlaclflacvlpalllggtalaseivggrrarphawpfmvslqlrgghfcgatliapnfvmsaahcvanvnvravrvvlgahnlsrreptrqvfavqrifengydpvnllndivilqlngsatinanvqvaqlpaqgrrlgngvqclamgwgllgrnrgiasvlqelnvtvvtslcrrsnvctlvrgrqagvcfgdsgsplvcnglihgiasfvrggcasglypdafapvaqfvnwidsiiqrsednpcphprdpdpasrth(seqidno:2)在50个、75个、100个、125个、150个、175个、200个、225个、250个、或260个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及elane多肽或其变体,所述变体具有elane的50个、75个、100个、125个、150个、175个、200个、225个、250个或260个连续氨基酸,所述elane多肽与seqidno:2是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或260个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、或262,并终止于氨基酸6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、或267。一些方面涉及维持对癌细胞的细胞毒性的elane的功能性多肽区段。在一些方面,多肽区段包含seqidno:2的50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个或250个连续氨基酸,包括其间的所有值和范围。在其他方面,可以通过对氨基酸侧链进行化学修饰(例如,交联、糖基化等),或通过在肽的氨基或羧基末端包括异源肽序列来修饰elane多肽。在一些实施方案中,elane多肽被糖基化。
在一些方面,可以使用鼠嗜中性粒细胞弹性蛋白酶(melane)或其变体,其氨基酸序列与malgrlssrtlaamllalflggpalaseivggrparphawpfmaslqrrgghfcgatliarnfvmsaahcvnglnfrsvqvvlgahdlrrqertrqtfsvqrifengfdpsqllndiviiqlngsatinanvqvaqlpaqgqgvgdrtpclamgwgrlgtnrpspsvlqelnvtvvtnmcrrrvnvctlvprrqagicfgdsggplvcnnlvqgidsfirggcgsglypdafapvaefadwinsiirshndhllthpkdregrtn(seqidno:5)(genpept登录号np_056594.2)在50个、75个、100个、125个、150个、175个、200个、225个、250个、或260个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及melane多肽或其变体,所述变体具有melane的50个、75个、100个、125个、150个、175个、200个、225个、250个或265个连续氨基酸,所述melane多肽与seqidno:5是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或260个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259或260,并终止于氨基酸6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264或265。在一些方面,melane多肽可以是维持降解cd95和诱导癌细胞死亡的能力的功能性多肽区段。在一些方面,多肽区段包含seqidno:5的50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个或250个连续氨基酸,包括其间的所有值和范围。在特定方面,melane多肽可包含seqidno:5的氨基酸29至245(胰蛋白酶样蛋白酶结构域)。
在一些方面,可以使用猪胰弹性蛋白酶(pela1)或其变体,其氨基酸序列与mlrllvvaslvlyghstqdfpetnarvvggteaqrnswpsqislqyrsgsswahtcggtlirqnwvmtaahcvdreltfrvvvgehnlnqndgteqyvgvqkivvhpywntddvaagydiallrlaqsvtlnsyvqlgvlpragtilannspcyitgwgltrtngqlaqtlqqaylptvdyaicssssywgstvknsmvcaggdgvrsgcqgdsggplhclvngqyavhgvtsfvsrlgcnvtrkptvftrvsayiswinnviasn(seqidno:6)(sp登录号p00772)在50个、75个、100个、125个、150个、175个、200个、225个、250个、260个至266个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及pela1多肽或其变体,所述变体具有pela1的50个、75个、100个、125个、150个、175个、200个、225个、250个或265个连续氨基酸,所述pela1多肽与seqidno:6是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或260个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、或261,并终止于氨基酸6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、或266。在一些方面,pela1多肽是维持降解cd95和诱导癌细胞死亡的能力的功能性多肽区段。在一些方面,多肽区段包含seqidno:6的50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个或265个连续氨基酸,包括其间的所有值和范围。在特定方面,pela1多肽可包含seqidno:6的氨基酸60至275(胰蛋白酶样蛋白酶结构域)。
一些实施方案涉及治疗或抗癌组合物,其包括降解cd95的蛋白酶或其变体,或编码它们的表达载体或表达盒的多种组合。在一些方面,多肽组合物可包含(1)组织蛋白酶g(ctsg)、(2)蛋白酶3(prtn3)、(3)鼠嗜中性粒细胞弹性蛋白酶(melane)、(4)猪胰弹性蛋白酶(pela1)、或(5)人嗜中性粒细胞弹性蛋白酶(elane)中的一种或多于一种。多肽可以单独以1μg/ml、50μg/ml、100μg/ml、150μg/ml、200μg/ml、250μg/ml、300μg/ml、350μg/ml、400μg/ml、450μg/ml至500μg/ml、550μg/ml、600μg/ml、650μg/ml、700μg/ml、750μg/ml、800μg/ml、850μg/ml、900μg/ml、950μg/ml;或1mg/ml、10mg/ml、20mg/ml、30mg/ml、40mg/ml、50mg/ml、60mg/ml、70mg/ml、80mg/ml、90mg/ml至100mg/ml、110mg/ml、120mg/ml、130mg/ml、140mg/ml、150mg/ml、160mg/ml、170mg/ml、180mg/ml、190mg/ml、200mg/ml的浓度(包括其间的所有值和范围)存在于组合物中。
本文描述的组合物可以杀伤各种癌细胞,而与癌细胞遗传学无关。因此,本文所述的组合物可以治疗各种类型的癌症。在一些方面,癌症是膀胱癌、血癌、骨癌(例如,骨肉瘤)、骨髓癌(例如,白血病)、脑/神经系统癌(例如,神经母细胞瘤、成胶质细胞瘤)、乳腺癌、结直肠癌(例如,结肠癌)、食管癌、胃肠癌、头癌、肾癌、肝癌(例如,肝细胞癌)、肺癌(例如,非小细胞肺癌)、鼻咽癌、颈癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌(例如、黑色素瘤)、胃癌、睾丸癌、舌癌、或子宫癌。本文所述的组合物对癌细胞有毒,但对非癌细胞无毒或毒性有限。
一些实施方案涉及通过降解cd95来杀伤癌细胞的方法,该方法包括向患有癌症的患者施用有效量的治疗组合物。在一些方面,癌症是膀胱癌、血癌、骨癌、骨髓癌、脑癌、乳腺癌、结直肠癌、食管癌、胃肠癌、头癌、肾癌、肝癌、肺癌、鼻咽癌、颈癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、胃癌、睾丸癌、舌癌或子宫癌。在一些方面,多肽组合物还可以包含另外的抗癌剂以增强多肽组合物的效力。在一些方面,可以在施用多肽组合物之前;期间;之后;之前和期间;之前和之后;期间和之后;或之前、期间和之后施用这些另外的抗癌剂。在一些方面,可以在施用免疫疗法、化学疗法、抗激素疗法、或放射疗法之前;期间;之后;之前和期间;之前和之后;期间和之后;或之前、期间和之后施用本文所述的组合物。在一些方面,本文所述的多肽组合物与化学疗法例如阿霉素和/或紫杉醇联合施用。
一些实施方案涉及编码蛋白酶丝氨酸蛋白酶或嗜中性粒细胞衍生的丝氨酸蛋白酶,特别是本文所述的那些多肽的全部或区段的表达载体或表达盒。可以向对象施用这样的载体或盒,以在靶细胞中或靶细胞附近表达蛋白酶以实现靶细胞中cd95的降解。
术语“有效量”是指在必要的剂量和时间段内有效达到期望的治疗或预防效果的量。
关于减少癌细胞生长的抗癌剂(例如本文所述的多肽组合物)的“有效量”是指能够在一定程度上减少一些癌细胞或肿瘤细胞的生长的量。该术语包括能够引起癌细胞或肿瘤细胞的生长抑制、细胞增殖抑制和/或细胞毒性作用和/或细胞凋亡的量。
关于癌症的治疗,“治疗有效量”是指能够引起以下一种或多于一种作用的量:(1)在一定程度上抑制癌症或肿瘤的生长,包括减慢生长或完全停止生长;(2)减少癌细胞或肿瘤细胞的数量;(3)减小肿瘤尺寸;(4)抑制(即减少、减慢或完全停止)癌细胞或肿瘤细胞向周围器官的浸润;(5)抑制(即减少、减慢或完全停止)转移;(6)增强抗肿瘤免疫应答,其可能但并非必需导致肿瘤的消退或排斥,或(7)在一定程度上缓解与癌症或肿瘤相关的一种或多于一种症状。治疗有效量可以根据诸如个体的病情、年龄、性别和体重以及一种或多于一种抗癌剂在个体中引起期望应答的能力等因素而变化。“治疗有效量”也是其中任何毒性或有害作用被治疗有益作用所抵消的量。
短语“治疗癌症”和“癌症的治疗”是指降低、减少或抑制癌细胞的复制;降低、减少或抑制癌症的扩散(转移的形成);减小肿瘤尺寸;减少肿瘤数量(即减少肿瘤负荷);减少或降低体内癌细胞的数量;防止在手术切除或其他抗癌疗法后癌症复发;或者改善或减轻由癌症引起的疾病症状。
术语“表达载体”或“表达构建体”是指适于转化宿主细胞并包含核酸序列的载体,该核酸序列指导和/或控制(与宿主细胞联合)与之可操作地连接的一种或多于一种异源编码区的表达。表达构建体可包括但不限于影响或控制转录、翻译的序列,并且如果存在内含子,则可影响与之可操作地连接的编码区的rna剪接。
当术语“抑制”或“减少”或“预防”用于权利要求和/或说明书时,其包括任何可测量的减少或完全抑制以实现所期望的结果。
当在权利要求和/或说明书中与术语“包含”一起使用时,要素前面不使用数量词可以表示“一个”,但是其也符合“一个或更多个”、“至少一个”和“一个或多于一个”的意思。
在整个本申请中讨论了各种实施方案。关于一个方面讨论的任何实施方案也适用于其他方面,反之亦然。本文描述的每个实施方案应理解为适用于所有方面的实施方案。可以预期的是,可以针对任何方法或组合物来实现本文所讨论的任何实施方案,反之亦然。此外,组合物和试剂盒可用于实现本文公开的方法。
在本申请中,术语“约”用于表明值包括用于确定值使用的装置或方法的误差的标准差。
在权利要求中使用术语“或”用于表示“和/或”,除非明确地说明仅指选择或选择是相互排斥的,但本公开支持仅指选择和“和/或”的定义。还预期使用术语“或”所列出的任何事物也可以特别地排除在外。
如本说明书和权利要求所使用的,单词“包含”、“具有”、“包括”或“含有”是包括性的或开放式的,并且不排除附加的、未列举的要素或方法步骤。本文描述的预期在术语“包含”的上下文中的实施方案也可以在术语“由……组成”或“基本上由……组成”的上下文中实现。
在整个本申请中讨论了其他实施方案。关于一个方面讨论的任何实施方案也适用于其他方面,反之亦然。实施例部分中的实施方案应理解为适用于所有方面的实施方案。
通过下面的详细描述,本发明的其他目的、特征和优点变得明显。然而,应该理解当详细的说明和具体的实施例表明具体实施方案时,仅通过说明的方式给出,因为通过该详细说明,在本发明的精神和范围内的各种变化和修改对本领域技术人员变得显而易见。
在治疗、诊断或生理目的或效果的上下文中的任何方法也可以以“用途”权利要求语言来描述,例如本文所讨论的任何化合物、组合物或试剂用于实现或实施所描述的治疗、诊断、或生理目的或效果的“用途”。
本文公开的任何实施方案可以与本文公开的任何其他实施方案一起实施或组合,包括化合物的实施方案的方面可以组合和/或替换,并且可以在本文所述的任何方法的背景下能够实施任何和所有化合物。类似地,任何方法实施方案的方面可以与本文公开的任何其他方法实施方案组合和/或替换。此外,本文公开的任何方法可以以“组合物的用途”的形式叙述以实现该方法。特别考虑到的是,关于本发明的一个实施方案讨论的任何限制可以适用于本发明的任何其他实施方案。此外,本发明的任何组合物可用于本发明的任何方法中,并且本发明的任何方法可用于生产或利用本发明的任何组合物。
附图说明
以下附图形成本说明书的一部分,并被包含以进一步证实本发明的特定方面。通过参照一个或多于一个这些附图,结合本文所提供的说明书实施方案的详细说明,可以更好地理解本发明。
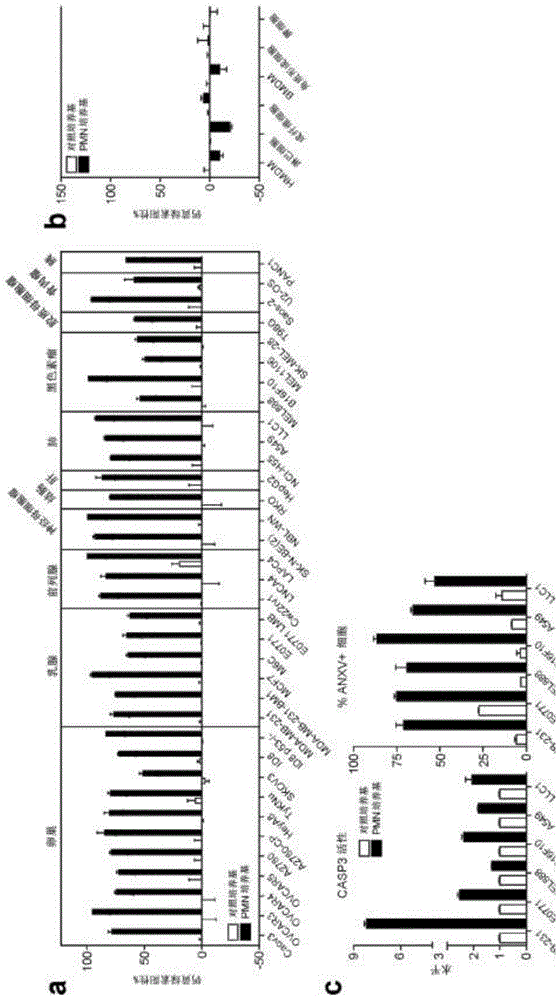
图1a至图1c:人嗜中性粒细胞衍生因子杀伤多种癌细胞,而不杀伤正常的健康细胞。从健康供体中分离出人外周血嗜中性粒细胞(pmn),并将其在无血清dmem中孵育以收集它的分泌因子(pmn培养基)。(a-b)将人或鼠癌细胞(a)或健康细胞(b)与pmn培养基或对照无血清dmem(对照培养基)一起孵育24小时。通过钙黄绿素am染色评估细胞活力。(c)用pmn培养基或对照培养基处理人或鼠癌细胞6小时。通过发光活性测定法检测胱天蛋白酶3/7活性,而通过流式细胞术评估细胞表面膜联蛋白v染色。结果表明,pmn培养基通过细胞凋亡诱导了癌细胞的死亡。*,p<0.05,学生t-检验。
图2:pmn培养基与紫杉醇协同作用杀伤癌细胞。用pmn培养基和紫杉醇(100nm)单独或组合处理mda-mb-231细胞6小时。通过钙黄绿素am染色评估细胞活力。*,p<0.05,学生t-检验。
图3a至图3c:蛋白组学鉴定出elane和ecp是介导pmn培养基的癌细胞杀伤能力的两种候选蛋白。(a)线性回归分析(线)显示,mda-mb-231癌细胞的杀伤与pmn培养基剂量密切相关。(b)使pmn培养基通过0.22μm过滤器,并在过滤前和过滤后溶液中测量蛋白浓度和对mda-mb-231癌细胞的杀伤活性。(c)蛋白组学分析在pmn培养基中鉴定出890种蛋白(≥2种肽),其中只有两种经过滤后在两种供体中明显降低(g-检验,p<0.001),即嗜中性粒细胞弹性蛋白酶(elane)和嗜酸性粒细胞阳离子蛋白(ecp)。通过质谱(光谱计数)定量pmn培养基过滤前后的elane和ecp水平。
图4a至图4c:elane和ecp协同作用杀伤癌细胞。(a)通过免疫沉淀耗尽pmn培养基中的elane或ecp;通过蛋白印迹证实耗尽。用各种剂量的耗尽的培养基处理mda-mb-231细胞4小时,并通过钙黄绿素am评估其杀伤。杀伤活性定义为(每体积添加的培养基(ul)在4小时内杀伤的癌细胞%)*100。结果表明,耗尽elane或ecp会减弱pmn培养基的杀伤活性。pmn培养基耗尽前=orig,耗尽后=ft。非特异性igg用作对照。(b)用纯化的天然elane或ecp以不同剂量处理mda-mb-231细胞或人单核细胞衍生的巨噬细胞(hmdm)24小时,并通过钙黄绿素am染色评估其杀伤作用。(c)用存在于pmn培养基中的相应水平的elane(0.25μg/ml)或ecp(0.05μg/ml)单独或组合处理mda-mb-231细胞和hmdm24小时,并通过钙黄绿素am染色检查杀伤作用。结果表明,elane和ecp协同杀伤癌细胞,并且这种混合物对非癌细胞无毒。*,p<0.05,学生t-检验。
图5a至图5b:elane是pmn培养基中的主要生物活性因子,并且其抗癌功能需要催化活性。(a)将纯化的天然elane或pmn培养基用pmsf(100um)或αms-抗胰蛋白酶(a1at;42nm)处理30min,并通过发色底物测定法确认elane催化活性的丧失。通过处理mda-mb-231细胞24小时进行杀伤测定,并通过钙黄绿素am染色进行评估。(b)通过发色底物活性测定法测定pmn培养基中的elane活性,并通过钙黄绿素am染色测定对暴露于各种剂量pmn培养基4小时的mda-mb-231细胞的pmn杀伤作用。杀伤活性定义为(每体积添加的培养基(ul)在4小时内杀伤的癌细胞%)*100。结果显示,pmn培养基中的elane催化活性与9个健康供体的pmn培养基的癌细胞杀伤活性线性相关(线性)。*,p<0.05,学生t-检验。
图6:elane杀伤多种癌细胞,但不杀伤正常的健康细胞。(a)用50nm纯化的天然elane或对照dmem培养基(对照培养基)处理癌细胞或健康细胞24小时,并通过钙黄绿素am染色评估细胞活力。(b)用50nm的elane或对照培养基处理癌细胞6小时,并通过胱天蛋白酶3/7发光活性测定或对细胞表面膜联蛋白v染色通过流式细胞术来评估细胞凋亡。*,p<0.05,学生t-检验。
图7a至图7d:ecp是elane催化活性的ii型别构激活剂。(a)将10nmelane与各种底物浓度下渐增浓度的ecp一起孵育。通过发色底物活性测定法测量催化活性。(b)km(app)和v最大(app)值是通过将曲线拟合到米氏方程(线性拟合)获得的。(c)km(app)相对于ecp浓度。(d)v最大(app)相对于ecp浓度。从人pmn培养基中免疫沉淀出elane,并用抗elane和抗ecp抗体探测样品。orig=pmn培养基,sup=流通,wash=珠洗涤,elute=与抗elane抗体结合。
图8a至图8c:elane处理导致cd95免疫反应性丧失。157-320(c-cd95)与elane(0.02μg)或载体(veh)在37℃下一起孵育2小时。通过sds-page然后考马斯亮蓝染色评估降解。结果显示,elane优先裂解cd95的c端结构域。(b)用elane(50nm)处理mel888癌细胞不同的时间,并使用c端特异性抗cd95抗体通过蛋白印迹分析评估cd95降解。*,降解产物。(c)用elane(50nm)处理癌细胞1小时,固定在10%福尔马林中,并用n端或c端特异性抗cd95抗体染色染色(绿色)。hoechst33342溶液用于核染色(蓝色)。图像是在40x下拍摄的。结果表明,经elane处理的癌细胞失去对c端特异性cd95抗体的免疫反应性,但未失去对n端特异性cd95抗体的免疫反应性。
图9a至图9b:elane被癌细胞摄取是其发挥抗癌功能必须的。(a)在存在或不存在广泛的内吞抑制剂dynasore(80um)下,用elane(100nm)处理癌细胞30分钟。通过发色底物测定法评估细胞裂解物中的elane催化活性。(b)在存在或不存在dynasore(80um)下,用elane(30nm)处理癌细胞6小时。通过钙黄绿素am染色检验细胞活力。*,p<0.05,学生t-检验。
图10a至图10d:elane诱导癌细胞中强效的杀伤程序。(a)用elane(50nm)处理癌细胞4小时,并通过蛋白印迹定量磷酸化的erk、nfkb和jnk以及总的erk、nfkb和jnk。以e0771癌细胞的免疫印迹为例。(b)用各种剂量的elane处理癌细胞1小时,并使用cm-h2dcfda染料通过流式细胞术测量线粒体ros。(c)用elane(50nm)处理癌细胞,并通过免疫印迹评估磷酸化h2ax(γh2ax)和总h2ax的dna损伤。以a549癌细胞的免疫印迹为例。(d)用elane(50nm)处理细胞8小时,并通过免疫印迹定量全长和裂解的casp3(c-casp3)和裂解的parp(c-parp)。以llc1癌细胞的免疫印迹为例。*,p<0.05,学生t-检验。
图11a至图11c:elane在健康的非癌细胞中不诱导强效的杀伤程序。(a)用elane(50nm)处理健康的非癌细胞4小时,并通过免疫印迹定量磷酸化的erk、nfkb和jnk以及总的erk、nfkb和jnk。以bmdm的免疫印迹为例。(b)用各种剂量的elane处理细胞1小时,并使用cm-h2dcfda染料通过流式细胞术测量线粒体ros。(c)用elane(50nm)处理细胞8小时,并通过免疫印迹定量全长和裂解的casp3(c-casp3)和裂解的parp(c-parp)。以bmdm的免疫印迹为例。
图12a至图12b:裂解cd95的能力预示了蛋白酶对癌细胞的杀伤能力。(a)将全长的重组cd95蛋白与各种丝氨酸蛋白酶(人elane(80nm)、pr3(80nm)、cstg(80nm)、ppe(80nm)、小鼠elane(80nm)、rpe(500nm)、gzmb(80nm)或胰蛋白酶(250nm))或其他类型的蛋白酶(ctsc(80nm);或mmp7(80nm)、mmp9(80nm)、ctsd(80nm),未显示)在37℃下一起孵育2小时。通过sds-page然后考马斯亮蓝染色评估降解。(b)将mda-mb-231癌细胞与各种蛋白酶一起孵育24小时。通过钙黄绿素am染色评估细胞活力。ppe:猪胰弹性蛋白酶。rpe:大鼠胰腺弹性蛋白酶。
图13a至图13c:猪胰弹性蛋白酶(ppe)和elane对癌细胞的毒性相同,但ppe更能抵抗丝氨酸蛋白酶抑制剂的抑制。(a)用各种剂量的纯化的天然elane或纯化的天然猪胰弹性蛋白酶(ppe)处理mda-mb-231癌细胞6小时,并通过钙黄绿素am染色评估其杀伤情况。(b)将纯化的天然elane或纯化的天然ppe与不同浓度的α不同浓抗胰蛋白酶(a1at)一起孵育15分钟。使用发色底物测定法测量催化活性。通过在存在或不存在a1at下用elane或ppe处理mda-mb-231癌细胞6小时,然后进行钙黄绿素am染色来确定癌细胞杀伤能力。(c)使用发色底物测定法测量催化活性。通过在存在或不存在fbs下用elane或ppe处理mda-mb-231癌细胞6小时,然后进行钙黄绿素am染色来确定癌细胞杀伤能力。
图14a至图14b:具有催化活性的elane减弱肿瘤的生长。(a)通过发色底物确定elane或经1mm的pmsf处理而失活的elane(pmsf-elane)的催化活性。(b)将e0771、b16f10或llc1癌细胞注射入c57bl/6小鼠。肿瘤达到约100mm3后,每天一次肿瘤内递送人血清白蛋白(hsa,11.6ug)、elane(11.6ug)或pmsf-elane(11.6ug),持续5天。用卡尺评估肿瘤体积。结果表明,活性elane减慢了肿瘤的生长,而pmsf-elane对肿瘤的生长没有影响。
图15a至图15b:肿瘤内递送的elane在许多癌症模型中减弱了肿瘤的生长。将mda-mb-231、a549或mel888细胞(异种移植模型)注射到无胸腺裸小鼠中;在scid小鼠中繁殖m1或4195肿瘤(tnbcpdx模型);将e0771、llc1或b16f10细胞(同系模型)注射到c57bl/6小鼠中。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6ug)或pmsf-elane(11.6ug),持续5天。n=8只至15只小鼠/组。用卡尺评估肿瘤体积(a)。绘制kaplan-meier曲线,将对数秩检验(mentel-cox方法)用于小鼠的生存分析(b)。第0天是指第一个治疗日。生存终点定义为肿瘤体积>1000mm3。
图16a至图16b:肿瘤内递送的elane诱导癌细胞凋亡。(a)将mda-mb-231、a549或mel888(异种移植模型)细胞注射到无胸腺裸小鼠中;在scid小鼠中繁殖m1或4195肿瘤(tnbcpdx模型);将e0771、llc1或b16f10细胞(同系模型)注射到c57bl/6小鼠中。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6ug)或pmsf-elane(11.6ug),持续5天。在第6天,分离肿瘤,用福尔马林固定,并通过免疫组织化学或免疫荧光染色检查tunel、裂解的parp(cparp)和裂解的casp3(ccasp3)。图像是在40x下拍摄的。(b)用n端(n-cd95)和c端(c-cd95)特异性抗cd95抗体对肿瘤切片进行染色,然后进行二抗染色(c-cd95和n-cd95分别用alexfluor488和alexfluor594)。对3个至4个区域/小鼠进行荧光强度定量。结果表明,elane治疗降低了体内c-cd95的水平。*,p<0.05,学生t-检验。
图17:肿瘤内递送的elane增加肿瘤的免疫细胞。将e0771、b16f10或llc1癌细胞注射入c57bl/6小鼠。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6μg)或pmsf-elane(11.6μg),持续5天。在第6天分离肿瘤,并消化以通过流式细胞术进行免疫细胞分析。cd45+细胞是总免疫细胞;巨噬细胞(mac)定义为cd45+cd11b+cd11c低mhcii低,嗜中性粒细胞(neu)定义为cd45+cd11b+ly6g+,树突状细胞(dc)定义为cd45+cd11b+cd11c高mhcii高,b细胞(b)定义为cd45+b220+,nk细胞(nk)定义为cd45+nk1.1+cd16+,cd4+t细胞(cd4t)定义为cd3+cd4+cd8-,cd8+t细胞(cd8t)定义为cd3+cd8+cd4-,cd8效应t细胞(cd8teff:包括效应记忆细胞)定义为cd3+cd8+cd4-cd62l低和高cd44+。*,p<0.05,学生t-检验。
图18:适应性免疫细胞有助于elane的治疗功效。向c57bl/6背景(无适应性免疫)的rag2缺陷(rag2-/-)小鼠和野生型(wt)c57bl/6小鼠注射e0771癌细胞。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6μg)或hsa(11.6μg),持续5天。(a)用卡尺评估肿瘤体积。(b)绘制kaplan-meier曲线,将对数秩检验(mentel-cox方法)用于生存分析。生存终点定义为肿瘤体积>1000mm3。
图19a至图19b:肿瘤内递送的elane诱导了远位效应。(a)将e0771癌细胞注射入c57bl/6小鼠的左侧(50万个细胞)和右侧(40万个细胞)乳腺脂肪垫中。左侧肿瘤达到约100mm3后,每天一次肿瘤内注射elane(11.6μg)或经pmsf灭活的elane(pmsf-elane)至左侧肿瘤,持续5天。n=10只小鼠/组。在肿瘤的右侧(远处侧)未执行任何操作。用卡尺测量两侧的肿瘤体积。(b)为了消除由于elane从左向右溢出而引起的远位影响的可能性,仅将e0771癌细胞注射到c57bl/6小鼠的左乳脂肪垫中,每天用elane(11.6μg)或pmsf-elane注入右乳脂肪垫来治疗小鼠。用卡尺测量肿瘤体积。结果显示,当将elane注射到对侧(无肿瘤)乳腺脂肪垫中时,不会降低肿瘤的生长。
图20:肿瘤内递送的elane在tnbc小鼠模型中具有抗pdl1的功效。将e0771癌细胞注射入c57bl/6小鼠。肿瘤达到约100mm3后,将小鼠随机分为四组:elane(11.6μg)、经pmsf灭活的elane(pmsf-elane)、抗pd-l1(bioxcell,10f.9g2,100μg)和elane(11.6μg)+抗pd-l1(100μg)。n=8只至9只小鼠/组。在肿瘤接种后第10天、14天、18天和22天腹膜内注射抗pd-l1单克隆抗体。当肿瘤达到约80mm3(癌细胞注射后约14天)时,肿瘤内递送elane或pmsf-elane。用卡尺测量肿瘤体积。绘制kaplan-meier曲线,将对数秩检验(mentel-cox方法)用于小鼠的生存分析。生存终点定义为肿瘤体积>1000mm3。*,p<0.05,学生t-检验。
图21a至图21d:elane不产生明显的毒性。每天一次将人血清白蛋白(hsa;11.6μg)或elane(11.6μg)注入健康的非荷瘤c57bl/6小鼠的乳腺脂肪垫中连续5天,并监测副作用。(a)在最后一次注射后2天,对细胞凋亡标志物(tunel、裂解的casp3(c-casp3)、裂解的parp(c-parp))进行免疫组织化学染色。(b)δ体重。(c)脾重量。(c)血液alt活性水平(肝功能的标志物)。
具体描述
嗜中性粒细胞是最丰富的免疫细胞群,占所有白细胞的50%至70%。癌症患者的每天产生约1011个嗜中性粒细胞,并且产量增加。荷瘤宿主中的嗜中性粒细胞可对抗或增强肿瘤的进展。已知肿瘤会释放促进嗜中性粒细胞从骨髓释放的分子,这可导致嗜中性粒细胞过早释放。这些嗜中性粒细胞可在炎症部位分化,或者肿瘤引发未成熟的嗜中性粒细胞发挥其通常无法发挥的功能。通常,嗜中性粒细胞在人体内的半衰期为7小时,但在肿瘤中,与肿瘤相关的细胞因子使其半衰期延长至17小时。嗜中性粒细胞的极化产生不同的表型,具体取决于特定的肿瘤衍生因子。一些因子激活了肿瘤和转移促进程序,而另一些因子则对嗜中性粒细胞的促肿瘤发生表型起负调节作用。细胞因子浓度和肿瘤生理学(例如缺氧)可能在嗜中性粒细胞极化中起作用,因为随着肿瘤的扩大和发展,细胞毒性嗜中性粒细胞转化为促肿瘤细胞。
嗜中性粒细胞衍生的弹性蛋白酶和嗜中性粒细胞的免疫抑制能力与肿瘤的发生密切相关。嗜中性粒细胞是促进癌症还是抗肿瘤发生尚不确定。文献倾向于指向嗜中性粒细胞的促肿瘤作用。几种促有丝分裂和促血管生成分子与嗜中性粒细胞驱动的肿瘤生长有关,包括弹性蛋白酶、前动力蛋白2(prok2,也称为bv8)和mmp9。
嗜中性粒细胞是血管生成的有效效应物,也可以将癌细胞吸引到内皮细胞中,从而促进内渗至血液循环中。肿瘤在原发部位扩大的一个有趣结果是嗜中性粒细胞在弥漫性癌细胞到达内脏器官之前在内脏器官中积累。
在其他方面,发明人已将cd95降解鉴定为elane杀伤癌细胞的作用机理,并且还表明,广泛的蛋白酶可模仿elane的cd95降解和癌细胞杀伤特性。本发明的各方面部分地基于以下观察。用两种不可逆的非竞争性elane抑制剂α制1-抗胰蛋白酶或pmsf处理elane或嗜中性粒细胞适应的培养基,使癌细胞免于凋亡。elane与ecp一起孵育增加其酶活性。发明人已经表明,ecp充当elane的2型别构激活剂,使对其底物的催化常数(kcat)增加12倍而不改变km。这些研究还确定了ecp以非常强的亲和力(kd约20nm)结合elane。elane降解纯化的cd95的c端结构域。重要的是,这种裂解模式不同于mmp7产生的裂解模式,mmp7先前已显示出裂解cd95的细胞外n端结构域,从而导致癌细胞免受fasl介导的细胞凋亡(strand等人,oncogene,2004)。用elane孵育癌细胞导致cd95从细胞表面丢失。流式细胞仪实验表明,cd95低的癌细胞对包括高膜联蛋白v和碘化丙啶的两种细胞死亡标志物的染色呈阳性。来自其他物种的其他丝氨酸蛋白酶,包括ctsg、prtn3和elane(鼠嗜中性粒细胞弹性蛋白酶或猪胰弹性蛋白酶)以与elane相同的降解模式裂解纯化的cd95,这些蛋白酶也杀伤癌细胞。
这些蛋白酶裂解cd95的效率与其杀伤癌细胞的能力密切相关。因此,靶向cd95的降解比上述fasl和sirna/shrna方法有三个重要优势。首先,与报道的对fasl的耐受不同,发明人已经表明癌细胞在体外和体内不能对这种降解途径产生耐受。其次,发明人已经表明,在多种小鼠癌症模型中瘤内递送纯化的elane(或elane和ecp)诱导了利用cd95降解途径的广泛细胞凋亡。这些发现表明治疗性蛋白不存在针对sirna/shrna方法所报道的递送和不稳定性问题。第三,发明人已经表明治疗性蛋白对包括t细胞在内的非癌细胞无毒。用这些elane(或elane和ecp)处理人血液t细胞不会在体外诱导细胞凋亡。此外,将这些蛋白注射到有或没有癌症的小鼠中并不会耗尽t细胞。因此,与sirna/shrna方法不同,本文所述的治疗性蛋白不会耗尽t细胞或抑制抗肿瘤免疫。实际上,用elane处理荷瘤小鼠时,肿瘤和脾t细胞数量增加。这些增加是特定于荷瘤小鼠的,因为将elane注射到非荷瘤小鼠中不会产生类似的效果。这些发现表明,由elane诱导的癌细胞凋亡引发了强的抗肿瘤适应性免疫应答。第四,与fasl方法不同,治疗性组合物在体内不会引起肝毒性。
i.组合物
a.嗜中性粒细胞分泌因子
发明人发现了能够杀伤广泛的癌细胞而不会明显影响非癌细胞活力的嗜中性粒细胞分泌因子。发明人已经鉴定出两种嗜中性粒细胞杀伤因子:(1)嗜酸性粒细胞阳离子蛋白(ecp)和(2)嗜中性粒细胞弹性蛋白酶(elane)。发明人还证明了这些组分彼此互补或具有协同作用。在特定的实施方案中,elane和/或ecp单独有效或彼此组合有效。一些实施方案涉及包含本文所述的一种或两种多肽(包括变体)的组合物。
通过以下方式鉴定出这些因子:(a)从健康的供体获得血液,(b)开发用于分离外周血嗜中性粒细胞并获得嗜中性粒细胞分泌因子的方法,(c)开发以96孔板形式量化癌细胞死亡的方法,(d)开发使用过滤器和色谱柱分离嗜中性粒细胞适应的培养基的方法,(e)开发用于嗜中性粒细胞适应的培养基和来自色谱柱的级分的蛋白组学分析的方法,(f)开发耗尽嗜中性粒细胞适应的培养基中的目标特定蛋白并检验癌细胞杀伤作用的方法,(g)使用纯化的重组蛋白确认观察结果,(h)优化蛋白组合以产生抗癌作用。
1.嗜酸性粒细胞阳离子蛋白(ecp)
嗜酸性粒细胞阳离子蛋白(ecp)也称为核糖核酸酶3,是位于嗜酸性粒细胞原初母体中的碱性蛋白(蛋白登录号np_002926,seqidno:1)。ecp蛋白在嗜酸性粒细胞脱粒过程中释放。ecp有三种糖基化形式,因此ecp的分子量范围为18kda至22kda。ecp可用于增加丝氨酸蛋白酶的活性,并可与多种丝氨酸蛋白酶联合使用。
ecp具有多种生物学活性,包括抑制t细胞增殖反应和b细胞合成免疫球蛋白、抑制肥大细胞脱粒、调节成纤维细胞活性、诱导气道黏液分泌以及与凝血和补体系统相互作用。ecp还显示出对细菌、寄生虫、病毒、呼吸道上皮和癌细胞的细胞毒性活性。ecp的作用机理是通过其在细胞膜上形成孔,因而导致磷脂双层的失稳和渗透性细胞溶解的细胞毒性能力介导的。
2.嗜中性粒细胞弹性蛋白酶(elane)
嗜中性粒细胞弹性蛋白酶是与胰凝乳蛋白酶同家族的丝氨酸蛋白酶,并具有广泛的底物特异性(蛋白登录号np_001963,seqidno:2)。该蛋白在炎症过程中由嗜中性粒细胞和巨噬细胞分泌,可破坏细菌和宿主组织。它还通过对dna的高度亲和力而定位于嗜中性粒细胞胞外阱(net),这是丝氨酸蛋白酶的非同寻常的特性。与其他丝氨酸蛋白酶一样,它包含由组氨酸、天冬氨酸和丝氨酸残基的催化三联体组成的电荷中继系统,这些残基分散在多肽的整个一级序列中,并在折叠的蛋白三维构象中结合在一起。嗜中性粒细胞弹性蛋白酶与其他细胞毒性免疫丝氨酸蛋白酶如颗粒酶和组织蛋白酶g密切相关。嗜中性粒细胞弹性蛋白酶的长度为218个氨基酸,带有两条与天冬酰胺连接的糖链。它存在于嗜中性粒细胞胞质中的嗜天青颗粒中。
elane在生理条件下具有广泛的底物特异性,过量的elane不仅会导致弹性蛋白的消化,还会导致其他细胞外基质蛋白的消化。肿瘤组织中免疫反应性ne的量是乳腺癌和肺癌患者的独立预后指标。特定的elane抑制剂(例如西维来司他和elafin)已显示出抑制移植到严重联合免疫缺陷小鼠中的癌细胞的生长,这暗示从活化的嗜中性粒细胞释放的elane刺激了癌细胞的生长和发展,从而表明elane的催化活性是促肿瘤发生功能所必需的。相较而言,发明人发现,elane具有强大的癌细胞杀伤能力。
b.蛋白酶组合物
发明人发现了能够杀伤广泛的癌细胞而不会明显影响非癌细胞活力的各种蛋白酶。这些蛋白酶包括:(1)组织蛋白酶g(ctsg)、(2)蛋白酶3(prtn3)、(3)鼠嗜中性粒细胞弹性蛋白酶(melane)、(4)鼠胰弹性蛋白酶(mela1)、(5)猪胰弹性蛋白酶(pela1)、(6)大鼠胰弹性蛋白酶(rela1/rpe)和(7)人嗜中性粒细胞弹性蛋白酶(elane)。
1.组织蛋白酶g(ctsg)
组织蛋白酶g(ctsg)是肽酶s1蛋白家族的成员,存在于嗜中性多形核白细胞的嗜天青颗粒中。该蛋白酶具有与胰凝乳蛋白酶c相似的特异性,并且可参与被吞噬的病原体的杀伤和消化,并参与炎症部位的结缔组织重塑。genpept登录号np_001902.1描述了智人的组织蛋白酶g前蛋白(seqidno:3)。在一些方面,ctsg多肽或其变体的氨基酸序列与seqidno:3在50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或255个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。所述区段是维持降解cd95和/或诱导癌细胞死亡的能力的功能性区段。在特定方面,ctsg多肽可包含seqidno:3的氨基酸21至241(胰蛋白酶样蛋白酶结构域)。在其他方面,可以通过对氨基酸侧链进行化学修饰(例如,交联、糖基化等),或通过在肽的氨基或羧基末端包括异源肽序列来修饰ctsg多肽。
2.蛋白酶3(prtn3)
蛋白酶3(prtn3)是一种主要在嗜中性粒细胞中表达的丝氨酸蛋白酶。尚不清楚其在嗜中性粒细胞功能中的确切作用,但在人嗜中性粒细胞中,蛋白酶3有助于抗菌肽的蛋白水解生成。它还是c-anca(细胞质亚型)类抗嗜中性粒细胞细胞质抗体(anca)的靶标,该抗体是一种在具有多血管炎的肉芽肿病(以前称为“韦格纳肉芽肿病”)中常见的抗体类型。genpept登录号np_002768.3描述了智人的prtn3(seqidno:4)。在一些方面,prnt3多肽或其变体的氨基酸序列与seqidno:4在50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或256个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。所述区段是维持降解cd95和/或诱导癌细胞死亡的能力的功能性区段。在特定方面,prtn3多肽可包含seqidno:4的氨基酸28至246(胰蛋白酶样蛋白酶结构域)。在其他方面,可以通过对氨基酸侧链进行化学修饰(例如,交联、糖基化等),或通过在肽的氨基或羧基末端包括异源肽序列来修饰prtn3多肽。
3.嗜中性粒细胞弹性蛋白酶(elane)
嗜中性粒细胞弹性蛋白酶(elane)是与胰凝乳蛋白酶同家族的丝氨酸蛋白酶,并具有广泛的底物特异性(蛋白登录号np_001963,seqidno:2)。该蛋白在炎症过程中由嗜中性粒细胞和巨噬细胞分泌,可破坏细菌和宿主组织。它还通过对dna的高度亲和力而定位于嗜中性粒细胞胞外阱(net),这是丝氨酸蛋白酶的非同寻常的特性。与其他丝氨酸蛋白酶一样,它包含由组氨酸、天冬氨酸和丝氨酸残基的催化三联体组成的电荷中继系统,这些残基分散在多肽的整个一级序列中,并在折叠的蛋白三维构象中结合在一起。嗜中性粒细胞弹性蛋白酶与其他细胞毒性免疫丝氨酸蛋白酶如颗粒酶和组织蛋白酶g密切相关。嗜中性粒细胞弹性蛋白酶的长度为218个氨基酸,带有两条与天冬酰胺连接的糖链。它存在于嗜中性粒细胞胞质中的嗜天青颗粒中。
elane在生理条件下具有广泛的底物特异性,过量的elane不仅会导致弹性蛋白的消化,还会导致其他细胞外基质蛋白的消化。肿瘤组织中免疫反应性elane的量是乳腺癌和肺癌患者的独立预后指标。特定的elane抑制剂(例如西维来司他和elafin)已经显示出抑制移植到严重联合免疫缺陷小鼠中的癌细胞的生长,这表明嗜中性粒细胞衍生的elane可以促进肿瘤发生。但是,我们发现,虽然鼠嗜中性粒细胞(从骨髓、腹膜腔或肺中分离)释放出elane,但该elane无催化活性。而且,从这些鼠嗜中性粒细胞收集的适应的培养基不能在体外杀伤癌细胞。因此,在小鼠中观察到的西维来司他和elafin的抗癌功能不太可能由它们抑制嗜中性粒细胞衍生的elane催化活性的能力所介导。
在一些方面,人嗜中性粒细胞弹性蛋白酶(elane)或其变体的氨基酸序列与seqidno:2在50个、75个、100个、125个、150个、175个、200个、225个、250个、或260个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及elane多肽或其变体,所述变体具有elane的50个、75个、100个、125个、150个、175个、200个、225个、250个或260个连续氨基酸,所述elane多肽与seqidno:2是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。优选地,所述区段是维持对癌细胞的细胞毒性的功能性区段。在其他方面,可以通过对氨基酸侧链进行化学修饰(例如,交联、糖基化等),或通过在肽的氨基或羧基末端包括异源肽序列来修饰elane多肽。在一些方面,elane多肽被糖基化。
在一些方面,可以使用鼠嗜中性粒细胞弹性蛋白酶(melane)或其变体,其氨基酸序列与seqidno:5(genpept登录号np_056594.2)在50个、75个、100个、125个、150个、175个、200个、225个、250个、或260个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及melane多肽或其变体,所述变体具有melane的50个、75个、100个、125个、150个、175个、200个、225个、250个或265个连续氨基酸,所述melane多肽与seqidno:5是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。所述区段是维持降解cd95和诱导癌细胞死亡的能力的功能性区段。在特定方面,melane多肽可包含seqidno:5的氨基酸29至245(胰蛋白酶样蛋白酶结构域)。
在一些方面,可以使用猪胰弹性蛋白酶(pela1)或其变体,其氨基酸序列与seqidno:6(genpept登录号xp_005655631orspp0072)在50个、75个、100个、125个、150个、175个、200个、225个、250个、260个、270个、280个、290个至297个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及pela1多肽或其变体,所述变体具有pela1的50个、75个、100个、125个、150个、175个、200个、225个、250个或265个连续氨基酸,所述pela1多肽与seqidno:6是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。所述区段是维持降解cd95和诱导癌细胞死亡的能力的功能性区段。在特定方面,pela1多肽可包含seqidno:6的氨基酸67至302(胰蛋白酶样蛋白酶结构域)。
在一些方面,可以使用鼠胰弹性蛋白酶(mela1)或其变体,其氨基酸序列与mlrflvfaslvlcghstedvpetdarvvggaearrnswpsqislqyqyggswhhtcggtlirsnwvmtaahcvdspmtyrvvvgehnlsqndgteqyvnvqkivshpywnknnvvagydiallrlaksvtlnnyvqlgvlpregtilannspcyitgwgrtrtngelaqtlqqaylpsvsysicssssywgssvkntmvcaggdgvrsgcqgdsggplhcmvngqyavhgvtsfvssmgcnvarkptvftrvsayiswmnnviasnseqidno:7(genpept登录号np_291090.2)在50个、75个、100个、125个、150个、175个、200个、225个、250个、260个、270个、270个、280个、290个至297个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及mela1多肽或其变体,所述变体具有mela1的50个、75个、100个、125个、150个、175个、200个、225个、250个或265个连续氨基酸,所述mela1多肽与seqidno:7是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或260个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、或261,并终止于氨基酸6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、或266。所述区段是维持降解cd95和诱导癌细胞死亡的能力的功能性区段。在特定方面,mela1多肽可包含seqidno:7的氨基酸26至258(胰蛋白酶样蛋白酶结构域)。
在一些方面,可以使用大鼠胰腺弹性蛋白酶(rela1/rpe)或其变体,其氨基酸序列与mlrflvfaslvlyghstqdfpetnarvvggaearrnswpsqislqylsggswyhtcggtlirrnwvmtaahcvssqmtfrvvvgdhnlsqndgteqyvsvqkivvhpnwnsnnvaagydiallrlaqsvtlnnyvqlavlpqegtilannnpcyitgwgrtrtngqlsqtlqqaylpsvdysicssssywgstvkttmvcaggdgvrsgcqgdsggplhclvngqysvhgvtsfvssmgcnvsrkptvftrvsayiswmnnviaynseqidno:8(genpept登录号np_036684.1)在50个、75个、100个、125个、150个、175个、200个、225个、250个、260个至266个连续氨基酸(包括其间的所有值和范围)内是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。其他方面涉及rela1多肽或其变体,所述变体具有rela1的50个、75个、100个、125个、150个、175个、200个、225个、250个或265个连续氨基酸,所述rela1多肽与seqidno:8是90%、92%、94%、96%、98%、99%至100%(包括其间的所有值和范围)相同的。多肽的片段或区段可以包含5个、10个、20个、30个、40个、50个、60个、70个、80个、90个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、或260个连续氨基酸(包括其间的所有值和范围),其起始于氨基酸1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263或264,并终止于氨基酸6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、101、102、103、104、105、106、107、108、109、110、111、112、113、114、115、116、117、118、119、120、121、122、123、124、125、126、127、128、129、130、131、132、133、134、135、136、137、138、139、140、141、142、143、144、145、146、147、148、149、150、151、152、153、154、155、156、157、158、159、160、161、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、194、195、196、197、198、199、200、201、202、203、204、205、206、207、208、209、210、211、212、213、214、215、216、217、218、219、220、221、222、223、224、225、226、227、228、229、230、231、232、233、234、235、236、237、238、239、240、241、242、243、244、245、246、247、248、249、250、251、252、253、254、255、256、257、258、259、260、261、262、263、264、265、266、267、268或269。所述区段是维持降解cd95和诱导癌细胞死亡的能力的功能性区段。在特定方面,rela1多肽可包含seqidno:的氨基酸26至258(胰蛋白酶样蛋白酶结构域)。
c.多肽组合物和制剂
“多肽”是指包含通过肽键或修饰的肽键连接的氨基酸的任何肽或蛋白。“多肽”是指短链,包括肽、寡肽或寡聚物,和较长链,包括蛋白。多肽可以包含除20种基因编码氨基酸以外的其他氨基酸。“多肽”包括通过自然过程如翻译后加工或通过化学修饰或本领域熟知的其他合成技术修饰的氨基酸序列。修饰可发生在多肽中的任何地方,包括肽主链、氨基酸侧链和氨基末端或羧基末端。应当理解,相同类型的修饰可以相同或不同程度存在于给定多肽的几个位点上。同样,给定的多肽可以包含许多类型的修饰。修饰包括末端融合(n端和/或c端)、乙酰化、酰化、adp-核糖基化、酰胺化、黄素的共价连接、血红素部分的共价连接、核苷酸或核苷酸衍生物的共价连接、脂质或脂质衍生物的共价连接、磷脂酰肌醇的共价连接、交联、环化、二硫键形成、去甲基化、共价交联的形成、胱氨酸的形成、焦谷氨酸的形成、甲酰化、γ-羧化、糖基化、gpi锚定蛋白形成、羟基化、碘化、甲基化、肉豆蔻酰基化、氧化、蛋白水解加工、磷酸化、异戊二烯化、外消旋化、硒化、硫酸化、转移rna介导的向蛋白添加氨基酸,例如精氨酰化和泛素化。
可以将多种可检测的标记附着到多肽及其变体上。对于用于细胞外检测和细胞内检测的流式细胞仪应用,常用的荧光团可以是异硫氰酸荧光素(fitc)、别藻蓝蛋白(apc)、r-藻红蛋白(pe)、芹菜素叶绿素蛋白(percp)、德克萨斯红、cy3、cy5荧光共振能量串联荧光团,例如percpcy5.5、pe-cy5、pe-cy5.5、pe-cy7、pe-德克萨斯红和apc-cy7。其他荧光团尤其包括
术语“分离的”可以指基本上不含其原始来源的细胞材料、细菌材料、病毒材料或培养基(当通过重组dna技术产生时)、或化学前体或其他化学物质(当化学合成时)的核酸或多肽。此外,分离的多肽是指可以作为分离的多肽施用给对象的多肽;换句话说,如果多肽黏附在色谱柱上或包埋在凝胶中,则不能简单地将其视为“分离的”。此外,“分离的核酸片段”或“分离的肽”是并非天然作为片段存在和/或通常不处于功能状态的核酸或蛋白片段。
术语“氨基酸”或“残基”应被理解为是指一种化合物,其具有基本分子式nh2chrcooh,包含氨基(nh2)、羧基(cooh)和任一不同侧链基团,并且通过肽键连接在一起形成蛋白。氨基酸可以是例如酸性、碱性、芳族、极性或衍生化的。非标准氨基酸可以称为“非规范”氨基酸。天然存在α性和l-形式的氨基酸,但是,也可以制备β式和d-形式的氨基酸。
通常使用单字母缩写系统来确定通常掺入天然存在的肽和蛋白中的二十种“规范”氨基酸残基,这些名称在本领域中是众所周知的。这样的单字母缩写在含义上可以与三字母缩写或非缩写的氨基酸名称完全互换。规范氨基酸及其三字母和单字母代码包括丙氨酸(ala)a、谷氨酰胺(gln)q、亮氨酸(leu)l、丝氨酸(ser)s、精氨酸(arg)r、谷氨酸(glu)e、赖氨酸(lys)k、苏氨酸(thr)t、天冬酰胺(asn)n、甘氨酸(gly)g、蛋氨酸(met)m、色氨酸(trp)w、天冬氨酸(asp)d、组氨酸(his)h、苯丙氨酸(phe)f、酪氨酸(tyr)y、半胱氨酸(cys)c、异亮氨酸(ile)i、脯氨酸(pro)p和缬氨酸(val)v。
一些实施方案还包括本文所述多肽的变体。所公开的多肽的变体可以通过在多肽序列内进行氨基酸添加或插入、氨基酸缺失、氨基酸置换和/或氨基酸残基的化学衍生来产生。本领域技术人员可以根据本文提供的用于增加稳定性、同时保持或增强多肽效力的指导,确定所需的氨基酸置换(无论是保守的还是非保守的)。在一些实施方案中,保守氨基酸置换可涵盖非天然存在的氨基酸残基,其通常通过化学肽合成而不是通过生物系统合成掺入。
保守修饰可产生的肽具有与进行此类修饰的肽相似的功能、物理和化学特性。相较而言,可以通过在氨基酸序列中选择在维持以下性质有明显不同作用的置换来实现肽的功能和/或化学特性的实质性修饰:(a)置换区域中分子骨架的结构,例如,作为α换螺旋构象,(b)分子在靶位点的电荷或疏水性,或(c)分子的大小。例如,“保守氨基酸置换”可以涉及用非天然残基置换天然氨基酸残基,从而对该位置上氨基酸残基的极性或电荷几乎没有影响。
重组dna和/或rna介导的蛋白表达和蛋白工程技术或制备肽的任何其他方法,可用于制备本文公开的多肽或在靶细胞或组织中表达本文公开的多肽。术语“重组”应理解为是指材料(例如,核酸或多肽)已通过人为干预人工或合成(即,非天然)改变。可以在材料的自然环境或自然状态内进行改变或从其自然环境或自然状态移除。例如,“重组核酸”是通过例如在克隆、dna改组或其他众所周知的分子生物学过程中对核酸进行重组而制成的。这种分子生物学方法的实例可见于maniatis等人,molecularcloning.alaboratorymanual,coldspringharborlaboratory,coldspringharbor,n.y.,1982。“重组dna分子”含有通过这种分子生物学技术连接在一起的dna片段。如本文所用,术语“重组蛋白”或“重组多肽”是指使用重组dna分子表达的蛋白分子。“重组宿主细胞”是含有和/或表达重组核酸的细胞。
可以根据本领域技术人员已知的方法在转化的宿主细胞中制备多肽。简而言之,制备编码该肽的重组dna分子或构建体。制备此类dna分子的方法是本领域众所周知的。例如,可以使用合适的限制性内切酶从dna中切除编码肽的序列。大量可用的和众所周知的宿主细胞中的任何一种都可以用于各种实施方案的实践中。特定宿主的选择取决于许多因素,包括例如与所选表达载体的相容性、由dna分子编码的多肽的毒性、转化率、多肽回收的难易程度、表达特性、生物安全性和成本等。意识到并非所有宿主对特定dna序列的表达可同样有效,应在这些因素之间取得平衡。在这些通用指南中,培养中可用的微生物宿主细胞包括细菌(例如大肠杆菌)、酵母(例如糖酵母)和其他真菌细胞、昆虫细胞、植物细胞、哺乳动物(包括人)细胞,例如cho细胞和hek293细胞。也可以在dna水平上进行修饰。可以将编码肽的dna序列改变为与所选宿主细胞更相容的密码子。对于大肠杆菌,优化的密码子是本领域已知的。可以替换密码子以消除限制位点或包括沉默的限制性内切位点,这可以帮助在选定的宿主细胞中加工dna。接下来,培养并纯化转化的宿主。可以在常规发酵条件下培养宿主细胞,从而表达所需的多肽。另外,所述dna任选地在融合蛋白的5'至编码区还编码可操作地连接至表达的多肽的信号肽序列(例如,分泌信号肽)。
也可以通过合成方法制备多肽。固相合成可以用作制备单个多肽的技术,因为它是制备小肽类的成本效益最好的方法。例如,众所周知的固相合成技术包括使用保护基、接头和固相支持物,以及特定的保护和脱保护反应条件,接头裂解条件,清除剂的使用以及固相肽合成的其他方面。合适的技术是本领域众所周知的。参见,例如,merrifield,chem.polypeptides,katsoyannis和panayotis编辑,第335-361页,1973;merrifield,j.am.chem.soc.85:2149,1963;davis等人,biochem.intl.10:394-414,1985;stewart和young,solidphasepeptidesynthesis,1969;美国专利3,941,763;finn等人,theproteins,第3版,2:105-253,1976;和erickson等人,theproteins,第3版,2:257-527,1976;“protectinggroupsinorganicsynthesis,”第3版,t.w.greene和p.g.m.wuts编johnwiley&sons,inc.,1999;novabiochemcatalog,2000;“syntheticpeptides,auser'sguide,”g.a.grant编,w.h.freeman&company,newyork,n.y.,1992;“advancedchemtechhandbookofcombinatorial&solidphaseorganicchemistry,”w.d.bennet,j.w.christensen,l.k.hamaker,m.l.peterson,m.r.rhodes和h.h.saneii编,advancedchemtech,1998;“principlesofpeptidesynthesis,第2版,”m.bodanszky编,springer-verlag,1993;“thepracticeofpeptidesynthesis,第二版,”m.bodanszky和a.bodanszky编,springer-verlag,1994;“protectinggroups,”p.j.kocienski编,georgthiemeverlag,stuttgart,germany,1994;“fmocsolidphasepeptidesynthesis,apracticalapproach,”w.c.chan和p.d.white编,oxfordpress,2000;g.b.fields等人,syntheticpeptides:auser'sguide,77-183,1990。
包含直接或间接通过接头部分共价连接、附着或结合至另一肽的多肽、载体(例如载剂)或半衰期延长部分的组合物是“缀合物”或“缀合”分子,无论是通过化学方法(例如,翻译后或合成后)还是通过重组融合而缀合。多肽的缀合可以通过多肽的n端和/或c端进行,或者可以在肽的一级氨基酸序列的中间进行。由于多肽对癌细胞的特异性,该多肽可以与其他细胞毒性部分偶联,以促进向癌细胞的特异性递送并增强本文所述的多肽的细胞毒性。接头可用于产生融合蛋白,其允许引入额外的部分以增强多肽的杀伤或定位。感兴趣的特定部分可包括化学治疗剂、促凋亡因子、靶向治疗剂(例如激酶抑制剂等)或促进杀伤的其他试剂。
在一些实施方案中,将1个、2个、3个或4个多肽偶联或包封在相同或不同的递送载体中,例如载剂(例如,颗粒)或脂质体。在一些实施方案中,一种或多于一种多肽与载体的偶联包括一种或多于一种共价和/或非共价相互作用。在一个实施方案中,载体是金属或聚合物颗粒。在一个实施方案中,载体是脂质体。颗粒的尺寸可以是微米级或纳米级的。在一些方面,颗粒的直径为至少、至多或约0.1μm至至少、至多或约10μm。在另一方面,颗粒的平均直径为至少、至多或约0.3μm至至少、至多或约5μm,0.5μm至至少、至多或约3μm,或0.2μm至至少、至多或约2μm。在一些方面,颗粒的平均直径可为至少、至多或约0.1μm,或至少、至多或约0.2μm,或至少、至多或约0.3μm,或至少、至多或约0.4μm,或至少、至多或约0.5μm,或至少、至多或约1.0μm,或至少、至多或约1.5μm,或至少、至多或约2.0μm,或至少、至多或约2.5μm,或至少、至多或约3.0μm,或至少、至多或约3.5μm,或至少、至多或约4.0μm,或至少至多包括约4.5μm,或至少、至多或约5.0μm,包括其间的所有值和范围。
在一些实施方案中,选择载体的电荷(例如,正、负、中性)以赋予特定于应用的益处(例如,生理相容性、有益的表面-肽相互作用等)。在一些实施方案中,载体具有净中性电荷或净负电荷(例如,以减少与通常带有净负电荷的细胞表面的非特异性结合)。在一些情况下,载体与多个多肽偶联并且可以具有暴露于表面的一些多肽或这些多肽的组合的2个、3个、4个、5个、6个、7个、8个、9个、10个……20个……50个……100个或多于100个拷贝。在一些实施方案中,载体展示单一类型的多肽。在一些实施方案中,载体在表面上展示多种不同的多肽。
如本文所用,术语“包装”、“包封”和“包裹”是指多肽在脂质体或类似载体中或与脂质体或类似载体结合或缀合。多肽可以与脂质双层结合或存在于脂质体的水性内部中,或两者。
脂质体可以由标准的形成囊泡的脂质形成,所述脂质通常包括中性和带负电荷的磷脂和固醇,例如胆固醇。通常通过考虑例如脂质体的大小和血流中脂质体的稳定性来指导脂质的选择。使用各种类型的脂质来产生脂质体。例如,发现有用的两亲脂质是两性离子、酸性脂质或阳离子脂质。两性离子两亲脂质的实例是磷脂酰胆碱、磷脂酰乙醇胺、鞘磷脂等。酸性两亲脂质的实例是磷脂酰甘油、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酸等。阳离子两亲脂质的实例是二酰基三甲基铵丙烷、二酰基二甲基铵丙烷、硬脂胺等。中性脂质的实例包括甘油二酯,例如甘油二油酸酯、甘油一油酸二棕榈油酸酯和混合的辛酸-癸酸甘油酯;甘油三酯,例如甘油三油酸酯、甘油一油酸三棕榈酸酯、甘油三亚油酸酯、甘油三辛酸酯和甘油三月桂酸酯;及其组合。另外,在一些实施方案中,胆固醇或植物固醇用于例如制备多囊脂质体。
多种方法可用于制备脂质体,如例如szoka等人,ann.rev.biophys.bioeng.9:467(1980),美国专利4235871、4501728和4837028所述,其全部内容通过引用并入本文。一种方法产生非均一大小的多层囊泡。在该方法中,将形成囊泡的脂质溶解在合适的有机溶剂或溶剂体系中,并在真空或惰性气体下干燥以形成薄的脂质膜。或者,可以将脂质溶解在合适的溶剂例如叔丁醇中,然后冻干以形成更均质的脂质混合物,其呈更容易水合的粉末状形式。将该膜或粉末用缓冲水溶液覆盖,并通常在搅拌下在15分钟至60分钟内使其水合。通过在更剧烈的搅拌条件下使脂质水合或通过添加增溶剂如脱氧胆酸盐,可以使所得多层囊泡的尺寸分布向较小的尺寸移动。
多层脂质体例如通过搅拌分散体而形成,优选通过使用薄膜蒸发器设备或通过摇动或涡旋混合来形成。通过对脂质固相的水分散体施加剪切力,例如通过超声处理或使用微流化设备例如均化器或弗氏压碎器施加剪切力,来形成单层囊泡。剪切力还可以通过注射、冻融、从脂质中透析洗涤剂溶液或其他已知的用于制备脂质体的方法来施加。脂质体的大小可以使用多种已知技术来控制,包括控制剪切力的持续时间。
“单层脂质体”也称为“单层囊泡”,是包括一个脂质双层膜的球形囊泡,该双层膜限定了单个封闭的水性隔室。双层膜包括两层脂质(或“脂单层(leaflet)”),即内层和外层。脂质分子的外层的亲水性头部朝向外部水性环境,疏水性尾部朝内指向脂质体内部。脂质的内层直接位于外层的下面,脂质的头部朝向脂质体的水性内部,而尾部朝向脂质的外层的尾部。
“多层脂质体”也称为“多层囊泡”或“多个层状囊泡”,包括多于一个的脂质双层膜,该膜限定了一个以上的封闭水性隔室。膜同心排列,以使不同的膜被水性隔室隔开,就像洋葱一样。
ii.表达和表达载体
可以将编码本文所述的任何多肽的核酸插入任何合适的表达系统中或与其一起使用。重组表达可以使用载体例如质粒、病毒等完成。载体可以包含可操作地连接到编码一种或多于一种多肽的核酸的启动子。载体还可以包含转录和翻译所需的其他元件。如本文所用,载体是指含有外源dna的任何载体。因此,载体是将外源核酸转运到细胞中而不发生降解的物质,并且包含在其被递送到的细胞中表达核酸的启动子。载体包括但不限于质粒、病毒核酸、病毒、噬菌体核酸、噬菌体、黏粒和人工染色体。可以产生适合携带、编码和/或表达编码蛋白酶的核酸的多种原核和真核表达载体。这样的表达载体包括例如pet、pet3d、pcr2.1、pbad、puc和酵母载体。载体可以例如在多种体内和体外情况下使用。载体可以是基因治疗载体,例如腺病毒载体、慢病毒载体或crisp-r载体。
表达盒、表达载体以及该表达盒或表达载体中的序列可以是异源的。如本文所用,当术语“异源”用于表达盒、表达载体、调节序列、启动子或核酸时,是指已经通过一定方式进行过操作的表达盒、表达载体、调节序列或核酸。例如,异源启动子可以是非天然地与待表达的核酸连接的启动子,或者是已经通过细胞转化程序引入细胞的启动子。异源核酸或启动子还包括天然存在于生物体中但已经以一定方式产生改变(例如,置于不同的染色体位置、突变、以多拷贝添加、与非天然启动子或增强子序列连接等)的核酸或启动子。异源核酸可包含包括cdna的序列。例如,当异源编码区与包含调控元件例如启动子的核苷酸序列连接,其中未发现该启动子与编码区天然结合时,或者当异源编码区与自然界中未发现的染色体部分结合时(例如,在基因座中表达的基因,其中编码区所编码的蛋白未正常表达),可以将异源编码区与内源编码区区分开。类似地,异源启动子可以是连接到编码区的启动子,其中天然上不存在该启动子与该编码区的连接。
可以使用的病毒载体包括与慢病毒、腺病毒、腺相关病毒、疱疹病毒、牛痘病毒、脊髓灰质炎病毒、aids病毒、神经营养性病毒、辛德毕斯和其他病毒有关的那些载体。同样有用的是任何具有这些病毒特性的病毒家族,这些特性使它们也适合用作载体。可以使用的逆转录病毒载体包括verma,i.m.,retroviralvectorsforgenetransfer.inmicrobiology-1985,americansocietyformicrobiology,第229-232页,华盛顿,(1985)中描述的那些。例如,这样的逆转录病毒载体可以包括马洛尼鼠科白血病病毒、mmlv和表达所需特性的其他逆转录病毒。通常,病毒载体包含非结构早期基因、结构晚期基因、rna聚合酶iii转录物、复制和衣壳化所必需的反向末端重复序列、以及控制病毒基因组转录和复制的启动子。当病毒工程化为载体时,通常去除一个或多于一个早期基因,并且将基因或基因/启动子盒插入病毒基因组代替去除的病毒核酸。
表达盒和/或表达载体中可以包括多种调控元件,包括启动子、增强子、翻译起始序列、转录终止序列和其他元件。“启动子”通常是当转录起始位点处于相对固定的位置时起作用的一个或多个dna序列。例如,启动子可以在编码蛋白酶的核酸区段的上游。“启动子”包含rna聚合酶和转录因子的基本相互作用所需的核心元件,并且可以包含上游元件和响应元件。“增强子”通常是指在距转录起始位点不固定距离处起作用的dna序列,“增强子”可以在转录单元的5'或3'。此外,增强子可以在内含子内以及在编码序列本身内。它们通常长度为10个至300个核苷酸,并且顺式起作用。增强子的功能是增强附近启动子的转录。像启动子一样,增强子也通常包含介导转录调控的反应元件。增强子通常决定表达的调节。
真核宿主细胞(酵母、真菌、昆虫、植物、动物、人或有核细胞)中使用的表达载体也可以包含终止转录所必需的序列,该序列可能影响mrna的表达。这些区域在编码组织因子蛋白的mrna的非翻译部分转录为聚腺苷酸化片段。3'非翻译区还包含转录终止位点。优选地,转录单元还包含聚腺苷酸化区域。该区域的一个好处是,增加所转录的单元像mrna一样被加工和运输的可能性。已很好地建立了表达构建体中多腺苷酸化信号的鉴定和使用方法。优选在表达构建体中使用同源的聚腺苷酸化信号。
来自表达盒或表达载体的一种或多于一种蛋白酶的表达可以由能够在原核细胞或真核细胞中表达的任何启动子控制。可以使用的原核启动子的实例包括但不限于sp6、t7、t5、tac、bla、trp、gal、lac或麦芽糖启动子。可以使用的真核启动子的实例包括但不限于组成型启动子,例如病毒启动子,例如cmv、sv40和rsv启动子,以及可调节启动子,例如诱导型启动子或抑制性启动子,例如tet启动子、hsp70启动子和受cre调控的合成启动子。用于细菌表达的载体包括pgex-5x-3,而用于真核表达的载体包括pcineo-cmv。
表达盒或载体可包含编码标记产物的核酸序列。该标记产物用于确定基因是否已经被递送至细胞,以及是否在递送后就被表达。优选的标记基因是编码β-半乳糖苷酶的大肠杆菌lacz基因和绿色荧光蛋白。在一些实施方案中,标记可以是选择性标记。当这些选择性标记成功地转移到宿主细胞中时,如果置于选择压力下,转化的宿主细胞可以存活。有两种广泛使用的不同类别的选择方案。第一类是基于细胞的新陈代谢和突变细胞系的使用,该突变细胞系缺乏独立于补充培养基进行生长的能力。第二类是显性选择,其是指在任何细胞类型中使用的选择方案,并且不需要使用突变细胞系。这些方案通常使用药物来阻止宿主细胞的生长。具有新基因的那些细胞将表达传递抗药性的蛋白,并在选择中存活下来。这种显性选择的实例使用药物新霉素(southernp.和berg,p.,j.molec.appl.genet.1:327(1982))、霉酚酸(mulligan,r.c.和berg,p.science209:1422(1980))或潮霉素(sugden,b.等人,mol.cell.biol.5:410-413(1985))。
可以使用包括但不限于质粒、病毒载体、病毒核酸、噬菌体核酸、噬菌体、黏粒和人工染色体中的遗传物质的直接转移,或者通过转移细胞或载体例如阳离子脂质体或病毒中的遗传物质,来获得基因转移。这样的方法在本领域中是众所周知的,并且容易适用于本文所述的方法。转移载体可以是用于将基因递送到细胞(例如质粒)中的任何核苷酸构建体,或者是作为递送基因的一般策略的一部分,例如作为重组逆转录病毒或腺病毒的一部分(ram等人cancerres.53:83-88,(1993))。用于转染的合适手段包括病毒载体、化学转染子或物理机械方法,例如电穿孔和dna的直接扩散,例如wolff等人,science,247,1465-1468,(1990);和wolff,nature,352,815-818,(1991)所描述的。
例如,可以通过任何方法将核酸分子、编码蛋白酶的表达盒和/或载体引入细胞,所述方法包括但不限于钙介导的转化、电穿孔、显微注射、脂质转染、粒子轰击等。可以在培养物中扩增细胞,然后将其施用于对象,例如哺乳动物,例如人。所施用的细胞的量或数量可以变化,但是可以使用约106个至约109个细胞的量。细胞通常在生理溶液如盐水或缓冲盐水中递送。细胞也可以在诸如脂质体、外泌体或微囊泡的载体中递送。
蛋白酶可由产生含有该蛋白酶的外泌体或微囊泡的转基因细胞产生。外泌体和微囊泡介导蛋白、脂质、mrna和微小rna中的多种的分泌,与邻近细胞相互作用,从而可以在细胞之间传递信号、蛋白、脂质和核酸(参见,例如shen等人,jbiolchem.286(16):14383-14395(2011);hu等人,frontiersingenetics3(april2012);pegtel等人,proc.nat'lacadsci107(14):6328-6333(2010);wo/2013/084000;其中每一个通过引用将完整地并入本文)。
因此,可以将具有表达一种或多于一种蛋白酶的异源表达盒或表达载体的转基因细胞施用给对象,并且由转基因细胞产生的外泌体将蛋白酶递送至对象的肿瘤和/或癌细胞。
根据以上内容,本公开涉及产生在基因工程和基因治疗中常规使用的载体特别是质粒、黏粒、病毒和噬菌体的方法,该载体包含编码本文定义的蛋白酶的多肽序列的核酸分子。在一些情况下,载体是表达载体和/或基因转移或靶向载体。衍生自病毒如逆转录病毒、牛痘病毒、腺相关病毒、疱疹病毒或牛乳头瘤病毒的表达载体可用于将所述的多核苷酸或载体递送至靶细胞群中。可以使用本领域技术人员众所周知的方法来构建重组载体。或者,可以将所述的核酸分子和载体重构到脂质体中以递送至靶细胞。可以通过众所周知的方法将含有本公开内容的核酸分子的载体转移到宿主细胞中,所述方法根据细胞宿主的类型而变化。
本发明的另一方面涉及包含蛋白酶基因构建体的基因治疗载体。基因治疗载体是本领域已知的,包括但不限于慢病毒载体、腺病毒载体、腺相关病毒载体、质粒等。本发明的基因治疗载体的构建可以通过本领域已知的方法进行。在一些方面,基因治疗载体可以以约、至多或至少10个、100个、1000个、1×104个、1×105个、1×106个、1×107个、1×108个、1×109个、1×1010个、1×1011个、1×1012个(包括其间的所有值和范围)病毒颗粒(vp)或菌落形成单位(cfu)的量施用。作为基因治疗载体的实例,蛋白酶表达盒可以包含在慢病毒载体中。可以将治疗载体离体转导到细胞中并将细胞递送给患者。同样,本发明的治疗载体可以直接递送给患者。
iii.药物制剂和施用
在一些实施方案中,实施方案还提供了包含以下中的1种、2种、3种、4种、5种、6种、7种或全部8种的组合物:(1)嗜酸性粒细胞阳离子蛋白(ecp),(2)人嗜中性粒细胞弹性蛋白酶(elane),(3)组织蛋白酶g(ctsg),(4)蛋白酶3(prtn3),(5)鼠嗜中性粒细胞弹性蛋白酶(melane),(6)鼠胰弹性蛋白酶(mela1),(7)猪胰弹性蛋白酶(pela1),(8)大鼠胰弹性蛋白酶(rela1/rpe)或其变体,以及以下中的一种或多于一种:药学上可接受的稀释剂;载剂;增溶剂;乳化剂;和/或防腐剂。这样的组合物可以包含有效量的至少一种抗癌剂或复合物。因此,还包括本文所述的一种或多于一种抗癌剂在制备药物药物组合物中的用途。这样的组合物可以用于治疗多种癌症。
可以将抗癌剂配制成各种剂型的治疗组合物,各种剂型例如但不限于液体溶液或混悬剂、片剂、丸剂、散剂、栓剂、聚合物微胶囊或微囊泡、脂质体和可注射或可输注溶液。优选的剂型取决于施用方式和所针对的特定疾病。所述组合物还优选包含本领域众所周知的药学上可接受的载体、载剂或佐剂。
用于药物制剂的可接受的制剂组分在所采用的剂量和浓度下对接受者无毒。除了提供的抗癌剂外,组合物还可包含用于修饰、维持或保持组合物的例如ph、渗透压、黏度、澄清度、颜色、等渗性、气味、无菌性、稳定性、溶出率、释放、吸附或渗透的组分。用于配制药物组合物的合适物质包括但不限于氨基酸(例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸);抗菌剂;抗氧化剂(例如抗坏血酸、亚硫酸钠或亚硫酸氢钠);缓冲剂(例如乙酸盐、硼酸盐、碳酸氢盐、tris-hcl、柠檬酸盐、磷酸盐或其他有机酸);填充剂(例如甘露醇或甘氨酸);螯合剂(如乙二胺四乙酸(edta));络合剂(例如,咖啡因、聚乙烯吡咯烷酮、β如环糊精或羟丙基-糊精环糊精);填充剂;单糖;二糖;和其他糖类(例如葡萄糖、甘露糖或糊精);蛋白质(例如血清白蛋白、明胶或免疫球蛋白);着色剂、调味剂和稀释剂;乳化剂;亲水性聚合物(例如聚乙烯吡咯烷酮);低分子量多肽;成盐的抗衡离子(例如钠);防腐剂(例如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢);溶剂(例如甘油、丙二醇或聚乙二醇);糖醇(例如甘露醇或山梨糖醇);助悬剂;表面活性剂或湿润剂(如普朗尼克类、peg、山梨聚糖酯、聚山梨酯,如聚山梨酯20、聚山梨酯80、曲通、三甲胺、卵磷脂、胆固醇、泰洛沙泊);稳定性增强剂(如蔗糖或山梨糖醇);张力增强剂(例如碱金属卤化物,优选氯化钠或氯化钾、甘露醇、山梨糖醇);递送载剂;稀释剂;赋形剂和/或药物佐剂(参见remington'spharmaceuticalsciences,第18版,(a.r.gennaro编),1990,mackpublishingcompany),其通过引用并入本文。
制剂组分以施用部位可接受的浓度存在。缓冲剂有利地用于将组合物维持在生理ph或稍低的ph,通常维持在至少、至多或约4.0至至少、至多或约8.5的ph范围,或替代地,维持在至少、最多、或约5.0至8.0的ph范围,包括其间的所有值和范围。药物组合物可包含至少、至多或约ph6.5至8.5(包括其间的所有值和范围)的tris缓冲液,或至少、至多或约ph4.0至5.5(包括其间的所有值和范围)的乙酸盐缓冲液,还可以包含山梨糖醇或其合适的替代物。
用于体内施用的药物组合物通常是无菌的。可以通过无菌滤膜过滤来实现灭菌。如果将组合物冻干,则可以在冻干和重构之前或之后进行灭菌。肠胃外施用的组合物可以冻干形式或溶液形式储存。在一些实施方案中,肠胃外组合物被置于具有无菌进入口的容器中,例如,具有可被皮下注射针刺穿的塞子的静脉内溶液袋或小瓶,或准备用于注射的无菌预填充注射器。
上述组合物可以使用常规的递送方式施用,包括但不限于静脉内施用、腹膜内施用、经口施用、淋巴管内施用、皮下施用、动脉内施用、肌内施用、胸膜内施用、鞘内施用、以及通过局部导管灌注。还考虑了对所讨论的肿瘤的局部施用(例如,瘤内施用)。当通过注射施用组合物时,可以通过连续输注或通过单次或多次剂量施用。对于肠胃外给药,抗转移剂可以以无热原的肠胃外可接受的水溶液形式施用,所述水溶液包含所需的在药学上可接受的载剂中的抗癌剂。用于肠胃外注射的特别合适的载剂是无菌蒸馏水,在无菌蒸馏水中将一种或多于一种抗癌剂配制为无菌等渗溶液,适当保存。
配制了药物组合物后,就可以将其以溶液、混悬剂、凝胶、乳剂、固体或脱水或冻干粉的形式储存在无菌小瓶中。这样的制剂可以以即用形式或在施用前重构的(例如冻干)形式存储。
如果需要,可以使用常规用于药物组合物中的稳定剂,例如蔗糖、海藻糖或甘氨酸。通常,此类稳定剂将以例如至少、至多、或约0.1重量/体积%至至少、至多、或约0.5重量/体积%的微小量添加。也可以常规量加入表面活性剂稳定剂,例如吐温
用于配制药物组合物的组分优选具有高纯度并且基本上不含潜在有害的污染物(例如,至少是国家食品(nf)级,通常至少是分析级,更通常至少是药物级)。此外,意在用于体内的组合物通常是无菌的。如果必须在使用前合成给定化合物,所得产物通常基本上不含任何潜在的毒性剂。肠胃外施用的组合物也是无菌的,基本上是等渗的,并在gmp条件下制备。
对于本文所述的化合物(单独或作为药物组合物的一部分),这样的剂量为至少、至多或约0.001mg/kg体重至10mg/kg体重,优选至少、至多或约1mg/kg体重至5mg/kg体重,最优选0.5mg/kg体重至1mg/kg体重,包括其间的所有值和范围。
治疗有效剂量可以通过本领域技术人员容易地确定,并且取决于疾病的严重程度和病程,患者的健康状况和对治疗的反应,患者的年龄、体重、身高、性别、既往病史和主治医师的判断。
在一些方法中,癌细胞是肿瘤细胞。癌细胞可能在患者体内。患者可能患有实体瘤。在这种情况下,实施方案还可以包括对患者进行手术,例如切除全部或部分肿瘤。可以在手术之前、之后或同时将组合物施用于患者。在另外的实施方案中,还可以直接、内窥镜、气管内、肿瘤内、静脉内、病灶内、肌肉内、腹膜内、区域、经皮、局部、动脉内、膀胱内或皮下施用于患者。治疗组合物可施用1次、2次、3次、4次、5次、6次、7次、8次、9次、10次、11次、12次、13次、14次、15次、16次、17次、18次、19次、20次或多于20次;并且组合物可以每1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时施用,或每1天、2天、3天、4天、5天、6天、7天施用或每1周、2周、3周、4周、5周施用,或每1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个月施用。
该方法还可以包括向对象施用选自化学疗法、放射疗法、免疫疗法、激素疗法(或其他靶向疗法)或基因疗法的第二癌症疗法。该方法还可以包括多于一次向对象施用1种、2种、3种、4种或全部5种多肽或其变体。
治疗癌症的方法还可以包括向患者施用化学疗法或放射疗法,其可以施用多于一次。化学疗法包括但不限于顺铂(cddp)、卡铂、丙卡巴肼、氮芥、环磷酰胺、喜树碱、异环磷酰胺、美法仑、苯丁酸氮芥、白消安、亚硝基脲、放线菌素d、柔红霉素、阿霉素、博莱霉素、普卡霉素、丝裂霉素、依托泊苷(vp16)、他莫昔芬、泰索帝、紫杉醇、跨铂、5-氟尿嘧啶、长春新碱、长春碱、氨甲蝶呤、吉西他滨、奥沙利铂、伊立替康、拓扑替康或其任何类似物或衍生变体。放射疗法包括但不限于x射线辐照、uv辐照、γ-辐照、电子束辐照或微波。此外,作为方法的一部分,可以向细胞或患者施用微管稳定剂,包括但不限于紫杉烷。特别考虑,任何化合物或衍生物或类似物可以与这些联合疗法一起使用。
在一些方面,可用于与本文描述的多肽组合的癌症疗法的其他治疗剂包括抗血管生成剂或血管生成抑制剂。许多抗血管生成剂已经被鉴定并且是本领域已知的,包括例如tnp-470、血小板因子4、血小板应答蛋白-1、金属蛋白酶的组织抑制剂(timp1和timp2)、催乳素(16-kd片段)、血管抑素(纤溶酶原的38-kd片段)、内皮细胞抑制素、bfgf可溶性受体、转化生长因子β、干扰素α、可溶性kdr和flt-1受体、胎盘增殖素相关蛋白、以及carmeliet和jain(2000)列出的那些。在一个实施方案中,抑制剂可以与vegf拮抗剂或vegf受体拮抗剂例如抗vegf抗体、vegf变体、可溶性vegf受体片段、能够阻断vegf或vegfr的适体、中和抗vegfr抗体、vegfr酪氨酸激酶抑制剂及其任何组合(例如,抗-hvegf抗体a4.6.1、贝伐单抗或雷珠单抗)联合使用。
本文所述的组合物可以与信号转导抑制剂组合。此类药剂的实例包括但不限于抗体疗法,例如赫赛汀(曲妥珠单抗)、爱必妥(西妥昔单抗)、伊匹单抗(易普利姆玛)和帕妥珠单抗。此类疗法的实例还包括但不限于小分子激酶抑制剂,例如伊马替尼(格列卫)、舒尼替尼(索坦)、索拉非尼(多吉美)、厄洛替尼(特罗凯)、吉非替尼(易瑞沙)、达沙替尼(施达赛)、尼洛替尼(达希纳)、拉帕替尼(泰立沙)、克唑替尼(赛可瑞)、鲁索替尼(捷恪卫)、维罗非尼(佐博伏)、凡德他尼(caprelsa)、帕唑帕尼(votrient)、阿法替尼、阿立塞替、阿莫替尼、阿昔替尼、博舒替尼、布立尼布、卡奈替尼(canertinib)、卡博替尼、西地尼布(cediranib)、crenolanib、达拉非尼、达克替尼、达鲁舍替、多韦替尼、foretinib、ganetespib、依鲁替尼、伊尼帕利布、乐伐替尼、林法尼布、林西替尼、马赛替尼、莫洛替尼、莫特塞尼、来那替尼、尼拉帕利、奥普佐米、奥拉帕尼、pictilisib、帕纳替尼、奎扎替尼、瑞格菲尼、瑞格色替、瑞卡帕布、塞卡替尼、saridegib、坦度替尼、tasocitinib、替拉替尼、tivantinib、tivozanib、托法替尼、曲美替尼、瓦他拉尼、维利帕尼、维莫德吉、volasertib、bms-540215、bms777607、jnj38877605、tki258、gdc-0941、bze235等。
免疫疗法或生物反应调节剂疗法可与本文所述疗法组合使用。这些疗法利用免疫系统抵抗疾病。免疫疗法可以帮助免疫系统识别癌细胞,或增强对癌细胞的应答。免疫疗法包括主动免疫疗法和被动免疫疗法。主动免疫疗法刺激机体自身的免疫系统,而被动免疫疗法通常使用在体外产生的免疫系统组分。
主动免疫疗法的实例包括但不限于疫苗,包括癌症疫苗、肿瘤细胞疫苗(自体或同种异体)、病毒疫苗、树突状细胞疫苗、抗原疫苗、抗独特型疫苗、dna疫苗、或具有白介素2(il-2)的肿瘤浸润淋巴细胞(til)疫苗、或淋巴因子激活杀伤(lak)细胞疗法。
被动免疫疗法的实例包括但不限于单克隆抗体和含有毒素的靶向疗法。单克隆抗体包括裸抗体和缀合抗体(也称为标签抗体、标记抗体或负载抗体)。裸单克隆抗体不具有结合的药物或放射性物质,而缀合的单克隆抗体则与例如化疗药物(化学标记)、放射性颗粒(放射性标记)或毒素(免疫毒素)结合。
在一些实施方案中,被动免疫疗法例如裸单克隆抗体药物可以与本文所述的多肽组合物组合使用以治疗癌症。这些裸单克隆抗体药物的实例包括但不限于抗cd20抗原的抗体利妥昔单抗(rittman),其用于治疗例如b细胞非霍奇金淋巴瘤;抗her2蛋白的抗体曲妥珠单抗(赫赛汀),其用于治疗例如晚期乳腺癌;抗cd52抗原的抗体阿仑单抗(坎帕斯),其用于治疗例如b细胞慢性淋巴细胞性白血病(b-cll);抗egfr蛋白的抗体西妥昔单抗(爱必妥),其例如与伊立替康联合用于治疗例如晚期结直肠癌和头颈癌;和抗血管生成疗法贝伐单抗(阿瓦斯汀),其可对抗vegf蛋白,并与例如化学疗法联合使用以治疗例如转移性结直肠癌。可以使用的治疗性抗体的其他实例包括但不限于:
在一些实施方案中,被动免疫疗法,例如缀合的单克隆抗体,可以与本文所述的多肽组合物组合使用以治疗癌症。这些缀合的单克隆抗体的实例包括但不限于放射性标记的抗体替伊莫单抗(zevalin),其直接向癌性b淋巴细胞传递放射性,用于治疗例如b细胞非霍奇金淋巴瘤;放射性标记的抗体托西莫单抗(bexxar),其用于治疗例如一些类型的非霍奇金淋巴瘤;以及含有卡奇霉素的免疫毒素吉妥珠单抗奥佐米星(mylotarg),其用于治疗例如急性骨髓性白血病(aml)。bl22是缀合的单克隆抗体,用于治疗例如毛细胞白血病,免疫毒素用于治疗例如白血病、淋巴瘤和脑瘤,以及放射性标记的抗体例如oncoscint例如用于结直肠癌和卵巢癌,prostascint例如用于前列腺癌。
在一些实施方案中,可以将含有毒素的靶向疗法与本文所述的多肽组合物联合使用以治疗癌症。包含毒素的靶向疗法是毒素与生长因子连接,或在特定实施方案中与本文所述的多肽连接,并且不包含抗体。
一些实施方案还包括将辅助免疫疗法与本文所述的多肽组合物组合使用,此类辅助免疫疗法包括但不限于细胞因子,例如粒细胞-巨噬细胞集落刺激因子(gm-csf)、粒细胞集落刺激因子(g-csf)、巨噬细胞炎性蛋白(mip)-1-α、白介素(包括il-1、il-2、il-4、il-6、il-7、il-12、il-15、il-18、il-21和il-27)、肿瘤坏死因子(包括tnf-瘤)和干扰素(包括ifn-扰、ifn-β和ifn-n);氢氧化铝(明矾);bacillecalmette-guérin(bcg);匙孔血蓝蛋白(klh);弗氏不完全佐剂(ifa);qs-21;detox;左旋咪唑;二硝基苯吩(dnp)及其组合,例如白介素(例如il-2)与其他细胞因子例如ifn-细的组合。
一些实施方案还包括将激素疗法(抗激素剂)与本文所述的多肽组合物组合使用。抗激素剂包括但不限于起到调节或抑制激素作用于肿瘤的作用的药物,例如抗雌激素和选择性雌激素受体调节剂(serm),包括例如他莫昔芬(包括
一些实施方案包括基因表达调节剂。如本文所用,“基因表达调节剂”可以是能够通过包括但不限于反义机制或通过rna干扰(rnai)介导的机制来诱导活细胞中基因表达的选择性调节的寡核苷酸剂,所述机制可以包括(i)转录失活;(ii)mrna降解或扣押;(iii)转录抑制或减弱或(iv)翻译抑制或减弱。寡核苷酸基因表达调节剂包括调节性rna(例如,几乎任何调节性rna),例如但不限于反义寡核苷酸、mirna、sirna、rnai、shrna、airna、dicer底物、适体及其任何类似物或前体,以及hdac抑制剂,例如帕比司他和贝利司他。
在一些实施方案中,施用本文所述组合物的癌症可以是膀胱癌、血癌、骨癌、骨髓癌、脑癌、乳腺癌、结直肠癌、食管癌、胃肠癌、头癌、肾癌、肝癌、肺癌、鼻咽癌、颈癌、卵巢癌、胰腺癌、前列腺癌、皮肤癌、胃癌、睾丸癌、舌癌或子宫细胞癌。
iv.抗菌组合物和方法
在另一个实施方案中,治疗组合物可用作抗菌多肽组合物。细菌中对抗生素和/或药物的耐药性的普遍存在正在成为主要的公共卫生威胁之一。当前的抗生素干扰病原体的关键生物学过程,并导致细菌死亡或生长停滞。结果,抗生素疗法施加了强选择性压力,有利于出现耐抗生素的菌株。因此,对一线抗生素产生抗性的细菌菌株的数量正以惊人的速度增长,但市场或渠道中没有替代治疗的迹象。确实存在的几种替代方案是昂贵的、高毒性的和/或作用缓慢的。在如今被认为易于治疗的感染中,例如结核病、沙门氏菌、大肠杆菌和淋病,耐药性甚至在增加。
在一些实施方案中,多肽组合物可用于治疗和/或预防细菌感染,例如鲍曼不动杆菌、蜡状芽孢杆菌、炭疽芽孢杆菌、肉毒梭状芽孢杆菌、难辨梭状芽孢杆菌、破伤风梭状芽孢杆菌、产气荚膜梭状芽孢杆菌、白喉棒状杆菌、肠球菌(例如,链球菌d)、单核细胞增生利斯特氏菌、肺炎球菌感染(例如肺炎链球菌)、葡萄球菌(staphylococcal)感染和链球菌感染;革兰氏阴性细菌,包括类杆菌、百日咳博德特氏杆菌、布鲁氏菌、弯曲杆菌感染、肠出血性大肠杆菌(ehec/大肠杆菌0157:h7)、肠侵染性大肠杆菌(eiec)、肠产毒性大肠杆菌(etec)、流感嗜血杆菌、幽门螺杆菌、肺炎克雷白氏杆菌、军团菌、卡他莫拉菌、淋病奈氏球菌、脑膜炎奈氏球菌、变形杆菌、铜绿假单胞菌、沙门氏菌、志贺氏菌、霍乱弧菌和耶尔森氏菌;抗酸细菌,包括结核分枝杆菌、鸟胞内分枝杆菌、约翰氏分枝杆菌、麻风分枝杆菌,非典型细菌,衣原体、支原体、立克次氏体、螺旋体、梅毒密螺旋体、欧洲回归热疏螺旋体、伯氏疏螺旋体(borreliaburgdorfii)、出血黄疸钩端螺旋体及其他各种细菌,包括放线菌和诺卡氏菌的感染。
耐药病原体在医院中尤其普遍。特别危险的菌株例如为耐甲氧西林的金黄色葡萄球菌(mrsa)。在一些方面,多肽组合物可用于治疗几种医疗相关(ha)和群落相关(ca)菌株。ha和ca菌株包括但不限于st228、st239、st5、st22、st45、st240、st247、st250、st15、st30、st36、st579、st45、st59、st80、st1:usa400和st8:usa300。
由一些微生物例如一些革兰氏阴性细菌引起的感染,由于药物无法穿透其较厚的细胞壁而通常对当今的抗生素无反应。包括结核分枝杆菌的一些耐酸杆菌也已变得具有多重耐药性。
可以将抗菌组合物配制为通过任何合适的途径施用/使用,包括但不限于经口、胃肠外、通过吸入喷雾、直肠或局部,以含有常规药学上可接受的载体、佐剂和载剂的剂量单位制剂施用/使用。本文所用的术语肠胃外包括皮下、静脉内、动脉内、肌内、胸骨内、腱内、脊柱内、颅内、胸腔内、腹膜内的输注技术。在优选的实施方案中,将组合物配制成用于施用/用作局部霜剂、混悬剂、口服制剂或静脉内制剂以用作抗菌剂。
抗菌组合物可以与医学装置结合使用,以改善或减轻细菌感染或污染。生物医学装置可以包含置于生物医学装置之上和/或之中的多肽复合物。预期多肽组合物可以与任何易受细菌感染,特别是金黄色葡萄球菌和/或铜绿假单胞菌感染的生物医学装置一起使用。在各种非限制性实施方案中,生物医学装置可以是医学植入物,包括但不限于矫形植入物(例如骨折固定装置、关节假体(膝盖、臀部、肩部等)等)、支架、移植物、分流器、支架移植物、血管成形术装置、血管导管、导尿管、主动脉移植物、球囊导管、瘘管、伤口敷料、牙科植入物、隐形眼镜消毒液和任何可植入的药物输送装置。所述组合物可以任何合适的量或布置存在于生物医学装置上,并且可以与一种或多于一种其他组分组合。在一个实施方案中,将组合物与聚合物涂层一起添加。在其他方面,多肽复合物用于抗菌组合物中。在各种非限制性实施方案中,抗菌组合物可以是固体(例如:固体肥皂)或液体(例如:液体肥皂),并且可以设置在基材(例如:消毒湿巾)上。
一些方面提供了治疗细菌感染的方法,所述方法包括向有需要的对象施用有效治疗感染的量的多肽复合物。患有细菌感染的任何对象都可以使用该方法进行治疗。
如本文所用,“治疗细菌感染”是指完成以下中的一项或多于一项:(a)减少或消除对象的感染;(b)减轻一种或多于一种细菌感染症状的严重程度;(c)限制或预防一种或多于一种细菌感染症状的发展;(d)抑制一种或多于一种细菌感染症状的恶化;(e)限制或预防先前具有相关症状的对象的一种或多于一种细菌感染症状的复发。
一些方面涉及对表面进行消毒的方法,其包括使表面与抗菌组合物接触。任何合适的表面均可进行消毒,包括但不限于柜台、水槽、厕所、门把手、书桌、医疗工具(例如医院、用具、设备、床等)。
实施例
给出以下实施例是为了说明各种实施方案,并不意味着以任何方式限制实施方案。本领域的技术人员容易理解,本发明非常适合于实现目的并获得所提及的结果和优点,并且这些目的、结果和优点是本文固有的。本实施例以及本文描述的方法目前是优选实施方案的代表,并且不意图作为对范围的限制。本领域技术人员将想到包含在由权利要求的范围所限定的精神内的改变和其他用途。
实施例1
治疗癌症的方法
人pmn广泛而有选择性地杀伤癌细胞。从健康供体中分离出人外周血嗜中性粒细胞(pmn),并将其在无血清dmem中孵育以收集它的分泌因子(pmn培养基)。(a-b)将人或鼠癌细胞(a)或健康细胞(b)与pmn培养基或对照无血清dmem(对照培养基)一起孵育24小时。通过钙黄绿素am染色评估细胞活力。(c)用pmn培养基或对照培养基处理人或鼠癌细胞6小时。通过发光活性测定法检测胱天蛋白酶3/7活性,通过流式细胞术评估细胞表面膜联蛋白v染色。结果表明,pmn培养基通过凋亡诱导了癌细胞的死亡。*,p<0.05,学生t-检验(图1)。
人嗜中性粒细胞适应的培养基杀伤多种癌细胞。从健康供体中分离出人外周血嗜中性粒细胞。将细胞接种在无血清的dmem中,并收集嗜中性粒细胞适应的培养基(neucm)24小时。用20μg/mlneucm处理癌细胞(caov3,一种人高级浆液性卵巢癌细胞系)24小时,并通过瑞特-吉姆萨染色、钙黄绿素am、膜联蛋白v染色和胱天蛋白酶-3/7活性证实了癌细胞杀伤作用。
人嗜中性粒细胞适应的培养基对非癌细胞无毒。从健康供体中分离出人外周血嗜中性粒细胞。将细胞接种在无血清的dmem中,并收集嗜中性粒细胞适应的培养基(neucm)24小时。用100μg/mlneucm处理非癌细胞(以人单核细胞衍生的巨噬细胞为例)24小时,并通过瑞特-吉姆萨染色、钙黄绿素am、膜联蛋白v染色和胱天蛋白酶-3/7活性证实了没有毒性。
鉴定介导选择性杀伤的因子的方法。开发了定量的癌细胞杀伤测定法以追踪生物活性因子。用各种剂量的pmn培养基处理mda-mb-231细胞,并通过钙黄绿素am活细胞荧光染色评估细胞活力。(图3a)线性回归分析(线)显示,mda-mb-231癌细胞的杀伤与pmn培养基剂量密切相关。(图3b)使pmn培养基通过0.22μm过滤器,并在过滤前溶液和过滤后溶液中测量蛋白浓度和对mda-mb-231癌细胞的杀伤活性。(图3c)蛋白组学分析在pmn培养基中鉴定出890种蛋白(≥2种肽),其中只有两种经过滤后在两种供体中明显降低(g-检验,p<0.001),即嗜中性粒细胞弹性蛋白酶(elane)和嗜酸性粒细胞阳离子蛋白(ecp)。通过质谱(光谱计数)定量pmn培养基过滤前后的elane和ecp水平。
在嗜中性粒细胞适应的培养基中将ecp、elane、anxa6、defa1和casp3鉴定为候选癌细胞杀伤蛋白。从2个不同的供体(供体1和供体2)获得嗜中性粒细胞适应的培养基。发明人发现,使适应的培养基通过0.2μm无菌过滤器消除了癌细胞的杀伤活性,而不降低总蛋白浓度。这些发现表明,0.2μm无菌过滤器特定地耗尽癌细胞杀伤蛋白而不耗尽其他蛋白。为了确定被0.2μm无菌过滤器耗尽的蛋白的种类,发明人对来自每个供体的过滤前后的适应的培养基进行了定量蛋白组学分析。蛋白组学分析确定了2000种蛋白,其中的4种(ecp、elane、anxa6和defa1)在两个供体的样品中均耗尽(g检验、p<0.05)。发明人探索了这些蛋白可能彼此相互作用或互补的可能性。使用两种方法检验了该假设。首先,发明人将嗜中性粒细胞适应的培养基与偶联有抗elane抗体的磁珠一起孵育,并通过蛋白印迹分析了上清液(sup)、洗涤液(wash)和洗脱液(elute)。该分析确定了ecp、defa1和casp3为elane结合蛋白。其次,发明人在阴离子交换柱(hitrapq-sepharose)上分离了嗜中性粒细胞适应的培养基,并发现elane、ecp、defa1、anxa6和casp3都在同一级分中共洗脱(级分13),这也是唯一具有癌细胞杀伤活性的部分。
免疫耗尽来自嗜中性粒细胞适应的培养基中的ecp、elane、anxa6、defa1或casp3减弱了癌细胞杀伤活性。将嗜中性粒细胞适应的培养基与未偶联的磁珠(对照)或与抗ecp、抗elane、抗anxa6、抗defa1或抗casp3抗体偶联的磁珠一起孵育。收集来自磁珠的上清液,并通过钙黄绿素am检测其杀伤mda-mb-231细胞(人三阴性乳腺癌细胞系)的能力。
为了确定elane和/或ecp是否起作用,发明人(1)免疫耗尽来自pmn培养基中的elane或ecp;(2)用商业来源的纯天然elane或ecp处理癌细胞或正常细胞。(图6a)通过免疫沉淀耗尽了pmn培养基中的elane或ecp;蛋白印迹证实了耗尽。pmn培养基耗尽前=orig,耗尽后=ft。非特异性igg用作对照。(图6b)用纯化的天然elane或ecp以不同剂量处理mda-mb-231细胞或人单核细胞衍生的巨噬细胞(hmdm)24小时,并通过钙黄绿素am染色评估其杀伤作用。(图6c)用存在于pmn培养基中的相应水平的elane(0.25μg/ml)或ecp(0.05μg/ml)单独或组合处理mda-mb-231细胞和hmdm24小时,并通过钙黄绿素am染色检查杀伤作用。结果表明,elane和ecp协同杀伤癌细胞,并且这种混合物对非癌细胞无毒。*,p<0.05,学生t-检验。
高剂量的ecp或elane可以杀伤癌细胞。发明人试图确定单独地添加纯化的人ecp(leebiosolutions)、人elane(abcam)、人defa1(abcam)、人anxa6(r&dsystems)或人casp3(abcam)是否可以杀伤癌细胞而不杀伤非癌细胞。将剂量渐增的每种蛋白添加到mda-mb-231细胞中5小时,或添加到人单核细胞衍生的巨噬细胞(hmdm)中24小时,并通过钙黄绿素am测定细胞活力。发现ecp和elane具有最高的癌细胞杀伤活性;defa1的活性很低;而anxa6和casp3不能杀伤癌细胞。仅ecp显示出对人单核细胞衍生的巨噬细胞的毒性。
elane和ecp协同作用以选择性杀伤癌细胞。用存在于pmn培养基中的相应水平的elane(0.25μg/ml)或ecp(0.05μg/ml)单独或组合处理mda-mb-231和人单核细胞衍生巨噬细胞(hmdm)24小时,通过钙黄绿素am染色检查杀伤作用。结果表明,elane和ecp协同杀伤癌细胞,并且这种混合物对非癌细胞无毒。
elane通过诱导细胞凋亡选择性杀伤癌细胞。(图6a)用50nm纯化的天然elane或对照dmem培养基(对照)处理癌细胞或健康细胞24小时,并通过钙黄绿素am染色评估细胞活力。(图6b)用50nm的elane或对照培养基处理癌细胞6小时,并通过胱天蛋白酶3/7发光活性测定或对细胞表面膜联蛋白v染色通过流式细胞术来评估细胞凋亡。*,p<0.05,学生t-检验。
化学疗法和嗜中性粒细胞适应的培养基的结合增强了对人三阴性乳腺癌细胞的杀伤作用。用嗜中性粒细胞适应的培养基(neu-cm;4μg/ml)、阿霉素(dox;0.3μm)或紫杉醇(ptx;3nm)单独或组合处理mda-mb-231细胞4小时,并通过钙黄绿素-am评估细胞活力。发现将阿霉素或紫杉醇与嗜中性粒细胞适应的培养基结合增强了癌细胞杀伤作用。
实施例2
cd95的降解与癌症治疗
elane催化活性是其选择性杀伤癌细胞所必需的。(图5a)将纯化的天然elane或pmn培养基用pmsf(100nm)或α-1-抗胰蛋白酶(a1at;42nm)处理30min,并通过发色底物测定法确认elane催化活性的损失。通过处理mda-mb-231细胞24小时进行杀伤测定,并通过钙黄绿素am染色进行评估。(图5b)通过发色底物活性测定法测定pmn培养基中的elane活性,并通过钙黄绿素am染色测定对暴露于pmn培养基4小时的mda-mb-231细胞的pmn杀伤作用。结果显示,pmn培养基中的elane催化活性与9个健康供体的pmn培养基的癌细胞杀伤能力线性相关(线性)。*,p<0.05,学生t-检验。
ecp是elane催化活性的ii型别构激活剂。(图7a)将10nmelane与各种底物浓度下渐增浓度的ecp一起孵育。通过发色底物活性测定法测量催化活性。(图7b)通过将曲线拟合到米氏方程(线)来获得km(app)和v最大(app)值。(图7c)km(app)相对于ecp浓度。(图7d)v最大(app)相对于ecp浓度。从人pmn培养基中免疫沉淀出elane,并用抗elane和抗ecp抗体探测样品。orig=pmn培养基,sup=流通,wash=珠洗涤,elute=与抗elane抗体结合。
elane降低癌细胞中cd95的水平,并且cd95水平降低与细胞凋亡相关。(图8a)对应于全长cd95(fl-cd95)、cd95的n端结构域(氨基酸1-173;n-cd95)或cd95的c端结构域(氨基酸157-320;c-cd95)的重组蛋白(1μg)在37℃下与elane(0.05μg)或载体(veh)一起孵育2小时。通过sds-page然后考马斯亮蓝染色评估降解。结果显示,elane优先裂解cd95的c端结构域(图8b),用elane(50nm)处理mel888癌细胞不同时间,并通过蛋白印迹分析使用c端特异性抗cd95抗体评估cd95降解。(图8c)用elane(50nm)处理癌细胞1小时,固定在10%福尔马林中,并用n端或c端特异性抗cd95抗体染色(绿色)。hoechst33342溶液用于核染色(蓝色)。图像是在40x下拍摄的。结果表明,经elane处理的癌细胞失去对c端特异性cd95抗体的免疫反应性,但未失去对n端特异性cd95抗体的免疫反应性。*,降解产物。
elane选择性裂解cd95的c端结构域。cd95途径对于多种癌细胞的生存是必不可少的,但是对于正常细胞的生存在很大程度上是可有可无的(adachi等人,nat.genet.,1995;karray等人,j.immunol.,2004)。可以通过蛋白水解来调节cd95功能(strand等人,oncogene,2004)。为了测试elane介导的细胞杀伤中cd95的参与,将elane(0.05μg)与1μg重组人c端(aa.157-320)或n端(aa.1-173)cd95在37℃下一起孵育2小时。通过sds-page然后用考马斯亮蓝染色评估降解。c端结构域裂解。n端结构域裂解。用elane(50nm)处理癌细胞1小时,固定在10%福尔马林中,并用n端或c端特异性抗cd95抗体染色。hoechst33342溶液用于核染色。图像是在40x下拍摄的。结果显示,在elane处理后,失去对c端特异性抗体的免疫反应性,但未丧失n端抗体的染色。将mel888癌细胞用elane(50nm)处理多次,并使用c端特异性抗cd95抗体通过蛋白印迹分析评估cd95降解。
elane内化是杀伤癌细胞必需的。(图9a)在存在或不存在广泛的内吞抑制剂dynasore(80μm)下,用elane(100nm)处理癌细胞30分钟。通过发色底物测定法评估细胞裂解物中的elane催化活性。(图9b)在存在或不存在dynasore(80μm)下,用elane(30nm)处理癌细胞6小时。通过钙黄绿素am染色检验细胞活力。*,p<0.05,学生t-检验。
elane诱导癌细胞中强效的杀伤程序。(图10a)用elane(50nm)处理癌细胞4小时,并通过蛋白印迹定量磷酸化的erk、nfkb和jnk以及总的erk、nfkb和jnk。以e0771癌细胞的免疫印迹为例。(图10b)用各种剂量的elane处理癌细胞1小时,并使用cm-h2dcfda染料通过流式细胞术测量线粒体ros。(图10c)用elane(50nm)处理癌细胞,并通过免疫印迹评估磷酸化(γh2ax)和总h2ax的dna损伤。以a549癌细胞的免疫印迹为例。(图10d)用elane(50nm)处理细胞8小时,并通过免疫印迹定量全长和裂解的casp3(c-casp3)和裂解的parp(c-parp)。以llc1癌细胞的免疫印迹为例。*,p<0.05,学生t-检验。
elane不在健康的非癌细胞中诱导强效的杀伤程序。(图11a)用elane(50nm)处理健康的非癌细胞4小时,并通过免疫印迹定量磷酸化的erk、nfkb和jnk以及总的erk、nfkb和jnk。以bmdm的免疫印迹为例。(图11b)用各种剂量的elane处理细胞1小时,并使用cm-h2dcfda染料通过流式细胞术测量线粒体ros。(图11c)用elane(50nm)处理细胞8小时,并通过免疫印迹定量全长和裂解的casp3(c-casp3)和裂解的parp(c-parp)。以bmdm的免疫印迹为例。
其他丝氨酸蛋白酶裂解cd95的c端结构域,并且裂解c端结构域的能力与癌细胞杀伤有关。(图12a)将全长的重组cd95蛋白与各种丝氨酸蛋白酶(人elane(80nm)、pr3(80nm)、cstg(80nm)、ppe(80nm)、小鼠elane(80nm)、大鼠elane(500nm)、gzmb(80nm)或胰蛋白酶(250nm))或其他类型的蛋白酶(ctsc(80nm);或mmp7(80nm)、mmp9(80nm)、ctsd(80nm),未示出)在37℃下一起孵育2小时。通过sds-page然后考马斯亮蓝染色评估降解。(图12b)将mda-mb-231癌细胞与各种蛋白酶一起孵育24小时。通过钙黄绿素am染色评估细胞活力。
猪胰弹性蛋白酶(ppe)和elane对癌细胞的毒性相同,但ppe更能抵抗丝氨酸蛋白酶抑制剂的抑制。(图13a)用各种剂量的纯化的天然elane或纯化的天然猪胰弹性蛋白酶(ppe)处理mda-mb-231癌细胞6小时,并通过钙黄绿素am染色评估其杀伤作用。(图13b)将纯化的天然elane或纯化的天然ppe与不同浓度的α不同浓抗胰蛋白酶(a1at)一起孵育15分钟。使用发色底物测定法测量催化活性。通过在存在或不存在a1at下用elane或ppe处理mda-mb-231癌细胞6小时,然后进行钙黄绿素am染色来确定癌细胞杀伤能力。(图13c)使用发色底物测定法测量催化活性。通过在存在或不存在fbs下用elane或ppe处理mda-mb-231癌细胞6小时,然后进行钙黄绿素am染色来确定癌细胞杀伤能力。
elane在多种癌细胞中诱导强效的杀伤程序。用elane处理人和小鼠癌细胞,并评估与癌细胞死亡相关的信号传导通路。用elane(50nm)处理细胞4小时,并通过蛋白印迹定量磷酸化的erk、nfkb和jnk以及总的erk、nfkb和jnk。用各种剂量的elane处理细胞1小时,并使用cm-h2dcfda染料通过流式细胞术测量线粒体ros。用elane(50nm)处理细胞,并通过免疫印迹评估磷酸化(γh2ax)和总h2ax的dna损伤。用elane(50nm)处理细胞8小时,并通过蛋白印迹定量全长和裂解的casp3和parp。
具有催化活性的elane被非癌细胞内化,从而导致丧失与c端特异性抗体的免疫反应性。用elane(50nm)处理非癌细胞1小时,固定在10%福尔马林中,并用n端或c端特异性抗cd95抗体染色。hoechst33342溶液用于核染色。图像是在40x下拍摄的。结果显示,在elane处理后,丧失与c端特异性抗体的免疫反应性,但未丧失n端抗体的染色。在存在或不存在广泛的内吞抑制剂dynasore(80μm)下,用elane(100nm)处理非癌细胞30分钟。使用发色底物测定法评估细胞裂解物中的elane催化活性。
在非癌细胞中未观察到elane诱导的杀伤程序。用elane处理人和小鼠非癌细胞,并评估与癌细胞死亡相关的信号传导通路。用elane(50nm)处理细胞4小时,并通过蛋白印迹定量磷酸化的erk、nfkb和jnk以及总的erk、nfkb和jnk。用各种剂量的elane处理细胞1小时,并使用cm-h2dcfda染料通过流式细胞术测量线粒体ros。用elane(50nm)处理细胞8小时,并通过蛋白印迹定量全长和裂解的casp3和parp。
elane活性是其体内抗肿瘤功能所必需的。(图14a)通过发色底物确定elane或通过用100nm的pmsf处理而失活的elane(pmsf-elane)的催化活性。(图14b)将e0771、b16f10或llc1癌细胞注射入c57bl/6小鼠。肿瘤达到约100mm3后,将人血清白蛋白(hsa,11.6μg)、elane(11.6μg)或pmsf-elane(11.6μg)每天一次肿瘤内递送,持续5天。用卡尺评估肿瘤体积。结果表明,活性elane减慢了肿瘤的生长,而pmsf-elane对肿瘤的生长没有影响。
肿瘤内递送的elane在许多癌症模型中减弱了肿瘤的生长。将mda-mb-231、a549或mel888细胞(异种移植模型)注射到无胸腺裸小鼠中;在scid小鼠中繁殖m1或4195肿瘤(tnbcpdx模型);将e0771、llc1或b16f10细胞(同系模型)注射到c57bl/6小鼠中。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6ug)或pmsf-elane(11.6μg),持续5天。n=8只至15只小鼠/组。用卡尺评估肿瘤体积。绘制kaplan-meier曲线,将对数秩检验(mentel-cox方法)用于小鼠的生存分析。第0天是指第一个治疗日。生存终点定义为肿瘤体积>1000mm3(图15)。
肿瘤内递送的elane诱导癌细胞凋亡。(图16a)将mda-mb-231、a549或mel888(异种移植模型)细胞注射到无胸腺裸小鼠中;在scid小鼠中繁殖m1或4195肿瘤(tnbcpdx模型);将e0771、llc1或b16f10细胞(同系模型)注射到c57bl/6小鼠中。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6μg)或pmsf-elane(11.6μg),持续5天。在第6天,分离肿瘤,用福尔马林固定,并通过免疫组织化学或免疫荧光染色检查tunel、裂解的parp(cparp)和裂解的casp3(ccasp3)。图像是在40x下拍摄的。(图16b)用n端(n-cd95)和c端(c-cd95)特异性抗cd95抗体对肿瘤切片进行染色,然后进行二抗染色(c-cd95和n-cd95分别为alexfluor488和alexfluor594)。对3个至4个区域/小鼠进行荧光强度定量。结果表明,elane处理可降低体内c-cd95的水平。*,p<0.05,学生t-检验。
在健康的非荷瘤小鼠中,elane没有产生明显的副作用。连续5天每天一次将4μm人白蛋白(对照)或4μmelane注入健康的非荷瘤c57bl/6小鼠的乳腺脂肪垫中,并监测副作用。体重、脾重量和血液alt活性水平(肝功能的标志物)。在最后一次注射后2天,对细胞凋亡标志物(裂解的casp3(c-casp3)、裂解的parp(c-parp))进行免疫组织化学染色。最后一次注射后2天,对血液中cd8+效应细胞毒性t细胞(定义为cd3+cd8+cd62llocd44hi)进行定量。
在免疫活性小鼠中进行的elane治疗要比在适应性免疫缺陷小鼠中进行的elane治疗更有效。基本原理基于以下观察结果:体内杀伤癌细胞的治疗剂已显示出可增强适应性免疫应答。因此,发明人探索了elane介导的癌细胞杀伤是否会积极影响肿瘤中的免疫细胞。c57bl/6背景(无适应性免疫)的rag2-/-小鼠和野生型(wt)c57bl/6小鼠均从jackson实验室获得。将e0771癌细胞注射入两种小鼠模型中。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6μg)或has(11.6μg),持续5天。用卡尺评估肿瘤体积。绘制kaplan-meier曲线,将对数秩检验(mentel-cox方法)用于小鼠的生存分析。生存终点定义为肿瘤体积>1000mm3。
肿瘤内递送的elane增加肿瘤的免疫细胞。将e0771、b16f10或llc1癌细胞注射入c57bl/6小鼠。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6μg)或pmsf-elane(11.6μg),持续5天。在第6天分离肿瘤,并消化以通过流式细胞术进行免疫细胞分析。cd45+细胞是总免疫细胞;巨噬细胞(mac)定义为cd45+cd11b+cd11c低mhcii低,嗜中性粒细胞(neu)定义为cd45+cd11b+ly6g+,树突状细胞(dc)定义为cd45+cd11b+cd11c高mhcii高,b细胞(b)定义为cd45+b220+,nk细胞(nk)定义为cd45+nk1.1+cd16+,cd4+t细胞(cd4t)定义为cd3+cd4+cd8-,cd8+t细胞(cd8t)定义为cd3+cd8+cd4-,cd8效应t细胞(cd8teff)定义为cd3+cd8+cd4-cd62l-cd44+。*,p<0.05,学生t-检验(图17)。
适应性免疫细胞有助于elane的治疗功效。向c57bl/6背景(无适应性免疫)的rag2缺陷(rag2-/-)小鼠和野生型(wt)c57bl/6小鼠注射e0771癌细胞。肿瘤达到约100mm3后,每天一次肿瘤内递送elane(11.6μg)或hsa(11.6μg),持续5天。(图18a)用卡尺评估肿瘤体积。(图18b)绘制kaplan-meier曲线,将对数秩检验(mentel-cox方法)用于生存分析。生存终点定义为肿瘤体积>1000mm3。
肿瘤内递送的elane诱导了远位效应。(图19a)将e0771癌细胞注射入c57bl/6小鼠的左侧(50万个细胞)和右侧(40万个细胞)乳腺脂肪垫中。左侧中肿瘤达到约100mm3后,每天一次肿瘤内注射elane(11.6μg)或经pmsf灭活的elane(pmsf-elane)至左侧肿瘤,持续5天。n=10只小鼠/组。在肿瘤的右侧(远处侧)未执行任何操作。用卡尺测量两侧的肿瘤体积。(图19b)为了消除由于elane从左向右溢出而引起的远位效应的可能性,仅将e0771癌细胞注射到c57bl/6小鼠的左乳脂肪垫中,并且每天用elane(11.6μg)或pmsf-elane注入右乳脂肪垫中对小鼠进行治疗。用卡尺测量肿瘤体积。结果显示,当将elane注射到对侧(无肿瘤)乳腺脂肪垫中时,不会降低肿瘤的生长。
肿瘤内递送的elane在tnbc小鼠模型中具有抗pdl1的功效。将e0771癌细胞注射入c57bl/6小鼠。肿瘤达到约100mm3后,将小鼠随机分为四组:elane(11.6μg)、经pmsf灭活的elane(pmsf-elane)、抗pd-l1(bioxcell,10f.9g2,100μg)和elane(11.6μg)+抗pd-l1(100μg)。n=8只至9只小鼠/组。在肿瘤接种后第10天、14天、18天和22天腹膜内注射抗pd-l1单克隆抗体。当肿瘤达到约80mm3(癌细胞注射后约14天),肿瘤内递送elane或pmsf-elane。(图20a)用卡尺测量肿瘤体积。(图20b)绘制kaplan-meier曲线,将对数秩检验(mentel-cox方法)用于小鼠的生存分析。生存终点定义为肿瘤体积>1000mm3。*,p<0.05,学生t-检验。
猪胰蛋白酶(ppe)显示出对α对抗胰蛋白酶(a1at)或血清封闭的敏感性较低。测量了各种剂量下纯化的天然elane或纯化的天然ppe的弹性蛋白酶活性。还测试了对mda-mb-231癌细胞相应的杀伤能力。治疗后6小时通过钙黄绿素am染色评估杀伤。将纯化的天然elane(40nm)或纯化的天然ppe(80nm)与不同浓度的a1at一起孵育15分钟,然后进行弹性蛋白酶活性测试和对mda-mb-231的杀伤能力测试。治疗后6小时通过钙黄绿素am染色评估杀伤。将纯化的天然elane(40nm)或纯化的天然ppe(80nm)与不同浓度的胎牛血清(fbs)一起孵育15分钟,然后进行弹性蛋白酶活性测试和对mda-mb-231的杀伤能力测试。治疗后6小时通过钙黄绿素am染色评估杀伤。
序列表
<110>芝加哥大学
<120>用于治疗癌症的方法和组合物
<130>arcd.p0633wo
<150>62/520325
<151>2017-06-15
<150>62/610,711
<151>2017-12-27
<160>8
<170>siposequencelisting1.0
<210>1
<211>160
<212>prt
<213>智人(homosapiens)
<400>1
metvalprolysleuphethrserglnilecysleuleuleuleuleu
151015
glyleumetglyvalgluglyserleuhisalaargproproglnphe
202530
thrargalaglntrpphealaileglnhisileserleuasnpropro
354045
argcysthrilealametargalaileasnasntyrargtrpargcys
505560
lysasnglnasnthrpheleuargthrthrphealaasnvalvalasn
65707580
valcysglyasnglnserileargcysprohisasnargthrleuasn
859095
asncyshisargserargpheargvalproleuleuhiscysaspleu
100105110
ileasnproglyalaglnasnileserasncysthrtyralaasparg
115120125
proglyargargphetyrvalvalalacysaspasnargaspproarg
130135140
aspserproargtyrprovalvalprovalhisleuaspthrthrile
145150155160
<210>2
<211>267
<212>prt
<213>智人(homosapiens)
<400>2
metthrleuglyargargleualacysleupheleualacysvalleu
151015
proalaleuleuleuglyglythralaleualasergluilevalgly
202530
glyargargalaargprohisalatrpprophemetvalserleugln
354045
leuargglyglyhisphecysglyalathrleuilealaproasnphe
505560
valmetseralaalahiscysvalalaasnvalasnvalargalaval
65707580
argvalvalleuglyalahisasnleuserargarggluprothrarg
859095
glnvalphealavalglnargilephegluasnglytyraspproval
100105110
asnleuleuasnaspilevalileleuglnleuasnglyseralathr
115120125
ileasnalaasnvalglnvalalaglnleuproalaglnglyargarg
130135140
leuglyasnglyvalglncysleualametglytrpglyleuleugly
145150155160
argasnargglyilealaservalleuglngluleuasnvalthrval
165170175
valthrserleucysargargserasnvalcysthrleuvalarggly
180185190
argglnalaglyvalcyspheglyaspserglyserproleuvalcys
195200205
asnglyleuilehisglyilealaserphevalargglyglycysala
210215220
serglyleutyrproaspalaphealaprovalalaglnphevalasn
225230235240
trpileaspserileileglnargsergluaspasnprocysprohis
245250255
proargaspproaspproalaserargthrhis
260265
<210>3
<211>255
<212>prt
<213>智人(homosapiens)
<400>3
metglnproleuleuleuleuleualapheleuleuprothrglyala
151015
glualaglygluileileglyglyarggluserargprohisserarg
202530
protyrmetalatyrleuglnileglnserproalaglyglnserarg
354045
cysglyglypheleuvalarggluaspphevalleuthralaalahis
505560
cystrpglyserasnileasnvalthrleuglyalahisasnilegln
65707580
argarggluasnthrglnglnhisilethralaargargalailearg
859095
hisproglntyrasnglnargthrileglnasnaspilemetleuleu
100105110
glnleuserargargvalargargasnargasnvalasnprovalala
115120125
leuproargalaglngluglyleuargproglythrleucysthrval
130135140
alaglytrpglyargvalsermetargargglythraspthrleuarg
145150155160
gluvalglnleuargvalglnargaspargglncysleuargilephe
165170175
glysertyraspproargargglnilecysvalglyaspargargglu
180185190
arglysalaalaphelysglyaspserglyglyproleuleucysasn
195200205
asnvalalahisglyilevalsertyrglylysserserglyvalpro
210215220
progluvalphethrargvalserserpheleuprotrpileargthr
225230235240
thrmetargserphelysleuleuaspglnmetgluthrproleu
245250255
<210>4
<211>256
<212>prt
<213>智人(homosapiens)
<400>4
metalahisargproproserproalaleualaservalleuleuala
151015
leuleuleuserglyalaalaargalaalagluilevalglyglyhis
202530
glualaglnprohisserargprotyrmetalaserleuglnmetarg
354045
glyasnproglyserhisphecysglyglythrleuilehisproser
505560
phevalleuthralaalahiscysleuargaspileproglnargleu
65707580
valasnvalvalleuglyalahisasnvalargthrglngluprothr
859095
glnglnhispheservalalaglnvalpheleuasnasntyraspala
100105110
gluasnlysleuasnaspvalleuleuileglnleuserserproala
115120125
asnleuseralaservalalathrvalglnleuproglnglnaspgln
130135140
provalprohisglythrglncysleualametglytrpglyargval
145150155160
glyalahisaspproproalaglnvalleuglngluleuasnvalthr
165170175
valvalthrphephecysargprohisasnilecysthrphevalpro
180185190
argarglysalaglyilecyspheglyaspserglyglyproleuile
195200205
cysaspglyileileglnglyileaspserphevaliletrpglycys
210215220
alathrargleupheproaspphephethrargvalalaleutyrval
225230235240
asptrpileargserthrleuargargvalglualalysglyargpro
245250255
<210>5
<211>265
<212>prt
<213>小白鼠(musmusculus)
<400>5
metalaleuglyargleuserserargthrleualaalametleuleu
151015
alaleupheleuglyglyproalaleualasergluilevalglygly
202530
argproalaargprohisalatrpprophemetalaserleuglnarg
354045
argglyglyhisphecysglyalathrleuilealaargasnpheval
505560
metseralaalahiscysvalasnglyleuasnpheargservalgln
65707580
valvalleuglyalahisaspleuargargglngluargthrarggln
859095
thrpheservalglnargilephegluasnglypheaspprosergln
100105110
leuleuasnaspilevalileileglnleuasnglyseralathrile
115120125
asnalaasnvalglnvalalaglnleuproalaglnglyglnglyval
130135140
glyaspargthrprocysleualametglytrpglyargleuglythr
145150155160
asnargproserproservalleuglngluleuasnvalthrvalval
165170175
thrasnmetcysargargargvalasnvalcysthrleuvalproarg
180185190
argglnalaglyilecyspheglyaspserglyglyproleuvalcys
195200205
asnasnleuvalglnglyileaspserpheileargglyglycysgly
210215220
serglyleutyrproaspalaphealaprovalalagluphealaasp
225230235240
trpileasnserileileargserhisasnasphisleuleuthrhis
245250255
prolysasparggluglyargthrasn
260265
<210>6
<211>266
<212>prt
<213>欧亚野猪(susscrofa)
<400>6
metleuargleuleuvalvalalaserleuvalleutyrglyhisser
151015
thrglnasppheprogluthrasnalaargvalvalglyglythrglu
202530
alaglnargasnsertrpproserglnileserleuglntyrargser
354045
glysersertrpalahisthrcysglyglythrleuileargglnasn
505560
trpvalmetthralaalahiscysvalasparggluleuthrphearg
65707580
valvalvalglygluhisasnleuasnglnasnaspglythrglugln
859095
tyrvalglyvalglnlysilevalvalhisprotyrtrpasnthrasp
100105110
aspvalalaalaglytyraspilealaleuleuargleualaglnser
115120125
valthrleuasnsertyrvalglnleuglyvalleuproargalagly
130135140
thrileleualaasnasnserprocystyrilethrglytrpglyleu
145150155160
thrargthrasnglyglnleualaglnthrleuglnglnalatyrleu
165170175
prothrvalasptyralailecyssersersersertyrtrpglyser
180185190
thrvallysasnsermetvalcysalaglyglyaspglyvalargser
195200205
glycysglnglyaspserglyglyproleuhiscysleuvalasngly
210215220
glntyralavalhisglyvalthrserphevalserargleuglycys
225230235240
asnvalthrarglysprothrvalphethrargvalseralatyrile
245250255
sertrpileasnasnvalilealaserasn
260265
<210>7
<211>266
<212>prt
<213>小白鼠(musmusculus)
<400>7
metleuargpheleuvalphealaserleuvalleucysglyhisser
151015
thrgluaspvalprogluthraspalaargvalvalglyglyalaglu
202530
alaargargasnsertrpproserglnileserleuglntyrglntyr
354045
glyglysertrphishisthrcysglyglythrleuileargserasn
505560
trpvalmetthralaalahiscysvalaspserprometthrtyrarg
65707580
valvalvalglygluhisasnleuserglnasnaspglythrglugln
859095
tyrvalasnvalglnlysilevalserhisprotyrtrpasnlysasn
100105110
asnvalvalalaglytyraspilealaleuleuargleualalysser
115120125
valthrleuasnasntyrvalglnleuglyvalleuproargglugly
130135140
thrileleualaasnasnserprocystyrilethrglytrpglyarg
145150155160
thrargthrasnglygluleualaglnthrleuglnglnalatyrleu
165170175
proservalsertyrserilecyssersersersertyrtrpglyser
180185190
servallysasnthrmetvalcysalaglyglyaspglyvalargser
195200205
glycysglnglyaspserglyglyproleuhiscysmetvalasngly
210215220
glntyralavalhisglyvalthrserphevalsersermetglycys
225230235240
asnvalalaarglysprothrvalphethrargvalseralatyrile
245250255
sertrpmetasnasnvalilealaserasn
260265
<210>8
<211>269
<212>prt
<213>褐家鼠(rattusnorvegicus)
<400>8
metleuargpheleuvalphealaserleuvalleutyrglyhisser
151015
thrglnasppheprogluthrasnalaargvalvalglyglyalaglu
202530
alaargargasnsertrpproserglnileserleuglntyrleuser
354045
glyglysertrptyrhisthrcysglyglythrleuileargargasn
505560
trpvalmetthralaalahiscysvalserserglnmetthrphearg
65707580
valvalvalglyasphisasnleuserglnasnaspglythrglugln
859095
tyrvalservalglnlysilevalvalhisproasntrpasnserasn
100105110
asnvalalaalaglytyraspilealaleuleuargleualaglnser
115120125
valthrleuasnasntyrvalglnleualavalleuproglnglugly
130135140
thrileleualaasnasnasnprocystyrilethrglytrpglyarg
145150155160
thrargthrasnglyglnleuserglnthrleuglnglnalatyrleu
165170175
proservalasptyrserilecyssersersersertyrtrpglyser
180185190
thrvallysthrthrmetvalcysalaglyglyaspglyvalargser
195200205
glycysglnglyaspserglyglyproleuhiscysleuvalasngly
210215220
glntyrservalhisglyvalthrserphevalsersermetglycys
225230235240
asnvalserarglysprothrvalphethrargvalseralatyrile
245250255
sertrpmetasnasnvalilealatyrasnserglugln
260265
- 还没有人留言评论。精彩留言会获得点赞!