包含FGFR选择性酪氨酸激酶抑制剂的药物组合物的制作方法
本发明涉及一种药物组合物,所述药物组合物包含fgfr选择性酪氨酸激酶抑制剂,具体为5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺或其药学上可接受的盐。
背景技术:
所述化合物由式(i)表示:
[化学式1]
被认为是5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺(下文中称作“化合物a”)。据报道,化合物a对成纤维细胞生长因子受体(fgfr)1、2和3有抑制活性,且对胃癌、肺癌、膀胱癌、子宫内膜癌(ptl1)、以及胆管癌(ptl2)和乳腺癌(ptl3)有细胞生长抑制活性。
引证文献清单
专利文献
[ptl1]us2014-235614
[ptl2]wo/2016/152907
[ptl3]wo/2017/104739
技术实现要素:
技术问题
化合物a在人类受试者中的药代动力学(下文中称作“pk”)与对其预期的治疗有效量之间的关系尚不清楚。
此外,尽管6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺(下文中称作“化合物b”)的结构和其在临床前模型中的fgfr抑制活性已在ptl1中公开,尚不知道当化合物a施用于人类受试者时,化合物a在体内会代谢生成化合物b。化合物b由式(ii)表示:
[化学式2]
问题的解決方案
本发明的目的是提供一种药物组合物,所述药物组合物包含治疗有效量的化合物a或其药学上可接受的盐。
本发明涉及以下<1>至<22>。
<1>一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述化合物a是由式(i)表示的5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺:
[化学式3]
<2>如<1>所述的口服剂型,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约28ng/ml至约3.5×102ng/ml的平均cmax。
<3>如<1>所述的口服剂型,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.2×102h*ng/ml至约7.2×103h*ng/ml的平均auc(0-t)。
<4>如<1>所述的口服剂型,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.3×102h*ng/ml至约7.4×103h*ng/ml的平均auc(0-inf)。
<5>如<1>所述的口服剂型,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到化合物b的从约19ng/ml至约1.0×102ng/ml的平均cmax,且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺:
[化学式4]
<6>如<1>所述的口服剂型,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到化合物b的从约2.7×102h*ng/ml至约1.6×103h*ng/ml的平均auc(0-t),且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)_1h-吲哚-1-甲酰胺:
[化学式5]
<7>如<1>所述的口服剂型,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到化合物b的从约2.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-inf),且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺:
[化学式6]
<8>一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量为约30mg至约140mg的单次每日剂量,且所述化合物a是由式(i)表示的5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺:
[化学式7]
<9>如<8>所述的口服剂型,其中在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约28ng/ml至约3.5×102ng/ml的平均cmax。
<10>如<8>所述的口服剂型,其中在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约7.2×103h*ng/ml的平均auc(0-t)。
<11>如<8>所述的口服剂型,其中在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约7.4×103h*ng/ml的平均auc(0-inf)。
<12>如<8>所述的口服剂型,其中在施用于人类受试者后所述单次每日剂量达到化合物b的从约19ng/ml至约1.0×102ng/ml的平均cmax,且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺:
[化学式8]
<13>如<8>所述的口服剂型,其中在施用于人类受试者后所述单次每日剂量达到化合物b的从约2.7×102h*ng/ml至约1.6×103h*ng/ml的平均auc(0-t),且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺:
[化学式9]
<14>如<8>所述的口服剂型,其中在施用于人类受试者后所述单次每日剂量达到化合物b的从约2.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-inf),且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺:
[化学式10]
<15>如<1>或<14>所述的口服剂型,其中所述口服剂型用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌。
<16>一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括口服向有需要的人类受试者施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量为约30mg至约140mg的单次每日剂量,并且所述化合物a是由式(i)表示的5-((2-(4-(1-(2-羟乙基)哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-6-(2-甲氧基乙氧基)-n-甲基-1h-吲哚-1-甲酰胺:
[化学式11]
<17>如<16>所述的方法,其中所述单次每日剂量的所述化合物a施用于人类受试者后cmax值达到从约28ng/ml至约3.5×102ng/ml。
<18>如<16>所述的方法,其中所述单次每日剂量的所述化合物a施用于人类受试者后auc(0-t)值达到从约2.2×102h*ng/ml至约7.2×103h*ng/ml。
<19>如<16>所述的方法,其中在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约7.4×103h*ng/ml的auc(0-inf)。
<20>如<16>所述的方法,其中在施用于人类受试者后所述单次每日剂量达到化合物b的从约19ng/ml至约1.0×102ng/ml的平均cmax,且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺:
[化学式12]
<21>如<16>所述的方法,其中在施用于人类受试者后所述单次每日剂量达到化合物b的从约2.7×102h*ng/ml至约1.6×103h*ng/ml的平均auc(0-t),且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺:
[化学式13]
<22>如<16>所述的方法,其中在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-inf),且所述化合物b是由式(ii)表示的6-(2-甲氧基乙氧基)-n-甲基-5-((2-(4-(哌啶-4-基)苯甲酰胺)吡啶-4-基)氧基)-1h-吲哚-1-甲酰胺:
[化学式14]
附图说明
[图1]图1示出了单剂量化合物a后,化合物a的血浆浓度分布图。
[图2]图2示出了重复剂量化合物a后,化合物a的血浆浓度分布图。
[图3]图3示出了在施用化合物a之前(左)和施用第3周期第1天(右),fgfr2基因扩增弥漫型胃癌患者的ct图像。
[图4]图4示出了pd标志物在第1周期第15天自基线的百分比变化。左:磷酸盐,中间:fgf23,和右:1,25-二羟基维生素d3。
具体实施方式
i.定义
为了能够更充分地理解本文所描述的发明,出于本公开的目的而提供以下定义:
术语“有效量”是指能够在有需要的人类受试者中实现治疗作用的化合物a的量。
术语“人类受试者”应意指正常健康的男性或女性志愿者,和/或表现出癌症临床体征或症状的任何个体。
表述“生物等效的”或“生物等效性”是本领域的术语,并且旨在根据由美国卫生和人类服务部(u.sdepartmentofhealthandhumanservices)出版的第34版《具有治疗等效性评价的经批准药物产品》(approveddrugproductswiththerapeuticequivalenceevaluations)(通常被称为“橙皮书”)来定义。相同药品的不同配制品的生物等效性涉及药物吸收的速率和程度的等效性。将测试配制品的吸收程度和速率与参考配制品进行比较,以便确定两种配制品是否是生物等效的。标准生物等效性研究以交叉方式通过广泛测试进行,包括施用于多名志愿者(通常为12至24名健康正常成人)单次剂量的测试药物和参考药物,然后随时间测量药物的血液或血浆水平。用于建立具有参考配制品的生物等效性的配制品的详细指导原则已由美国食品药品管理局通用药品办事处(fdaofficeofgenericdrugs)的生物等效性部门(divisionofbioequivalence)出版。
其pk参数(例如cmax、auc或tmax)相差-20%/+25%或更小的两种配制品通常被认为是“生物等效的”。另一种平均生物等效性的方法涉及测试产品和参考产品的测量值的平均值(群体几何平均值)比率的90%置信区间的计算。为了建立生物等效性,计算的置信区间通常应该在产品平均值比率的80%-125%之间。除了这种一般方法,其他方法包括(1)药代动力学数据的对数转换,(2)评估序列效应的方法和(3)评估异常值数据的方法,可能有助于建立生物等效性。例如,在上述(1)中,置信区间通常应该在对数转换的pk参数的平均值的差的80%-125%之间。
术语“一种或多种剂型”应意指施用药品(活性药物成分(api))的方式,或者促进药物向患者和其他哺乳动物给药、施用和递送的方式。剂型根据施用途径和施用部位进行分类,包括例如口服、局部、直肠、阴道、静脉内、皮下、肌内、眼部、鼻部、耳部和吸入施用。可替代地,剂型根据物理形式进行分类,例如固体、半固体或液体。此外,剂型根据它们的形式、功能和特征进行细分,包括但不限于片剂、胶囊剂或注射剂,如在日本药典(japanesepharmacopoeia)第16版(jp16)或美国药典-nf(u.s.pharmacopoeia-nf)(37)(usp37)中的通则(generalchapter)<1151>药物剂型(pharmaceuticaldosageforms)的专论中所述。
术语“赋形剂”应意指典型地非活性成分,其用作载体(例如水、胶囊壳等)、稀释剂或构成剂型或药物组合物(包含药物例如治疗剂)的组分。所述术语还包括典型地非活性成分,其赋予组合物凝聚功能(即粘合剂)、崩解功能(即崩解剂)、润滑功能(润滑剂)和/或其他功能(即溶剂、表面活性剂等)。
术语“平均值”是指算数平均值。药代动力学参数例如“平均cmax”或“平均auc”是指cmax或auc的算术平均值。
本申请中使用的术语的缩写和定义的列表如下。
auc:血浆浓度-时间曲线下面积
auc(0-t):从时间零到最后可计量浓度时间的血浆浓度-时间曲线下面积
auc(0-inf):从时间零到无穷大时间的血浆浓度-时间曲线下面积
cl/f:血管外(如口服)施用后的表观总清除率
cmax:最大观测浓度
t1/2:终端消除半衰期
tmax:施用药物后达到最大(峰值)浓度的时间
vz/f:末期表观分布体积
术语“约”,除非另有说明,是指不超过被所述术语修饰的值的10%以上或以下的值。例如,术语“约30mg”是指从27mg到33mg的范围。
所述口服剂型中包含的化合物a或其药学上可接受的盐的量表示为游离形式的化合物a的量。例如,术语“包含约30mg化合物a或其药学上可接受的盐的口服剂型”意指口服剂型包含等同于约30mg游离形式化合物a的化合物a或其药学上可接受的盐。当口服剂型呈包含特定量的化合物a或其药学上可接受的盐的剂量单位形式(如片剂和胶囊剂)时,一个或多个剂量单位可以提供包含在口服剂型中的化合物a或其药学上可接受的盐的量。例如,术语“包含约30mg化合物a或其药学上可接受的盐的口服剂型”意指包含在一个剂量单位中的化合物a或其药学上可接受的盐的量可以是约30mg,或两个或更多个剂量单位中化合物a或其药学上可接受的盐的量可以是总共约30mg。
ii.实施例的描述
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约28ng/ml至约3.5×102ng/ml的平均cmax。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约28ng/ml至约2.3×102ng/ml的平均cmax。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.2×102h*ng/ml至约7.2×103h*ng/ml的平均auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.2×102h*ng/ml至约4.0×103h*ng/ml的平均auc(0-t)。在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.2×102h*ng/ml至约3.9×103h*ng/ml的平均年auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.3×102h*ng/ml至约7.4×103h*ng/ml的平均auc(0-inf)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.3×102h*ng/ml至约4.1×103h*ng/ml的平均auc(0-inf)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.3×102h*ng/ml至约4.0×103h*ng/ml的平均auc(0-inf)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约19ng/ml至约1.0×102ng/ml的平均cmax。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约19ng/ml至约64ng/ml的平均cmax。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约2.7×102h*ng/ml至约1.6×103h*ng/ml的平均auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约2.7×102h*ng/ml至约1.4×103h*ng/ml的平均auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约2.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-inf)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约2.9×102h*ng/ml至约1.5×103h*ng/ml的平均auc(0-inf)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约13ng/ml至约5.5×102ng/ml的平均cmax。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约13ng/ml至约3.8×102ng/ml的平均cmax。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约1.5×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约1.6×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约1.5×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约1.6×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物b的从约12ng/ml至约1.6×102ng/ml的平均cmax。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物b的从约12ng/ml至约1.1×102ng/ml的平均cmax。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物b的从约1.9×102h*ng/ml至约2.1×103h*ng/ml的平均auc(0-t)。
在一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物b的从约1.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约28ng/ml至约3.5×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约28ng/ml至约2.3×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.2×102h*ng/ml至约7.2×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.2×102h*ng/ml至约4.0×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.2×102h*ng/ml至约3.9×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.3×102h*ng/ml至约7.4×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.3×102h*ng/ml至约4.1×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物a的从约2.3×102h*ng/ml至约4.0×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约19ng/ml至约1.0×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约19ng/ml至约64ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约2.7×102h*ng/ml至约1.6×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约2.7×102h*ng/ml至约1.4×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约2.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后单次每日剂量的所述口服剂型达到所述化合物b的从约2.9×102h*ng/ml至约1.5×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约13ng/ml至约5.5×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约13ng/ml至约3.8×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约1.5×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约1.6×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约1.5×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物a的从约1.6×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物b的从约12ng/ml至约1.6×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物b的从约12ng/ml至约1.1×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物b的从约1.9×102h*ng/ml至约2.1×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含约30mg至约140mg化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中在施用于人类受试者后重复的每日一次剂量的所述口服剂型达到所述化合物b的从约1.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约28ng/ml至约3.5×102ng/ml的平均cmax。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约28ng/ml至约2.3×102ng/ml的平均cmax。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约7.2×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约4.0×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约3.9×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约7.4×103h*ng/ml的平均auc(0-inf)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约4.1×103h*ng/ml的平均auc(0-inf)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约4.0×103h*ng/ml的平均auc(0-inf)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约19ng/ml至约1.0×102ng/ml的平均cmax。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约19ng/ml至约64ng/ml的平均cmax。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.7×102h*ng/ml至约1.6×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.7×102h*ng/ml至约1.4×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-inf)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.9×102h*ng/ml至约1.5×103h*ng/ml的平均auc(0-inf)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约13ng/ml至约5.5×102ng/ml的平均cmax。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约13ng/ml至约3.8×102ng/ml的平均cmax。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.5×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.6×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.5×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.6×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约12ng/ml至约1.6×102ng/ml的平均cmax。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约12ng/ml至约1.1×102ng/ml的平均cmax。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约1.9×102h*ng/ml至约2.1×103h*ng/ml的平均auc(0-t)。
在另一个实施例中,本发明提供了一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约1.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约28ng/ml至约3.5×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约28ng/ml至约2.3×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约7.2×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含包括治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约4.0×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含包括治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约3.9×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约7.4×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约4.1×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约4.0×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约19ng/ml至约1.0×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约19ng/ml至约64ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含包括治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.7×102h*ng/ml至约1.6×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含包括治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.7×102h*ng/ml至约1.4×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.9×102h*ng/ml至约1.5×103h*ng/ml的平均auc(0-inf)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约13ng/ml至约5.5×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约13ng/ml至约3.8×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.5×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.6×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.5×102h*ng/ml至约4.7×103h*ng/ml的平均auc(n-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.6×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约12ng/ml至约1.6×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约12ng/ml至约1.1×102ng/ml的平均cmax。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约1.9×102h*ng/ml至约2.1×103h*ng/ml的平均auc(0-t)。
在另外的实施例中,本发明提供了一种用于治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约1.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约28ng/ml至约3.5×102ng/ml的cmax。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约28ng/ml至约2.3×102ng/ml的cmax。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约7.2×103h*ng/ml的auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约4.0×103h*ng/ml的auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.2×102h*ng/ml至约3.9×103h*ng/ml的auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约7.4×103h*ng/ml的auc(0-inf)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约4.1×103h*ng/ml的auc(0-inf)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物a的从约2.3×102h*ng/ml至约4.0×103h*ng/ml的auc(0-inf)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约19ng/ml至约1.0×102ng/ml的cmax。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约19ng/ml至约64ng/ml的cmax。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.7×102h*ng/ml至约1.6×103h*ng/ml的auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.7×102h*ng/ml至约1.4×103h*ng/ml的auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.9×102h*ng/ml至约1.7×103h*ng/ml的auc(0-inf)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至约140mg的单次每日剂量,且在施用于人类受试者后所述单次每日剂量达到所述化合物b的从约2.9×102h*ng/ml至约1.5×103h*ng/ml的auc(0-inf)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约13ng/ml至约5.5×102ng/ml的平均cmax。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约13ng/ml至约3.8×102ng/ml的平均cmax。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.5×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.6×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.5×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物a的从约1.6×102h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约12ng/ml至约1.6×102ng/ml的平均cmax。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约12ng/ml至约1.1×102ng/ml的平均cmax。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约1.9×102h*ng/ml至约2.1×103h*ng/ml的平均auc(0-t)。
在又另一个实施例中,本发明提供了一种治疗胃癌、肺癌、膀胱癌、子宫内膜癌、胆管癌或乳腺癌的方法,所述方法包括向有需要的人类受试者口服施用一种口服剂型,所述口服剂型包含治疗有效量的化合物a或其药学上可接受的盐以及至少一种药学上可接受的赋形剂,其中所述治疗有效量是约30mg至140mg的重复的每日一次剂量,且在施用于人类受试者后所述重复的每日一次剂量达到所述化合物b的从约1.9×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-t)。
在本发明中,所述口服剂型可以包含约30mg至约140mg、约35mg至约140mg、约60mg至约140mg、约70mg至约140mg、约100mg至约140mg、或105mg至约140mg化合物a或其药学上可接受的盐。在本发明中,化合物a或其药学上可接受的盐的治疗有效量可以是约30mg至约140mg、约35mg至约140mg、约60mg至约140mg、约70mg至约140mg、约100mg至约140mg、或105mg至约140mg的单次每日剂量。在本发明中,化合物a或其药学上可接受的盐的治疗有效量可以是约30mg至约140mg、约35mg至约140mg、约60mg至约140mg、约70mg至约140mg、约100mg至约140mg、或105mg至约140mg的重复的每日一次剂量。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约34ng/ml至约3.5×102ng/ml、或从约55ng/ml至约3.5×102ng/ml的平均cmax。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约38ng/ml至约2.3×102ng/ml、或从约85ng/ml至约2.3×102ng/ml的平均cmax。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约2.7×102h*ng/ml至约7.2×103h*ng/ml、或从约6.0×102h*ng/ml至约7.2×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约5.3×102h*ng/ml至约4.0×103h*ng/ml、或从约1.0×103h*ng/ml至约4.0×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约5.2×102h*ng/ml至约3.9×103h*ng/ml、或从约1.0×103h*ng/ml至约3.9×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约3.0×102h*ng/ml至约7.4×103h*ng/ml、或从约6.4×102h*ng/ml至约7.4×103h*ng/ml的平均auc(0-inf)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约3.1×102h*ng/ml至约7.4×103h*ng/ml、或从约6.3×102h*ng/ml至约7.4×103h*ng/ml的平均auc(0-inf)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约5.5×102h*ng/ml至约4.1×103h*ng/ml、或从约1.1×103h*ng/ml至约4.1×103h*ng/ml的平均auc(0-inf)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物a的从约5.5×102h*ng/ml至约4.0×103h*ng/ml、或从约1.1×103h*ng/ml至约4.0×103h*ng/ml的平均auc(0-inf)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物b的从约16ng/ml至约1.0×102ng/ml、或从约34ng/ml至约1.0×102ng/ml的平均cmax。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物b的从约35ng/ml至约64ng/ml、或从约38ng/ml至约64ng/ml的平均cmax。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物b的从约3.0×102h*ng/ml至约1.6×103h*ng/ml、或从约4.9×102h*ng/ml至约1.6×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物b的从约6.5×102h*ng/ml至约1.4×103h*ng/ml、或从约6.4×102h*ng/ml至约1.4×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物b的从约3.3×102h*ng/ml至约1.7×103h*ng/ml、或从约5.3×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-inf)。
在本发明中,在施用于人类受试者后单次每日剂量的所述口服剂型可以达到所述化合物b的从约6.8×102h*ng/ml至约1.5×103h*ng/ml、或从约6.9×102h*ng/ml至约1.5×103h*ng/ml的平均auc(0-inf)。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物a的从约50ng/ml至约5.5×102ng/ml、或从约1.1×102ng/ml至约5.5×102ng/ml的平均cmax。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物a的从约50ng/ml至约3.8×102ng/ml、或从约1.1×102ng/ml至约3.8×102ng/ml的平均cmax。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物a的从约4.9×102h*ng/ml至约8.1×103h*ng/ml、或从约9.1×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物a的从约5.0×102h*ng/ml至约8.1×103h*ng/ml、或从约9.0×102h*ng/ml至约8.1×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物a的从约4.9×102h*ng/ml至约4.7×103h*ng/ml、或从约1.3×103h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物a的从约5.0×102h*ng/ml至约4.7×103h*ng/ml、或从约1.3×103h*ng/ml至约4.7×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物b的从约44ng/ml至约1.6×102ng/ml、或从约40ng/ml至约1.6×102ng/ml的平均cmax。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物b的从约44ng/ml至约1.1×102ng/ml、或从约55ng/ml至约1.1×102ng/ml的平均cmax。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物b的从约5.6×102h*ng/ml至约2.1×103h*ng/ml、或从约7.0×102h*ng/ml至约2.1×103h*ng/ml的平均auc(0-t)。
在本发明中,在施用于人类受试者后重复的每日一次剂量的所述口服剂型可以达到所述化合物b的从约5.6×102h*ng/ml至约1.7×103h*ng/ml、或从约8.0×102h*ng/ml至约1.7×103h*ng/ml的平均auc(0-t)。
在本发明中,可以通过本领域(例如us2014-235614和wo/2016/152907)中已知的方法制备化合物a。
药学上可接受的盐可以包括但不限于无机酸盐;有机羧酸盐;有机磺酸盐;氨基酸盐;季胺盐;碱金属盐;以及碱土金属盐。优选的药学上可接受的盐包括琥珀酸盐,例如1.5琥珀酸盐。
本发明的口服剂型包括胶囊剂、颗粒剂、锭剂、微丸、丸剂、粉剂、悬浮剂、片剂,优选胶囊剂、颗粒剂、微丸、丸剂、片剂。
可以使用本领域通常已知的标准技术和制造方法来制备本发明的口服剂型。参见例如日本药典(japanesepharmacopoeia)第16版或美国药典-nf(u.s.pharmacopoeia-nf)(37)中的通则(generalchapter)<1151>药物剂型(pharmaceuticaldosageforms)的专论。
实例
以下实例说明本发明的各个方面。这些实例不应被解释为以任何方式限制权利要求。
根据wo/2016/152907所描述的方法合成化合物a1.5琥珀酸。
为了评价化合物a1.5琥珀酸口服施用于实体瘤患者时的耐受性和安全性,进行了以下研究。我们试图通过评估化合物a1.5琥珀酸口服施用于实体瘤患者时的剂量限制性毒性(dlt)来确定最大耐受剂量(mtd)。实例中的每个剂量表示为游离形式化合物a的剂量。
方法
采用改良的毒性概率区间(mtpi)设计来确定化合物a的mtd。根据基于25%的目标剂量限制性毒性(dlt)率和相应的三个毒性概率区间的mtpi设计规则来给每个受试者分配化合物a的剂量,这三个毒性概率区间被定义为20%至30%(适当剂量)、0至20%(不足剂量)和30%至100%(过量剂量)。整个剂量分配决策规则可以根据mtpi设计进行预先计算,并显示在如下双向表中。
[表1]
剂量分配决策规则
e=递增到下一个更高剂量,s=保持当前剂量,d=递减到下一个更低剂量,u=当前剂量具有不可接受的毒性(即,不要重新进入当前剂量)
mtr下的目标dlt率=25%并且它的等效毒性区间=20%至30%,组群大小=2名受试者省略了当前剂量下10名以上受试者的显示
a:针对起始剂量,可以添加额外的受试者。
b:可以考虑提前结束登记。
施用方案
1)周期0(7天)
为了评估以单剂量施用时的pk,在第1天施用针对每个治疗组(那组的相应剂量)的单剂量化合物a。在至少禁食10小时醒来后,立即空腹施用化合物a。施用后2小时内禁止摄取任何膳食,只允许饮水。
2)周期1或以后(28天的周期)
第1个周期在第0个周期施用后的8至10天之间开始,且化合物a每日一次连续施用。化合物a在早餐后至少2小时施用,且施用后1小时内禁止任何食物摄取。不过,在第1个周期的第8天,受试者在经过至少10小时的过夜禁食后,醒来后立即施用化合物a,以评估pk。施用后2小时内禁止摄取任何膳食,只允许饮水。
设定起始剂量
本研究中化合物a的起始剂量是根据“抗癌药物的非临床评价(nonclinicalevaluationforanticancerpharmaceuticals)”(ichs9;pfsb/eld通知编号0604-1,日期:2010年6月4日)中的指南确定的。根据这个指南,针对许多小分子的一种常见方法是在10%的啮齿动物中设置起始剂量为1/10的严重毒性剂量(std10;剂量与致死率、危及生命的毒性或不可逆转的毒性有关),或1/6的最高非严重毒性剂量(hnstd)(在非啮齿动物是最合适的测试物种的情况下)。考虑到受试者的安全性,因此采用从对大鼠的毒性研究中计算出的1.46mg剂量(大鼠对毒性高度敏感),并且将本研究中的起始剂量设定为1mg(低于1.46mg剂量的剂量)。
入选标准
(1)在知情同意时受试者年龄>=20岁
(2)患有组织学和/或细胞学诊断出的实体瘤的受试者
(3)标准治疗失败或没有适当治疗的受试者。
(4)校正后血清钙<=uln
(5)血清磷酸盐<=uln
(6)由美国东部肿瘤协作组(easterncooperativeoncologygroup,ecog)确定的体能状态(performancestatus,ps)评分为0-1的受试者
排除标准
(1)与临床症状相关的或需要治疗的脑转移受试者
(2)有临床意义的心血管损害病史
(3)目前有>=2级的角膜疾病的证据或病史
dlt标准
(1)持续7天以上的4级中性粒细胞减少症或发热性中性粒细胞减少症
(2)需要输血的4级血小板减少症或3级血小板减少症
(3)任何3级或更高的非血液学毒性,除了:
a)无临床意义的异常临床实验室值。
b)可以通过最大程度的医学管理来管理和控制到2级或以下的任何事件。
(4)影像学证实的在诸如软组织、肾、肠、心、肺等中被认为有临床意义的新钙化
(5)高磷血症,其定义如下
a)>7mg/dl>7d,尽管采用了磷酸盐降低疗法
b)>9mg/dl,尽管采用了磷酸盐降低疗法。
(6)被认为与化合物a有关的、以及需要从第0周期到第1周期治疗中断8天或更久的任何毒性的发展。
结果
患者特征
[表2]
剂量递增研究概要
在每日一次剂量的化合物a治疗的患者中:1mg(2名患者)、2mg(2名患者)、4mg(2名患者)、8mg(2名患者)、16mg(2名患者)、30mg(2名患者)、60mg(3名患者)、100mg(3名患者)、140mg(3名患者)和180mg(3名患者),180mg剂量的一名患者出现dlt(3级ast/alt升高)。未定义mtd,推荐剂量确定为每日一次140mg。
治疗引起的不良事件(>=5%)如下表所示。
[表3]
在3名患者中出现严重不良事件(8mg组群中1名患者呼吸困难,8mg组群中的1名患者肿瘤疼痛加重,以及30mg组群中的1名患者发热)。不过,这些症状都不被认为与化合物a有关。
没有导致研究药物停药的死亡或不良事件的报告。
导致剂量降低的不良事件有alt升高(2名患者)、掌跖感觉丧失性红斑综合征(2名患者)和ast升高(1名患者)。
导致剂量中断的不良事件是恶心(3名患者)、呕吐(2名患者)、厌食(2名患者)、发热(2名患者)、感冒(1名患者)、中性粒细胞计数减少(1名患者)、黄斑水肿(1名患者)和掌跖感觉丧失性红斑综合征(1名患者)。
药代动力学
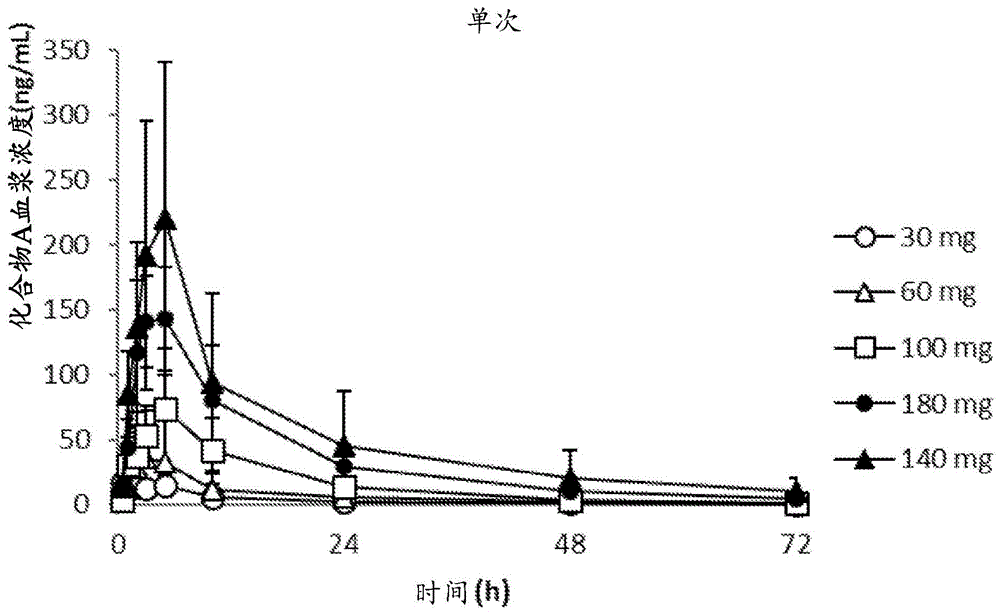
在单剂量和重复剂量的化合物a1.5琥珀酸盐之后,化合物a的血浆浓度分布分别如图1和图2所示。图2所示的分布图是在稳定状态下的分布图。
下表显示了在单剂量和重复剂量的化合物a1.5琥珀酸盐之后,化合物a的药代动力学参数。如下所示的在重复剂量的化合物a1.5琥珀酸盐之后的化合物a的药代动力学参数是稳定状态下的药代动力学参数。
[表4]
cmax和acc随剂量的增加而增加,中值tmax为2-5小时,平均t1/2为15.1-26.4小时。a:n=z
在获得上述数据后更新的、单剂量和重复剂量的化合物a1.5琥珀酸盐之后的化合物a的药代动力学参数如下表所示。如下所示的在重复剂量的化合物a1.5琥珀酸盐之后的化合物a的药代动力学参数是稳定状态下的药代动力学参数。
[表5]
除tmax外,数据显示为平均值±sd:对于tmax,示出了中值(最小值-最大值)。
通过nca方法计算pk参数,使用血浆浓度的即时结果,标称时间。
cmax和auc随剂量的增加而增加,tmax中值为2-5小时,平均t1/2为15.2-26.6小时。
a:n=2
在单剂量和重复剂量的化合物a1.5琥珀酸盐之后,化合物b的药代动力学参数如下表所示。如下所示的在重复剂量的化合物a1.5琥珀酸盐之后的化合物b的药代动力学参数是稳定状态下的药代动力学参数。
[表6]
除tmax外,数据显示为平均值±sd;对于tmax,示出了中值(最小值-最大值)。
a:n=2
抗肿瘤活性
化合物a以180mg每日一次施用于患有fgfr2基因扩增扩散型胃癌(低分化腺癌)的患者(45岁女性)。患者的ct图像如图3所示。左图是施用前的图像,右图是第3周期第1天的图像。通过施用化合物a,肿瘤大小显著减小。
当将化合物a以30mg每日一次施用于患有fgfr2-融合基因阳性(78%)的肝内胆管癌患者时,肿瘤体积减小约9%。
药效动力学(pd)
在施用化合物a之前和第1个周期的第15天,测量磷酸盐、fgf23和1,25-(oh)2-维生素d(它们是fgfr途径抑制的pd标志物)的血清浓度。化合物a施用期间的浓度变化如图4所示。化合物a的施用诱导每种标志物的剂量依赖性增加,并且这些增加在每日一次给药约100-140mg时达到最大。
- 还没有人留言评论。精彩留言会获得点赞!