搭载核酸的单元型聚离子复合物的制作方法
本发明涉及一种搭载核酸的单元型聚离子复合物和包含该单元型聚离子复合物的组合物。
背景技术:
由于核酸药物可以控制细胞中的各种基因,因此,迫切期望将其应用于目前为止被认为难以治疗的癌症、遗传性疾病等各种疾病。而另一方面,由于核酸分子本身在生物体内的稳定性低,因此,核酸药物需要将其适当地递送至靶细胞的技术。例如,作为核酸递送技术,目前,有利用具有亲水性聚合物链段和阳离子性聚合物链段的嵌段共聚物,通过静电相互作用使核酸与该嵌段共聚物形成复合体(聚离子复合物)的技术。
作为通过上述现有技术得到的聚离子复合物,例如,可列举:一种分别由非特定数量的核酸与嵌段共聚物构成的聚离子复合物,在该聚离子复合物中,该嵌段共聚物使亲水性聚合物链段朝向外侧,并且使阳离子性聚合物链段朝向内侧,在包裹核酸的状态下以放射状排列(下面,有时称为“胶束型聚离子复合物”);以及一种分别由特定数量的核酸与嵌段共聚物构成的聚离子复合物,该聚离子复合物在生物体内例如在血中以稳定的结构单元体存在(下面,有时称为“单元型聚离子复合物”或“upic”)(例如,专利文献1)。
专利文献1中记载的单元型聚离子复合物具有分别由特定数量的核酸与嵌段共聚物构成的明确的结构,能够提高核酸的血中滞留性。
现有技术文献
专利文献
专利文献1:国际公开第2013/162041号小册子
技术实现要素:
发明所要解决的技术问题
在专利文献1中所记载的单元型聚离子复合物的制备中,需要谨慎地设计核酸和/或嵌段共聚物,以使来自核酸的负电荷与来自嵌段共聚物的正电荷相抵消,使单元型聚离子复合物成为电中性。
本申请发明是为了解决上述技术问题而完成的,其主要目的在于提供一种能够更简便地设计的单元型聚离子复合物。
用于解决技术问题的技术方案
根据本发明,提供了一种单元型聚离子复合物,该单元型聚离子复合物由特定数量的嵌段共聚物和特定数量的核酸构成,该特定数量的嵌段共聚物具有聚乙二醇链段和阳离子性聚氨基酸链段。在该单元型聚离子复合物中,来自该嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和不被来自该核酸的负电荷量的总和抵消;该核酸的链长为10~50个碱基长度;该聚乙二醇链段的分子量为40×103以上;该嵌段共聚物相对于该核酸的结合常数(ka)为3.0×105以上。
在一种实施方式中,上述单元型聚离子复合物由两分子的上述嵌段共聚物与一分子的上述核酸构成。
在一种实施方式中,上述核酸为双链核酸。
在一种实施方式中,上述聚乙二醇链段的分子量为60×103以上。
在一种实施方式中,上述聚乙二醇链段为双链支链型,各聚乙二醇链的分子量为20×103以上。
在一种实施方式中,上述阳离子性聚氨基酸包含鸟氨酸作为构成氨基酸。
根据本发明的另一方面,提供一种核酸递送用组合物,该核酸递送用组合物包含:上述单元型聚离子复合物;以及能够构成该单元型聚离子复合物的嵌段共聚物,该嵌段共聚物为游离的嵌段共聚物。
在一种实施方式中,上述组合物中的来自上述嵌段共聚物的氨基的摩尔浓度与来自上述核酸的磷酸基的摩尔浓度之比(n/p比)为1~20。
发明的效果
在本发明中,使用对核酸具有规定的亲和性的嵌段共聚物。令人惊奇的是,由此能够得到即使在电荷不被抵消的状态在也能够提高核酸的血中滞留性的单元型聚离子复合物。这样的单元型聚离子复合物在制备时不需要严格控制来自核酸的负电荷与来自嵌段共聚物的正电荷,因此,能够比现有的单元型聚离子复合物更简便地进行设计。
附图说明
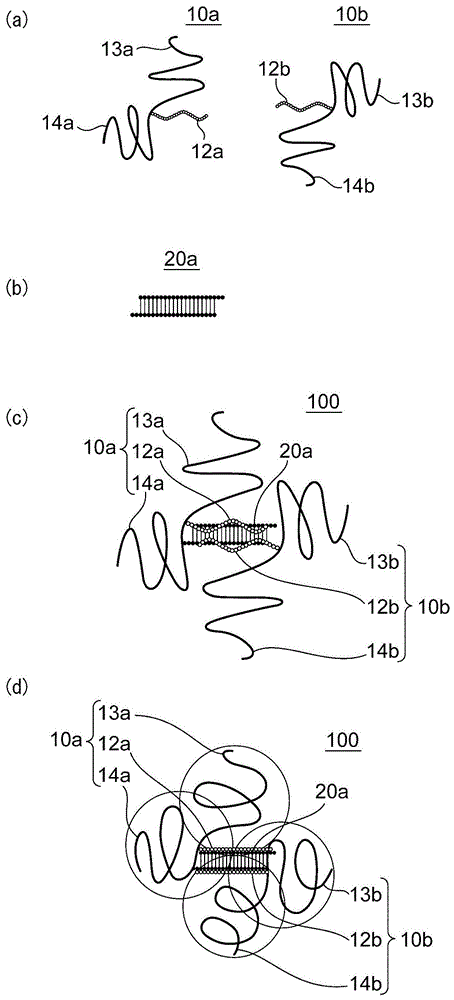
图1为对本发明的一种实施方式中的单元型聚离子复合物的构成进行说明的概略图。
图2为表示单元型聚离子复合物的平均粒径和单元型聚离子复合物中的核酸缔合数的图表。
图3为表示核酸的血中滞留性的图表。
具体实施方式
[a.单元型聚离子复合物]
根据本发明,提供一种单元型聚离子复合物,该单元型聚离子复合物由特定数量的嵌段共聚物和特定数量的核酸构成,该嵌段共聚物具有聚乙二醇链段与阳离子性聚氨基酸链段,该单元型聚离子复合物中的来自嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和不被来自核酸的负电荷量的总和抵消(结果形成没有被电中和的单元型聚离子复合物)。下面,对本发明的实施方式进行说明,但本发明不限于这些实施方式。需要说明的是,在本发明中使用的嵌段共聚物和核酸分别作为聚合反应物得到的情况下,它们会显示一定程度的多分散性。因此,在本说明书中,在提及嵌段共聚物的性能(分子量、聚合度、电荷等)以及核酸的性能(碱基长度、电荷等)时,除非另有说明,否则表示显示多分散性的所有聚合反应物的平均。因而,例如,以实际测得的阳离子性氨基酸残基的聚合度为平均聚合度,基于该平均聚合度来算出嵌段共聚物的电荷量。另外,例如,作为聚乙二醇链段的分子量,能够应用实际测得的平均分子量(例如,数均分子量)。
[a-1.第一实施方式]
[a-1-1.单元型聚离子复合物的整体构成]
图1的(a)~(d)为对本发明的第一实施方式中的upic的一个例子进行说明的概略图。具体而言,图1的(a)为本发明中能够使用的嵌段共聚物的概略图,图1的(b)为本发明中能够使用的核酸的概略图,图1的(c)为由图1的(a)的嵌段共聚物与图1的(b)的核酸构成的upic的概略图,图1的(d)为表示图1的(c)的upic中peg链段的空间扩展的概略图。
图1的(a)所示的嵌段共聚物10a、10b分别具有双链支链型的peg链段13a、14a、13b、14b与阳离子性聚氨基酸链段12a、12b。另外,图1的(b)所示的核酸20a为分别具有两个碱基的突出端的双链核酸。嵌段共聚物10a、10b与核酸20a通过来自阳离子性聚氨基酸链段12a、12b的正电荷与来自核酸20a的负电荷之间的静电相互作用而缔合,由此,形成了upic100(图1的(c))。在upic100中,嵌段共聚物10a、10b通常能够在核酸20a的主链方向上以彼此相反的朝向排列。由此,能够抑制peg链段13a、13b、14a、14b的相互重叠所造成的空间位阻。其结果,即使是具有支链型的长链peg链段的嵌段共聚物,也能够与核酸适当地静电结合而形成upic。另外,通过这样进行排列,如图1的(d)所示,四根peg链段13a、13b、14a、14b能够以覆盖核酸20a的整体的方式进行扩展,能够有助于对核酸20a的高度保护。在一种实施方式中,四根peg链段能够以使各自的端部成为大致正四面体的顶点的方式定位,核酸能够位于该正四面体内。
本实施方式的upic只要由特定数量的嵌段共聚物与特定数量的核酸构成即可,不限于上述图示例子的构成。
作为本实施方式的upic,在生理ph环境(ph=约7.4)下,来自嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量不会被来自核酸的负电荷量抵消,作为结果,没有被电中和。需要说明的是,在本说明书中,“单元型聚离子复合物中的来自嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和不被来自核酸的负电荷量的总和抵消”或“upic不被电中和”的记载表示,来自upic中所含的全部的嵌段共聚物的阳离子性聚氨基酸链段的侧链的电荷量的总和(绝对值)小于来自upic中所含的全部的核酸的电荷量的总和(绝对值)的90%或大于来自upic中所含的全部的核酸的电荷量的总和(绝对值)的110%。在upic的开发中,目前,在来自阳离子性聚氨基酸链段的侧链的正电荷与来自核酸的负电荷不抵消的情况下,存在下述担忧:upic整体上形成带电状态,静电吸引血液中的蛋白质、酶导致血中滞留性降低;带电的upic相互缔合或与嵌段共聚物和/或核酸进一步缔合而导致均匀性降低。对此,根据本发明人的研究可知,通过选择对核酸具有规定亲和性的嵌段共聚物,且采用长链的peg链段,即使是带电的upic,也能够保持其结构的稳定,能够具有优异的血中滞留性。在一种实施方式中,生理ph环境下的来自upic中的全部的嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和可以为来自upic中的全部的核酸的负电荷量的总和的45%以上且小于90%(例如50%~85%或50%~80%)。在另一种实施方式中,生理ph环境下的来自upic中的嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和可以为来自核酸的负电荷量的总和的超过110%且150%以下(例如115%~140%)。
本实施方式的upic代表性地比胶束型pic尺寸小(小型)。本实施方式的upic的粒径(流体动力学直径)优选为10nm~30nm,例如为10nm~25nm,另外例如为10nm~20nm。如此小的尺寸能够有助于将所搭载的核酸递送至组织深处。
[a-1-2.嵌段共聚物]
本实施方式中能够使用的嵌段共聚物具有peg链段和阳离子性聚氨基酸链段,对作为递送对象的核酸,具有3.0×105以上、优选5.0×105以上(例如,8.0×105以上、1.0×106以上、1.5×106以上或2.0×106以上)的结合常数(ka)。推测如下:通过使用对核酸具有上述规定的亲和性的嵌段共聚物,使得嵌段共聚物在血中难以从upic中解离,或者,即使解离也能够立即重新缔合,作为结果,即使在来自核酸的负电荷与来自嵌段共聚物的正电荷没有被抵消的状态下,也能够良好地保护核酸并得到很高的血中滞留性。另一方面,结合常数(ka)的上限值不作特别限制,但从容易实现性的观点出发,例如可以为4.0×106以下。需要说明的是,在本说明书中,嵌段共聚物也包含该嵌段共聚物的药学上可接受的盐。
上述结合常数(ka)通过下述的实施例中所记载的方法来测定。随着阳离子性聚氨基酸链段与核酸之间的静电结合变多或随着各个静电结合变强,结合常数(ka)具有增大的倾向。因此,通过调节阳离子性聚氨基酸链段的正电荷数量;适当地选择阳离子性聚氨基酸链段的构成氨基酸的种类等,能够将结合常数(ka)控制在所希望的范围。此外,一般认为在固定了嵌段共聚物的构成的情况下,结合常数(ka)主要取决于核酸的负电荷量,如果碱基长度相等,则不会由于碱基序列的差异而产生实质上的变化。
上述peg链段优选为支链型,更优选为双链支链型。当然,上述peg链段也可以为仅包含一个peg链的单链型。
上述peg链段的分子量(在支链型的情况下为各peg链的分子量的总和)为40×103以上,优选为50×103以上,更优选为60×103以上。在支链型的情况下,只要各链的分子量的总和满足上述范围,则各peg链的分子量不作限制,可以彼此相同,也可以不同。支链型的各peg链的分子量优选为10×103以上,例如可以为20×103以上、25×103以上、30×103以上或35×103以上。优选地,支链型的peg链均具有20×103以上、25×103以上、30×103以上或35×103以上的分子量。另一方面,各peg链的分子量可以分别单独地为例如80×103以下、60×103以下或50×103以下。通过使peg链段的分子量在这种范围内,即使upic为带电的状态,也能够适当保护核酸免于酶解等。另外,能够提高upic的生物相容性,并防止其被作为异物降解或排出。需要说明的是,peg链段的分子量能够通过凝胶过滤色谱(gfc)等求得,此时,能够将分子量已知的市售peg(例如,作为gfc用分子量标准物质的peg)用作分子量标记物。
作为上述阳离子性聚氨基酸链段,只要其在生理ph环境下具有所希望的正电荷,且嵌段共聚物对核酸的结合常数(ka)为3.0×105以上,则能够包含任意适当的碱性氨基酸作为构成单元。作为该碱性氨基酸,从容易实现所希望的结合常数出发,优选选自赖氨酸、鸟氨酸、2,3-二氨基丙酸和2,4-二氨基丁酸中的至少一种碱性氨基酸,其中,更优选鸟氨酸。
作为上述至少一种碱性氨基酸的数量(在包含两种以上上述碱性氨基酸的情况下,该数量为它们的总和)相对于构成上述阳离子性聚氨基酸链段的氨基酸残基总数的比例,优选为50%~100%,例如可以为80%~100%、90%~100%或100%。
只要能够得到所希望的结合常数,则上述阳离子性聚氨基酸链段还可以包含其它碱性氨基酸作为构成单元。作为其它碱性氨基酸,例如,可列举:精氨酸、组氨酸等天然碱性氨基酸、以及在酸性氨基酸侧链上引入阳离子残基而得到的氨基酸衍生物(例如,在天门冬氨酸的侧链上中引入乙二胺结构而得到的asp(det))。
来自上述阳离子性聚氨基酸链段的侧链的正电荷量(每1分子嵌段共聚物)可以根据所期望的与核酸的结合常数(ka)、upic的构成、核酸的负电荷量、碱性氨基酸残基的种类等来适当设置。该正电荷量(每1分子嵌段共聚物)的优选范围会由于核酸的负电荷量、碱性氨基酸残基的种类等变动,因此,不作限定,例如,可以为9以上、10以上或11以上的整数。从另一观点出发,该正电荷量(每1分子嵌段共聚物)同样不作限定,可以为核酸的负电荷量的22.5%以上、25%以上或27%以上。通过使用上述碱性氨基酸残基(例如,赖氨酸、鸟氨酸、2,3-二氨基丙酸或2,4-二氨基丁酸)实现这样的正电荷量,能够合适地得到对核酸具有规定值以上的结合常数(ka)的嵌段共聚物。另一方面,若该正电荷量过多,则聚合物本身的血中滞留性可能降低。因此,该正电荷量优选为50以下,例如,可以为40以下、30以下或25以下。
只要能够获得本发明的效果,则上述阳离子性聚氨基酸链段也可以包含非碱性氨基酸残基(例如,疏水性氨基酸残基)。作为非碱性氨基酸残基的数量,可以设为构成阳离子性聚氨基酸链段的氨基酸残基总数量的例如10%以下,更优选为5%以下,进一步优选为2%以下。
上述peg链段与阳离子性聚氨基酸链段通过任意适当的连接基团结合。例如,可列举:包含酯键、酰胺键、亚氨基、碳碳键、醚键等的连接基团。另外,这些链段可以经由在生物体内能够开裂的连接基团(例如,二硫键、腙键、马来酰胺酸酯(maleamate)键、缩醛基)而连接。
可以在能够得到本发明的效果的范围内,对上述嵌段共聚物的peg链段侧末端和/或阳离子性聚氨基酸链段侧末端进行任意适当的修饰。作为该修饰,例如,可列举:引入保护基、引入目标结合位点等。
上述目标结合位点可以根据目标组织或目的等而为任意适当的位点。目标结合位点例如可以通过将具有目标结合位点的化合物结合于上述嵌段共聚物的peg链段的自由末端而形成。需要说明的是,在本说明书中,目标结合位点是指具有生物识别功能的位点,该位点可以与来自生物体和病毒的物质特异性结合,从而与该物质形成生物结合对。通过引入目标结合位点,能够提高核酸到达所希望的目标位点的性能。
上述嵌段共聚物的优选的具体例子可以通过下面的通式(1)或(2)来表示。
(上述各式中,
r1a~r1d相互独立地表示氢原子、或者未取代或取代的碳原子数1~12的直链或支链烷基,
r2表示氢原子、碳原子数1~12的未取代或取代的直链或支链烷基或碳原子数1~24的未取代或取代的直链或支链烷基羰基,
r3表示羟基、碳原子数1~12的未取代或取代的直链或支链烷氧基、碳原子数2~12的未取代或取代的直链或支链烯氧基、碳原子数2~12的未取代或取代的直链或支链炔氧基、或者碳原子数1~12的未取代或取代的直链或支链烷基取代的亚氨基,
l表示二价连接基团或价键,
x1~x4相互独立地表示455~1,800的整数,
z表示9~50的整数,
w表示1~4的整数,
l和m相互独立地表示0~5的整数。)
上述式(1)或(2)中,l为二价连接基团或价键。作为二价连接基团,可以采用任意适当的连接基团。例如,式(1)中,l可以为-l1-l2-l3-,式(2)中,l可以为-l4-l5-l6-。其中,l1和l4相互独立地为-(o-(ch2)a)b-l1a-,其中,a为1~5,b为0~300的整数,b为2以上时,a无需全部相同,l1a为价键、-s-s-、-nh-、-o-、-o-ch(ch3)-o-、-oco-、-oconh-、-nhco-、-nhcoo-、-nhconh-、-conh-或coo;l2和l5相互独立地为价键或-l2a-l2b-l2c-,其中,l2a和l2c为作为间隔基(spacer)的结构,没有特别限制,例如为取代或未取代的碳原子数1~12的烷基,l2b为下述式(iii)~(v)所示结构中的任意一个;l3为-((ch2)c-o)d-(ch2)e-l3a-,其中,c为1~5,d为0~500,e为0~5的整数,d为2以上时,c无需全部相同,l3a为-nh-或-o-;l6为-((ch2)f-o)g-(ch2)h-l6a-(ch2)i-co-,其中,f为1~5,g为0~300,h为0~5,i为0~5的整数,g为2以上时,f无需全部相同,l6a为-oco-、-nhco-、-oconh-、-nhcoo-、-nhconh-、-conh-或-coo-。
作为上述r1a~r1d、r2或r3的基团中定义的碳原子数1~12的直链或支链烷氧基、烷基取代的亚氨基以及烷基的烷基部分,例如,可列举:甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、正己基、癸基和十一烷基等。作为碳原子数2~12的直链或支链烯氧基或者碳原子数2~12的直链或支链炔氧基中的烯基或炔基部分,可列举:碳原子数2以上的在上述所示例的烷基中包含双键或三键的基团。
对于这样的基团或部分,“被取代”时的取代基不作限定,示出c1-6烷氧基、芳氧基、芳基c1-3氧基、氰基、羧基、氨基、c1-6烷氧羰基、c2-7酰基酰胺基、三-c1-6烷基甲硅烷氧基、甲硅烷氧基、甲硅烷基氨基,或者,可列举:缩醛化甲酰基、甲酰基、氯或氟等卤素原子。其中,例如,“c1-6”的表达表示碳原子数1~6,下面作为表示同样意义的表达来使用。而且,作为碳原子数1~24的未取代或取代的直链或支链烷基羰基中的碳原子数1~12的未取代或取代的直链或支链烷基部分,能够参考上述示例,作为碳原子数13以上的烷基部分,例如,可列举:十三烷基、十四烷基、十五烷基、十九烷基、二十烷基和二十四烷基等。另外,该取代基可以为包含目标结合位点的基团。
z设置为使形成upic时来自嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和小于来自核酸的负电荷量的总和的90%或大于110%。另外,z可以设置为使与核酸的结合常数(ka)成为规定值以上。虽然z会根据w的值、核酸的负电荷数等产生变动,但在z为例如核酸的负电荷量的22.5%以上、25%以上或27%以上的整数的情况下,能够优选得到对核酸具有规定值以上的结合常数(ka)的嵌段共聚物。同样地,虽然z会根据w的值、核酸的负电荷数等产生变动,但在z为9以上的整数,例如10以上的整数或11以上的整数的情况下,能够优选得到对核酸具有规定值以上的结合常数(ka)的嵌段共聚物。z的上限可以为例如40以下的整数或30以下的整数。
从提高与核酸的结合常数观点出发,w优选为1~3的整数,而且,从可制造性的观点出发,更优选为3。例如,在z为14以下、特别是13以下的情况下,w为1~3的整数,例如,优选为3。w可以对所属的全部重复单元选择相同的基团,也可以对各个重复单元选择不同的基团。在选择不同的基团的情况下,各重复单元的结合顺序是任意的,可以是无规结构,也可以是嵌段结构。
表示乙二醇的重复数的x1~x4相互独立,它们的下限为例如600,另外例如700,再例如800,上限为例如1400,另外例如1200,再例如1100。
[a-1-3.核酸]
在本说明书中,核酸表示以由嘌呤或嘧啶碱基、戊糖、磷酸构成的核苷酸为基本单元的多核苷酸或寡核苷酸。例如,可以优选使用寡或聚双链rna、寡或聚双链dna、或者在相同的链上混合存在rna与dna的寡或聚双链核酸等双链核酸。该核酸中含有的核苷酸可以为天然型核苷酸,也可以为化学修饰后的非天然型核苷酸,另外,还可以添加有氨基、巯基、荧光化合物等分子。
上述核酸的链长(在双链核酸中,该链长为构成双链的部分的长度)代表性地为10~50个碱基长度,例如可以是10~30个碱基长度。
作为上述核酸,能够优选列举:sirna、mirnamimic、shrna、decoy核酸等功能性核酸。
作为上述sirna,例如,能够使用针对目标基因或多核苷酸使用任意适当的方法所设计的全部sirna。作为sirna的链长,构成双链的部分的长度能够优选为15~50个碱基,更优选为18~30个碱基,包括该技术领域中公知的化合物、以及具有与其同样作用或功能的全部核苷酸。虽然不作限定,但sirna的具体例子能够参考可以作为基因疗法对象的基因来进行设计。
[a-2.第二实施方式]
根据本发明的第二实施方式,提供一种单元型聚离子复合物,该单元型聚离子复合物为由特定数量的嵌段共聚物和由特定数量的核酸构成的单元型聚离子复合物,该嵌段共聚物具有聚乙二醇链段与阳离子性聚氨基酸链段,
来自该嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和不被来自该核酸的负电荷量的总和抵消,
该核酸的链长为10~50个碱基长度,
该聚乙二醇链段的分子量为40×103以上,
该嵌段共聚物对由序列编号1所示的正义链和序列编号2所示反义链构成的双链核酸(其中,各链的5’末端上没有添加磷酸基)具有规定的结合常数(ka)。
在本实施方式的upic中,生理ph环境下的来自嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和不会被来自核酸的负电荷量的总和抵消,作为结果,没有被电中和。生理ph环境下的来自upic中的全部嵌段共聚物的阳离子性聚氨基酸链段的侧链的正电荷量的总和可以为来自upic中的全部核酸的负电荷量的总和的45%以上且低于90%(例如50%~85%或50%~80%)、或者超过110%且150%以下(例如115%~140%)。
上述嵌段共聚物对由例如序列编号1所示的正义链和序列编号2所示的反义链构成的双链核酸(其中,各链的5’末端上没有添加磷酸基)可以具有3.0×105以上、优选5.0×105以上(例如,8.0×105以上、1.0×106以上、1.5×106以上或2.0×106以上)的结合常数(ka)。对该双链核酸的结合常数(ka)能够采用例如4.0×106以下。这样的嵌段共聚物对10~50个碱基长度左右的全部短链核酸显示高亲和性,能够适当地缔合而形成upic。作为上述嵌段共聚物,可以使用例如a-1-2项中所记载的嵌段共聚物。
作为上述核酸,可以使用例如a-1-3项中所记载的核酸。在本实施方式的upic中,与双链核酸同样地,也优选使用单链核酸(例如,寡或聚单链rna、寡或聚单链dna或混合存在rna与dna的寡或聚单链核酸)。作为链长为10~50个碱基长度的单链核酸的具体例子,能够优选列举:microrna、反义核酸、适体、核酶等功能性核酸。在使用单链核酸的情况下,第二实施方式的upic可以为由一分子的核酸与一分子的嵌段共聚物构成的upic或者由一分子的核酸与两分子的嵌段共聚物构成的upic。
[b.单元型聚离子复合物的制备方法]
本发明的upic例如能够通过将任意适当的嵌段共聚物与核酸在根据需要缓冲化后的水溶液(例如,磷酸缓冲生理盐水、hepes缓冲液)中混合而制备。
[c.核酸递送用组合物]
本发明的核酸递送用组合物包含a项中所记载的upic和能够构成该upic的嵌段共聚物,该嵌段共聚物为游离状态的嵌段共聚物。根据本发明的核酸递送用组合物,可以得到比单独使用upic时更优异的核酸的血中滞留性。作为得到这样的效果的原因,例如推测如下。即,在包含upic的溶液中,作为可逆反应,产生了核酸-嵌段共聚物之间的解离和缔合,其结果,upic可逆地降解和再形成。因此,通过在upic基础上配合游离状态的嵌段共聚物,能够使平衡向缔合侧偏移,其结果,可以认为能够比upic单独时更适当地保护核酸。
作为上述游离状态的嵌段共聚物,只要能够替换构成upic的嵌段共聚物而形成upic即可。作为具体例子,可列举a-1-2项中所记载的嵌段共聚物,优选列举与构成upic的嵌段共聚物相同的嵌段共聚物。该嵌段共聚物与核酸的亲和性高,因此,即使在血中也可以与核酸适当地重新缔合。
本发明的核酸递送用组合物可以通过在根据需要缓冲化后的水溶液中以成为所希望的n/p比的方式将上述嵌段共聚物与核酸混合而得到。其中,n/p比表示组合物中的来自上述嵌段共聚物的氨基的摩尔浓度与来自上述核酸的磷酸基的摩尔浓度之比。
在本发明的核酸递送用组合物中,n/p比例如为1以上,优选为1.5以上,更优选为2以上。另外,n/p比的上限代表性地能够采用20以下,例如10以下、5以下或4以下。在本发明的核酸递送用组合物中,选择双链核酸作为递送对象的核酸,并使用对该核酸具有例如8.0×105以上、优选1.0×106以上的结合常数(ka)的嵌段共聚物,由此,即使n/p比为5以下(例如,3左右),也能够在给药3小时后实现10%以上的核酸的血中滞留性。
实施例
下面,通过实施例对本发明进行更具体的说明,但本发明不限于这些实施例。需要说明的是,在下面的实施例中,以peg的分子量(kda)和聚氨基酸的聚合度的顺序标记聚合物结构。例如,在双链支链型peg链的各分子量为37kda,阳离子性聚氨基酸链段由十个鸟氨酸残基构成的情况下,缩写为“peg-porn(37×2-10)”。
<嵌段共聚物的制备>
使用具有各种分子量的双链支链型的聚(乙二醇)衍生物(nof公司制造),通过与专利文献1实施例中所记载的嵌段共聚物的制备方法同样的方法,得到以下的嵌段共聚物(盐酸盐):peg-porn(37×2-11)、peg-porn(37×2-14)、peg-porn(37×2-20)、peg-porn(37×2-40)、peg-plys(37×2-9)、peg-plys(37×2-14)、peg-plys(37×2-20)、peg-plys(37×2-40)的白色粉体。聚氨基酸链段的聚合度通过1h-nmr来确定。
[实施例1]
将peg-porn(37×2-11)与sirna分别溶解于10mmhepes缓冲液(ph7.3)中,以使sirna的最终浓度为10μm,且n/p比为0.25、0.5、1、2、3、5或10的方式混合,从而制备pic溶液。作为sirna,使用各链的5’末端上没有添加磷酸基的siluc(对于荧光素酶的sirna),并根据需要在5’末端上加上alexa647等标记而使用。
siluc的碱基序列:
正义5’-cuuacgcugaguacuucgadtdt-3’(序列编号1)
反义5’-ucgaaguacucagcguaagdtdt-3’(序列编号2)
[实施例2]
使用peg-porn(37×2-14)代替peg-porn(37×2-11),除此之外,与实施例1同样地操作,制备pic溶液。
[实施例3]
使用peg-plys(37×2-14)代替peg-porn(37×2-11),除此之外,与实施例1同样地操作,制备pic溶液。
[比较例1]
使用peg-plys(37×2-9)代替peg-porn(37×2-11),除此之外,与实施例1同样地操作,制备pic溶液。
[参考例1]
使用peg-plys(37×2-20)代替peg-porn(37×2-11),除此之外,与实施例1同样地操作,制备upic溶液。参考例1中得到的upic溶液(n/p比=10)大致相当于专利文献1的表2中作为药物制剂b所公开的upic溶液,包含由一分子的sirna与两分子的嵌段共聚物构成的upic。
<upic的结构分析1>
针对上述实施例1~3和比较例1中制备的pic溶液,利用沉降平衡法进行超速离心分析(se-auc分析)和荧光相关光谱分析(fcs分析),由此,求得每一个pic的核酸缔合数和嵌段共聚物缔合数。具体的方法如下所示。
[se-auc分析]
se-auc分析使用具备吸收光学系统的分析用超速离心系统beckmanoptimaxl-a(beckmancoulter公司制造)来进行。将上述实施例和比较例中按照n/p比=1所制备的pic溶液用包含150mmnacl的10mmhepes缓冲液(ph7.4)进行稀释,以使sirna浓度为0.6μm,将其作为测定试样。在20℃离心72小时后,将波长260nm处的吸收作为r的函数进行测定。使用origin软件对各试样的测定结果进行分析,从而求出pic的分子量(da)。
[fcs分析]
fcs分析通过使用搭载有40×物镜(c-apochromat,carlzeiss公司制造)和confocor3模块的激光扫描共聚焦显微镜(carlzeiss公司制造,产品名“lsm510”)来进行。将上述实施例和比较例中按照n/p比=1所制备的pic溶液用包含150mmnacl的10mmhepes缓冲液(ph7.4)进行稀释,以使sirna浓度为100nm,将其作为测定试样。将测定试样转移到8孔腔中,以15秒的采样时间、5次重复次数进行fcs测定。利用confocor3软件对测定结果进行分析,由此,求出测定区域内的荧光颗粒平均数。然后,使用以下式(a)进行计算,由此求出每一个pic的核酸缔合数。
ansirna=nsirna/npic(a)
(式中,ansirna为每一个pic的核酸缔合数,nsirna和npic分别为仅包含荧光标记后的sirna的对照试样的荧光颗粒平均数和来自pic溶液的测定试样的荧光颗粒平均数)。
通过将上述pic的分子量(da)和每一个pic的核酸缔合数代入下面的式(b),算出每一个pic的嵌段共聚物缔合数。
ancopolymer=[mwpic-(mwsirna×ansirna)]/mwcopolymer(b)
式中,ancopolymer为每一个pic的嵌段共聚物缔合数,mwpic为通过上述se-auc分析得到的pic的分子量(da),mwsirna和mwcopolymer分别为基于sirna和嵌段共聚物的结构式所算出的分子量(da)。
将上述结构分析的结果示于表1。
[表1]
*:将每一个pic的核酸缔合数设为1、聚合物缔合数设为2而算出的、来自聚合物侧链的电荷相对于来自核酸的电荷的比例。
如表1所示,通过实际进行fcs分析和超速离心分析所确定的sirna和嵌段共聚物的缔合数分别为约1和约2。其中,各缔合数的标准偏差为0.1以下表示实施例1~3和比较例1中得到的pic在构成上的均匀性非常高,具有特定的均匀的构成。根据以上内容,可以合理地理解为,实施例1~3和比较例1中所制备的pic为由一分子的sirna与两分子的嵌段共聚物构成的upic。
<upic的结构分析2>
对上述参考例1中得到的upic溶液,与上述upic的结构分析1同样地进行fcs分析,由此,求出每一个pic的核酸缔合数和pic的平均粒径(流体动力学直径:dh)。需要说明的是,使用confocor3,将上述fcs测定中得到的自相关曲线转换为扩散时间,然后,使用cy5色素作为对照将该扩散时间转换为扩散系数(dc),将该扩散系数代入爱因斯坦关系式(stokes-einsteinequation),由此算出pic的平均粒径(dh)。将结果示于图2。
如图2所示,在参考例1的upic溶液中,在n/p比=1~10的范围内,upic的平均粒径为约18nm,另外,核酸缔合数为约1,两者均几乎是一定的。由此可知,参考例1的upic作为稳定的结构单元体存在,upic不会彼此缔合或与游离的嵌段共聚物进行二次缔合。
<结合常数的测定>
上述得到的各嵌段共聚物对sirna的结合常数(ka)通过以下方法来确定。将结果示于表2。
结合常数通过定量溴乙锭(etbr)和嵌段共聚物对sirna的结合的竞争、对溴乙锭(etbr)与核酸结合时增强的荧光的强度进行定量而确定。上述荧光强度的定量使用荧光分光光度计(日本分光公司制造,fp-6600)来进行。具体而言,将作为测定对象的嵌段共聚物与上述sirna(实施例和比较例中所使用的siluc,但没有用alexa647标记)分别溶解于包含150mmnacl的10mmhepes缓冲液(ph7.3)中,以使sirna的最终浓度为1μm且n/p比为0.25、0.5或1的方式混合,从而制备pic溶液。向各n/p比的1mlpic溶液中滴加十次约0.5mm的etbr水溶液,每次滴加10μl,每次滴加都测定荧光强度(ex525nm,em600nm)。根据已知方法(j.chem.edu.71,77(1994))对得到的荧光强度进行分析,从而算出结合常数。
[表2]
*1:使用nakedsirna代替pic所测得的值。
<sirna的血中滞留性评价1>
将实施例、比较例和参考例中得到的upic溶液(n/p比=1)尾静脉给药于6周龄雌性balb/c小鼠。此时,以使siluc的给药量为2nmol/小鼠的方式进行给药。然后,使用invivo共聚焦成像系统(nikona1r,尼康公司制造),经时性测定小鼠的耳血管内的来自siluc的荧光强度,通过以下式求出相对荧光强度(n=1)。将刚给药后、5分钟后、10分钟后、30分钟后和60分钟后的相对荧光强度示于表3。
相对荧光强度(%)=(测定时的强度-背景强度)/(最大强度-背景强度)×100
[表3]
如表3所示,根据实施例1~3的upic溶液,得到了与参考例1的upic溶液同等以上的优异的核酸的血中滞留性。特别是,在使用与核酸的结合常数(ka)超过1.0×106的嵌段共聚物的实施例1和实施例2中,得到了比参考例1更优异的核酸的血中滞留性。另一方面,比较例1的upic溶液在刚给药后,荧光强度大大降低,之后无法进行稳定的测定。
<sirna的血中滞留性评价2>
使用n/p比=10的upic溶液,除此之外,与sirna的血中滞留性评价1同样地,向6周龄的雌性balb/c小鼠尾静脉给药upic溶液,经时性测定小鼠的耳血管内的来自siluc的荧光强度,求出相对荧光强度(n=1)。将相对荧光强度的经时性变化示于图3。
如图3所示,根据实施例1~3的upic溶液(核酸递送用组合物),得到与参考例1的upic溶液同等的优异的核酸的血中滞留性。另一方面,比较例1的upic溶液比实施例和参考例1的upic溶液的核酸的血中滞留性差。
产业上的可利用性
本发明的upic能够适当地用于核酸医药等的药物输送系统。
符号说明
100单元型聚离子复合物
10嵌段共聚物
12阳离子性聚氨基酸链段
13、14聚乙二醇链段
20核酸
序列表
<110>国立大学法人东京大学
公益财团法人川崎市产业振兴财团
<120>搭载核酸的单元型聚离子复合物
<130>tku15218pct
<150>jp2017-166735
<151>2017-08-31
<160>2
<170>patentinversion3.5
<210>1
<211>21
<212>dna
<213>人工序列
<220>
<223>包括dt末端的对于荧光素酶的sirna的正义链
<400>1
cuuacgcugaguacuucgatt21
<210>2
<211>21
<212>dna
<213>人工序列
<220>
<223>包括dt末端的对于荧光素酶的sirna的反义链
<400>2
ucgaaguacucagcguaagtt21
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于CRISPR‑Cas9系统的基因编辑载体及其应用的制造方法与工艺
- 一种基于CRISPR/Cas9技术制备水稻OsPIL15突变体的方法及应用与流程
- 检测黄曲霉毒素M1的核酸适配体、传感器、试剂盒及应用的制造方法与工艺
- 一组肌酸激酶同工酶核酸适配体及其应用的制造方法与工艺
- 用于抑制KRAS靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制EIF4E靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制VEGFA靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 一种新型向导RNA表达盒及在CRISPR/Cas系统中的应用的制造方法与工艺
- 一种具备双单链末端PCR产物的获得方法及其检测方法与流程
- 一种通过生物技术扩增脱氧胸苷三磷酸的方法与流程