使用x射线微束辐射治疗受损周围神经的方法与流程
相关申请的交叉引用
该申请要求待决的2017年11月17日提交的美国临时专利申请序列号62/587,848,题为“使用x射线微束辐射和施用施万细胞祖细胞引发施万细胞再生以在周围神经中产生髓鞘再生”的权益和优先权,其全部内容在此通过引用整体并入本文作为参考。
本公开总体上涉及x射线辐射疗法,尤其涉及使用x射线辐射疗法治疗周围神经损伤的方法。
背景
哺乳动物的周围神经可通过多种方式受伤,包括机械、辐射和免疫系统造成的损害。例如,坐骨神经可能会在事故中被压伤,在要控制肿瘤的情况下,颅神经和前列腺神经可能会在辐射治疗期间受伤,以及神经可能会因自身免疫系统疾病而受损。
尽管已经进行的一些研究建议使用辐射疗法修复中枢神经系统(cns),但是周围神经系统(pns)在几个方面与中枢神经系统(cns)不同。首先,与在我们的cns中为轴突产生髓磷脂的少突胶质细胞相反,为周围神经产生髓磷脂的细胞是施万(schwann)细胞。其次,虽然我们的轴突位于cns组织中,其中充斥着少突胶质前体细胞(opc),也称为祖胶质细胞(pgc),但我们的周围神经周围具有相对较少的施万细胞祖细胞(也称为施万细胞前体)。无论损伤是通过机械手段、辐射还是其他因素造成的,这都使我们的周围神经的恢复具有挑战性。
众所周知,在cns中,pgc不会分裂,只要它们能够感觉到周围存在髓磷脂。这种作用称为“接触抑制”。但是,cns的机械或其他损伤可能会“破坏”这种接触抑制作用,并使pgc分裂、增殖并填充髓鞘剥脱的邻近组织。然后,产生的新细胞可以分化为成熟的神经胶质细胞,并恢复其髓鞘再生功能。对于施万细胞或施万细胞祖细胞,已知没有类似的如上对于cns所描述的脱髓鞘和髓鞘再生过程。
此外,已知还没有使用x射线辐射治疗受损周围神经的方法。
发明概述
结合附图并考虑以下详细描述,本公开的特征将变得明显。然而,应当理解,设计附图仅用于说明,而不定义成对本公开的限制。
本公开涉及使用x射线微束辐射治疗受损周围神经的方法。
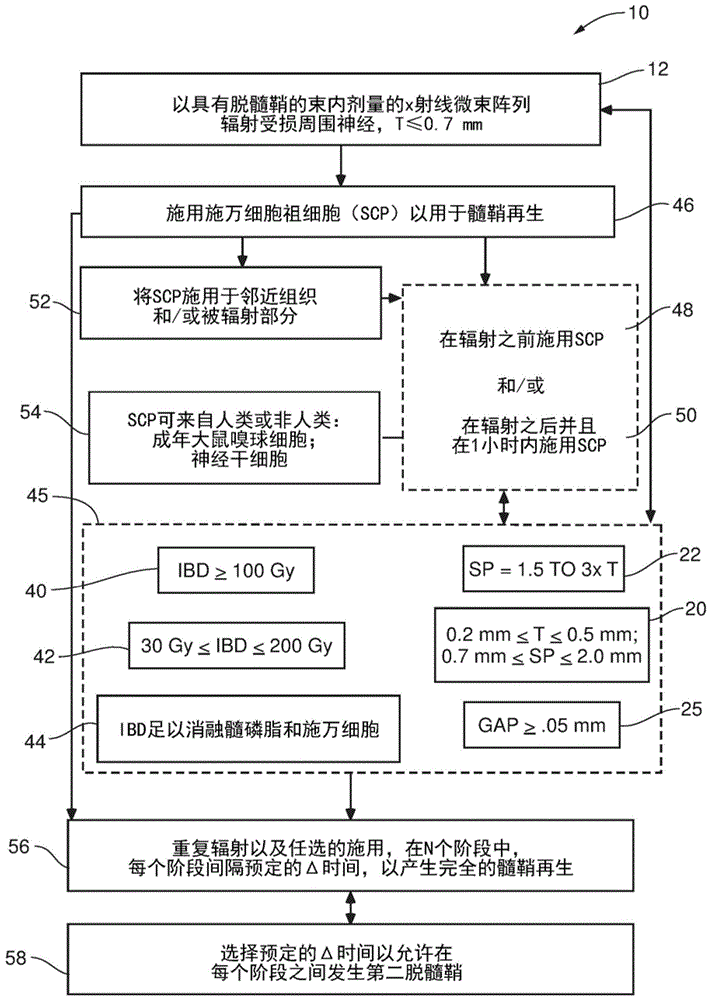
本公开还涉及一种用于治疗受试者的受损周围神经的方法,其包括用x射线微束阵列辐射至少部分受损周围神经,x射线微束阵列的束内剂量(in-beamdose)足以在周围神经中引发脱髓鞘,其中阵列中的每个微束的厚度为不大于0.7mm。
在多个方面,该方法还包括将施万细胞祖细胞施用于阵列辐射的至少部分受损周围神经,以优选刺激受损周围神经中新髓磷脂的产生。在多个方面,可以在辐射步骤之前施用施万细胞祖细胞,而在其他方面,可以在辐射步骤之后施用,而在某些方面,可以在辐射步骤之后一小时内施用施万细胞祖细胞。
在一些方面,该方法还可以包括将施万细胞祖细胞施用于被辐射部分的邻近组织。
在多个方面,该方法可以还包括在多个治疗阶段中重复辐射所述部分和施用施万细胞祖细胞的每个步骤,每个治疗阶段间隔预定的时间段。在其他方面,治疗阶段的数量为足以产生完全的髓鞘再生的数量。
在一些方面,每个治疗阶段之间的预定时间段足以允许在每个治疗阶段之间发生第二脱髓鞘。
在本公开的任何方法中,其包括施用施万细胞祖细胞,施万细胞祖细胞可以源自人或源自人以外的动物。例如,施万细胞祖细胞可以是成年大鼠嗅球细胞。
在多个方面,施万细胞祖细胞可以是神经干细胞。
在本公开的方法的方面中,阵列中的每个微束的厚度可以在约0.2mm至约0.5mm之间,包括端点;并且在阵列中的相邻微束之间的中心间距可以在约0.7mm至约2.0mm之间,包括端点。
在多个方面,在被辐射的部分上的相邻微束之间保持至少0.05mm的间隙。
在一些方面,阵列中的相邻微束之间的中心间距可以是微束厚度的约1.1倍至约3倍。
在本公开的方法方面,每个微束的束内剂量可以是至少30gy。
在本公开的方法方面,每个微束的束内剂量可以是至少100gy。
在其他方面,束内剂量在约30至200gy之间,包括端值。
在多个方面,微束阵列是基本上平行的平面微束阵列。
在用于治疗受试者的受损周围神经的方法的方面中,包括用平行的平面x射线微束阵列辐射至少部分受损周围神经,x射线微束阵列的束内剂量足以在周围神经中引发脱髓鞘,该束内剂量足以消融受损周围神经的髓磷脂,该方法包括消融旧的施万细胞带和受损的髓磷脂,从而为新的髓磷脂腾出空间。
在本公开的任何方法的方面中,该方法可以还包括提供x射线微束阵列,包括提供朝向至少部分受损周围神经的x射线源,以及将多孔平行光管定位在x射线源的下游和轨迹中,或定位在受试者附近或其上,以生成x射线微束阵列。
在其他方面,x射线源可以是旋转阳极x射线管或正电压x射线管。
还在其他方面,x射线源是计算机断层摄影(ct)扫描仪的x射线管,该方法还包括:提供计算机断层摄影扫描仪,以及在计算机断层摄影扫描仪中定位受试者和x射线源,使得x射线源朝向至少部分受损周围神经,多孔平行光管定位在x射线源的轨迹中,或定位在受试者附近或受试者上,以产生x射线微束阵列。
本公开还涉及一种用于治疗受试者的受损周围神经的方法,该方法包括用平行的平面x射线微束阵列辐射所述部分受损周围神经,以至少引发,并且在多个方面,以在周围神经中产生脱髓鞘,每个微束递送约30至200gy的束内剂量,并且其中阵列中的每个微束的厚度为不大于0.7mm。
在多个方面,该方法还包括将施万细胞祖细胞施用于阵列辐射的所述部分受损周围神经,从而刺激受损周围神经中新髓磷脂的产生。
在一些方面,施用步骤在辐射步骤之前进行。
在其他方面,施用步骤在辐射步骤之后的一个小时内进行。
在本公开的任何方法中,施万细胞祖细胞可以是成年大鼠嗅球细胞,或者在其他方面,施万细胞祖细胞可以是神经干细胞。
本公开还涉及一种用于治疗受试者的受损周围神经的方法,包括用平行的平面x射线微束阵列辐射部分受损周围神经,以在周围神经中至少引发脱髓鞘,并且在多个实施方案中产生脱髓鞘,每个微束递送约30至200gy的束内剂量,并且其中阵列中的每个微束的厚度不大于0.7mm,该方法还包括提供平行的平面x射线微束阵列,包括提供朝向部分受损周围神经的x射线源,以及将多缝平行光管定位在x射线源的下游和轨迹中以及定位在受试者附近或受试者上,以生成平行的平面x射线微束阵列。
在多个方面,x射线源包括旋转阳极x射线管和正电压x射线管中的一个。
在一些方面,x射线源是计算机断层摄影(ct)扫描仪的x射线管,该方法还包括:提供计算机断层摄影扫描仪,以及在计算机断层摄影扫描仪中定位受试者和x射线源,使得x射线源朝向部分受损周围神经,多缝平行光管定位在x射线源的轨迹中以及定位在受试者附近或受试者上,以生成平行的平面x射线微束阵列。
该方法包括提供计算机断层摄影扫描仪,并且还可以包括将施万细胞祖细胞施用于阵列辐射的部分受损周围神经,从而刺激受损周围神经中新髓磷脂的产生,其中施用步骤可以在辐射步骤之前进行,或在辐射步骤后的一个小时内进行。
本公开还涉及一种用于治疗受试者的受损周围神经的方法,该方法包括用至少一个x射线微束辐射至少部分受损周围神经,该x射线微束的厚度不大于0.7mm,以在受损周围神经中引发脱髓鞘。
在多个方面,至少一个微束递送至少30gy的束内剂量。
在多个方面,该方法还包括将施万细胞祖细胞施用至以至少一个微束辐射的至少部分受损周围神经。在其他方面,这可以刺激或增强受损周围神经中新髓磷脂的产生。
在多个方面,施用步骤在辐射步骤之前进行。
在其他或任选方面,施用步骤在辐射步骤之后,并且在一些方面,在辐射步骤之后的一小时内进行。
在多个方面,施万细胞祖细胞可以是成年大鼠嗅球细胞和/或神经干细胞。
在特定方面,至少一个x射线微束是x射线微束阵列。
还在其他方面,至少一个x射线微束是基本平行的平面微束阵列。
在多个方面,该方法可以还包括提供x射线微束阵列,包括提供朝向所述部分受损周围神经的x射线源,以及将多孔平行光管定位在x射线源的下游以及附近或定位在受试者上,以产生x射线微束阵列。
在多个方面,x射线源包括旋转阳极x射线管和正电压x射线管中的一个。
在其他方面,x射线源是计算机断层摄影(ct)扫描仪的x射线管,该方法还包括:提供计算机断层摄影扫描仪,以及在计算机断层摄影扫描仪中定位受试者和x射线源,使得x射线源朝向部分受损周围神经,多孔平行光管定位在受试者附近或受试者上,以产生x射线微束阵列。
在多个方面,在受辐射的部分上的相邻微束之间保持至少0.05mm的间隙。
除了本公开的上述方面之外,根据以下说明书中呈现的实施方案并结合附图,本公开的其他方面、目的、特征和优点将是显而易见的。
附图简要说明
附图构成本公开的一部分,并且包括可以以各种形式实现的示例。应当理解,在某些情况下,本公开的各个方面可以夸大或放大地示出以促进理解。通过结合以下对于附图的简要描述并考虑详细描述,可以容易地理解本公开的教导。
图1表示本公开的以微束x射线辐射治疗受试者的周围神经损伤的方法的实施方案。
图2a是以均匀间隔开的,平行的x射线微束阵列辐射大鼠头部上方的图示,其示出了本公开的微束阵列的实施方案。
图2b是通过本公开的x射线微束阵列的另一实施方案的横截面的图示,该微束具有圆形横截面。
图3是以本公开的微束阵列辐射腿中几个受损周围神经部分的图示。
图4表示以微束x射线辐射治疗受试者周围神经损伤的方法的其他实施方案。
图5表示用于实现本公开的方法的实施方案的计算机断层摄影(ct)扫描仪的x射线源的实施方案。
参考前述附图和以下对于某些实施方案的详细描述,进一步详细描述了本公开的上述各个方面。
详细说明
以下参考附图对本公开中的实施方案进行详细描述。对于本领域技术人员应该显而易见的是,本文提供的所描述的实施方案仅是示例性的,而非限制性的,并且仅以举例的方式给出。除非另有明确说明,否则本说明书中公开的所有特征可以由执行相同或相似目的的替代特征代替。因此,可以设想,其修改的多种其他实施方案及其等同物落入本文定义的本公开的范围内。在以下描述中,省略了对本领域中已知的相关公知功能或特征的详细解释,以避免使本公开的实施方案因不必要的细节而变得模糊。
在整个说明书中,在将条目描述为具有、包括或包含一个或多个特定组分的情况下,或者在将方法描述为具有、包括或包含一个或多个特定步骤的情况下,还可以设想,根据本公开的条目基本上由一种或多种所述组件组成或由其组成,并且根据本公开的方法基本上由一种或多种所述处理步骤组成或由其组成。
参考图1,本公开涉及用于治疗受试者或患者的受损周围神经的方法10,包括在12处用x射线微束阵列14辐射至少部分受损周围神经,在实施方案中,该x射线微束阵列14是平行或基本平行的平面微束(见图2a),并且具有足以在周围神经中引发脱髓鞘的束内剂量。参考图2a和2b,阵列14中的每个微束16具有的厚度18不大于0.7mm。
本公开的微束阵列还优选包括中心间距24(见图2a和2b),该间距足以确保在辐射之后相邻微束16之间的间隙25能促进组织保留效应,如下文进一步描述的。还参考图1,在实施方案中,该间隙25可以被描述为在半高宽(full-width-halfmax,fwhm)处的光束之间的边到边的间距,其可以小至0.05mm。
在一些实施方案中,使用为平行或基本上平行的平面微束的微束16可能是有利的,如图2a所示,其中微束的横截面具有矩形轮廓。然而,在实施方案中,阵列14可以包括任何形状和布置的微束16,其中微束16的厚度18小于0.7mm,并且相邻微束16之间的间隙25足以允许组织保留。
阵列14可以是如图2a所示的一维阵列,或者是如图2b所示的二维阵列。而图2b的二维阵列设置在矩形栅格上,其中其相邻微束16之间具有相同的间隙25,在实施方案中,它们可以沿圆的半径等距间隔开,或者在其他实施方案中,它们之间没有规则的间隔图案。图2b中的微束16的横截面是圆形的,有时称为铅笔束。如将理解的,本公开的微束16可以是任何形状的横截面,包括但不限于矩形(平面)、正方形、椭圆形(oval)、圆形或圆形(roundorcircular)、椭圆形(elliptical)、多边形、弓形等。
在特定实施方案中,方法10包括在12处辐射受损周围神经30的部分32(见图3),其中阵列14的特征在于,在图1中的20处,每个微束的厚度18在约0.2mm至约0.5mm之间(包括端点),并且阵列14中的相邻微束之间的中心间距24(见图2a,2b)在约0.7mm至约2.0mm之间(包括端点)。在其他实施方案中,厚度18可以在约0.2mm至约0.5mm之间(包括端点),并且相邻微束16之间的间隙25为至少0.05mm。
如本领域技术人员将理解的,取决于产生微束的x射线源的焦点尺寸,微束中将存在一定量的发散。因此,在实施方案中,该方法包括适当地设置形成微束的多孔平行光管的尺寸,以考虑到源的自然发散,使得在靶向神经30的至少被辐射部分32上保持至少为0.05mm的间隙25。
在任何实施方案中,例如,方法10可包括在12处以阵列14辐射该部分,其特征在于,在图1中,在22处的微束的厚度18不大于0.7mm,并且微束16之间的间隙25足以实现组织保留效应。在实施方案中,如上所述,至少在被治疗的受损周围神经30的部分32上保持至少0.05mm的间隙25。在一些其他实施方案中,中心间距24将是厚度18的至少1.1倍,或者在实施方案中,是厚度18的至少1.2倍,或者在实施方案中,是厚度18的至少1.5倍。在任何方法的其他实施方案中,中心间距可以是厚度18的至少1.5至3(三)倍。
可以根据用于辐射的周围神经的靶向部分的大小来选择阵列中的束的数量。在某些情况下,可以在单个辐射中用单个阵列来辐射受损周围神经的整个区域。在其他实施方案中,可以对受损周围神经的不同部分进行几次辐射,整体而言,几次辐射可以治疗受损周围神经的整个区域。平行微束阵列的其他辐射参数将取决于所需的束内剂量和其他因素,但微束的厚度应小于0.7mm,并且它们之间的间隙25应足以受益于组织保留效应,如上所述。
在一些实施方案中,可以选择以下合适的参数:微束厚度为约0.2至0.6mm,中心间距为约0.4至1.0mm,束内剂量选自约30gy至约200gy。
关于本公开的微束之间的间距和微束的厚度,本公开的使用x射线微束辐射的治疗方法是基于使用分段高能的厚度小于0.7mm的x射线束观察到的组织保留效应。在1990年代初期,在brookhavennationallaborator(bnl)的nationalsynchrotronlightsource(nsls),以微束辐射治疗(mrt)为题研究了使用所谓的微束作为使用平行平面同步加速器x射线阵列进行的可能辐射疗法。例如,早期研究表明大鼠小脑单次暴露于同步加速器x射线,称为微束的平行的,37μm平面的阵列后的组织保护效果,该微束中心间距75μm,束内深度为250gy至1,000gy的三重光束。在三个月时,使用250gy微束时没有可见的损伤,而在1000gy辐射下观察到的唯一损伤是颗粒细胞在每个微束的直接路径中消失,但没有引起一般性的组织坏死。这种组织保留效应促使人们对x射线微束的组织耐受性的受试者进行了更多的研究,首先是在nsls,然后不久就是grenoble,france的欧洲同步辐射实验室(europeansynchrotronradiationfacility,esrf)。
尽管仍在研究这些细分段光束的组织保留效应的辐射生物学机制,但普遍认为,广泛存在于组织保留效应的两个机制是“剂量-体积效应”和“及时的生物修复效应”。第一个效应是指已知这样的观察结果,目标越小,其剂量耐受性越大,并且其效应不限于mm或亚毫米光束。然而,第二个“及时的生物修复”效应是专门针对亚毫米尺寸的x射线束,并且已经在动物研究中进行了探索。它基于对微束暴露引起的毛细血管快速修复的观察。例如,在用小鼠小脑中数百gy入射剂量的esrf平面同步加速器产生的25μm的微束进行的实验中,观察到毛细血管在12-24小时内自我修复。
在2000年代初期对大鼠脊髓和大脑进行nsls的其他研究中,观察到厚度为0.02mm至0.68mm的x射线平面微束仍然保留了大部分的cns保留效应。实际上,在其脊髓上以中心间距为3mm,束内剂量为400gy的微束阵列进行轴面微束辐射,四只大鼠中有三只存活了一年。参考图2a,以基本上平行且呈平面的,厚度18为0.68mm,中心间距24为1.32mm且递送170gy的束内剂量的阵列14中的微束16辐射大鼠的几乎整个大脑15(8mmx12mm),在一年内未显示神经功能缺损的迹象。上述研究还表明,可以将朝向靶成90°角度的两个0.68mm厚的x射线微束阵列进行交织(或交织)以在靶向上产生厚实的辐射场。然后使用该技术以120gy剂量消融大鼠大脑中的3mm目标。6个月后,mri研究未发现对周围组织的明显损害。
很难分配一个参数来定量比较一方面分段的薄平面平行x射线辐射束(即“微束”)与另一方面厚实常规束之间的组织耐受性。但是,可以通过比较上一段落中的结果(表明整个大鼠大脑可耐受170gy中心间距为1.32mm的0.68mm微型光束)与其他研究者使大鼠大脑的大部分暴露于~2lgy的单剂量部分的250kvpx射线的结果来估计组织耐受性。辐射在52周内产生了50%的白质坏死。考虑到在一年结束时,170gy微型光束暴露中几乎没有观察到辐射效应,据估计,在大鼠大脑示例中,0.68mm厚的微束阵列比固态x射线束的耐受性优势至少为8:1,最有可能接近10:1。从这些观察结果推测,可以以高入射剂量使用具有微束阵列的辐射疗法,而损害皮肤和靶附近的正常组织的可能性较小。
再次参考图1以及图3,其示出了以微束16的阵列来辐射腿34的几个受损周围神经30,用于治疗受损周围神经30的方法(见图3)包括用厚度小于0.7mm的微束在12处辐射至少受损周围神经30的部分32。
应当理解,在实施方案中,根据本公开的方法的辐射治疗靶向的组织的体积包括辐射靶向的受损周围神经30的部分32和受损周围神经30周围的边缘体积两者。边缘体积由常规辐射治疗领域技术人员已知的因素确定。这样的因素可以包括用于靶向受损周围神经30的辐射源的准确性,以及对需要治疗的受损周围神经的可能扩散或错估的程度的考虑。
图3是辐射需要治疗的腿34的受损周围神经30的部分32的平面微束16的图示。
再次参考图2a和2b,在方法的任何实施方案中,微束16的厚度18可以为约0.3mm。本公开的方法包括在12处提供足以引发脱髓鞘的束内剂量,以及使用阵列14的微束提供束内剂量,这还将促进组织保留和修复作用。
应当注意的是,本文所称的术语“束内剂量”是指在阵列的每个微束中递送的剂量。
在一些实施方案中,在12处通过用本公开的微束阵列以辐射治疗受损周围神经可能足以至少引发,并且在实施方案中,产生脱髓鞘和随后的髓鞘再生。在实施方案中,脱髓鞘和随后的髓鞘再生可以在单个辐射阶段中实现,或在另外的实施方案中,在一个以上的阶段中实现。在实施方案中,可以通过计算机模型和/或动物研究来确定用于特定周围神经脱髓鞘的足够高剂量。
在实施方案中,参考图1,在12处以足够高的剂量辐射受损周围神经30的部分32以至少引发脱髓鞘包括在40处以至少100gy的束内剂量进行辐射。
在替代或另外的实施方案中,在12处以足够高的剂量辐射受损周围神经30的部分32以引发脱髓鞘包括在42处以约30gy至200gy(包括端点)的束内剂量进行辐射。
还在其他实施方案中,束内剂量可以大于约40gy。应当注意的是,上述关于同步加速器产生的厚度为0.02mm至0.68mm的x射线微束的组织保留效应的较早研究是使用正常的健康大鼠进行的。在对大鼠健康脊髓的研究表明,高剂量的750gy的0.27mm的微束可以消融其直接路径中的少突胶质细胞、星形胶质细胞和少突胶质前体细胞(opc)的细条带,并且还可以破坏受辐射的带中的髓磷脂。然而,这些辐射被证明是整个组织都可以耐受的,并且观察到不会对组织的微脉管系统造成任何长期的损害。根据这些对正常健康大鼠的研究,假设正常的髓磷脂以及“不完整”,“低质量”的髓磷脂都可以被单个微束消融,而新的正常髓磷脂将在消融后取代“旧的髓磷脂”(包括不完整或低质量的髓磷脂)。这种不完整,低质量的髓磷脂通常是由例如多发性硬化症(ms)患者的cns产生的,这是由于ms发作后身体自然反复进行的髓鞘再生尝试而导致的,这些发作之间的距离太近,以致于不能产生完整或高质量的髓磷脂。
在这些先前的实验中还表明,正常大鼠的正常脊髓的轴面辐射在两周内引起了实质性的白质脱髓鞘,随后在三个月内几乎进行了完全的髓鞘再生。此外,从治疗后通过神经丝染色的辐射组织的图像观察到,轴突基本上没有受到影响。在辐射后的几个月中,大鼠行走非常正常,这一事实也清楚地表明,轴突没有明显损害。
观察到的髓鞘再生归因于来自祖神经胶质细胞pgc(或少突胶质细胞前体细胞,opc)的神经胶质系统的再生。在该过程中,认为opc的消融打破了它们与髓磷脂之间的接触抑制。结果,opc增殖,填充了暴露产生的0.27mm细胞空隙(和髓鞘空隙),分化并立即开始产生新的功能少突胶质细胞。三个月后,观察到0.27mmcns带的完全髓鞘再生。此外,如上文所述的其他实验中所述,实验证据表明,高剂量微束辐射可消融成熟的少突胶质细胞和星形胶质细胞,而不会破坏微血管,而微血管是组织的基础设施。
再次参考图1,在该方法的实施方案中,在12处,以足以引发脱髓鞘的束内剂量辐射受损周围神经30的至少部分32,包括在44处提供足以消融髓磷脂和施万细胞的束内剂量,随后进行受损周围神经的髓鞘再生,其中旧的施万细胞带和受损的髓磷脂被消融,从而为新的髓磷脂腾出空间。
参考图1和图3,在方法10的其他实施方案中,包括如本文公开和描述的任何合适的特征以及束内剂量和/或微束和阵列的尺寸的组合,包括但不限于所示特征的示例,在45处,可以通过在46处对以微束16辐射的受损周围神经30的部分32额外施用施万细胞祖细胞(scp)来增强髓鞘再生。通常在pns中供应不足的scp的添加可能会刺激受损周围神经产生新的髓磷脂。
在一些实施方案中,在48处,可在12处的辐射阶段后一(1)小时内施用scp,并且在其他实施方案中,可在此后的几分钟内施用scp。
在其他或附加实施方案中,在50处,可以在12处的辐射步骤之前即刻,优选在几分钟内,或者在实施方案中,直到在12处的辐射步骤之前一个小时,施用scp。
尽管可以将scp施用到被辐射部分32,但是在实施方案中,可以在12处的辐射步骤之前或之后,在52处将scp另外或可替代地施用到邻近被辐射部分32的周围神经组织。这将确保在辐射时可有更多的施万细胞前体。
对于包括在46处施用scp的方法10的任何实施方案,任何合适的来源都可以是施万细胞前体的来源,包括人类和其他动物。例如,在54处,scp可以是成年大鼠嗅球细胞或来自例如小鼠、大鼠和/或人类的神经干细胞。
在实施方案中,包括在44处消融髓磷脂和“旧”的施万细胞以为新的髓磷脂腾出空间,并还向被辐射部位和/或其周围施用施万细胞前体,由微束辐射产生的诱人环境可以激活所施用的scp,以填充由暴露的微束所产生的空隙,安置在那些组织带中,分化,产生新的施万细胞,并使组织发生髓鞘再生。以这种方式,所施用的spc可以在被辐射的组织中确定其位置,分化为成熟的施万细胞并产生新的髓磷脂。
在图1的方法10的另外的实施方案中,在12处的辐射步骤,以及任选的,在实施方案中,在46处的施用步骤可以在56处以多个治疗阶段进行,每个治疗阶段间隔预定的时间段。
在其他实施方案中,治疗阶数的数目是足以产生完全的髓鞘再生的数目。在某些实施方案中,可以在几天、几周或几个月的过程中多次重复治疗阶段以产生完全的髓鞘再生。
在一些实施方案中,在58处的每个治疗阶段之间的预定时间段是足够的,以允许在每个治疗阶段之间发生第二脱髓鞘。
参考图4,在方法10的其他实施方案中,辐射步骤12可以还包括提供x射线微束的阵列,在实施方案中,其可以是在60处的平行平面x射线微束的阵列,其可以还包括在62处提供朝向部分受损周围神经的x射线源,以及在64处定位用于生成平面微束的多孔平行光管,在实施方案中,该多孔平行光管是多缝平行光管,位于x射线源的下游和轨迹内,并且在受试者附近或其上,以产生x射线微束阵列。
还应注意的是,对于图1和图4的任何实施方案,在65处的束内剂量可以为30-200gy,包括端点。此外,在参考图4描述的任何实施方案中,可以适当选择本文公开和描述的x射线微束的特征的任何组合,包括但不限于图1中的45处提供的示例。
在一些实施方案中,在66处提供的x射线源是旋转阳极x射线管或正电压管。
可以使用在本领域中已知的任何合适的多孔平行光管,使用在68处提供的x射线源,适当地确定其尺寸以产生本公开的微束阵列,如下文进一步描述的。
还参考图5,在其他实施方案中,在68处提供的x射线源是ct扫描仪72的x射线源70。合适的ct扫描仪72,且系统描述于例如共同拥有的dilmanian等人(“dilmanian申请”)的国际专利申请序列号pct/us18/59401,其国际申请日为2018年11月6日,其全部内容通过引用合并于此作为参考。ct扫描仪72配备有台架74,该台架可用于绕其旋转轴75旋转以将x射线源70定位在例如放置有受试者的床76下方。在本实施方案中,虽然在实施方案中可能,在12处待辐射的周围神经通常不以沿着典型的ct扫描仪的床的中心定位轴线居中。然而,例如在dilmanian申请中所描述的,除了能够沿着水平方向78移入和移出扫描仪74之外,在实施方案中,ct扫描仪72的床76也可以沿旋转的台架旋转轴75的垂直方向80定位,以及沿横向82定位,以便例如受试者腿部34的受损周围神经30的部分32(其远离身体中线或中央正中平面)可以在12处以微束16的阵列进行辐射治疗。
因此,参考图4和图5,本公开的方法包括通过在68处使用ct扫描仪72的x射线源70在60处生成阵列,该方法还可以包括在86处将两个源70(例如通过台架74的旋转)和受试者(例如通过床76的定位)进行定位,使得x射线源70朝向受损周围神经的待辐射部分32。
参考图4,该方法还可以包括在90处将多孔平行光管(例如多狭缝平行光管88)定位在受试者上或附近以及定位在x射线源70的轨迹中。例如,如图5所示,多孔平行光管88可以与x射线源70一起安装以与x射线源70一起在台架74上旋转,其在dilmanian申请中有进一步描述。
参考图5,在实施方案中,还如在dilmanian申请中所述,通过在64处将多孔平行光管88'固定在床76本身上,可以将多孔平行光管88'定位在受试者附近或其上。例如,床76可以在床76的侧面上或在床76的端部上包括狭缝,其中可以将多孔平行光管88'插入并定位在需要的位置以将其对准x射线源70的轨迹,并用微束16辐射受损周围神经。在其他实施方案中,可通过将多孔平行光管88安装到x射线源70或台架74本身上来将其安装在x射线源70的轨迹内,并保持在尽可能近的位置,和在实施方案中,与受试者接触。在使用ct扫描仪72的ct源的其他实施方案中,如参考图5所描述的,多孔平行光管是用于产生平面微束的多狭缝平行光管。在实施方案中,微束16可以垂直于旋转轴线75对准,如图5所示。在使用ct扫描仪72的各种实施方案中,通过旋转平行光管88、88',平面微束16可以可替代地平行于旋转轴。通过说明的方式,参考图2a,如果旋转轴相对于图2a所示的微束16的平面沿着轴75′设置,则将微束平行于旋转轴。
再次参考图4,虽然上文描述的方法使用微束阵列来治疗受损周围神经,但在其他实施方案中,在12'处的辐射步骤可包括用至少一个x射线微束辐射至少部分受损周围神经,以在受损周围神经中引发脱髓鞘。在特定实施方案中,辐射步骤使用单个微束。
该方法可以还包括在12'处使用至少一个微束的辐射步骤,以及在52处将施万细胞祖细胞(在54处,其可以是例如成年大鼠嗅觉干细胞或神经干细胞)施用于以至少一个微束辐射的至少受损周围神经部分。在48处的施用步骤可以在辐射步骤12’之前,和/或辐射步骤之后,以及在某些实施方案中,在辐射步骤12’之后的1小时内(在50处)进行。注意,当在12'处的至少一个x射线微束是x射线微束阵列时,本文所述的方法包括在12处的辐射步骤。
尽管已经参考本发明的某些实施方案示出和描述了本发明,但是本领域技术人员将理解,在不脱离本发明及其等同物的精神和范围的情况下,可以在形式和细节上进行各种改变。
- 还没有人留言评论。精彩留言会获得点赞!