包含从紫苏叶提取物中提取的木犀草素-7-O-二葡萄糖醛酸苷和芹菜素-7-O-二葡萄糖醛酸苷为有效成分的改善眼疲劳用药物组合物的制作方法
包含从紫苏叶提取物中提取的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷和芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷为有效成分的改善眼疲劳用药物组合物
技术领域
1.本发明涉及一种包含从紫苏叶提取物中提取的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷(luteolin
‑7‑
o
‑
diglucuronide)和芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷(apigenin
‑7‑
o
‑
diglucuronide)为有效成分的改善眼疲劳用药物组合物及保健功能食品组合物。
背景技术:
2.紫苏(学名:perilla frutescens(l.)brittonvar.acuta(thunb.)kudo)作为一年生药用植物,在生物学分类上属于被子植物门、双子叶植物纲、唇形科,并分布于韩国和中国。
3.茎直立且呈顿方形,全株带紫色并具有香味,叶成对生长,叶阔卵形,先端短尖,基部圆形或大致楔形且边缘具有锯齿,两面具有柔毛,尤其最长短具有长柔毛,叶柄较长。花在8月至9月以淡紫色盛开,并作为总状花序生在茎和枝的末端、上部叶腋上。花萼被分为2部分,上层又被分为3排,下层被分为2排,并且筒部的内外具有柔毛。花冠为短筒状唇形,下唇比上唇稍长,雄蕊为二强雄蕊,果实为分果呈圆形并具有网纹。叶和茎可供药用,并且幼叶和种子可以食用。
4.幼叶与苏子叶非常相似,以至于难以分辨,并且由紫苏中所包含的紫苏醛(perylaldehyde)制造的糖是强的甜味剂,其强度是正常糖的2000倍,因此可用于烟、酱、牙膏等中。叶子呈绿色而不是紫色的称之为青苏叶(for.viridis)。青苏叶的花呈白色,香味比紫苏强且多用于药材。
5.一方面,用于识别物体的眼球由膜状组织构成,该膜状组织存在于眼的最内层,并且对视觉功能(如接收光)起着重要的作用。视网膜被分为10个层,例如,从外部以如下顺序形成的视网膜分为色素上皮层、神经上皮层、外界膜、外核层、外网层、内核层、内网层、节细胞层、神经纤维层及内界膜。
6.从外界照射到视网膜的光从内界膜一侧传递到视网膜的层,并被作为存在于神经上皮层的光感受器细胞的视觉细胞(视杆细胞和视锥细胞)接收。在视觉细胞中,光被转换为神经信号,并且信号被存在于视网膜的多种神经细胞处理,并且信息最终通过视神经,从存在于视网膜表面的神经节细胞传递到大脑中心。
7.在高度发达的机械文明中,由于各种环境污染、过度观看电视、过度使用个人计算机和电子娱乐设备等使眼睛容易疲劳,并且当夜间行驶或夜间作业时,会出现暗适应能力下降等视力下降的现象。为了防止这种视力下降的现象,寻求各种医药品、天然食品等,其中作为医药品,以从野生蓝莓中提取的花青素(anthocyanoside)为主要成分的视力改善剂在国内外被广泛使用。
8.本发明中,以利用韩国传统植物资源的产业化为目的,确认了紫苏提取物的冷冻干燥及喷雾干燥粉末中所含有的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、芹菜素
‑7‑
o
‑
二葡萄糖醛
酸苷的等效性,并且本发明旨在提供包含从紫苏叶提取物中分离的有效成分的用于改善眼疲劳的药物组合物及保健功能食品组合物。
技术实现要素:
9.发明所要解决的问题
10.本发明提供一种包含从韩国天然资源的紫苏叶提取物中提取的化合物为有效成分的改善眼疲劳用药物组合物及保健功能食品组合物。
11.用于解决问题的方案
12.为了解决上述问题,本发明提供一种包含从紫苏叶提取物中提取的化合物为有效成分的改善眼疲劳用药物组合物及保健功能食品组合物。从紫苏叶提取物中提取的化合物为选自由木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷和芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷组成的组中的一个以上的黄酮配糖体化合物。紫苏叶提取物包含可溶于水、具有1至5个碳原子数的醇或其混合溶剂中的任意一个中的提取物。
13.本发明提供一种黄酮配糖体化合物的制备方法,该方法包括如下过程:上述提取物是通过加入甲醛系树脂hp
‑
20来制备紫苏叶分馏物的,所制得的分馏物通过制备型hplc(高效液相色谱)进行分离,并用nmr、mr鉴定其结构。
14.上述保健功能食品组合物根据常规的方法分别以片剂、胶囊、丸、颗粒、液状、粉末、片状、浆状、糖浆等方式,用作具有改善眼疲劳效果的眼疲劳改善用药物组合物及保健功能食品组合物。
15.发明效果
16.本发明的从紫苏叶提取物中分离的化合物,尤其是包含木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷为有效成分的改善眼疲劳用药物组合物及保健功能食品组合物,通过增加与从大鼠的眼中分离的睫状体平滑肌细胞的舒张相关的no、cgmp含量及减少[ca
2+
]i含量,以及通过动物实验增加与睫状体平滑肌舒张相关联的因子cgmp来确认可以有效改善眼疲劳。由此,从紫苏中提取的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物作为韩国天然资源,可以用作具有改善眼疲劳效果的有用的药物组合物及保健功能食品组合物。
附图说明
[0017]
图1是示出通过hplc分析的紫苏叶提取物中包含的化合物的图。(1)示出木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷,(2)示出芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷,(3)示出迷迭香酸(rosmarinic acid)。
[0018]
图2是示出利用c2c
12
细胞的紫苏叶提取物的抑制ros(活性氧)生成效果的图。a:mtt法(mtt assay)(细胞毒性),b:ros检测。
[0019]
图3是示出紫苏叶提取物在从兔中分离的睫状肌中的舒张效果的图。
[0020]
图4是示出紫苏叶提取物对主动脉平滑肌(hasmc)中的cgmp和camp含量变化的图。a:15分钟、30分钟以及60分钟的cgmp含量;b:15分钟、30分钟以及60分钟的camp含量。
[0021]
图5是示出紫苏叶提取物在主动脉平滑肌(hasmc)中对pde5a及pde3a活性的抑制效果的图。a:pde5a活性;b:pde3a活性。
[0022]
图6是示出紫苏叶提取物对主动脉平滑肌(hasmc)中的[ca
2+
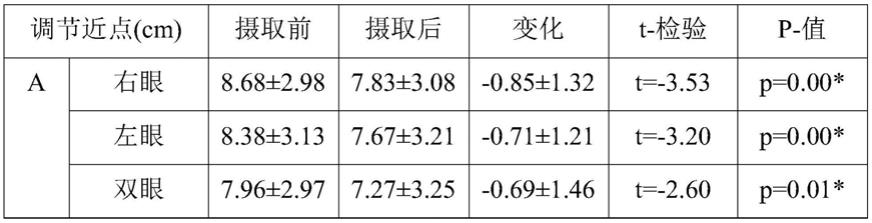
]i浓度变化的图。
[0023]
图7是示出紫苏叶提取物在主动脉平滑肌(hasmc)中对由et
‑
1(内皮素)诱导的[ca
2+
]i含量的抑制效果的图。
[0024]
图8是从紫苏叶提取物中分离的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物分离模式图。
[0025]
图9是示出从紫苏叶提取物中分离的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷成分结果的图。(a
‑
1):木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷的化合物结构;(a
‑
2):芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的hplc分析;(a
‑
3):木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷的紫外光谱(uv spectrum);(b
‑
1):芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的化合物结构;(b
‑
2):芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的hplc分析;(b
‑
3):芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的紫外光谱。
[0026]
图10是示出根据紫苏叶热水提取物的冷冻干燥及喷雾干燥方法的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物的等效性二葡萄糖醛酸苷化合物的等效性的图。fd:冷冻干燥(freeze
‑
dried),sd:喷雾干燥(spray
‑
dried)。
[0027]
图11是紫苏叶提取物对从sd大鼠的眼中分离的睫状体细胞的细胞毒性及一氧化氮(no)生成效果的图。紫苏提取物冷冻干燥物的细胞毒性(a)和no含量(b)。
[0028]
图12是示出紫苏叶提取物对从sd大鼠的眼中分离的睫状体细胞的cgmp和camp含量变化量的图。紫苏叶提取物的冷冻干燥物的cgmp和camp含量变化量。
[0029]
图13是示出紫苏叶提取物对从sd大鼠的眼中分离的睫状体细胞的[ca
2+
]i浓度变化量的图。(a)紫苏叶提取物的冷冻干燥物对从sd大鼠中分离的睫状肌细胞的[ca
2+
]i含量的影响,(b)紫苏叶提取物的冷冻干燥物对从sd大鼠中分离的睫状肌细胞的[ca
2+
]i含量变化量的影响。
[0030]
图14是示出在通过对大鼠的眼睛照射光而引起疲劳后,将100mg/kg、200mg/kg的紫苏叶提取物经口给药3天后,检测大鼠的眼睛中cgmp含量变化的图。
[0031]
图15是示出从sd大鼠的眼中分离的睫状体细胞的cgmp含量相对于从紫苏叶提取物分离的化合物变化的图。
具体实施方式
[0032]
本发明的改善眼疲劳用保健功能食品组合物包含从紫苏叶提取物分离的化合物作为有效成分。以下,本发明的实施例中将举例说明木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷作为从紫苏叶提取物中分离的化合物。为了优化工业化,确认了根据干燥方法的紫苏提取物的木犀草素
‑7‑
o
‑
二葡糖醛酸苷和芹菜素
‑7‑
o
‑
二葡糖醛酸苷含量变化的差异。
[0033]
上述黄酮类化合物通过增加作为眼睫状肌的舒张因子的cgmp含量来舒张所收缩的睫状肌,从而确认了改善眼疲劳的结果。
[0034]
本发明中上述黄酮配糖体化合物选自由下述化学式1来表示的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、由下述化学式2来表示的芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷组成的组中的至少一个。
[0035]
实施例1.紫苏提取物在主动脉平滑肌细胞(体外)及兔眼睫状肌(离体)、调节近点(人体适用试验)中的效果
[0036]
1、紫苏叶热水提取制备
[0037]
利用10倍的蒸馏水将3kg紫苏叶(干叶)在100℃下热水提取3小时。将上述所提取的水提取物进行减压浓缩及冷冻干燥,并获得紫苏叶热水冷冻干燥物650g。
[0038]
2、利用hplc来分析紫苏提取物成分
[0039]
在紫苏叶热水提取物的成分分析中所使用的hplc装置是yl 9100hplc系统,并且色谱柱使用了triart c18 plus(250x 4.6mm,5um,ync有限公司)。流动相为甲醇(流动相a)和hplc用蒸馏水(流动相b,0.1%的甲酸),并且将甲醇的比例从30%(0
‑
10分钟)调节为30%~50%(10
‑
30分钟)、60%(35
‑
40分钟)、60~70%(40~53分钟)、70~100%(53~56分钟),以及最后调节为30%(56~60分钟)。流速为1ml/min,并使用uv/vis(9120)检测器在325nm处进行了分析。
[0040]
图1是示出通过hplc分析的紫苏叶提取物中包含的化合物的图。利用hplc分析紫苏叶热水提取物的结果,确认了作为主要物质包含迷迭香酸、木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物。图中所图示的(1)表示木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷,(2)表示芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷,(3)表示迷迭香酸。
[0041]
3、利用c1c
12
细胞检测ros
[0042]
将5x105细胞/ml的c1c
12
细胞种植到48孔板上,并且用过氧化氢(h2o2,200μm)处理2小时以诱导氧化应激,然后,用紫苏提取物(50μg/ml、100μg/ml、200μg/ml)反应24小时。通过mtt法来检测细胞毒性。为了检测ros,除去培养基,用pbs洗涤两次,然后用1%的曲拉通
‑
x
‑
100(pbs)进行处理并在37℃下裂解细胞10分钟。在暗室室温下用dcf
‑
da(10μm)反应30分钟。反应后将细胞用pbs洗涤两次,并利用荧光光谱仪在485nm激发,530nm发射下进行检测。
[0043]
图2是示出利用c2c
12
细胞的紫苏叶提取物的抑制ros(活性氧)生成效果的图。a表示mtt法(细胞毒性)结果,b表示ros检测结果。可以确认,紫苏叶提取物(50μg/ml、100μg/ml、200μg/ml)以浓度依赖性的方式抑制作为由h2o2诱导的氧化应激物质的ros的生成。
[0044]
4、测定兔眼睫状体的舒张率
[0045]
购买兔子作为实验动物(2.4~2.7kg)并使其适应环境,并用于本实验。通过向实验动物肌肉注射舒泰
‑
隆朋(zoletil
‑
rompun)混合物(1:2)来进行全身麻醉,并切除眼球。通过切开巩膜并在眼球的赤道处将所切除的眼球切成两半,并除去晶状体后,小心地将睫状肌从巩膜中分离。通过将分离的睫状肌切成宽度3mm
×
长度6mm的样品来获得样本。
[0046]
向睫状肌切片通入95%氧气、5%二氧化碳混合气,并放入重碳酸盐缓冲液(krebs
‑
henseleit)(cacl
2 1.5mm、nacl 118mm、kcl 4.7nm、mgso
4 1.1mm、kh2po
4 1.2mm、nahco
3 25mm、葡萄糖10mm;ph 7.4)中进行实验。针对睫状肌的收缩,通过使用张力传感器并施加1g的负荷来进行悬挂。并且将睫状肌的切片稳定90分钟,然后通过添加卡巴胆碱(carbachol)(100μm/ml)使睫状肌收缩。对上述睫状肌进行最后刺激后,通过在睫状肌上添加紫苏叶提取物(100μg/ml、200μg/ml)来确认舒张率。
[0047]
图3是示出紫苏叶提取物在从兔中分离的睫状肌中的舒张效果的图。并且,确认了紫苏叶提取物是否影响从兔分离的睫状肌的舒张。即,利用卡巴胆碱(100μm/ml)使兔的睫状肌收缩后,通过添加100μg/ml及200μg/ml的紫苏提取物来确认了舒张率。添加蒸馏水(对照组)的组不影响收缩的睫状肌,相反,200μg/ml紫苏提取物有效地使通过卡巴胆碱收缩的睫状肌舒张。
[0048]
5、利用主动脉平滑肌细胞的舒张机制
[0049]
5.1、测定cgmp及camp含量
[0050]
从atcc(美国模式培养物集存库,pcs
‑
100
‑
012,美国弗吉尼亚州马纳萨斯)购买人主动脉平滑肌细胞(primary human aortic smooth muscle cells,hasmcs),并且在5%co2培养箱(incubator)中用添加有血管平滑肌细胞生长试剂盒(vascular smooth muscle cell growth kit)的血管细胞基础培养基(vascular cell basal medium)进行培养。将hasmc以5x105细胞/孔的方式种植于6孔中并将其稳定24小时。稳定后,用3
‑
异丁基
‑1‑
甲基黄嘌呤(ibmx,1mm)预处理10分钟,然后用紫苏叶提取物(50μg/ml、100μg/ml、200μg/ml)进行15分钟、30分钟、60分钟反应。通过利用elisa试剂盒来测定cgmp和camp含量。
[0051]
图4是示出紫苏叶提取物对主动脉平滑肌(hasmc)中的cgmp和camp含量变化的图。a表示15分钟、30分钟以及60分钟的cgmp含量;b表示15分钟、30分钟以及60分钟的camp含量。即,紫苏叶提取物(50μg/ml、100μg/ml及200μg/ml)以浓度依赖性的方式增加与睫状体舒张相关的cgmp含量,另外,证实了cgmp含量是随紫苏叶提取物的反应时间来增加的。相反,紫苏叶提取物不影响camp含量的变化。
[0052]
5.2、测定磷酸二酯酶(phosphodiesterase,pde)抑制率
[0053]
根据试剂盒(bps生物科学,加拿大圣地亚哥)的方法测定pde5a和pde3a的活性。即,分别添加50μl的反应混合物(reaction mixture)(pde5a 10ng/ml、pde3a 20ng/ml、fam
‑
cyclic
‑
3',5'
‑
gmp、fam
‑
cyclic
‑
3',5'
‑
amp 200nm),并添加紫苏叶提取物(50μg/ml、100μg/ml、200μg/ml)。将反应混合物在室温中反应1小时。添加稀释的粘合剂(diluted binding agent)(100μl)并再次将反应混合物反应1小时。在激发480nm和发射528nm下测定每个样品的荧光极化。
[0054]
图5是示出紫苏叶提取物在主动脉平滑肌(hasmc)中对pde5a及pde3a活性的抑制效果的图。a表示pde5a活性结果;b表示pde3a活性结果。虽然紫苏叶提取物(50μg/ml、100μg/ml、200μg/ml)以浓度依赖性的方式抑制了pde5a活性,但是对pde3a活性的抑制没有任何的影响。即,在紫苏叶提取物50μg/ml、100μg/ml、200μg/ml浓度下,pde5a活性分别显示为51.23
±
0.29、42.42
±
0.13、36.58
±
0.37%的抑制率。由此可知,紫苏提取物通过cgmp机制影响平滑肌的舒张。
[0055]
5.3、[ca
2+
]i含量测定
[0056]
将作为钙离子敏感性荧光物质的乙酰氧基甲基酯形式的fura
‑
2/am(fura
‑
2/am;分子探针,eugene,or)用作钙离子标记物质。在阻断光的状态下,在hepes缓冲液中处理5μm fura
‑
2/am、0.001%f127和细胞,并在室温下反应60分钟。用hepes缓冲液洗涤数次后,使缓冲液流动5分钟并使其稳定。利用紫苏热水提取物(50μg/ml、100μg/ml、200μg/ml)按照浓度依次处理100秒。以相同方法将细胞稳定5分钟后,用每一种浓度的紫苏叶提取物处理100秒。
[0057]
另外,将细胞用内皮素
‑
1(et
‑
1;10nm)处理并刺激100秒,然后将紫苏热水提取物(50μg/ml、100μg/ml、200μg/ml)按照浓度依次处理100秒。此时,所有缓冲液和化学物质的处理是通过根据重力的灌注装置来实现。从灯发出的光通过计算机控制轮使波长为340nm和380nm的波长的光选择性地暴露于细胞上。并且以每2秒的间隔在340nm和380nm下拍摄了照片,并且通过515nm长通滤光片入射的发射器荧光经过冷却型ccd照相机并通过数字荧光
分析仪而获得340nm/380nm比率值。
[0058]
图6是示出紫苏叶提取物对主动脉平滑肌中的[ca
2+
]i浓度变化的图。对于紫苏叶提取物的主动脉平滑肌细胞(rcsmcs),紫苏叶提取物(50μg/ml、100μg/ml、200μg/ml)以浓度依赖性地减少与睫状体收缩相关的[ca
2+
]i的浓度含量。
[0059]
图7是示出紫苏叶提取物在主动脉平滑肌(hasmc)中对由et
‑
1(内皮素)诱导的[ca
2+
]i含量的抑制效果的图。将内皮素
‑
1(10μm)添加到hasmcs细胞中,来增加[ca
2+
]i的浓度含量,然后通过添加50μg/ml、100μg/ml及200μg/ml紫苏叶提取物来对[ca
2+
]i的浓度含量进行测定的结果,证实了紫苏叶提取物显著减少了[ca
2+
]i的浓度。
[0060]
实施例2.紫苏叶提取物中所包含的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷对从sd大鼠中分离的睫状肌细胞的眼疲劳的效果
[0061]
1.制备紫苏叶热水提取物以及分离黄酮配糖体化合物
[0062]1‑
1.制备紫苏叶水提取物
[0063]
利用蒸馏水在100℃下对紫苏干叶进行热水提取3小时。将上述提取物减压浓缩后进行冷冻干燥和喷雾干燥,并获得紫苏叶热水冷冻干燥物(650g,21.6%)和喷雾干燥物(669g,22.4%)。
[0064]1‑
2.利用甲醛系树脂hp
‑
20(diaion hp
‑
20resin)的有效成分的分离
[0065]
为了从紫苏叶提取物中分离有效成分,将2l的紫苏叶热水提取物添加至甲醛系树脂hp
‑
20中,并将水和甲醇依次以30:70、50:50、70:30、0:100的比例进行洗脱。最终通过2l的丙酮洗脱来获得5个分馏物。在5个分馏物中第一个小馏分(subfraction)(30:70)通过利用waters制备型hplc来获得化合物1(150mg,纯度96.7%)、化合物(250mg,纯度96.4%)。
[0066]
图8是从紫苏叶提取物中分离的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物分离模式图。
[0067]1‑
3.利用nmr的结构鉴定
[0068]
通过利用nmr和ms,分别将上述实施例1
‑
2中所获得的物质、化合物1和化合物2的结构鉴定为木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷和芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷。图9是示出从紫苏叶提取物中分离的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷、芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷成分结果的图。(a
‑
1):木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷的化合物结构;(a
‑
2):芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的hplc分析;(a
‑
3):木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷的紫外光谱(uv spectrum);(b
‑
1):芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的化合物结构;(b
‑
2):芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的hplc分析;(b
‑
3):芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的紫外光谱。
[0069]
分别鉴定的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷和芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的nmr及ms的分析结构如下。
[0070]
1)木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷的分析结构
[0071]
化合物1,浅黄褐色粉末,esi
‑
ms:639(m+h)
+
.1hnmr(500mhz,吡啶
‑
d5)δ4.25~4.74(1h,h
‑
1glua2),4.38~4.76(1h,d,j=7.2hz,h
‑
1glua1),4.92(1h,d,j=9.5hz,h
‑
5”),5.57(1h,d,j=8hz,h
‑
1”'),6.05(1h,d,j=7hz,h
‑
1”),6.82(1h,s,h
‑
3),7.13(1h,d,j=2hz,h
‑
6),7.17(1h,d,j=2hz,h
‑
8),7.21(1h,d,j=8.5hz,h
‑
5'),7.43(1h,dd,j=2.0,8.5hz,h
‑
6'),7.85(1h,d,j=2hz,h
‑
2')。
[0072]
13
cnmr(125mhz,吡啶
‑
d5)δ72.43(c
‑
4”),3.16(c
‑
4”'),6.02(c
‑
2”'),6.80(c
‑
5”),
7.40(c
‑
3”),7.62(c
‑
3”'),8.06(c
‑
5”'),3.89(c
‑
2”),5.61(c
‑
8),00.06(c
‑
1”),00.64(c
‑
6),03.77(c
‑
3),06.57(c
‑
1”'),06.75(c
‑
10),14.49(c
‑
2'),16.57(c
‑
5'),19.47(c
‑
6'),22.46(c
‑
1'),47.47(c
‑
3'),51.61(c
‑
4'),57.55(c
‑
5),62.46(c
‑
9),63.47(c
‑
7),65.00(c
‑
2),71.79(c
‑
6”'),72.37(c
‑
6”'),82.61(c
‑
4)。
[0073]
2)芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的分析结果
[0074]
化合物2,浅黄褐色粉末esi
‑
ms:623(m+h)
+
.1hnmr(500mhz,吡啶
‑
d5)δ4.25~4.65(1h,h
‑
1glua2),4.38~4.77(1h,d,j=7.2hz,h
‑
1glua1),4.95(1h,d,j=7h z,h
‑
5”),5.58(1h,d,j=8hz,h
‑
1”'),6.08(1h,d,j=7hz,h
‑
1”),6.81(1h,s,h
‑
3),7.13(1h,d,j=2hz,h
‑
6),7.16(1h,d,j=2hz,h
‑
8),7.20(1h,d,j=8.5hz,h
‑
5'),7.29(1h,dd,j=2.0,8.5hz,h
‑
6'),7.80(1h,d,j=8.5hz)。
[0075]
13
cnmr(125mhz,吡啶
‑
d5):72.46(c
‑
4”),3.16(c
‑
4”'),6.02(c
‑
2”'),6.83(c
‑
3”),7.43(c
‑
5”),7.63(c
‑
3”'),8.06(c
‑
5”'),3.95(c
‑
2”),5.60(c
‑
8),00.06(c
‑
1”),00.78(c
‑
6),03.69(c
‑
3),06.57(c
‑
10),06.79(c
‑
1”'),16.57(c
‑
3'),16.57(c
‑
5'),21.82(c
‑
1'),28.74(c
‑
2'),28.74(c
‑
6'),57.56(c
‑
5),62.46(c
‑
9),62.52(c
‑
4'),63.58(c
‑
7),64.63(c
‑
2),71.78(c
‑
6”'),72.36(c
‑
6”'),82.64(c
‑
4)。
[0076]
2.根据紫苏叶热水提取干燥方法的化合物等效性比较
[0077]
通过hplc对紫苏叶热水提取物冷冻干燥物和喷雾干燥物的化合物的等效性进行了成分分析。所使用的hplc装置为沃特斯系列hplc系统(沃特斯公司,美国马萨诸塞州枫树大街34),并且色谱柱使用了triart c18 plus(250
×
4.6mm,5um,ync co.ltd)。流动相为甲醇(流动相a)和hplc用蒸馏水(流动相b,0.1%甲酸),并且将甲醇的比例从30%(0
‑
10分钟)调节为30%~50%(10
‑
30分钟)、60%(35
‑
40分钟)、60~70%(40~45分钟)、70~100%(45~53分钟)、100%(53~56分钟),以及最后调节为30%(56~60分钟),流速为1ml/min,其通过二极管阵列检测器(2998)在254nm处进行分析。
[0078]
图10是示出根据紫苏叶热水提取物的冷冻干燥及喷雾干燥方法的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物的等效性的图。fd:冷冻干燥(freeze
‑
dried),sd:喷雾干燥(spray
‑
dried)。
[0079]
将3kg紫苏用蒸馏水水洗之后,再次加入30l蒸馏水,用电热水壶在100℃下加热、提取3小时。将所提取的溶液用400目滤布进行过滤之后,用旋转减压浓缩机来进行减压浓缩。利用冷冻干燥机(freeze dryer)来对所浓缩的一半的热水提取物进行冷冻干燥,并且将所剩的热水提取物用喷雾干燥机(spray dryer)进行喷雾干燥。紫苏叶热水提取物的冷冻干燥物和喷雾干燥物的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷的含量分别为40.14mg/g、41.11mg/g,并且芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷的含量分别为13.04mg/g,14.01mg/g,并由此确认等效性。
[0080]
3.从大鼠眼中分离睫状肌及细胞培养
[0081]
为了进行包含木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物为主要成分的紫苏叶提取物的睫状肌细胞实验,从3~4周龄的斯泼累格
·
多雷(sprague
‑
dawley)大鼠的眼中分离睫状肌。即,将分离的眼切成两半并将角膜部分(corneal portion)放入添加有木瓜蛋白酶(papain)溶液的15ml离心管中,并且在37℃下反应90分钟。将细胞悬浮液转移至新的15ml离心管中并在室温下进行离心分离(300xg,5分
钟)。除去上清液后,立即在dmem/f
‑
12(美国英杰生命技术有限公司
‑
gibco(胶原酶),美国纽约格兰德岛)培养基中培养细胞。
[0082]
4.用紫苏叶提取物测定从大鼠中分离的睫状肌细胞的存活率及no
[0083]
通过使用包含10%fbs的培养基将从大鼠眼中分离的睫状体细胞(rcsmcs)以1x 104细胞/孔的方式种植于96孔板,并培养3日。培养3日后,以50μg/ml、100μg/ml和200μg/ml浓度添加包含木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物为主要成分的紫苏叶提取物,并且在37℃、co2培养箱中进行反应24小时。反应后,将wst
‑
1溶液分别以100μl添加到各孔中,并在37℃下进行反应,然后利用制造商所提示的方法在450nm波长处利用酶标仪(microplate reader)来进行测定。
[0084]
一方面,通过如下方式进行no测定:利用包含10%fbs的培养基,将从大鼠眼中分离的睫状体细胞(rcsmcs)以5x 104细胞/孔的方式种植于96孔板,并培养3日。培养3日后,以50μg/ml、100μg/ml和200μg/ml浓度添加包含木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物为主要成分的紫苏叶提取物,并且在37℃、co2培养箱中进行反应24小时。通过利用格里斯反应(griess反应)来测定针对上层液的no测定。
[0085]
图11是紫苏叶提取物对从sd大鼠的眼中分离的睫状体细胞的细胞毒性及一氧化氮(no)生成效果的图。紫苏提取物冷冻干燥物的细胞毒性(a)和no含量(b)。50、100和200μg/ml的紫苏叶提取物以浓度依赖性方式增加了no含量,而没有细胞毒性。
[0086]
5.测定紫苏叶提取物对于从大鼠分离的睫状体细胞的camp和cgmp含量
[0087]
将从大鼠眼中分离的睫状体细胞(rcsmcs)以5x 104细胞/孔的方式种植于6孔中,稳定一日。使其稳定后,用3
‑
异丁基
‑1‑
甲基黄嘌呤(3
‑
isobuytyl
‑1‑
methylxanthine)(1mm)进行预处理10分钟,然后用紫苏叶提取物进行反应15分钟。通过利用elisa试剂盒来测定cgmp和camp含量。
[0088]
图12是示出紫苏叶提取物对从sd大鼠的眼中分离的睫状体细胞的cgmp和camp含量变化的图。紫苏叶提取物的冷冻干燥物的cgmp(a)和camp(b)含量变化量。紫苏叶提取物(50、100和200μg/ml)以浓度依赖性的方式增加了与睫状体舒张相关的cgmp含量,相反,紫苏叶提取物对camp含量变化没有影响。
[0089]
6.测定紫苏叶提取物对于从大鼠分离的睫状体细胞的[ca
2+
]i含量
[0090]
将作为钙离子敏感性荧光物质的乙酰氧基甲基酯形式的fura
‑
2/am(fura
‑
2/am;分子探针,eugene,or)用作钙离子标记物质。在阻断光的状态下,在hepes缓冲液中处理5μm fura
‑
2/am、0.001%f127和细胞,并在室温下反应60分钟。用hepes缓冲液洗涤数次后,使缓冲液流动5分钟并使其稳定。利用紫苏热水提取物(50μg/ml、100μg/ml、200μg/ml)按照浓度依次处理100秒。以相同方法将细胞稳定5分钟后,用每一种浓度的紫苏叶提取物处理100秒。
[0091]
此时,所有缓冲液和化学物质的处理是通过根据重力的灌注装置来实现,并且从灯发出的光通过计算机控制轮使波长为340nm和380nm的波长的光选择性地暴露于细胞上。并且以每2秒的间隔在340nm和380nm下拍摄了照片,并且通过515nm长通滤光片入射的发射器荧光经过冷却型ccd照相机并通过数字荧光分析仪而获得340nm/380nm比率值。
[0092]
图13是示出紫苏叶提取物对从sd大鼠的眼中分离的睫状体细胞的[ca
2+
]i浓度变化量的图。(a)紫苏叶提取物的冷冻干燥物对从sd大鼠中分离的睫状肌细胞的[ca
2+
]i含量
的影响,(b)紫苏叶提取物的冷冻干燥物对从sd大鼠中分离的睫状肌细胞的[ca
2+
]i含量变化量的影响。紫苏叶提取物(50μg/ml、100μg/ml和200μg/ml)以浓度依赖性的方式减少了与睫状体舒张相关的[ca
2+
]i浓度含量。
[0093]
7.通过紫苏叶提取物的动物实验来测定cgmp含量
[0094]
作为实验动物使用了体重为180~200g的5~6周龄雄性sd大鼠(samtaco)。在整个实验期间供应了固形饲料和水,以便可以自由摄取,并且在温度为23
±
3℃、湿度为50
±
20%、12小时明暗周期条件下进行饲养。并且使实验动物在饲养室中适应1周后,用于实验。所有实验程序均按照iacu指南以及全南生物产业振兴院自然资源研究中心的实验动物管理和使用指南来进行。
[0095]
动物实验组分为如下四个组:正常组,仅摄取蒸馏水3日后在最后一天未给予光;对照组,仅摄取蒸馏水3日后在最后一天进行光照射15分钟;紫苏提取物组,进行光照射并且摄取紫苏提取物3日以及在最后一天进行光照射15分钟的组,并且每组各分配5只动物。将动物处死之后,从sd大鼠摘取眼,然后立即用pbs来洗涤。对洗涤的眼进行均质化,然后通过离心分离来取上清液并利用cgmp elisa试剂盒来测定其含量。
[0096]
图14是示出在通过对大鼠的眼睛照射光而引起疲劳后,将100mg/kg、200mg/kg的紫苏叶提取物经口给药3日后,检测大鼠的眼睛中cgmp含量变化的图。与仅照射光的对照组相比,对于紫苏叶提取物(100mg/kg和200mg/kg),以200mg/kg浓度摄入的组中显著增加了cgmp含量,并证实了对睫状肌的舒张具有效果。
[0097]
8.测定从紫苏叶提取物中分离的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物的cgmp含量
[0098]
将从大鼠眼中分离的睫状体细胞(rcsmcs)以5x 104细胞/孔的方式种植于6孔中,稳定一日。使其稳定后,用3
‑
异丁基
‑1‑
甲基黄嘌呤(1mm)进行预处理10分钟,然后用从紫苏叶提取物中分离的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物,以0.01μg/ml、0.05μg/ml、0.1μg/ml及1μg/ml的浓度进行反应15分钟。通过利用elisa试剂盒来测定上述化合物的cgmp含量。
[0099]
图15是示出从sd大鼠的眼中分离的睫状体细胞(rcsmcs)的cgmp含量相对于紫苏叶提取物变化的图。证实了从紫苏叶提取物中分离的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物(0.01、0.05、0.1及1μg/ml)是增加与睫状体舒张相关的cgmp含量的成分。由此可知,从紫苏叶提取物中分离的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷成分影响眼疲劳效果。
[0100]
实施例3:眼调节的人体适用试验
[0101]
1.人体适用试验方法
[0102]
本研究在d大学附属医院医疗器械临床试验审查委员会(irb许可编号:dsgoh
‑
033)的批准下进行了临床试验。
[0103]
总共对35名年龄在18岁以上至60岁以下的成人男女进行了筛查,并且受试者在接受了本研究的说明文后自愿在书面上同意。没有先天性或慢性疾病;内科诊疗结果,没有病理症状或特征;血液检查和生命体征检查结果属于正常范围的;并且等效球面屈光度为
‑
3.00d以上的人通过筛查的结果,被选为最终研究对象的人总共有30人。本研究通过如下方式进行:服用紫苏提取物及安慰剂对照组,并且在进行最后服用前进行近距离作业(vdt)2
小时。
[0104]
2.调节近点(near point of accomodation)检查
[0105]
调节近点以如下方式进行测定:在矫正远距离折射异常的状态下,利用“上推(push
‑
up)”方法在40cm的距离遮住一只眼,使其清晰地注视近距离视力表的数字后,将其拉近未被遮住的被检查者的眼前,同时测量了最早出现模糊的模糊点状态的距离。检查右眼和左眼后检查双眼,并且使用反复测量3次的平均值。
[0106]
表1是示出紫苏叶提取物组和安慰剂(placebo)组的摄取前、摄取后调节近点的变化量。在紫苏叶提取物组和安慰剂组中对摄取前、摄取后实施视觉近距离作业2小时,之后对平均调节近点变化进行比较的结果如下:据统计在紫苏热水提取物组的右眼中,调节近点从摄取前的8.68
±
2.98cm有效减少至7.83
±
3.08cm(p〈0.001)。在左眼中,调节近点从摄取前的8.38
±
3.13cm有效减少至7.67
±
3.21cm(p〈0.001)。据统计,在双眼中调节近点也从摄取前的7.96
±
2.97cm有效减少至7.27
±
3.25cm(p〈0.001)。
[0107]
据统计,安慰剂(placebo)组的右眼中,调节近点从摄取前的8.90
±
2.60cm明显增加至9.63
±
2.40cm(p〈0.001)。左眼中,调节近点从摄取前的8.60
±
2.49cm明显增加至9.43
±
2.42cm(p〈0.001),并且据统计,在双眼中调节近点也从摄取前的9.00
±
2.45cm明显增加至9.67
±
2.48cm(p〈0.001)。
[0108]
表1
[0109]
紫苏叶提取物组和安慰剂组的摄取前、摄取后的调节近点的变化量
[0110][0111][0112]
单位:cm,*:p<0.05a:紫苏提取物组;b:安慰剂对照组
[0113]
工业利用性
[0114]
通过使用作为韩国天然资源的紫苏叶提取物中所包含的木犀草素
‑7‑
o
‑
二葡萄糖醛酸苷及芹菜素
‑7‑
o
‑
二葡萄糖醛酸苷化合物作为有效成分,即使长时间服用也可以无副作用地、安全地使用,能够有效地用作包含这些化合物的、具有通过改善眼疲劳的视力改善功能的改善用药物组合物及保健功能食品组合物。并且通过确认冷冻干燥物和喷雾干燥物化合物的等效性,可以期待通过降低生产成本和工业化来增加替代收入及增加农户收入。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1