一种金花茶叶提取物的提取方法及其神经保护用途与流程
背景技术:
随着生活节奏的加快,人口老龄化日益加深,与衰老和压力相关的神经、精神疾患也倍受关注。氧化应激是公认的脑衰老发生发展的重要病因,大脑衰老过程脑内氧化应激和脂质过氧化增加,使脑内氧化应激性损伤加剧。此外,压力与慢性应激性生活事件也是诱发大脑损伤的重要因素,可引起人体内皮质醇(动物为皮质酮)水平的持续升高,导致海马等脑区结构与功能的改变。这些损伤因素可导致大脑功能低下,诱发认知功能减退、老年痴呆及抑郁症等神经精神疾患。目前,从天然产物中寻找和研发神经保护剂,已成为防治相关疾病的重要策略。
金花茶是山茶科山茶属植物,分布种植范围较为限定,主要分布在广西西南部和越南北部。金花茶是一种具有极高的药用价值药食两用植物,民间又称金花茶为“神茶”,有“常饮金花茶健康又长寿”之说。叶作为金花茶花的副产品,近年来在金花茶资源开发中逐渐受到重视。研究表明金花茶叶主要含有多酚(黄酮)、多糖及皂苷类活性成分,具有抗肿瘤,抗氧化,降血糖和血脂等活性。作为民间的长寿神茶,在抗衰老方面,目前仅开展了简单的体外抗氧化评价,金花茶叶对于衰老相关的神经保护作用研究未见报道,限制了其相关药物和功能食品的开发。
技术实现要素:
针对上述未解决问题,本发明的目的在于提供一种金花茶叶提取物的提取方法及其神经保护用途,用于缓解衰老相关的氧化应激损伤。为金花茶叶提取物相关功能产品的开发提供科学的实验数据。
为实现上述目的,同时考虑金花茶叶的药品和食品相关用途,本发明提供了一种金花茶叶提取物的提取方法,该提取方法包括以下步骤:步骤a将金花茶叶晾干后粉碎,称取一定量的金花茶叶粉沫,用75%的乙醇提取液料比为1∶20,温度为70℃,冷凝回流反应1h;同样液料比提取至少3次。将上述滤液用旋蒸仪蒸发浓缩,得到粗提液。步骤b将粗提液采用正己烷按1∶1比例萃取3次,脱去正己烷部位;步骤c将上述的粗提液采用乙酸乙酯萃取,萃取比为1∶1,萃取3次,在45℃下旋蒸得到金花茶叶乙酸乙酯部位浓缩液;步骤d将步骤c中得到的浓缩液经真空冷冻或低温干燥,得到金花茶叶提取物,其中滤液进行浓缩、干燥的步骤,温度控制在不高于50℃。
本发明提供了金花茶叶提取物的神经保护用途,采用mtt法检测金花茶叶提取物对h2o2诱导的sh-sy5y细胞损伤具有明显的保护作用(测定细胞活力);采用dcfh-da法检测金花茶叶提取物显著降低h2o2诱导的细胞内活性氧(reactiveoxygenspecies,ros)水平升高;采用羟胺法测定金花茶叶提取物有效逆转h2o2诱导的细胞内超氧化物歧化酶(superoxidedismutase,sod)活力的降低;采用比色法测定金花茶叶提取物并缓解了h2o2对细胞内过氧化氢酶(catalase,cat)活力的损伤,发挥显著的细胞保护作用,对衰老相关的氧化应激性损伤发挥神经保护作用。
附图说明
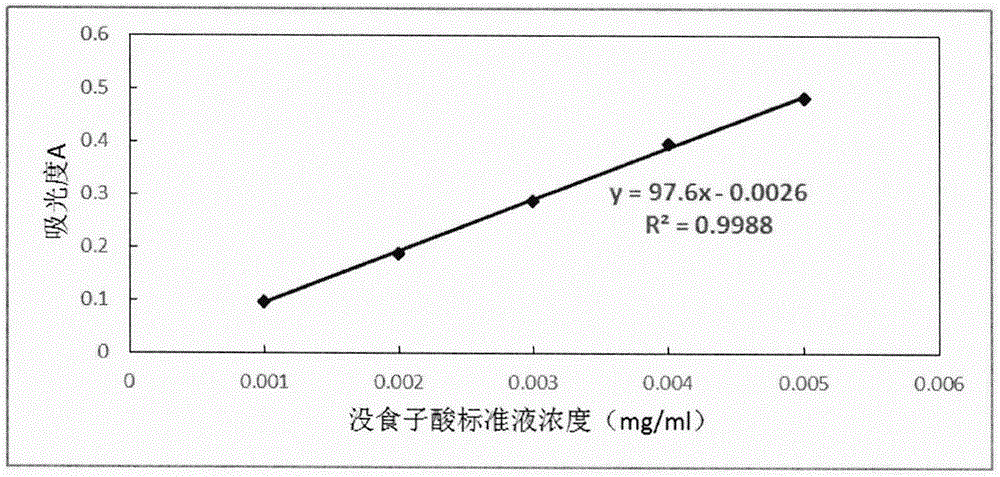
图1没食子酸标准曲线
图2芦丁标准曲线
图3不同浓度的h2o2对sh-sy5y细胞的损伤作用。柱状图代表各组均值±标准差,n=6.**p<0.01,与对照组比较
图4金花茶叶提取物对h2o2损伤细胞的保护作用。柱状图代表各组均值±标准差,n=6.##p<0.01,与对照组比较;**p<0.01,与模型组比较
图5金花茶叶提取物对h2o2损伤模型细胞内ros的影响。柱状图代表各组均值±标准差,n=6.##p<0.01,与对照组比较;**p<0.01,与模型组比较
图6金花茶叶提取物对h2o2损伤模型细胞内的sod活力的影响。柱状图代表各组均值±标准差,n=6.#p<0.05,与对照组比较;**p<0.01,与模型组比较
图7金花茶叶提取物对h2o2损伤模型细胞内的cat活力的影响。柱状图代表各组均值±标准差,n=6.##p<0.01,与对照组比较;**p<0.01,与模型组比较
图8不同浓度的皮质酮对pc12细胞的损伤作用。柱状图代表各组均值±标准差,n=6.**p<0.01,与对照组比较
图9金花茶叶提取物对皮质酮损伤细胞的保护作用。柱状图代表各组均值±标准差,n=6.##p<0.01,与对照组比较;**p<0.01,与模型组比较
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。本领域的技术人员应当理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均在本发明的保护范围。
具体实施中用到的实验设备电子天平(上海舜宇恒平科学仪器有限公司),循环水式多用真空泵(郑州长城科工贸有限公司),旋转蒸发仪(上海亚荣生化仪器厂),恒温水浴锅(上海精宏实验设备有限公司),高速多功能粉碎机(永康市铂欧五金制品有限公司),真空冷冻干燥机(德国christ公司),酶标仪(瑞士tecan公司),台式低速离心机(湖南赫西仪器装备有限公司),涡旋震荡仪(海门市其林贝尔仪器制造有限公司),紫外分光光度计(上海舜宇恒平科学仪器有限公司),超净工作台(美国nuaire公司),co2培养箱(英国rebiotech),倒置相差显微镜(德国zeiss公司)。
实验例1
金花茶叶提取物的提取
本发明提供了一种金花茶叶提取物的提取方法,总的提取方法包括以下步骤:步骤a将金花茶叶晾干后粉碎,称取一定量的金花茶叶粉末,用75%的乙醇提取,液料比为1∶20,温度为70℃,冷凝回流反应1h,同样液料比提取至少3次得到滤液。将上述滤液用旋蒸仪蒸发浓缩,得到粗提液。步骤b将粗提液采用正己烷按1∶1比例萃取3次,脱去正己烷部位;步骤c将上述的粗提液采用乙酸乙酯萃取,萃取比为1∶1,萃取3次,45℃下旋蒸得到金花茶叶乙酸乙酯部位浓缩液。步骤d将步骤c中得到的浓缩液经真空冷冻或低温干燥,得到金花茶叶提取物,其中滤液进行浓缩、干燥的步骤,温度控制在不高于50℃。金花茶叶提取物收率约为3.57%。
实验例2
金花茶叶提取物多酚含量测定
在本发明提供的一种具有神经保护作用的金花茶叶提取物提取方法确立过程中,用福林酚比色法测定样品多酚含量。首先用没食子酸标准品建立多酚含量测定的标准曲线,精确称取5mg没食子酸标准品,用去离子水配制质量浓度为0.1mg/ml的没食子酸标准液。分别量取0、0.250ml、0.500ml、0.750ml、1.000ml、1.250ml、1.500ml没食子酸标准液于试管中,加入5ml超纯水和2.5ml10%福林酚试剂,漩涡震荡,混匀静置3min后加入12%(w/v)na2co3溶液1ml,用去离子水定容至25ml,室温下反应1h后,在765nm波长下测定吸光度值。金花茶叶提取物样品稀释至一定浓度后取1ml按照上述方法进行总多酚的测定。标准曲线见图1,经过本发明提供的一种具有神经保护作用的金花茶叶提取物的提取方法得到的金花茶叶提取物的多酚含量>6%,约为292.1±9.8mg当量没食子酸/g干重。
实验例3
金花茶叶提取物黄酮含量测定
用芦丁标准品建立黄酮含量测定的标准曲线,精确称取5mg芦丁,用70%乙醇定容至25ml。分别准确吸取0、0.5、1.0、1.5、2.0ml芦丁标准溶液,放入10毫升容量瓶内,分别加入相应体积的70%乙醇溶液补足至5ml;再加入5%亚硝酸钠溶液0.3ml摇匀,放置6min:加入10%氯化铝溶液0.3ml,放置6min;加入4%氢氧化钠溶液4.0ml,加入70%乙醇将总体积补足至10ml并摇匀后,放置15min;在510nm处用分光光度计测定吸光度。称取一定量的金花茶提取物溶解后取1ml在相同条件下测定吸光度。芦丁标准曲线见图2。经过本发明提供的一种具有神经保护作用的金花茶叶提取物的提取方法得到的金花茶叶提取物的黄酮含量>8%,约为774.7±26.4mg当量芦丁/g干重。
实验例4
金花茶叶提取物在细胞氧化应激模型中保护作用评价
应用h2o2诱导的sh-sy5y细胞损伤模型评价金花茶叶提取物的神经保护作用,试验包括细胞活力、ros、cat活性和sod活性的测定。
一、金花茶叶多酚对h2o2诱导sh-sy5y细胞损伤的保护作用研究
采用h2o2诱导sh-sy5y细胞损伤模型评价其的神经保护作用,并采用dcfh-da法检测金花茶叶提取物对h2o2诱导的细胞内ros水平的影响,采用羟胺法测定金花茶叶提取物对h2o2诱导的细胞内sod活力的影响;采用比色法测定金花茶叶提取物对h2o2损伤细胞内cat活力的影响,探讨金花茶叶提取物神经保护机制。
h2o2损伤模型的建立:sh-sy5y细胞用dmem培养基(10%fbs+1%青霉素-链霉素双抗,ph7.4),置于培养箱(37℃,5%co2)培养。取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置100、200、400、600、800μmol/l的h2o2,每个浓度为一组,每组设置6个复孔,分组滴加至细胞孔,孵育6h。按mtt法测定细胞活力:
式中:a处理组为加药组细胞孔的吸光度;a空白组为无细胞空白对照组的吸光度;对照组为不加药组细胞孔的吸光度。
根据实验结果,确定用200μm浓度h2o2构建模型。
二、金花茶叶提取物对h2o2损伤模型的保护作用
取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,向96孔板的各孔滴加100μl细胞悬液,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置金花茶叶提取物提取液,混匀后通过滤器除菌,向各细胞孔加入100μl金花茶叶提取液,每组六个复孔,孵育12h。在损伤组和金花茶叶提取物保护组加入100μl的浓度为200μmol/l的h2o2,孵育6h。mtt法及细胞活力计算同上。
金花茶叶提取物对h2o2损伤细胞内ros的影响:采用dcfh-da方法检测细胞内ros表达水平。取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,向96孔板的各孔滴加100μl细胞悬液,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置金花茶叶提取物提取液,混匀通过滤器除菌,向各细胞孔加入100μl金花茶叶提取液,孵育12h。吸取10μl的dcfh-da加入到10ml的pbs中进行稀释至浓度为10μm,吸出金花茶叶提取物提取液后加100μl的dcfh-da稀释液,孵育40min。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的dcfh-da。加入200μm的h2o2100μl,孵育6h。在荧光酶标仪上,于激发波长500,发射波长530,测定孔荧光强度(fluorescenceintensity,f)
其中:f处理组为处理组细胞孔的荧光强度;f对照组为对照组的荧光强度;f空白组为空白组的荧光强度。
金花茶叶提取物对h2o2损伤细胞内sod、cat活性的影响:取对数期的sh-sy5y细胞,制成单细胞悬液,细胞计数,按照1×105个/ml的密度接种于6孔板中,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置金花茶叶提取物提取液,混匀后通过滤器除菌,向各细胞孔加入2ml金花茶叶提取液,孵育12h。在损伤组和金花茶叶提取物保护组加入2ml的浓度为200μmol/l的h2o2,孵育6h。弃去培养基,用pbs洗净后加入裂解液(1.21g/ltrisbase,3.72g/ledta,10g/ltritonx-100,4g/lsds)冰上裂解,30分钟后将细胞裂解液移至离心管,3000转/分离心15min,吸取上清液待用。
用bca法测定细胞裂解液蛋白浓度。细胞裂解上清液用三蒸水稀释3倍。混匀,每管吸取同样量至96孔培养板,静置10min,在酶标仪上采用波长562nm检测各管od值。计算公式:
注:a、b和c的分别指代空白管、标准管和测定管的od值。单位g/l
采用羟胺法测定金花茶叶提取物对h2o2损伤细胞内sod活性的影响。按sod测定试剂盒说明书操作。按下列公式计算:
采用比色法测定金花茶叶提取物对h2o2损伤细胞内cat活性的影响。按cat测定试剂盒说明书操作,取0.05ml细胞裂解上清液,与试剂混匀后与405nm波长处,测定吸光度。计算公式:
注:271为斜率的倒数,单位u/mgprot表示每mg蛋白每秒钟分解1μmol的h2o2的量。
cat、sod的活性最终表示为空白组的百分比,并使用以下等式计算:
由图3结果可知h2o2可浓度依赖性的(100μm、200μm、400μm、600μm、800μm)对sh-sy5y产生损伤作用。根据文献报道细胞损伤的存活率在40~60%时适合开展细胞保护作用及机制研究,在本实验中200μmol/l的h2o2损伤6h后sh-sy5y细胞存活率在63%左右(p<0.01),因此选用这个损伤条件建立氧化应激模型。由图4结果可知,不同浓度的样品对h2o2损伤的细胞均有保护作用,且各组存活率随浓度升高而上升。当浓度大于150μg/ml时,细胞存活率接近空白对照组。可见,金花茶叶提取物对于h2o2损伤的sh-sy5y细胞有明显的保护作用。
图5为不同浓度金花茶叶提取物对h2o2损伤细胞内ros水平的影响,由结果可知,本发明提供的一种具有神经保护作用的金花茶叶提取物提取方法得到的金花茶叶提取物能够显著降低由h2o2引发的ros水平的升高(p<0.01)。
由图6和图7可知,h2o2可引发细胞内可知200mmh2o2处理sh-sy5y细胞后,细胞内cat和sod分别降至67.9%和59.4%。加入不同浓度样品后,cat和sod活性明显升高。说明金花茶提取物具有显著增强细胞内抗氧化酶活性作用,这可能是其抗细胞氧化应激性损伤的机制之一。
实验例5
金花茶叶提取物在皮质酮诱导的细胞损伤模型中保护作用评价
一、皮质酮损伤模型的建立
pc12细胞用rpmi1640培养基(10%hs+5%fbs+1%青霉素-链霉素双抗,ph7.4),置于培养箱(37℃,5%co2)培养。取对数生长期的pc12细胞,将密度调整为1×104个/ml,以每孔100μl接种于无菌96孔培养板,待细胞融合度达到70%~80%,弃去培养基,加入不同浓度梯度的皮质酮(100-250μm),每组6个复孔,作用24h后移除培养基并加入10μlmtt,37℃避光孵育4h后,加入90μldmso,震荡混匀10min,设置酶标仪570nm波长并检测各孔吸光值,按下列公式计算相对细胞活力:
由图8结果可知皮质酮可浓度依赖性的(100μm、150μm、200μm、250μm)对pc12细胞产生损伤作用。在本实验中150μmol/l的h2o2损伤24h后pc12细胞存活率在60%左右(p<0.01),适宜展开后续实验,因此选用这个损伤条件建立模型。
二、金花茶叶提取物对皮质酮损伤模型的保护作用
取对数期的pc12细胞,制成单细胞悬液,细胞计数,按照1×104个/ml的密度接种于96孔板中,向96孔板的各孔滴加100μl细胞悬液,孵育过夜并观察,当细胞面积占孔的80%左右时进行实验。用无血清培养基配置金花茶叶提取物提取液,混匀后通过滤器除菌,向各细胞孔加入100μl金花茶叶提取液,每组六个复孔,孵育12h。弃去培养基,在损伤组和金花茶叶提取物保护组加入100μl的浓度为150μm的皮质酮,孵育24h后用mtt法测定细胞活力。
由图9结果可知,不同浓度的样品对皮质酮损伤的细胞均有保护作用,且各组存活率随浓度升高而上升。当浓度为100或150μg/ml时,细胞存活率显著提升(p<0.05);可见,样品对于皮质酮诱导损伤的细胞模型具有明显的保护作用。
- 还没有人留言评论。精彩留言会获得点赞!