抑制Rac1表达的干扰RNA及在增加乳腺癌化疗敏感性中的应用的制作方法
本发明涉及生物领域,尤其是涉及一种抑制rac1表达的干扰rna及在增加乳腺癌化疗敏感性中的应用。
背景技术:
癌症发病率呈逐年上升趋势,目前已成为威胁人类健康最严重的疾病之一。
目前,化疗仍是癌症治疗的基石,但是化疗药缺乏靶向性,对肿瘤细胞杀伤的同时对正常的细胞也极大的损害,这导致部分患者无法耐受化疗副作用而中断治疗。而且很多接受化疗的患者,在治疗一段后容易产生耐药性。
目前,还研制了一些新型的抗癌药物,例如分子靶向药、抗体偶联药物、rna干扰技术以及纳米药物等。
已经发现在肿瘤细胞中有多种癌驱动相关基因,癌驱动相关基因在肿瘤中和在肿瘤微环境中高表达,与肿瘤的发生发展及转移密切相关。现阶段,针对癌驱动相关基因的分子靶向药(如针对her2+肿瘤的拉帕替你)在临床上广泛使用。然而,类似于化疗药,分子靶向药同样具体毒副作用;而且患者接受分子靶向药治疗一段时间后,也容易出现耐药性。
抗体偶联药物(antibody-drugconjugates,adcs)是将具有靶向性质的抗体和强细胞毒性的药物(主要是化疗药)偶联而成的一种新型抗肿瘤药物,主要由靶向性的抗体,偶联的药物和抗体与药物之间的连接子构成。抗体偶联药虽然可以提高化疗药物靶向性,但在血液循环中不稳定,容易分解,导致最终治疗结果不理想。
rna干扰(rnainterference,rnai)技术近年来发展迅速,在多种疾病的治疗应用中潜能巨大。和小分子靶向药物比较,sirna对靶点的选择性会更好,能够特异性结合靶基因并下调靶基因表达,而且不会影响细胞中其它正常基因的表达。但是rnai技术在临床转化时最大难题是缺少低毒高效的载体将sirna输送到病灶部位和细胞内。对于基于rnai技术的癌症治疗,sirna在输送过程还需要解决一系列生理屏障,例如如何靶向肿瘤细胞、穿透肿瘤组织和细胞膜、从内涵体高效逃逸以及在细胞质内有效释放sirna等。虽然使用传统的病毒载体如腺病毒和逆转录病毒传递sirna可以克服上述各种生理屏障,但具有制备困难、sirna容量小、靶向特异性差、免疫原性强等缺点。
纳米药物由纳米载体和化疗药物组成,其中化疗药物被包埋在纳米载体中,是一类新的肿瘤化疗药物,如白蛋白紫杉醇和脂质体阿霉素。相对于普通的化疗药物,纳米药物改变其体内代谢方式和器官分布情况,纳米药物在提高肿瘤治疗效果的同时,显著降低毒副作用,改善肿瘤患者的生活质量;但是,目前的临床上使用的纳米药物仍具有药物释放不可控、治疗方式单一等弊端。
技术实现要素:
本发明旨在克服上述现有技术的至少一种缺陷(不足),发明提供了一种抑制rac1表达的干扰rna及在增加乳腺癌化疗敏感性中的应用。
本发明采取的技术方案是,一种抑制rac1表达的干扰rna(sirna),所述干扰rna的基因序列为5’-agacggagctgtaggtaaa-3’,如seqno.1所示;或,所述干扰rna的基因序列为5’-cctttgtacgctttgctca-3’,如seqno.2所示。
在之前研究中,rac1基因主要和肿瘤的侵袭和转移相关,申请人首次发现该基因与化疗耐药性有关。rac1在乳腺癌细胞系中比乳腺癌正常上皮细胞系mcf10a高表达,其中在三阴性乳腺癌细胞系中表达最高。因此,本发明通过用sirna在乳腺癌细胞系中沉默rac1的表达,发现敲低rac1后,化疗药(顺铂,阿霉素,多西他赛等)在细胞针对生长能力、平板克隆和凋亡中都发挥更明显的细胞毒性作用;并且,敲低rac1后,细胞的dna损伤修复时间延长,也就是说,rac1还通过影响dna损伤来影响细胞对化疗的敏感性。本发明提供了一种抑制rac1表达的干扰rna,通过敲低rac1提高癌细胞的化疗敏感性。
因此,本发明提出了将靶向耐药基因rac1的sirna——sirac1应用于增加乳腺癌化疗敏感性。
本发明提供了一种乳腺癌化疗药物,包括上述的抑制rac1表达的干扰rna、化疗药物以及用于运输所述干扰rna和所述化疗药物的肿瘤微环境响应的载体。
本方案使用对肿瘤微环境响应(如酸响应、乏氧响应、酶响应等)的纳米载体材料,同时包载靶向耐药基因的sirna和化疗药物。由于这些纳米载体能在血液循环和正常生理组织中稳定存在;到达肿瘤部位后,能够对肿瘤细胞内外微环境做出快速响应,加快sirna的释放效率,显著提高基因治疗效果并减轻毒副作用;同时该纳米载体材料还同时负载sirna和化疗药物,可显著抑制与化疗耐药相关基因表达,提高化疗敏感性,协同杀伤肿瘤细胞并降低对正常组织细胞的损伤。
进一步地,所述载体为酸性ph响应的高分子聚合物。
进一步地,所述载体的响应ph值为6.0~6.5。研究发现,人体正常血液循环及组织的ph约为7.4,而肿瘤区域由于其代谢旺盛,处在缺氧环境中,有过多的乳酸代谢物产生,使肿瘤组织微环境呈弱酸性(ph6.5),此外,细胞内涵体的基质环境ph值约为5.5~6.0。本发明使用该材料制备的纳米载体共输送sirna和化疗药物时,能够对内涵体的酸性ph做出响应,加快sirna和化疗药物的胞内释放,沉默化疗耐药相关的靶基因并增加化疗敏感性,协同杀伤肿瘤细胞。
优选地,所述纳米载体的响应ph值为6.24。
进一步地,所述纳米载体为嵌段聚合物聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯)(polyethyleneglycol-b-poly(2-(diisopropylamino)ethylmethacrylate),peg-b-pdpa)。本发明所采用的酸敏高分子材料为peg-b-pdpa,该酸敏高分子材料的pka为6.24。
进一步地,所述化疗药物包括顺铂前药(ddpprodrug)、阿霉素(dox)或多西他赛(dtx)。
与现有技术相比,本发明的有益效果为:
(1)本发明提供了一种抑制rac1表达的干扰rna,该干扰rna能够高效的抑制rac1基因的表达。由于rac1与乳腺癌的化疗耐药有关,并且和乳腺癌的分期及生存预后相关,其通过影响细胞的dna损伤进而影响细胞的化疗敏感性。本发明通过敲低rac1能够提高癌细胞的化疗敏感性。
(2)本发明所提供的乳腺癌化疗药物采用酸敏的纳米材料作为载体,能高效输送sirna和化疗药物到肿瘤细胞内,在血液中的循环时间较长,在肿瘤中富集量高;同时包载有sirna和化疗药物,sirna能够高效沉默靶基因,有效抑制耐药基因表达,再结合化疗药物能够大大增强对肿瘤细胞的杀伤,显著提高肿瘤化疗效果,且对正常组织细胞毒副作用小,对心、肝等重要器官无明显损伤。
附图说明
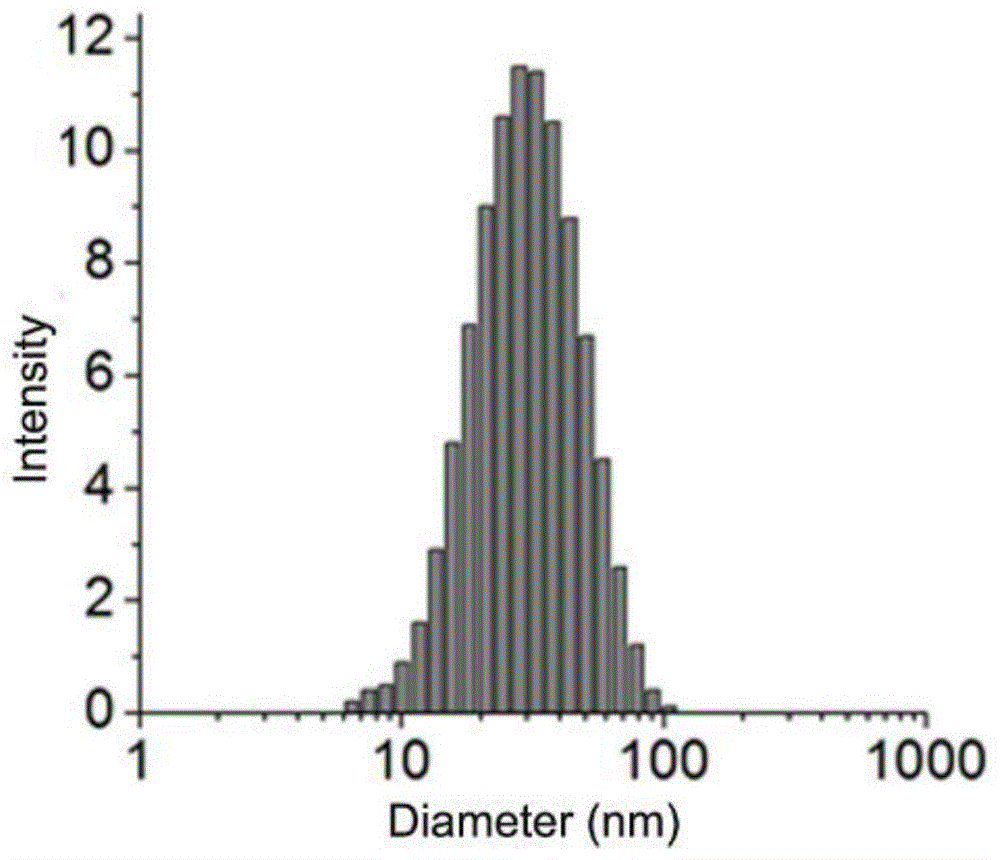
图1为靶向化疗制剂的纳米粒子的尺寸分布图。
图2为靶向化疗制剂的纳米粒子微观形貌图。
图3为靶向化疗制剂在不同ph水溶液中释放曲线。
图4为载有荧光染料标记sirna和顺铂前药的纳米粒子与细胞培养1小时和4小时后荧光照片。
图5为敲低rac1对于化疗药对细胞生长能力的影响。
图6为敲低rac1对于化疗药对细胞克隆形成能力的影响。
图7为敲低rac1对于化疗药导致的细胞凋亡情况的影响。
图8为敲低rac1对于化疗药对细胞dna的损伤的影响(γ-h2ax为dna损伤标志)。
图9为敲低rac1对于dna的损伤修复的影响(γ-h2ax为dna损伤标志)。
图10为纳米粒子在不同浓度sirna浓度下,敲低目标基因和损伤dna的效率。
图11为各治疗组肿瘤的生长曲线及肿瘤重量示意图。
图12为各治疗组裸鼠心、肝、脾、肺、肾的病理组织染色图。
具体实施方式
下面结合具体实施方式对本发明作进一步阐述,但本发明并不限于以下实施方式。
实施例
本实施例提供了一种乳腺癌化疗药物,包括内涵体酸性ph响应的纳米载体,所述纳米载体中包载有sirna和化疗药物,sirna能够敲低癌细胞的耐药基因rac1的表达。
其中,该sirna为抑制rac1表达的干扰rna,其基因序列可以是5’-agacggagctgtaggtaaa-3’(sirac1-1),如seqno.1所示,其基因序列也可以是5’-cctttgtacgctttgctca-3’(sirac1-2),如seqno.2所示。
在本实施例中,该纳米载体采用的是聚乙二醇-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯)(peg-b-pdpa),其响应ph值在细胞内涵体的基质环境ph值范围内,也就是说,纳米载体的响应ph值为6.0~6.5。在实际应用中,纳米载体并不仅仅限定于peg-b-pdpa,只要响应ph值在细胞内涵体的基质环境ph值范围内即可。
在本实施例中,化疗药物采用顺铂前药。除此之外,还可以采用阿霉素或多西他赛。
其中,上述靶向化疗制剂的制备方法具体为:使用纳米沉淀法制备载有sirna和顺铂前药的纳米粒子。选取二甲基甲酰胺作为溶剂,分别配置peg-b-pdpa和顺铂前药的溶液。随后取peg-b-pdpa溶液、顺铂前药溶液、sirna水溶液,与阳离子脂质体的溶液混合,在搅拌条件下,逐滴加入到去离子水中。随后将纳米溶液转移至超滤膜中(emdmillipore,mwco100k),离心分离纳米粒子,使用去离子水洗涤两次后,收集纳米粒子并将其分散到1ml磷酸缓冲盐溶液(pbs缓冲溶液)中备用。采用该方法得到的纳米粒子即为本实施例所提供的靶向化疗制剂。
使用nano-zszen3600型粒径仪测定纳米粒子的尺寸。使用tecnaig20s-twin型的tem观测纳米粒子的形貌。载有sirna的纳米粒子的尺寸分布和微观形貌分别见图1和图2。
(1)靶向化疗制剂控制释放包载的sirna和顺铂前药
按照上述方法制备载有荧光染料标记sirna和顺铂前药的纳米粒子。多次洗涤后,将其分散在1mlpbs中。将该纳米粒子溶液转移至透析管中,随后将透析管放置于37℃的pbs水溶液中(ph=7.4或ph=6.0)。每个4h取出5μl纳米粒子溶液并加入到100μl二甲亚砜溶液,使用荧光分光光度计测量荧光染料的荧光强度。sirna的累计释放率按下面公式计算:累计释放量(%)=(mt/m∞)×100;其中mt是在指定时间点从纳米粒子里释放出的sirna或顺铂前药,m∞是纳米粒子里负载的sirna或顺铂前药总量。
测试结果如图3所示,由图中曲线可知,纳米粒子在ph=6.0的环境下能很快将sirna和顺铂前药全部释放出来,而在ph=7.4的环境下的释放量很小。因此,本实施例所提供的纳米粒子能高效输送sirna和化疗药物到肿瘤细胞内,在血液中的循环时间较长,在肿瘤中富集量高;同时还能在内涵体中能快速释放sirna和化疗药物。
(2)内涵体逃逸性能检测
将细胞接种在6孔板中,加入1ml含10%胎牛血清的培养基孵育24小时,让其充分贴壁。随后加入载有荧光染料标记sirna和顺铂前药的纳米粒子。孵育4小时后,移去培养基并用pbs冲洗细胞三次。加入lysotrackergreen和hoechst33342分别标记内涵体和细胞核,使用激光共聚焦显微镜观测纳米粒子的内涵体逃逸。
如图4所示是载有荧光染料标记sirna和顺铂前药的纳米粒子与细胞培养1小时和4小时后荧光照片;其中,endosomes为内涵体的荧光照片(绿色),sirac1为载有荧光染料标记sirna的荧光照片(红色),dapi为染料dapi的荧光照片(蓝色),merge为重叠后的荧光照片。由图4可知,在1小时时,由于聚合物刚开始位于内涵体中酸性环境下,sirna的红色荧光基本上与内涵体的绿色荧光完全重合,说明sirna主要位于内涵体中,sirna由纳米粒子先运输到内涵体中;到4小时时,sirna的红色荧光已脱离了内涵体的绿色荧光,也就是说,sirna已经完全从内涵溶酶体中逃逸出来而进入到细胞质中。
(3)敲低rac1增加乳腺癌细胞dna损伤,增加化疗敏感性
rac1在乳腺癌细胞系中比乳腺癌正常上皮细胞系mcf10a高表达,其中在三阴性乳腺癌细胞系mda-mb-231中表达最高,故我们用sirna在mda-mb-231中沉默其表达,研究其功能。
1)mts法测细胞增殖能力
将mda-mb-231分为三组,分别转染阴性对照sirna(sictl)和两条靶向敲低rac1的sirna(sirac1-1,sirac1-2)(其中,sirac1-1的基因序列见seqno.1;sirac1-2的基因序列见seqno.2;sictl的基因序列为5’-uaaggcuaugaagagauac-3’,见seqno.3),转染48小时后将各组等量的细胞(1000个/孔)种于黑色96-孔板(透明底),每组细胞六孔重复。当细胞贴壁后,分别加或不加5μm的化疗药顺铂(ddp)、2.5μm阿霉素(dox)和1nm多西他赛(dtx)。顺铂和阿霉素处理组分别于第1-5天测定细胞的增殖情况,多西他赛组在0(不加药),2,4,6,8天测定细胞增殖情况,细胞经pbs清洗两遍,后加入mts试剂(1:10溶于细胞培养基),37℃孵育2h后将96孔板置于glomaxmultidetectionsystem仪器读数。吸收波长为492nm。测定吸光度od值。
由图5可以看出,敲低rac1能增强化疗药对细胞生长能力的抑制。
2)平板克隆实验
将mda-mb-231分为三组,分别转染阴性对照sirna(sictl)和两条靶向敲低rac1的sirna(sirac1-1,sirac1-2),转染48小时后将各组等量的细胞(1000个/孔)种于6孔板中,每组重复3次。当细胞贴壁后,分别加或不加5μm的化疗药顺铂(ddp)、2.5μm阿霉素(dox)和1nm多西他赛(dtx)。化疗药处理2h后撤药,10-14天后用10%多聚甲醛固定15分钟,15%结晶紫染色15分钟,统计大于5mm的克隆形成。
由图6可以看出,敲低rac1能增强化疗药对细胞克隆形成能力的抑制。
3)流式细胞技术测定凋亡
将mda-mb-231分为三组,分别转染阴性对照sirna(sictl)和两条靶向敲低rac1的sirna(sirac1-1,sirac1-2),转染48小时后将各组等量细胞(1×105个)分别染上annexiniv(20μg/ml)和propidiumiodide(50μg/ml),37℃孵育15min,用cytomicstmfc500机器进行分析。
由图7可以看出,敲低rac1能增强化疗药导致的细胞凋亡。
4)westernblotting测定dna损伤
将mda-mb-231分为三组,分别转染阴性对照sirna(sictl)和两条靶向敲低rac1的sirna(sirac1-1,sirac1-2),转染48小时后,分别加或不加5μm的化疗药顺铂(ddp),2.5μm阿霉素(dox)和1nm多西他赛(dtx)。24h后提取蛋白,进行westernblotting实验。一抗:rac1(millipore,1:1,000),γh2ax(cellsignaling,1:1,000),gapdh(cellsignaling,1:10,000)。二抗:羊抗兔(cellsignaling,1:5,000),羊抗鼠(1:5,000)。
由图8可以看出,敲低rac1能增强化疗药对细胞dna的损伤。
5)免疫荧光测定dna损伤恢复
将mda-mb-231分为三组,分别转染阴性对照sirna(sictl)和两条靶向敲低rac1的sirna(sirac1-1,sirac1-2),转染48小时后,用射线照射15min后分别在0h、0.5h、12h、24h、48h用10%进行免疫荧光检测。γh2ax(cellsignaling,1:200),荧光二抗(alexafluor488,thermofisher,1:200),dapi(solarbio,1:10)。
由图9可以看出,敲低rac1能够延迟dna的损伤修复。
由图5~9可以看出,敲低rac1后,化疗药(顺铂(ddp),阿霉素(dox),多西他赛(dtx)在细胞针对生长能力、平板克隆和凋亡中都发挥更明显的细胞毒性作用。众所周知,化疗药对细胞的杀伤作用主要是直接或间接对细胞dna的损伤,我们发现,敲低rac1能增强化疗药物对细胞dna的损;并且,敲低rac1后,细胞的dna损伤修复时间延长。我们发现rac1通过影响dna损伤影响细胞对化疗的敏感性。
(4)目标基因沉默和化疗药物作用体外效率
将乳腺癌mda-mb-231细胞接种在6孔板(每孔10,000个细胞)中,加入2ml含10%胎牛血清的培养基孵育24小时,让其充分贴壁。随后加入不同浓度的载有sirac1(rac1高表达与化疗耐药相关)和顺铂(ddp)的prodrug的纳米粒子。孵育24小时后,将细胞换液再孵育48小时。提蛋白后进行westernblot检测rac1的表达和γ-h2ax的表达(dna损伤的标志,检测ddp的药效)。
图10是纳米粒子在不同浓度sirna浓度下,敲低目标基因和损伤dna的效率。由图10可以看出,随着sirac1的浓度升高,rac1的表达被抑制的程度越高,γ-h2ax的表达越高,dna损伤越强。当sirac1的浓度达到50nm时,rac1的表达几乎完全消除。
(5)目标基因沉默和化疗药物作用体内疗效
我们在体内验证载sirac和顺铂(ddp)的prodrug的纳米粒子的作用,把25只裸鼠分5组,在背部皮下种植1×107的mda-mb-231细胞,等待瘤子长大到体积约150mm3时我们分别给予1)pbs200ul(control);2)单纯的peg-b-pdpa纳米材料(nps);3)载有sirac1的纳米材料(nps+siraac1);4)载有ddpprodrug的纳米材料(nps+ddp);5)载有sirac1和ddpprodrug的纳米材料(nps+ddp+siraac1)。隔天尾静脉注射200ul(sirac1为1nmol),注射3次后观察约3周。
由图11可以看出,nps+ddp+siraac1组的治疗效果最好。对各组裸鼠进行心、肝、脾、肺、肾进行he染色,结构如图12所示,由图12可知各治疗组的重要器官均无损伤。
总的来说,本实施例采用了一种对细胞内涵体ph响应的高分子嵌段聚合物作为纳米平台(载体),该平台可以通过易于操作的聚合物合成技术进行合成,并纳米粒子合成过程中可按比例进行构建,能高效输送sirna和prodrug到肿瘤细胞内,通过有效沉默靶基因,并且肿瘤胞浆内的还原性谷胱甘肽(gsh)等还原性物质可把prodrug的疏水基团进行剪切,释放出化疗药物,达到治疗肿瘤的目的。
本实施例的有益效果包括:1、在血液中的循环时间较长;2、在肿瘤中富集量高;3、pdpa的pka(~6.24),在内涵体ph(6.0-6.5)中能加快sirna和prodrug释放;4、可高效沉默靶基因;5.增加对肿瘤细胞的杀伤,把sirac1和ddpprodrug载进纳米平台,在体外和体内都表现出很好的肿瘤杀伤作用,并且对心、肝等重要器官无明显损伤。
显然,本发明的上述实施例仅仅是为清楚地说明本发明技术方案所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!