一种用于腔隙注射治疗骨关节炎的人源脐带间充质干细胞注射液的制备方法与流程
本发明涉及生物医药技术领域,更具体的说,它涉及一种用于腔隙注射治疗骨关节炎的人源脐带间充质干细胞注射液及其制备方法。
背景技术:
在许多国家中,骨关节炎(oa)是越来越普遍的关节疾病。已知,可使用一些抗发炎药物、镇痛剂、或润滑补充剂治疗oa。另可选择地,还可以一种包括钻孔、微骨折和自体骨软骨镶嵌移植术(mosaicplasty)的手术,进行缺损部位的修复或重建以治疗oa,但这种方式仅能暂时改善症状,无法永久治愈或使退化组织再生。
近来已发展出一种细胞治疗方法,包括移植细胞或组织工程的软骨,藉以协助关节软骨缺损的修复。据报导,可通过移植在单层细胞培养条件下的自体软骨细胞而成功地治疗膝盖软骨缺损。在最近的报导中也说明,能自我更新并分化成各种间充质组织的间充质干细胞(mscs)成为临床应用的一个有效的工具。举例而言,用于成骨不全的细胞治疗与软骨及骨的组织工程。来自健康捐赠者的同种异体mscs可作为“全适捐赠细胞”而用于治疗患有肌肉骨骼疾病的患者。
技术实现要素:
针对现有技术存在的不足,本发明的目的在于提供一种用于腔隙注射治疗骨关节炎的人源脐带间充质干细胞注射液的制备方法,其所制得的人源脐带间充质干细胞注射液能将人源脐带间充质干细胞分化为软骨细胞,可用于腔隙注射治疗骨关节炎。
本发明的上述技术目的是通过以下技术方案得以实现的:
一种用于腔隙注射治疗骨关节炎的人源脐带间充质干细胞注射液的制备方法,其特征在于,包括脐带组织块的获取步骤、干细胞的原代培养步骤、干细胞的传代培养步骤和人源脐带间充质干细胞注射液的制备步骤;所述人源脐带间充质干细胞注射液的制备步骤包括采用复方电解质注射液重悬pe代人源脐带间充质干细胞,反复吹洗,待pe代人源脐带间充质干细胞悬液均匀后,补充复方电解质注射液,调节人源脐带间充质干细胞浓度为4×104-6×104个/ml,加入软骨分化诱导剂,得到人源脐带间充质干细胞注射液;其中,e=6、7、8、9、10。
进一步,所述软骨分化诱导剂包括青霉素、链霉素、tgf-β1、铁蛋白、抗坏血酸、地塞米松和丙酮酸钠,青霉素的用量为100u/ml,链霉素的用量为100μg/ml,tgf-β1的用量为10ng/ml,转铁蛋白的用量为5μg/ml,抗坏血酸的用量为50μg/ml,地塞米松的用量为10-7mol/l,丙酮酸钠的用量为6.25μg/ml。
进一步,还包括干细胞的冻存步骤以及干细胞的复苏与培养步骤;所述干细胞的冻存步骤包括待pm代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对pm代人源脐带间充质干细胞清洗,并在无血清间充质干细胞冻存液中重悬,将pm代人源脐带间充质干细胞悬液分装于冻存管中并封口,立即将冻存管放置于程序降温盒后并立即将程序降温盒放置于-80℃的冰箱中冻存12-24小时,之后将冻存管取出并立即放置于液氮中冻存。
进一步,所述无血清间充质干细胞冻存液包括以质量份数计的无血清培养基80份、二甲基亚砜10份、l-薄荷基吡喃糖苷5份、甘油4份、n-乙酰葡萄糖胺1份。
进一步,所述干细胞的复苏与培养步骤包括从液氮中取出待复苏的pm代人源脐带间充质干细胞冻存管,放入温度为37℃水浴中,待pm代人源脐带间充质干细胞融化后转移至生理盐水中,离心并弃去上清液,并在无血清培养基中重悬得pm代人源脐带间充质干细胞悬液,将pm代人源脐带间充质干细胞悬液接种于细胞培养瓶,并将细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养得pm+1代人源脐带间充质干细胞。
进一步,所述脐带组织块的获取步骤包括两端结扎的脐带经消毒后,置于内含1wt%双抗的生理盐水中;去除脐带两结扎端,脐带中间段剪成0.8-1.2cm长的脐带组织段,采用内含1wt%双抗的生理盐水对脐带组织段反复漂洗去除血迹;剖开脐带组织段,去除血管及表皮组织,获得华通氏胶组织,采用内含1wt%双抗的生理盐水对华通氏胶组织反复漂洗,剪碎得1mm×1mm×1mm的脐带组织块。
进一步,所述干细胞的原代培养步骤包括将脐带组织块贴壁接种至培养皿中,温度为37℃、体积分数为5%的co2培养箱中静置1-2h,向培养皿中加入完全培养液培养,每隔3天半量更换完全培养液,静置培养14天后,弃掉培养液及脐带组织块,采用生理盐水清洗细胞,加入0.5wt%的tryple-express消化液,温度为37℃静置2-3分钟,待伪足完全回缩,细胞变圆,加入完全培养液终止消化,吹打得到p1代人源脐带间充质干细胞悬液。
进一步,所述干细胞的传代培养步骤包括待pn代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对pn代人源脐带间充质干细胞清洗,并在无血清培养基中重悬得pn代人源脐带间充质干细胞悬液,将pn代人源脐带间充质干细胞悬液接种于细胞培养瓶,并将细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养,得pn+1代人源脐带间充质干细胞。
进一步,所述无血清培养基为hystemcell人间充质干细胞无血清培养基。
进一步,所述人源脐带间充质干细胞悬液的浓度为1×107个/ml。
综上所述,本发明具有以下有益效果:
第一、本发明所制得的人源脐带间充质干细胞注射液能将人源脐带间充质干细胞分化为软骨细胞,可用于腔隙注射治疗骨关节炎。
第二、采用本发明提供的无血清间充质干细胞冻存液结合本发明提供干细胞的冻存步骤,对人源脐带间充质干细胞的冻存起到更好的冻存效果。复苏后的细胞不仅在存活率上有明显的提高,细胞增殖能力也优于常规的冻存方法,而且人源脐带间充质干细胞的特异性表面标记也没有明显的下降,均有较高的表达率。其完善人源脐带间充质干细胞的储备,保障了人源脐带间充质干细胞的存活率、增殖能力和特异性。
附图说明
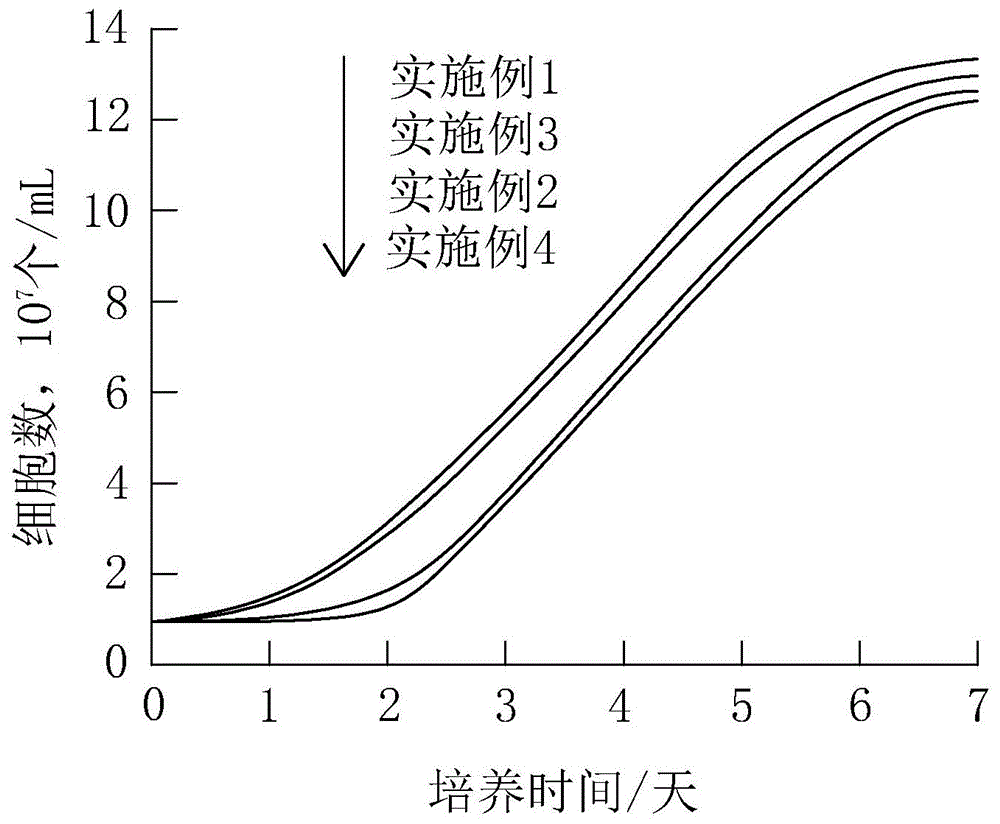
图1是实施例1所得到的p5代人源脐带间充质干细胞进行培养7天的生长曲线、实施例2所得到的p5代人源脐带间充质干细胞进行复苏后培养7天的生长曲线、实施例3所得到的p10代人源脐带间充质干细胞进行培养7天的生长曲线以及实施例4所得到的p10代人源脐带间充质干细胞进行复苏后培养7天的生长曲线。
具体实施方式
以下结合实施例对本发明作进一步详细说明。
实施例1
一种用于腔隙注射治疗骨关节炎的人源脐带间充质干细胞注射液的制备方法,包括脐带组织块的获取步骤、干细胞的原代培养步骤、干细胞的传代培养步骤、干细胞的冻存步骤、干细胞的复苏与培养步骤和人源脐带间充质干细胞注射液的制备步骤。
脐带组织块的获取步骤包括两端结扎的脐带经消毒后,置于内含1wt%双抗的生理盐水中;去除脐带两结扎端,脐带中间段剪成0.8-1.2cm长的脐带组织段,采用内含1wt%双抗的生理盐水对脐带组织段反复漂洗去除血迹;剖开脐带组织段,去除血管及表皮组织,获得华通氏胶组织,采用内含1wt%双抗的生理盐水对华通氏胶组织反复漂洗,剪碎得1mm×1mm×1mm的脐带组织块。
干细胞的原代培养步骤包括将脐带组织块贴壁接种至培养皿中,温度为37℃、体积分数为5%的co2培养箱中静置1-2h,向培养皿中加入完全培养液培养,每隔3天半量更换完全培养液,静置培养14天后,弃掉培养液及脐带组织块,采用生理盐水清洗细胞,加入0.5wt%的tryple-express消化液,温度为37℃静置2-3分钟,待伪足完全回缩,细胞变圆,加入完全培养液终止消化,吹打得到p1代人源脐带间充质干细胞悬液,调整p1代人源脐带间充质干细胞悬液浓度为1×107个/ml。
干细胞的传代培养步骤包括待pn代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对pn代人源脐带间充质干细胞清洗,并在hystemcell人间充质干细胞无血清培养基中重悬得pn代人源脐带间充质干细胞悬液,调整pn代人源脐带间充质干细胞悬液浓度为1×107个/ml,将pn代人源脐带间充质干细胞悬液接种于t-175细胞培养瓶,并将t-175细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养,得pn+1代人源脐带间充质干细胞。其中,n=1、2、3、4、5。
人源脐带间充质干细胞注射液的制备步骤包括采用复方电解质注射液重悬p6代人源脐带间充质干细胞,反复吹洗,待p6代人源脐带间充质干细胞悬液均匀后,补充复方电解质注射液,调节人源脐带间充质干细胞浓度为4×104-6×104个/ml,加入软骨分化诱导剂(青霉素的用量为100u/ml,链霉素的用量为100μg/ml,tgf-β1的用量为10ng/ml,转铁蛋白的用量为5μg/ml,抗坏血酸的用量为50μg/ml,地塞米松的用量为10-7mol/l,丙酮酸钠的用量为6.25μg/ml),得到人源脐带间充质干细胞注射液。
实施例2
一种用于腔隙注射治疗骨关节炎的人源脐带间充质干细胞注射液的制备方法,包括脐带组织块的获取步骤、干细胞的原代培养步骤、干细胞的传代培养步骤、干细胞的冻存步骤、干细胞的复苏与培养步骤和人源脐带间充质干细胞注射液的制备步骤。
脐带组织块的获取步骤包括两端结扎的脐带经消毒后,置于内含1wt%双抗的生理盐水中;去除脐带两结扎端,脐带中间段剪成0.8-1.2cm长的脐带组织段,采用内含1wt%双抗的生理盐水对脐带组织段反复漂洗去除血迹;剖开脐带组织段,去除血管及表皮组织,获得华通氏胶组织,采用内含1wt%双抗的生理盐水对华通氏胶组织反复漂洗,剪碎得1mm×1mm×1mm的脐带组织块。
干细胞的原代培养步骤包括将脐带组织块贴壁接种至培养皿中,温度为37℃、体积分数为5%的co2培养箱中静置1-2h,向培养皿中加入完全培养液培养,每隔3天半量更换完全培养液,静置培养14天后,弃掉培养液及脐带组织块,采用生理盐水清洗细胞,加入0.5wt%的tryple-express消化液,温度为37℃静置2-3分钟,待伪足完全回缩,细胞变圆,加入完全培养液终止消化,吹打得到p1代人源脐带间充质干细胞悬液,调整p1代人源脐带间充质干细胞悬液浓度为1×107个/ml。
干细胞的传代培养步骤包括待pn代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对pn代人源脐带间充质干细胞清洗,并在hystemcell人间充质干细胞无血清培养基中重悬得pn代人源脐带间充质干细胞悬液,调整pn代人源脐带间充质干细胞悬液浓度为1×107个/ml,将pn代人源脐带间充质干细胞悬液接种于t-175细胞培养瓶,并将t-175细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养,得pn+1代人源脐带间充质干细胞。其中,n=1、2、3、4。
干细胞的冻存步骤包括待p5代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对p5代人源脐带间充质干细胞清洗,并在无血清间充质干细胞冻存液中重悬,调整p5代人源脐带间充质干细胞浓度为1×107个/ml,将p5代人源脐带间充质干细胞悬液分装于冻存管中并封口,立即将冻存管放置于程序降温盒后并立即将程序降温盒放置于-80℃的冰箱中冻存12-24小时,之后将冻存管取出并立即放置于液氮中冻存。无血清间充质干细胞冻存液包括以质量份数计的hystemcell人间充质干细胞无血清培养基80份、二甲基亚砜10份、l-薄荷基吡喃糖苷5份、甘油4份、n-乙酰葡萄糖胺1份。
干细胞的复苏与培养步骤包括从液氮中取出待复苏的p5代人源脐带间充质干细胞冻存管,放入温度为37℃水浴中,待p5代人源脐带间充质干细胞融化后转移至生理盐水中,离心并弃去上清液,并在hystemcell人间充质干细胞无血清培养基中重悬得p5代人源脐带间充质干细胞悬液,将p5代人源脐带间充质干细胞悬液接种于t-175细胞培养瓶,并将t-175细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养得p6代人源脐带间充质干细胞。
人源脐带间充质干细胞注射液的制备步骤包括采用复方电解质注射液重悬p6代人源脐带间充质干细胞,反复吹洗,待p6代人源脐带间充质干细胞悬液均匀后,补充复方电解质注射液,调节人源脐带间充质干细胞浓度为4×104-6×104个/ml,加入软骨分化诱导剂(青霉素的用量为100u/ml,链霉素的用量为100μg/ml,tgf-β1的用量为10ng/ml,转铁蛋白的用量为5μg/ml,抗坏血酸的用量为50μg/ml,地塞米松的用量为10-7mol/l,丙酮酸钠的用量为6.25μg/ml),得到人源脐带间充质干细胞注射液。
实施例1所得到的p5代干细与实施例2进行复苏后得到的p5代人源脐带间充质干细胞的表面标记表达率的结果对比。人源脐带间充质干细胞的特异性表面标记有cd34-、cd44+、cd45-、cd90+。实施例1所得到的p5代干细与实施例2进行复苏后得到的p5代人源脐带间充质干细胞分别在培养3天后消化收集后制成人源脐带间充质干细胞悬液,加入带有免疫荧光的抗体进行孵育,进行人源脐带间充质干细胞表面标记物的流式检测,加入的特异性抗体分别为cd34(呈阴性表达)、cd45(呈阴性表达)、cd44(呈阳性表达)、cd90(呈阳性表达)。实施例1所得到的p5代人源脐带间充质干细胞在培养3天后,流式结果显示cd34-cd44+表达率为99.9%,cd45-cd90+表达率为99.9%;实施例2进行复苏后得到的p5代人源脐带间充质干细胞在培养3天后,流式结果显示cd34-cd44+表达率为99.6%,cd45-cd90+表达率为98.9%。由此可知,经过采用本发明提供的无血清间充质干细胞冻存液结合本发明提供干细胞的冻存步骤后,人源脐带间充质干细胞的特异性表面标记也没有明显的下降,均有较高的表达率。
实施例1所得到的p5代人源脐带间充质干细胞和实施例2进行复苏后得到的p5代人源脐带间充质干细胞与的增殖情况进行对比。绘制实施例2所得到的p5代人源脐带间充质干细胞进行培养7天的生长曲线图以及实施例2所得到的p5代人源脐带间充质干细胞进行复苏后培养7天的生长曲线图,结果如图1所示。本发明提供的无血清间充质干细胞冻存液结合本发明提供干细胞的冻存步骤,对人源脐带间充质干细胞的冻存起到更好的冻存效果,复苏后的干细胞的增殖能力略差于未经冻存的干细胞的增殖能力。由此可知,相较于现有技术,复苏后的干细胞不仅在存活率上有明显的提高,细胞增殖能力也优于常规的冻存方法。
将实施例1和实施例2得到的人源脐带间充质干细胞注射液接种于由重量比为95:5的dmem高糖培养液和血清替代物所组成的培养基中,诱导4天后,采用4%多聚甲醛室温固定15分钟后执行阿利新蓝染色鉴定,检测得到的细胞是否为软骨细胞。
阿利新蓝染色鉴定是吸去多聚甲醛,用pbs漂洗2次后,加入ph2.5的阿利新蓝染液染色30分钟,蒸馏水冲洗2分钟,在倒置相差显微镜下观察染色情况,如果显微镜下可见有细胞小球生成,且被阿利新蓝染液染为蓝色,即为细胞胞浆内硫酸化糖胺多糖表达阳性,表现出了软骨细胞的生物学特性。
结果表明,不管是实施例1,还是实施例2,均在显微镜下可见有细胞小球生成,且细胞胞浆内硫酸化糖胺多糖表达阳性(被阿利新蓝染液染为蓝色),表现出了软骨细胞的生物学特性。
实施例3
一种用于腔隙注射治疗骨关节炎的人源脐带间充质干细胞注射液的制备方法,包括脐带组织块的获取步骤、干细胞的原代培养步骤、干细胞的传代培养步骤、干细胞的冻存步骤、干细胞的复苏与培养步骤和人源脐带间充质干细胞注射液的制备步骤。
脐带组织块的获取步骤包括两端结扎的脐带经消毒后,置于内含1wt%双抗的生理盐水中;去除脐带两结扎端,脐带中间段剪成0.8-1.2cm长的脐带组织段,采用内含1wt%双抗的生理盐水对脐带组织段反复漂洗去除血迹;剖开脐带组织段,去除血管及表皮组织,获得华通氏胶组织,采用内含1wt%双抗的生理盐水对华通氏胶组织反复漂洗,剪碎得1mm×1mm×1mm的脐带组织块。
干细胞的原代培养步骤包括将脐带组织块贴壁接种至培养皿中,温度为37℃、体积分数为5%的co2培养箱中静置1-2h,向培养皿中加入完全培养液培养,每隔3天半量更换完全培养液,静置培养14天后,弃掉培养液及脐带组织块,采用生理盐水清洗细胞,加入0.5wt%的tryple-express消化液,温度为37℃静置2-3分钟,待伪足完全回缩,细胞变圆,加入完全培养液终止消化,吹打得到p1代人源脐带间充质干细胞悬液,调整p1代人源脐带间充质干细胞悬液浓度为1×107个/ml。
干细胞的传代培养步骤包括待pn代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对pn代人源脐带间充质干细胞清洗,并在hystemcell人间充质干细胞无血清培养基中重悬得pn代人源脐带间充质干细胞悬液,调整pn代人源脐带间充质干细胞悬液浓度为1×107个/ml,将pn代人源脐带间充质干细胞悬液接种于t-175细胞培养瓶,并将t-175细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养,得pn+1代人源脐带间充质干细胞。其中,n=1、2、3、4、5、6、7、8、9。
人源脐带间充质干细胞注射液的制备步骤包括采用复方电解质注射液重悬p10代人源脐带间充质干细胞,反复吹洗,待p10代人源脐带间充质干细胞悬液均匀后,补充复方电解质注射液,调节人源脐带间充质干细胞浓度为4×104-6×104个/ml,加入软骨分化诱导剂(青霉素的用量为100u/ml,链霉素的用量为100μg/ml,tgf-β1的用量为10ng/ml,转铁蛋白的用量为5μg/ml,抗坏血酸的用量为50μg/ml,地塞米松的用量为10-7mol/l,丙酮酸钠的用量为6.25μg/ml),得到人源脐带间充质干细胞注射液。
实施例4
一种用于腔隙注射治疗骨关节炎的人源脐带间充质干细胞注射液的制备方法,包括脐带组织块的获取步骤、干细胞的原代培养步骤、干细胞的传代培养步骤、干细胞的冻存步骤、干细胞的复苏与培养步骤、干细胞的传代培养步骤和人源脐带间充质干细胞注射液的制备步骤。
脐带组织块的获取步骤包括两端结扎的脐带经消毒后,置于内含1wt%双抗的生理盐水中;去除脐带两结扎端,脐带中间段剪成0.8-1.2cm长的脐带组织段,采用内含1wt%双抗的生理盐水对脐带组织段反复漂洗去除血迹;剖开脐带组织段,去除血管及表皮组织,获得华通氏胶组织,采用内含1wt%双抗的生理盐水对华通氏胶组织反复漂洗,剪碎得1mm×1mm×1mm的脐带组织块。
干细胞的原代培养步骤包括将脐带组织块贴壁接种至培养皿中,温度为37℃、体积分数为5%的co2培养箱中静置1-2h,向培养皿中加入完全培养液培养,每隔3天半量更换完全培养液,静置培养14天后,弃掉培养液及脐带组织块,采用生理盐水清洗细胞,加入0.5wt%的tryple-express消化液,温度为37℃静置2-3分钟,待伪足完全回缩,细胞变圆,加入完全培养液终止消化,吹打得到p1代人源脐带间充质干细胞悬液,调整p1代人源脐带间充质干细胞悬液浓度为1×107个/ml。
干细胞的传代培养步骤包括待pn代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对pn代人源脐带间充质干细胞清洗,并在hystemcell人间充质干细胞无血清培养基中重悬得pn代人源脐带间充质干细胞悬液,调整pn代人源脐带间充质干细胞悬液浓度为1×107个/ml,将pn代人源脐带间充质干细胞悬液接种于t-175细胞培养瓶,并将t-175细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养,得pn+1代人源脐带间充质干细胞。其中,n=1、2、3、4。
干细胞的冻存步骤包括待p5代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对p5代人源脐带间充质干细胞清洗,并在无血清间充质干细胞冻存液中重悬,调整p5代人源脐带间充质干细胞浓度为1×107个/ml,将p5代人源脐带间充质干细胞悬液分装于冻存管中并封口,立即将冻存管放置于程序降温盒后并立即将程序降温盒放置于-80℃的冰箱中冻存12-24小时,之后将冻存管取出并立即放置于液氮中冻存。无血清间充质干细胞冻存液包括以质量份数计的hystemcell人间充质干细胞无血清培养基80份、二甲基亚砜10份、l-薄荷基吡喃糖苷5份、甘油4份、n-乙酰葡萄糖胺1份。
干细胞的复苏与培养步骤包括从液氮中取出待复苏的p5代人源脐带间充质干细胞冻存管,放入温度为37℃水浴中,待p5代人源脐带间充质干细胞融化后转移至生理盐水中,离心并弃去上清液,并在hystemcell人间充质干细胞无血清培养基中重悬得p5代人源脐带间充质干细胞悬液,将p5代人源脐带间充质干细胞悬液接种于t-175细胞培养瓶,并将t-175细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养得p6代人源脐带间充质干细胞。
干细胞的传代培养步骤包括待pn代人源脐带间充质干细胞达80-90%汇合度时,弃去上清液,加入0.5wt%的tryple-express消化液,待消化完全后,加入完全培养液终止消化,离心并弃去上清液,用生理盐水对pn代人源脐带间充质干细胞清洗,并在hystemcell人间充质干细胞无血清培养基中重悬得pn代人源脐带间充质干细胞悬液,调整pn代人源脐带间充质干细胞悬液浓度为1×107个/ml,将pn代人源脐带间充质干细胞悬液接种于t-175细胞培养瓶,并将t-175细胞培养瓶置于温度为37℃、体积分数为5%的co2培养箱中培养,得pn+1代人源脐带间充质干细胞。其中,n=6、7、8、9。
人源脐带间充质干细胞注射液的制备步骤包括采用复方电解质注射液重悬p10代人源脐带间充质干细胞,反复吹洗,待p10代人源脐带间充质干细胞悬液均匀后,补充复方电解质注射液,调节人源脐带间充质干细胞浓度为4×104-6×104个/ml,加入软骨分化诱导剂(青霉素的用量为100u/ml,链霉素的用量为100μg/ml,tgf-β1的用量为10ng/ml,转铁蛋白的用量为5μg/ml,抗坏血酸的用量为50μg/ml,地塞米松的用量为10-7mol/l,丙酮酸钠的用量为6.25μg/ml),得到人源脐带间充质干细胞注射液。
实施例3所得到的p10代人源脐带间充质干细胞与实施例4进行复苏后得到的p10代人源脐带间充质干细胞的表面标记表达率的结果对比。人源脐带间充质干细胞的特异性表面标记有cd34-、cd44+、cd45-、cd90+。实施例3所得到的p10代人源脐带间充质干细胞以及实施例4进行复苏后得到的p10代人源脐带间充质干细胞分别在培养3天后消化收集后制成干细胞悬液,加入带有免疫荧光的抗体进行孵育,进行人源脐带间充质干细胞表面标记物的流式检测,加入的特异性抗体分别为cd34(呈阴性表达)、cd45(呈阴性表达)、cd44(呈阳性表达)、cd90(呈阳性表达)。实施例3所得到的p10代人源脐带间充质干细胞在培养3天后,流式结果显示cd34-cd44+表达率为99.9%,cd45-cd90+表达率为99.8%;实施例4进行复苏后得到的p10代人源脐带间充质干细胞在培养3天后,流式结果显示cd34-cd44+表达率为99.5%,cd45-cd90+表达率为98.6%。由此可知,经过采用本发明提供的无血清间充质干细胞冻存液结合本发明提供干细胞的冻存步骤后,再经过传代培养的人源脐带间充质干细胞的特异性表面标记也没有明显的下降,均有较高的表达率。
实施例3所得到的p10代人源脐带间充质干细胞与实施例4所得到的p10代人源脐带间充质干细胞的增殖情况进行对比。绘制实施例3所得到的p10代人源脐带间充质干细胞进行复苏后培养7天的生长曲线图与实施例4所得到的p10代人源脐带间充质干细胞进行培养7天的生长曲线图,结果如图1所示。由此可知,经过采用本发明提供的无血清间充质干细胞冻存液结合本发明提供干细胞的冻存步骤后再经过传代培养的人源脐带间充质干细胞的增殖能力略差于未经冻存的干细胞的增殖能力。由此可知,相较于现有技术,复苏后的干细胞不仅在存活率上有明显的提高,细胞增殖能力也优于常规的冻存方法。
将实施例3和实施例4得到的人源脐带间充质干细胞注射液接种于由重量比为95:5的dmem高糖培养液和血清替代物所组成的培养基中,诱导4天后,采用4%多聚甲醛室温固定15分钟后执行阿利新蓝染色鉴定,检测得到的细胞是否为软骨细胞。
阿利新蓝染色鉴定是吸去多聚甲醛,用pbs漂洗2次后,加入ph2.5的阿利新蓝染液染色30分钟,蒸馏水冲洗2分钟,在倒置相差显微镜下观察染色情况,如果显微镜下可见有细胞小球生成,且被阿利新蓝染液染为蓝色,即为细胞胞浆内硫酸化糖胺多糖表达阳性,表现出了软骨细胞的生物学特性。
结果表明,不管是实施例3还是实施例4,均在显微镜下可见有细胞小球生成,且细胞胞浆内硫酸化糖胺多糖表达阳性(被阿利新蓝染液染为蓝色),表现出了软骨细胞的生物学特性。
应该理解的是,本发明实施例所述制备方法仅仅是用于说明本发明,而不是对本发明的限制,在本发明的构思前提下对本发明制备方法的简单改进都属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!