mmu-miR-375-3p在制备抑制胚胎着床的药物中的应用的制作方法
本发明涉及mmu-miR-375-3p在制备抑制胚胎着床的药物中的应用。(二)
背景技术:
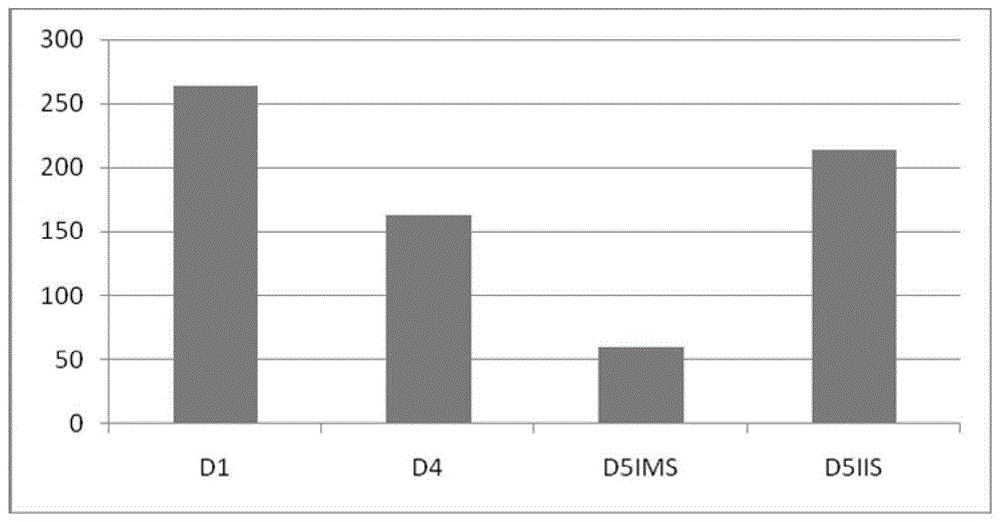
:miRNA是一种长度在22nt左右的内源性非编码短链RNA分子,能够靶向裂解mRNA或抑制翻译过程等方式在转录后水平调控基因的表达。miRNA具有较高的同源性,广泛存在于动植物体内,参与多种生物生长、发育、分化、疾病防御等进程的调控,其在不同生理状态下的特异性表达更使其有望成为检测特定生理过程的分子标记物。此外,miRNA能够被多种细胞以不同形式选择性分泌到微环境当中,作为一种介质参与细胞间的交流对话。miR-375是哺乳动物常见的miRNA之一,存在于多种细胞和组织中。研究证实,miR-375已被证实参与多种恶性肿瘤的发生、转移、微血管形成等过程,并在其中发挥促癌或抑癌基因作用。而在胚胎着床过程中,也发生迁移、分化、增殖、微血管形成等生理过程,子宫内膜上皮细胞与胚胎之间会进行相互侵入,细胞增殖分化,胚胎滋养层侵入子宫内膜上皮,微血管生成。虽然已经证实了miR-375在肿瘤细胞的迁移、分化、增殖、微血管形成中的作用,但尚无文献证实其在胚胎着床过程中的作用。通过miRBase查询比对发现,miR-375-3p在不同物种中具有保守性,人源的miR-375-3p与鼠源的miR-375-3p的一致性达到了100%,因此可以选择小鼠为模式动物,进行miR-375-3p对胚胎着床影响的研究,开发抑制或促进胚胎着床的药物。(三)技术实现要素:本发明目的是提供mmu-miR-375-3p在抑制胚胎着床的药物中的应用。本发明采用的技术方案是:微小RNAmmu-miR-375-3p在制备抑制胚胎着床的药物中的应用。具体的,所述mmu-miR-375-3p序列如下:5’-UUUGUUCGUUCGGCUCGCGUGA-3’。优选的,所述mmu-miR-375-3p经分子修饰获得的更稳定的双链小RNA用于制备所述药物,具体的,所述分子修饰为:全部碱基甲基化修饰+5'端前3个碱基UUU和3'端前4个碱基GUGA之间进行硫代修饰+3'末端进行胆固醇修饰。与未经修饰的双链小RNA相比,修饰后的RNA与细胞膜亲和力更高,细胞转染实验转染试剂用量显著减少,特别适合动物体内干扰实验,并且在体内实验中具有更高的稳定性和抑制效果,可以采用全身注射或局部注射等多种方式给药,操作简便。进一步,所述药物为避孕药物。具体的,所述药物制成注射用制剂,通过注射到受体子宫达到抑制胚胎着床的作用。本发明有益效果主要体现在:本发明提供了mmu-miR-375-3p在抑制胚胎着床的药物中的应用,经试验证明mmu-miR-375-3p对胚胎着床有极其显著的抑制作用,提示其可作为避孕药物使用,为新药筛选提供了新的途径。(四)附图说明图1为D1、D4、D5IMS、D5IIS子宫内膜中mmu-miR-375-3p的变化趋势;图2为小鼠不同发情阶段的阴道涂片结果:A:发情前期;B:发情期;C:发情后期;D:间情期;图3为qPCR法验证差异表达mmu-miR-375-3p的变化;图4为假孕模型中mmu-miR-375-3p的变化;图5为延时模型与延时激活模型中mmu-miR-375-3p的相对含量柱状图;图6为注射mmu-miR-375-3p后对小鼠胚胎着床数的影响;A为注射mmu-miR-375-3p实验组,左侧为注射DEPC水对照,右侧为注射mmu-miR-375-3pagomir;B为对照组,左侧注射DEPC水做对照,右侧注射NegativeControl做对照。(五)具体实施方式下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:实施例1:一、小RNA测序1.取材ICR小鼠品系,于晚上17点选取发情的母鼠与公鼠进行合笼,第二天早上9点验栓,如果母鼠阴道口出现白色栓状物,证明母鼠已经受孕,记做怀孕D1天。收集妊娠后第一天(D1),第四天(D4),第五天着床位点(D5IMS)和非着床位点(D5IIS)的子宫内膜组织:收集方法为,在相应的天数内,上午十点通过断颈法人道处死小鼠,使用75%的酒精进行消毒,然后取出小鼠的子宫组织,去除黏连的脂肪和血管,洗去附着的血液,通过挤压剥离法分离小鼠的子宫内膜。分别获得妊娠后第一天(D1),第四天(D4),第五天着床位点(D5IMS)和非着床位点(D5IIS)的子宫内膜组织。2.组织miRNA抽提miRNA抽提操作步骤:(TIANGEN试剂盒;此方法用于对miRNA的纯度要求较高,比如在研究miRNA芯片、miRNA克隆时使用。)(1)样品处理:将组织在液氮中磨碎。每30~50mg动物组织或者100mg植物组织加1mL裂解液MZ,用匀浆仪进行匀浆处理。样品体积不应超过裂解液MZ体积的十分之一。(2)将匀浆样品在室温放置5min,使得核酸蛋白复合物完全分离。(3)4℃12,000rpm(~13,400×g)离心5min,取上清,转入一个新的无RNase的离心管中。(4)加入200μL氯仿,盖好管盖,剧烈振荡15sec,室温放置5min。(5)4℃12,000rpm(~13,400×g)离心15min,样品会分成三层:黄色的有机相,中间层和无色的水相,RNA主要在水相中,水相的体积约为所用裂解液MZ试剂的50%。把水相转移到新管中,进行下一步操作。(6)量取转移液的体积,缓慢加入转移液体积0.43倍的无水乙醇(如:500μL的转移液加215μL无水乙醇),混匀(此时可能会出现沉淀)。将得到的溶液和沉淀一起转入向吸附柱miRspin中,室温12,000rpm(~13,400×g)离心30sec,若一次不能将全部溶液和混合物加入向吸附柱miRspin中,请分两次转入,离心后弃掉向吸附柱miRspin,保留流出液。(7)量取流出液的体积,缓慢加入流出液体积0.75倍的无水乙醇(如:700μL的流出液加525μL无水乙醇),混匀(此时可能会出现沉淀)。将得到的溶液和沉淀一起转入吸附柱miRelute中,室温12,000rpm(~13,400×g)离心30sec,若一次不能将全部溶液和混合物加入吸附柱miRelute中,请分两次转入,离心后弃掉流出液,保留吸附柱miRelute。(8)向吸附柱miRelute中加入500μL去蛋白液MRD(请先检查是否已加入乙醇),室温静置2min,室温12,000rpm(~13,400×g)离心30sec,弃废液。(9)向吸附柱miRelute中加入500μL漂洗液RW(请先检查是否已加入乙醇),室温静置2min,室温12,000rpm(~13,400×g)离心30sec,弃废液。(10)重复操作步骤9。(11)将吸附柱miRelute放入2mL收集管中,室温12,000rpm(~13,400×g)离心1min,去除残余液体。离心后将吸附柱miRelute在室温放置片刻,或置于超净工作台上通风片刻,以充分晾干。(12)将吸附柱miRelute转入一个新的RNase-Free1.5mL离心管中,加20μLRNase-FreeddH2O,室温放置2min,室温12,000rpm(~13,400×g)离心2min。3.小RNA测序及结果分析送生物公司进行小RNA测序,妊娠后第一天(D1),第四天(D4),第五天着床位点(D5IMS)和非着床位点(D5IIS)的子宫内膜组织miRNA各三个生物重复。通过对测序结果的分析,找出在着床窗口期起关键作用的miRNA。结果显示,在胚胎着床过程中,mmu-miR-375-3p在着床前后有着极其显著的差异。小鼠组织miRNA测序结果中mmu-miR-375-3p的绝对定量读出条数结果如图1。结果显示D1与D4、D5IMS都有显著性的差异,D4与D5IMS、以及D5IMS与D5IIS都具有显著性的差异,结果说明mmu-miR-375-3p在胚胎着床过程中起着关键的作用。对所送去测序的样品各组中的生物重复进行相关性分析,分析数据结果如表1所示,结果显示妊娠后第一天(D1),第四天(D4),第五天着床位点(D5IMS)和非着床位点(D5IIS)的子宫内膜组织miRNA各组的三个生物重复之间的差异较小,样品的一致性较高,测序结果稳定可靠。表1测序样品组间相关性系数分析(表1数据都一样吗?)都一样,与具体某miRNA无关sampleD1-1D1-2D1-3D4-1D4-2D4-3D1-110.890.920.990.990.97D1-20.8910.960.840.880.81D1-30.920.9610.90.90.89D4-10.990.840.910.990.99D4-20.990.880.90.9910.98D4-30.970.810.890.990.981sampleD5IIS-1D5IIS-2D5IIS-3D5IMS-1D5IMS-2D5IMS-3D5IIS-110.990.890.990.990.99D5IIS-20.9910.910.990.990.99D5IIS-30.890.9110.930.910.91D5IMS-10.990.990.9310.990.99D5IMS-20.990.990.910.9911D5IMS-30.990.990.910.9911三、妊娠后第一天到第七天miR-375-3p的变化为了进一步确定在妊娠前期miR-375-3p的变化规律,将研究范围扩展到妊娠后前七天,通过荧光定量的方法对miR-375-3p进行相对定量,研究变化趋势。1.取材(1)小鼠阴道涂片确定发情周期阴道黏液涂片的制作:ICR小鼠品系,用右手小拇指和无名指夹住小鼠尾根,手背压过小鼠背部,再用大拇指和食指握紧小鼠颈部背侧和耳部的皮肤以完成小鼠的固定工作。移液枪插紧枪头,吸取10μL生理盐水,打入小鼠阴道内部,并来回抽吸数次,充分混匀后滴到载玻片中央,均匀涂开,在空气中自然干燥。然后将干燥好的载玻片放到95%酒精里固定15min,苏木精染色15~30min,自来水冲洗2min,伊红染色1min,蒸馏水冲洗干净剩余染料,封片镜检。连续检测14天,找出发情期与发情间期的图片差异标准,涂片结果详见图2。发情前期阴道涂片的特征为形状不规则或蝌蚪状的有核上皮细胞占绝大多数,白细胞和角质化上皮细胞很少(图2A);发情期阴道涂片的特征几乎全是片状的,无核角质化细胞(图2B);发情后期阴道涂片特征为少量无核角质化上皮细胞,白细胞占大多数(图2C);发情间期阴道涂片特征为上皮细胞少而皱缩,涂片中有大量白细胞(图2D)。(2)小鼠妊娠前期及发情期、发情间期的子宫内膜组织收集ICR小鼠品系,于晚上17点选取发情的母鼠与公鼠进行合笼,第二天早上9点验栓,如果母鼠阴道口出现白色栓状物,证明母鼠已经受孕,记做怀孕D1天。收集妊娠后第一天(D1)、第二天(D2)、第三天(D3)、第四天(D4)、第五天着床位点(D5IMS)、非着床位点(D5IIS)、第六天(D6)、第七天(D7)、发情期(F)和间情期(J)的子宫内膜组织:收集方法为,在相应的天数内,上午十点通过断颈法人道处死小鼠,使用75%的酒精进行消毒,然后取出小鼠的子宫组织,去除黏连的脂肪和血管,洗去附着的血液,通过挤压剥离法分离小鼠的子宫内膜。分别获得相应的子宫内膜组织。2.组织miRNA抽提提取方法如前所述。(TIANGEN)3.miRNA反转成cDNA(TIANGEN)操作步骤(1)反转录体系的配制解冻2×miRNARTReactionBuffer并混匀,miRNARTEnzymeMix放于冰中备用,在冰上预冷RNaseFree的反应管内加入以下试剂至总体积20μL(最后加入miRNARTEnzymeMix)。配制比例见表2。表2反转录体系的配制(20μL)试剂组分体积终浓度TotalRNA*-可达2μg2×miRNAReactionBuffer10μL1×miRNARTEnzymeMix2μL-RNase-FreeddH2O补至20μL-(2)反转录程序移液器轻轻混匀上述配制的反应液,按下表3的程序进行miRNA的逆转录反应:表3逆转录反应程序合成的cDNA反应液可放置于-20℃保存;也可以直接进行下游荧光定量检测。在进行下游荧光定量检测时,为避免逆转录体系对定量PCR反应的抑制,得到最适的Ct值(15-30之间),可将cDNA反应液稀释10-1000倍后使用。4.荧光定量检测D1-D7及小鼠发情期及发情间期mmu-miR-375-3p的相对变化趋势。操作步骤:(1)室温融化2×miRcutePlusmiRNAPreMix、50×ROXReferenceDye和ReversePrimer。(2)使用时请将2×miRcutePlusmiRNAPreMix上下颠倒轻轻均匀混合,避免起泡,并经轻微离心后使用。(如果试剂没有混匀,其反应性能会有所下降,且不要使用振荡器混匀。)(3)将试剂置于冰上,并按表4配制反应体系:(使用的荧光定量仪为ABI公司SteponeplusPCRSystem荧光定量仪。)表4荧光定量PCR配制反应体系PCR反应程序设置时,采用表5程序进行定量PCR反应:表5荧光定量PCR反应程序妊娠后第一天到第七天mmu-miR-375-3p的变化趋势结果见图3。结果显示,在胚胎着床过程中,mmu-miR-375-3p的相对含量逐渐降低,与妊娠第一天有显著性的差异,并且着床窗口期(D4-D5)的mmu-miR-375-3p的含量显著降低,与发情期的含量相比,降低程度极其显著。结果说明在胚胎着床的过程中,mmu-miR-375-3p具有重要的意义。四、假孕模型验证mmu-miR-375-3p的作用功能1.输精管结扎手术制备结扎公鼠(1)雄鼠的麻醉:6周以上的雄鼠使用戊巴比妥钠麻醉,以PBS把戊巴比妥钠以2mg/mL溶解,按体重0.1mL/10g腹腔注射。(2)用70%的酒精消毒腹部手术部位,沿腹中线剪毛,切开皮肤:用钝镊子夹起皮肤,使之离开腹壁。沿腹中线在适当位置开口。注意,要保持剪子向上抬起。(3)切开体壁:用小镊子夹住体壁,提起,使之离开肠管。再用眼科剪子在腹中线轻轻剪1厘米长的切口。注意不要触伤下面的肠管。(4)找到睾丸的白色脂肪垫,把一侧睾丸从阴囊推入腹腔。用小镊子夹住腹壁切口一缘,找到附于睾丸的白色脂肪垫。(5)取出睾丸,用钝镊子夹住脂肪体,将其轻轻拉出切口,继之睾丸、输精管等也被拉出。不能直接触及或操作睾丸,只能通过操作脂肪体使睾丸移动和定位。(6)结扎输精管:仔细辨认睾丸和附睾,将附睾尾下方的输精管用小镊子夹起,用缝合线在夹起的输精管段的两端结扎,然后在两个结扎部的中间区域剪断。(也可用灼热的小镊子烧断输精管,或者去掉一段输精管)。(7)复位:结扎完后,轻轻牵动脂肪体,使睾丸等复回腹腔。按上述方法结扎另一侧输精管。(8)缝合:外科手术缝合刀口,撒上适量抗生素。(9)术后护理:手术后的雄鼠要认真护理,提高环境温度。一般术后两周后才能使用。2.假孕小鼠模型的制备将发情期的小鼠与结扎公鼠合笼,ICR小鼠品系,于晚上17点选取发情的母鼠与公鼠进行合笼,第二天早上9点验栓,如果母鼠阴道口出现白色栓状物,证明母鼠已经受孕,记做怀孕D1天。取假孕第一天(D1)和假孕第四天(D4)的子宫内膜进行mmu-miR-375-3p的相对定量,结果如图4所示。在假孕模型中,在没有胚胎存在的情况下,与妊娠第一天相比,第四天的子宫内膜中mmu-miR-375-3p同样出现了显著的降低。该结果证明,在妊娠前期的mmu-miR-375-3p降低是子宫本身为了接受胚胎的附着而进行的母体调节,与胚胎存在与否没有直接关系,当胚胎存在的情况下,mmu-miR-375-3p的降低水平更加显著。五、延时着床模型与延时着床激活模型验证mmu-miR-375-3p的功能正常妊娠第4天上午,对妊娠雌鼠施以双侧卵巢切除手术。而后分别于妊娠第5天及第6天上午8:00给卵巢切除的妊娠小鼠皮下注射孕酮(progsterone,P4,美国Sigma公司,1mg/0.1mL/只)。妊娠第7天将这些小鼠分为两组:一组注射17β-雌二醇(17β-estradiol,E2,美国Sigma公司,25ng/0.1mL/只)和P4(1mg/0.1mL/只),为延迟着床激活组;另一组只注射P4(1mg/0.1mL/只),为延迟着床组。最后一次注射24h后,颈椎脱臼法处死小鼠。延迟着床组将一侧子宫取材,另一侧子宫用生理盐水冲洗,以镜检见到延迟着床的胚胎为准。延迟着床激活组的小鼠尾静脉注射1%芝加哥蓝(0.1mL/只),5min后检查,以见到子宫上有蓝色着床位点为准。分别取延迟着床组和延迟着床激活组子宫抽提RNA,反转成cDNA,进行荧光定量PCR。定量结果如图5、表6所示。表6延时模型与延时激活模型中mmu-mir-375-3p的荧光定量数据结果延时模型与延时激活模型结果显示,在胚胎着床时,着床事件是导致mmu-miR-375-3p降低的直接原因。与延时着床模型相比,激活胚胎进行着床时,mmu-miR-375-3p降低的极其显著。直接证明了mmu-miR-375-3p与胚胎着床有密切相关。六、miR-375-3p作为抑制胚胎着床的药物在小鼠体内进行效果探究在活体妊娠小鼠体内添加mmu-miR-375-3p,探究注射mmu-miR-375-3p后对小鼠胚胎着床数的影响。具体实验步骤为:依据从miRBase获得的下调表达的mmu-miR-375-3p成熟体核苷酸序列,5’-3’序列为UUUGUUCGUUCGGCUCGCGUGA,经过甲基化碱基标记(全部碱基甲基化修饰),硫代修饰(5'端前3个碱基和3'端前4个碱基之间进行硫代修饰)和胆固醇修饰(3'末端进行胆固醇修饰)获得的更稳定的双链小RNA(mmu-miR-375-3pagomir),妊娠D3天时,一侧子宫角注射合成的mmu-miR-375-3pagomir10nmol(5μL),另一侧注射5μLDEPC水作为对照,通过模拟内源性的mmu-miR-375-3p来调节靶基因的生物学功能,观察对胚胎着床位点及数量的影响。在D7天时处死小鼠检查着床位点数变化,结果如图6所示。注射结果证明,与对照组相比,注射mmu-miR-375-3p后,子宫角中的胚胎着床点数明显降低,可见mmu-miR-375-3p对胚胎着床有极其显著的抑制作用,提示其可作为避孕药物使用。序列表<110>浙江大学<120>mmu-miR-375-3p在制备抑制胚胎着床的药物中的应用<160>1<170>SIPOSequenceListing1.0<210>1<211>22<212>RNA<213>人工序列(ArtificialSequence)<400>1uuuguucguucggcucgcguga22当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1