一种化学免疫干预剂及应用的制作方法
本发明涉及一种化学免疫干预剂及应用,属于医药技术领域。
背景技术:
众所周知,传统全身化疗及放疗对原发性肝癌的疗效有限,主要原因是临床病患多伴有不同程度肝损伤,无选择性使用细胞毒剂和放射疗法,会进一步加深肝脏损伤。肝癌目前临床主流治疗方案主要分两线。第一线治疗方法为动脉栓塞化疗术(tace),即借助影像学手段,将导管插入股动脉,寻找到肝动脉后灌注栓塞剂和化疗药物,将肿瘤养分/氧气通路直接切断,以“饿”死肿瘤的方式抗肿瘤。这种方式的优势在于化疗毒副作用大大降低,特异性高,疗效大幅度提高,经临床证明,此法确可延长中晚期肝癌病人生命,甚至少数病人可获得化疗前移,即经治疗后可进行手术切除。然而,tace依然存在一些尚未解决的问题:1.tace疗法反复几次后依然存在较强的肝毒性,总体疗效尚不够满意;2.tace治疗后会引起肿瘤部位缺血及低ph程度加重,反而会促进肿瘤血管内皮细胞vegf的活化,帮助形成新生血管,vegf是肿瘤发生、发展及转移重要的桥梁启动因子。第二线治疗方法为口服分子靶向药物,如索拉非尼,乐伐替尼等。这类药物为多激酶抑制剂,如alk、vegf、ros1等激酶抑制剂,通过多靶点的干预作用,切断肿瘤细胞生长通路。这种方式的优势在于靶向性强,特异性高,能够对抗多种肿瘤。但是,分子靶向药的手足皮肤毒性发生率很高(>70%),腹泻呕吐等发生率较高(>40%),并且价格昂贵,大部分患者的经济实力难以承受。目前临床资料表明,上述两种肝癌治疗方案的5年生存率依然较低(<10%),显然,仅通过“堵”和“杀”都难以有效延长患者生存时间,亟需一种“内通外堵”的联合治疗手段对抗肝癌。
肿瘤学经典的“种子-土壤”假说认为,肿瘤细胞是“种子”,肿瘤微环境则是“土壤”,后者在肿瘤的发生、发展、转移进程中扮演着决定性的作用。肿瘤微环境中有一类非常重要的细胞,即肿瘤相关免疫细胞。这些免疫细胞有抑制肿瘤生长的“好”细胞(如t细胞、nk细胞等)、也有促进肿瘤生长的“坏”细胞(如肿瘤相关成纤维细胞(tafs)、血管内皮细胞等),还有一类比较特殊,属于亦正亦邪的细胞(如肿瘤相关巨噬细胞(tams)),一般成熟的tams可分为经典活化的m1型和代替活化的m2型,前者能够激活肿瘤免疫清除能力;后者能够促进肿瘤组织发展,是多种肿瘤组织tams的主要表型。可见,tams在调控肝癌免疫网络过程中扮演了核心的角色。tams在干预肿瘤发生发展的机制主要表现为以下几方面:首先,在肿瘤起始阶段未成熟的tams被趋化因子(如细胞集落刺激因子-1(csf-1)、趋化因子c-c结构域配体2(ccl2)等)招募到肿瘤附近,通过转录因子信号转导和转录激活因子3(stat3)活化作用加速肿瘤细胞的活化和增殖;其次,随着肿瘤发展向前推进,tams逐步极化为m2型,并分泌多种促血管生长分子(如肿瘤坏死因子α(tnf-α)、金属蛋白酶(mmp)、血管内皮生长因子(vegf)等)协助形成血管结构,并逐步浸润到肿瘤组织的乏氧区域发展成为成熟的m2型tams;同时,m2型tams分泌各种促纤维因子(如转化生长因子β1(tgf-β1)、血小板源性生长因子(pdgf)、vegf等)调节成tafs活化,进而形成胶原沉积,造成肿瘤间质压升高,阻碍药物递送;此外,m2型tams还通过趋化因子(如ccl17/18/22)帮助调节性t细胞(treg细胞)、抑制t/nk细胞的活化;最后,m2型tams还分泌egfr家族配体(如肝素结合性表皮生长因子(hb-egf)等)和stat3活化物(如白介素6(il-6)、白介素10(il-10)等),诱导肿瘤细胞干性作用,抵抗毒性药物对组织的杀伤作用。由此可知,抑制tams的m2极化对于抗肿瘤化学免疫治疗意义重大。与之相反,m1型tams能够招募粒细胞或者通过自身的吞噬能力直接清除肿瘤细胞;通过抑制血管内皮细胞或者tafs增生阻断肿瘤组织的构建;通过减少趋化因子的释放提高t淋巴细胞的活性,整体上激活肿瘤免疫微环境。显然,诱导tams的m1极化对于抗肿瘤化学免疫治疗同样重要。目前,如何诱导tams的m1极化还处于空白阶段,借助合理的药物干预手段降低m2表型数量、诱导其发生m1极化,通过重新激活肝癌免疫微环境的方式使tams成为清除肿瘤的“领军”力量,已经成为极具前景的抗肿瘤新策略。申请人前期研究基础发现,超顺磁氧化铁纳米粒(spions)能够诱导m2型tams向m1型极化,进而引发fe离子与m1型tams产生的过氧化氢发生fenton反应。可见,spions有望作为化学免疫干预药物,用于tamsm1极化诱导剂,激活肿瘤免疫微环境,抑制肿瘤的发生和发展。此外,临床常用spions作为mri的造影剂和缺铁性贫血的补铁剂,安全性相对有保障。但是,spions用于tams极化干预的浓度高于临床常用剂量(约10倍),因此,无法直接将现有的spions市售制剂用于化学免疫治疗。
技术实现要素:
本发明的目的是针对上述现有技术中的缺陷,提出一种化学免疫干预剂及应用,填补目前空缺。
本发明通过以下技术方案解决技术问题:一种化学免疫干预剂,由药物与栓塞材料混合制成。
所述药物为超顺磁氧化铁纳米粒、猪苓多糖、香菇多糖、熊果酸或上述化合物相应的铁纳米粒(制备方法见201810925321.0)中的一种;所述栓塞材料为无水乙醇,鱼肝油酸钠、碘化油、标准化明胶海绵颗粒、药物洗脱微球中的一种。
本发明进一步提供上述化学免疫干预剂的应用,包括所述化学免疫干预剂在制备诱导m2型巨噬细胞向m1型巨噬细胞极化的药物中的应用。上述应用中还包括微乳系统药物,所述微乳由以下组分按重量比组成,药物(2-20):油(100-400):表面活性剂(350-600):助表面活性剂(100-300):水(2000-5000)。
所述药物(4-16):油(200-300):表面活性剂(400-600):助表面活性剂(150-300):水(2500-3500)。
将上述所有组分在室温下搅拌2-8小时至混匀,注入水,得到微乳。微乳系统粒径均为30-150nm,多分散系数均在0.200以下。
化学免疫干预剂与微乳的剂量比为10-30:5mg/kg。
本发明的制剂可诱导m2型tams向m1型极化,为抗肿瘤药物提供新的途径。本发明整合了tace的治疗特点和化学免疫治疗优势,利用tace定点运输药物的特点实现了化学免疫药物在肿瘤部位的足量聚集;同时,化学免疫治疗也弥补了tace治疗可能引起的vegf等因子活化以及易复发的劣势。这种化学免疫药物的在tace治疗中的新应用有望为临床治疗肝癌带来全新的治疗模式和值得期待的治疗效率。
附图说明
图1为tace-磁纳米粒对原发性肝癌tams特征信息考察示意图,图中(a)基因相对表达量,(b)cd206相对表达量,(c)tams上清液tnf-α及(d)il-10。
图2为tace-磁纳米粒对原发性肝癌药效学考察示意图,图中(a)肿瘤生长体积变化,(b)治疗终点和起点的肿瘤指数比,(c)各组体重变化,(d)各组动物的生存曲线.(x±s,n=6);**p<0.01。
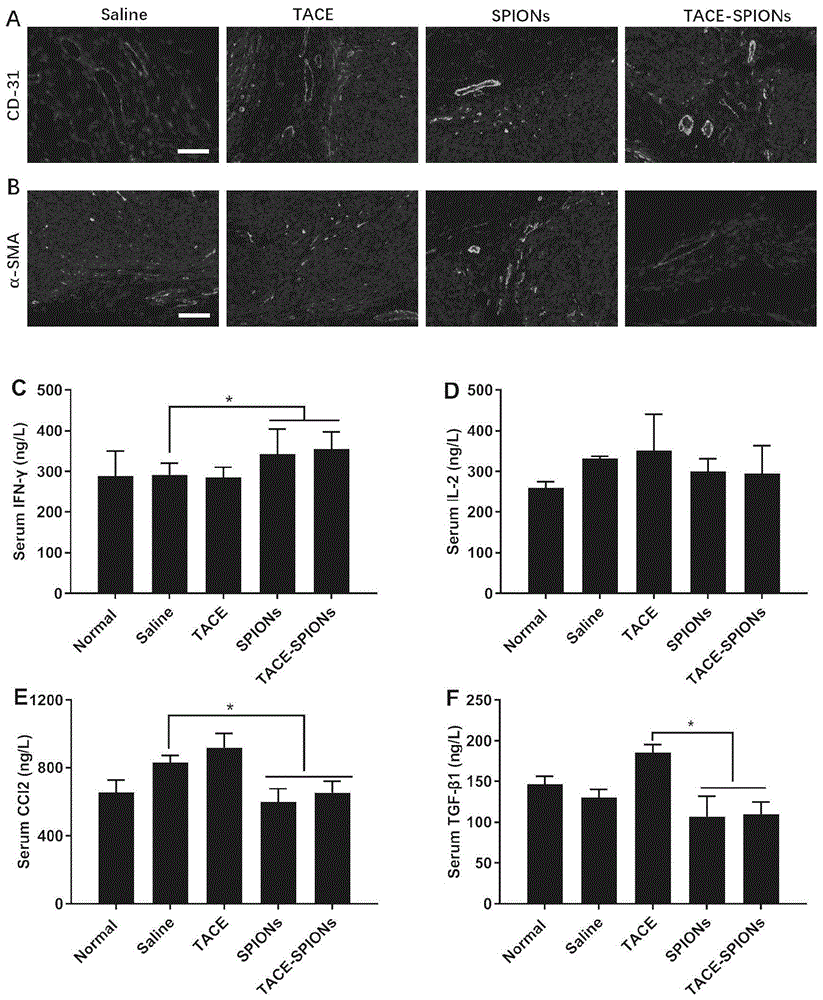
图3为tace-磁纳米粒对原发性肝癌模型肿瘤免疫微环境影响的评价示意图,图中(a)肿瘤血管免疫染色图片,(b)肿瘤组织成纤维细胞免疫染色图片,(c-f)动物血清ifn-γ、il-2、ccl2、tgf-β的含量变化。
图4为分子靶向微乳的制备及表征示意图,图中(a)乐伐替尼微乳tem图,(b)乐伐替尼-薏苡仁油微乳tem图,(c)索拉非尼微乳tem图,(d)索拉非尼-薏苡仁油微乳tem图,(e)乐伐替尼微乳粒径图,(f)索拉非尼微乳粒径图。
图5为分子靶向微乳对原发性肝癌药效学考察示意图,图中(a)肿瘤体积变化,(b)生存曲线,(c)ki67免疫组化图及(d)he染色。
图6为分子靶向微乳对原发性肝癌模型肿瘤激酶影响评价示意图,图中(a)alk表达,(b)vegf表达,(c)ros1表达及(d)fgfr表达定量图。
图7为mri(t2加权成像)在化学免疫&分子靶向联合治疗对原发性肝癌模型治疗评价示意图。
具体实施方式
实施例
本实施例以原发性肝癌老鼠为模型,依托tace技术将含有超顺磁氧化铁纳米粒的化学免疫干预剂灌注至肿瘤部位,提前诱导瘤内m2型tams向m1型极化,激活tams清除肿瘤能力、遏制其转移;再将分子靶向药构建成微乳递药系统,借助微乳促吸收技术将药物高效递送至肿瘤部位,进一步切断肿瘤生长。治疗过程中,还可以凭借超顺磁氧化铁纳米粒的mri成像能力,实时调整治疗方案,验证治疗效果。
首先,建立一种基于tace技术的化学免疫治疗肝癌方案。该方案需优化的参数包含构建原发性肝癌模型、给药方案优化、影像学数据追踪以及治疗方案评估,原发性肝癌动物模型选用裸鼠、昆明小鼠、sd大鼠等,原发性肝癌特定的接种细胞为hepg2细胞、huh-7细胞、smmc-7721细胞、hhcc细胞等,接种类型为肝脏原位注射、皮下注射、尾静脉静注等;给药方案涉及到三部分,一是栓塞材料的选择,主要以无水乙醇、鱼肝油酸钠、碘化油、标准化明胶海绵颗粒、药物洗脱微球中等液体栓塞材料,二是铁纳米粒的给药浓度,设为10mg/kg、20mg/kg、30mg/kg三个剂量组;三是化学免疫干预药物的选择,主要以超顺磁氧化铁纳米粒、猪苓多糖、香菇多糖、熊果酸等;影像学手段为小动物pet/ct、小动物pet/mri、spect/ct、spect/mri等;治疗方案评估为游标卡尺测量异位瘤体积、小动物pet/ct、小动物pet/mri、spect/ct、spect/mri等影像学手段量化肿瘤体积。
本实施例按以下方法配制化学免疫干预剂:
以碘化油作为栓塞材料为例,分为油包水(碘化油油滴包含水溶性的药物)和水包油(水溶性的药物包含碘油油滴)两种形式,前者更容易在肿瘤部位聚集,方法为:将碘油缓慢滴入水溶液中,体积比通常为1:2-2:1,搅拌30min,搅拌速率为50-200rmp,温度为室温。以spions作为化学免疫干预剂为例:使用非离子型造影剂溶解spions制备治疗药物水溶液,浓度为1-30mg/ml,备用。碘化油乳剂的制备中推荐采用两个注射器与三通相连的方式进行混合;载药注射器的溶剂应首先推入含有碘化油的注射器,使大滴药物包绕于碘化油内,形成良好的油包水乳剂。通过三通阀快速混合的力量降低乳剂油滴的大小,至少20次的混合可以得到tace栓塞所需要的70-100μm的乳剂。碘化油的用量可以达到肿瘤直径的2-3倍,并且栓塞材料与药物的比例可在1:50-50:1之间酌情选择。
该方法中的药物还可以为猪苓多糖、香菇多糖、熊果酸以及上述化合物的铁纳米粒中的一种,上述化合物的铁纳米粒(制备方法见201810925321.0);所述栓塞材料还可替换为无水乙醇,鱼肝油酸钠、标准化明胶海绵颗粒、药物洗脱微球中的一种。
再构建一种分子靶向药物口服微乳递送系统。该微乳递药系统的处方构成为药物,油,表面活性剂,助表面活性剂与水,五者之间的重量比是(2-20):(100-400):(350-600):(100-300):(2000-5000),最优的质量比为(4-16):(200-300):(400-600):(150-300):(2500-3500)。通过以上方案所制备的系统粒径均在30-150nm之间,多分散系数均在0.200以下,溶液澄明,ph、储存、血清稳定性均达到实验标准,体外释放速率和药动学主要参数均达到预期目标,优于分子靶向药物原型。
最后,建立一种基于tace技术的化学免疫治疗联合分子靶向药物口服微乳的抗肝癌方案。该方案需优化的参数除上述两个技术方案所涉及的参数外,还包含联合给药方案优化、以及实时优化治疗方案、评估联合治疗效率,给药方案涉及到三方面,一是两种治疗的联合顺序,主要以造模后同时给药、造模后先tace化学免疫治疗,再口服分子靶向微乳药物、肿瘤生长到一定体积后同时给药、肿瘤生长到一定体积后先tace化学免疫治疗,再口服分子靶向微乳药物等;二是分子靶向微乳药物的介入时间,以肿瘤的大小为量化指标(50mm3,100mm3,200mm3);三是氧化铁纳米粒与分子靶向药的剂量比,特征为10/5mg/kg、20/5mg/kg、30/5mg/kg三个剂量比组。所述的实时优化治疗方案、评估联合治疗效率,特征为借助流式细胞分析技术表征瘤内肿瘤相关巨噬细胞(tams)的分型变化,瘤组织的细胞因子变化,特征mrna水平变化,借助小动物pet/ct、小动物pet/mri、spect/ct、spect/mri等影像学手段量化肿瘤体积等。
本实施例构建的“化学免疫—分子靶向—实时成像”三位一体式联合诊疗方案,将依托肿瘤动脉栓塞技术预先灌注超顺磁氧化铁纳米粒至肿瘤部位,诱导瘤内m2型tams向m1型极化,激活tams清除肿瘤能力、遏制其转移;后续再依托微乳促吸收技术将分子靶向药高效递送至肿瘤部位,进一步切断肿瘤生长。整个治疗过程可以在mri成像下实时优化治疗方案,评估治疗效果。
体内验证tace技术支撑下超顺磁氧化铁纳米粒化学免疫治疗原发性肝癌的药效学:
1)体内荷瘤动物模型:将0.05-0.2ml107-105/ml肝癌细胞接种在动物体内不同部位,建立原位/异位/循环肿瘤动物模型。
2)体内tace化学免疫治疗:借助pet/ct、小动物pet/mri、spect/ct、spect/mri等影像学手段,将10-30mg/kg的铁纳米粒混入无水乙醇、鱼肝油酸钠、碘化油等液体栓塞剂中,通过导管从股动脉插入,寻找到肝癌血供动脉。
3)体内抗肿瘤效应评价:借助小动物pet/mri、spect/mri等核磁共振成像仪,不同时间点核磁成像评价肿瘤大小变化情况。
4)体内化学免疫疗效评价:给药12-48天后,采集血液,制备血清1000-5000ml,进行细胞因子tnf-α、il-2、il-4、il-6、il-12a、inf-γ、趋化因子ccl-2、tgf-β、生长因子egf家族等测定;处死动物,剥离肿瘤组织,切片免疫染色定性定量考察cd86、cd206等特征markers的情况,westernblot法测定mmp家族、egf家族、tgf-β等蛋白表达,pcr考inos、arg1等mrna的表达情况。
更优选的方案包括(此方案以原位肝癌模型为例):
1)体内荷瘤动物模型:将0.1ml105/mlwalker256肝癌细胞接种在sd大鼠肝脏部位,建立原位肿瘤大鼠模型,14d后考察模型建立情况。
2)体内tace化学免疫治疗:借助小动物pet/ct影像学手段,将30mg/kg的铁纳米粒混入碘化油栓塞剂中,通过导管从股动脉插入,寻找到肝癌血供动脉,30min内灌注完毕。
3)体内抗肿瘤效应评价:借助小动物pet/mri、spect/mri等核磁共振成像仪,在给药后1d、3d、5d、7d、12d、24d等不同时间点,核磁成像评价肿瘤大小变化情况,黑色为正常组织,白色为肿瘤组织。
4)体内化学免疫疗效评价:给药12天后,采集血液,制备血清2000ml,进行细胞因子tnf-α、il-2、il-4、il-6、il-12a、inf-γ、趋化因子ccl-2、tgf-β、生长因子egf家族等测定;处死动物,剥离肿瘤组织,切片免疫染色定性定量考察cd86、cd206等特征markers的情况,westernblot法测定mmp家族、egf家族、tgf-β等蛋白表达,pcr考inos、arg1等mrna的表达情况。
体内验证微乳递药技术对分子靶向药物治疗原发性肝癌的药效学影响:
1)分子靶向药物口服微乳的制备
取油类(包括有活性的和普通油相辅料)、表面活性剂、助表面活性剂以及分子靶向药物,室温搅拌2-8h至完全混匀,高速搅拌下缓慢注入水相,制得抗肿瘤微乳;
2)体内荷瘤动物模型:将0.05-0.2ml107-105/ml肝癌细胞接种在动物体内不同部位,建立原位/异位/循环肿瘤老鼠模型。
3)体内抗肿瘤治疗及效应评价:借助小动物pet/mri、spect/mri等核磁共振成像仪,在给药后不同时间点,测量肿瘤体积或根据核磁成像评价肿瘤大小变化情况。
更优选的制备方法包括(此部分以薏苡仁油-乐伐替尼微乳为分子靶向微乳代表):
1)分子靶向药物口服微乳的制备
取薏苡仁油400mg、表面活性剂hs15400mg、助表面活性剂peg400130mg、乐伐替尼10mg,室温搅拌4h至完全混匀,高速搅拌下缓慢注入水相3ml,制得薏苡仁油-乐伐替尼微乳;
2)体内荷瘤动物模型:将0.1ml105/mlwalker256肝癌细胞接种在sd大鼠肝脏部位,建立原位肿瘤大鼠模型,14d后考察模型建立情况。
3)体内抗肿瘤治疗及效应评价:借助小动物pet/mri、spect/mri等核磁共振成像仪,在给药后不同时间点,测量肿瘤体积或根据核磁成像评价肿瘤大小变化情况。
体内验证tace-化学免疫联合分子靶向微乳药物治疗原发性肝癌的药效学:
1)联合治疗方案
联合治疗分为同时给予两种药物和序贯给药两大类:第一类,选用原位肝癌老鼠模型,通过tace技术将含有铁纳米粒的栓塞剂灌注到肿瘤血供处,并同时给予分子靶向口服微乳;第二类为通过tace技术将含有铁纳米粒的栓塞剂灌注到肿瘤血供处,通过mri观察肿瘤部位形态学和尺寸变化,择机给予分子靶向口服微乳联合治疗。
2)影像学技术支撑下的药效学评价
联合给药12-48天的后,借助小动物pet/mri、spect/mri等核磁共振成像仪,核磁成像评价肿瘤大小变化情况
3)联合治疗对肿瘤微环境影响以及优势评价
体内化学免疫疗效评价:给药12-48天后,采集血液,制备血清1000-5000ml,进行细胞因子tnf-α、il-2、il-4、il-6、il-12a、inf-γ、趋化因子ccl-2、tgf-β、生长因子egf家族等测定;处死动物,剥离肿瘤组织,切片免疫染色定性定量考察cd86、cd206等特征markers的情况,westernblot法测定mmp家族、egf家族、tgf-β等蛋白表达,pcr考inos、arg1等mrna的表达情况。并通过组间比较,评价联合治疗的优势。
更优选的制备方法包括(此部分以原位肝癌模型、薏苡仁油-乐伐替尼微乳为分子靶向微乳为代表):
1)联合治疗方案
联合治疗分为同时给予两种药物和序贯给药两大类:第一类,选用walker256原位肝癌sd大鼠模型,造模14d后,pet/ct验证模型成立。在pet/ct影像学技术支撑下,通过tace技术将含有30mg/kg的铁纳米粒混入碘化油栓塞剂中,30min内缓慢灌注到肿瘤血供处,每96h介入治疗一次,8-12d后mri和pet/ct双重手段观察肿瘤情况,在肿瘤回缩的情况下给予5mg/kg薏苡仁油-乐伐替尼微乳,治疗14d后,mri和pet/ct等影像学手段持续跟踪判断。
2)影像学技术支撑下的药效学评价
联合给药12-48天的后,借助小动物pet/mri、spect/mri等核磁共振成像仪,核磁成像评价肿瘤大小变化情况
3)联合治疗对肿瘤微环境影响以及优势评价
体内化学免疫疗效评价:给药28天后,采集血液,制备血清3000ml,进行细胞因子tnf-α、il-2、il-4、il-6、il-12a、inf-γ、趋化因子ccl-2、tgf-β、生长因子egf家族等测定;处死动物,剥离肿瘤组织,切片免疫染色定性定量考察cd86、cd206等特征markers的情况,westernblot法测定mmp家族、egf家族、tgf-β等蛋白表达,pcr考inos、arg1等mrna的表达情况。并通过组间比较,评价联合治疗的优势。
具体如下:
1.tace-磁纳米粒对原发性肝癌tams特征信息考察
以huh-7肝癌荷瘤小鼠为模型,按既定方案给药后,剥离肿瘤组织并进行单细胞分散,以lps+ifn-γ组合干预作为m1极化阳性组,以il-4干预为m2极化阳性组,不同治疗组细胞用rt-pcr法定量药物干预后特征基因表达(m1型的inos和cd86,m2型的arg1),并制备细胞爬片,固定、封闭、打孔,cd206-apc抗体染色,流式检测m2型特征markercd206的表达情况;利用常规的elisa法测试不同干预后细胞上清液中tnf-α(m1)和il-10(m2)细胞因子水平。研究发现,tace-spions能够有效抵抗巨噬细胞il-4活化,显著降低m2型标志物cd206表达,明显减少m2型特征细胞因子il-10分泌,并上调m1型特征基因的表达(图1a-d),提高特征细胞因子tnf-α的水平。结果证实,tace-spions可有效抑制tams的m2极化,促进m1型极化。
此外,以tace-猪苓多糖、猪苓多糖-spions和tace-猪苓多糖-spions(以猪苓多糖计,10-80mg/kg)为测试组做相同指标测试,研究发现,三组均能够具有m1极化诱导趋势,显著升高m1型标志物cd86表达,降低m2型标志物cd206表达,明显减少m2型特征细胞因子il-10分泌,促进tnf-α的分泌,不仅能下调m2型特征基因arg1表达,还能上调m1型特征基因inos、cd86表达(图2a-d)。组间结果比较显示,tace-猪苓多糖-spions在降低m1型tams标志物上活性显著高于tace-猪苓多糖和猪苓多糖-spions组,提示了tace与猪苓多糖-spions联用在抗肝癌方面的优势。
2.tace-磁纳米粒对原发性肝癌药效学考察
采用生理盐水组为阴性对照,考察tace、spions以及tace-spions三组对原发性肝癌治疗效应。结果表明与生理盐水组相比,各组均有抑制肿瘤增长的作用,其中tace介入治疗两组明显优于普通注射spions(图3a)。通过裸鼠肿瘤增长趋势对比图发现,tace-spions治疗前后不仅有效抑制了肿瘤生长,还将肿瘤体积缩小一半以上(图3b),明显优于单独tace组以及单独spions组。治疗期间给药各组均未出现降低裸鼠体重的不良反应(图3c)。相同治疗条件下,tace-spions组的小鼠生存时间高于50天,明显优于其他各组(图3c,d)。
3.tace-磁纳米粒对原发性肝癌模型肿瘤免疫微环境影响的评价
以生理盐水组为阴性对照组,比较tace、spions以及tace-spions治疗原发性肝癌对肿瘤免疫微环境,包括肿瘤血管、肿瘤相关成纤维细胞、各类细胞因子/趋化因子的影响。结果提示,tace-spions组可显著改善肿瘤组织中血管的病理状态,具体表现为血管密度明显降低,血管直径明显增加;但是单独tace组,血管密度较大,且细小的血管较多,提示tace-spions治疗后vegf活化程度较低(图3a)。此外,我们还对肿瘤相关成纤维细胞(tafs)膜上的肌动蛋白α-sma进行抗体标记染色,表征治疗后瘤组织内tafs的密度。结果显示,tace-spions治疗后的荧光强度最低,但是生理盐水组和tace组的荧光强度较高,提示瘤组织的tafs密度经过tace-spions治疗后可显著降低(图3b)。
血清中的细胞因子也是肿瘤微环境的重要组成部分。通过elisa试剂盒对荷瘤小鼠血清中il-2,ccl2,tgf-β1与ifn-γ进行含量测定。结果表明,tace-spions和spions组能够显著提高ifn-γ的水平,明显降低ccl2和tgf-β1血清含量(图3c-f),提示化学免疫以及介入-化学免疫治疗可能减少趋化因子的分泌,降低肿瘤生长和转移的可能性。
4.分子靶向微乳的制备及表征
该发明中的分子靶向药物微乳制备方法如下,取1.0g薏苡仁油和1.0ghs15,室温搅拌4-8h或升温搅拌0.5-2h,完全混匀后加入0.5g助乳化剂peg400至上述混合体系中,室温下继续搅拌2h,备用。再加入10-30mg索拉非尼继续搅拌2h,最后10ml去离子水恒速、缓慢滴入上述制备的混合体系中,并不断匀速搅拌体系,直至出现透亮澄明的体系出现。油相还可以用cs1944替代,乳化剂hs15还可以用rh40等替代,分子靶向药物索拉非尼还可以用乐伐替尼、厄洛替尼等替代。图4结果表明,乐伐替尼微乳和乐伐替尼-薏苡仁油微乳形态成近圆形,粒径约为40nm;索拉非尼微乳和索拉非尼-薏苡仁油微乳形态也成近圆形,粒径约为30nm;厄洛替尼微乳和厄洛替尼微乳形态成近圆形,粒径约为30nm。
5.分子靶向微乳对原发性肝癌药效学考察(以乐伐替尼微乳为例)
实验设置乐伐替尼、乐伐替尼微乳、生理盐水三组,结果如图5a所示,乐伐替尼和乐伐替尼微乳组明显抑制了肿瘤的生长,并且两组在治疗终点时肿瘤体积也有显著性差异。通过对比治疗期间肿瘤生长的趋势比(图5b)可知,生理盐水组体积增长了3.34倍,乐伐替尼组体积增长了1.85倍,而乐伐替尼微乳组瘤体积增加了1.24倍,微乳组抑瘤趋势明显强于裸药组。图5c是三种治疗的ki67免疫组化图,微乳组动物的瘤组织切片褐色明显低于乐伐替尼,显示其抑制肿瘤细胞增殖的能力较强。图5d展示的是三组治疗的he染色图,结果可知生理盐水组的肿瘤细胞坏死较少,但是乐伐替尼两组的肿瘤细胞核明显形态异样,提示治疗能够引起肿瘤细胞坏死。
6.分子靶向微乳对原发性肝癌模型肿瘤激酶影响评价(以乐伐替尼微乳为例)
实验设置乐伐替尼、乐伐替尼微乳、生理盐水三组,结果如图6所示,乐伐替尼和乐伐替尼微乳均能显著抑制alk、vegf、ros1、fgfr的蛋白水平,提示制备成微乳体系后没有影响乐伐替尼多激酶抑制能力。
7.mri(t2加权成像)在化学免疫&分子靶向联合治疗对原发性肝癌模型治疗评价
实验设置tace-spions和tace-spions&lev-mes联合组两组治疗,最后一次治疗后24h进行小动物mri成像。结果如图7所示,tace-spions治疗后肿瘤体积约为200mm3,而tace-spions&lc-mes治疗后体积约为80mm3,提示联合治疗对于治疗原发性肝癌的优势。8.化学免疫&分子靶向联合治疗对原发性肝癌药效学
实验设置tace-spions、lev-mes和tace-spions&lev-mes联合组三组治疗,最后一次治疗后24h进行小动物mri成像,观察肿瘤体积与治疗前的比例,并对肿瘤组织病理切片进行观察。结果如表1所示,tace-spions治疗后肿瘤体积约为治疗前的76%,而lev-mes组肿瘤体积相比治疗前增长了34%,但是tace-spions&lev-mes组瘤体积仅为治疗前的53%,明显优于其他两组。此外,三组老鼠的最大生存时间最长的组别为联合治疗组。通过对ki-67免疫组化结果对比可知,联合治疗组的阳性率最低,提示这种治疗方式抑制肿瘤细胞增殖能力最强。tunel免疫组化结果对比可知,联合治疗组的阳性率最高,提示这种治疗方式诱导肿瘤细胞凋亡能力最强。
表1化学免疫&分子靶向联合治疗对原发性肝癌药效学考察
9.化学免疫&分子靶向联合治疗对对原发性肝癌模型肿瘤免疫微环境影响
实验设置tace-spions、lev-mes和tace-spions&lev-mes联合组三组治疗,最后一次治疗后24h进行血样采集,制备血清和用elisa试剂盒对各种细胞因子以及免疫细胞标记物进行定量。结果如表2所示,联合治疗组血清的ifn-γ水平最高,但是tgf-β1水平最低,提示联合治疗能够促进m1tams极化,抑制m2tams极化过程。此外,单独tace-spions治疗后肿瘤组织内的cd31阳性细胞比例为11.2%,明显高于lev-mes组和联合治疗组,提示介入治疗有活化vegf的缺点,联合治疗则可以进行针对性的解决此类问题。此外,各组治疗后的瘤组织内α-sma+细胞率排名分别为lev-mes>tace-spions>联合治疗,α-sma是肿瘤相关成纤维细胞的标志物,也是肝癌肿瘤微环境中另一个重要的免疫细胞,是主要的促瘤因素。结果表明联合治疗有助于降低肿瘤相关成纤维细胞的比例,有利于恢复肿瘤免疫抑制微环境,提高抗肿瘤能力。
表2化学免疫&分子靶向联合治疗对对原发性肝癌模型肿瘤免疫微环境影响的评价
10.化学免疫&分子靶向联合治疗对原发性肝癌模型肿瘤激酶影响
实验设置tace-spions、lev-mes和tace-spions&lev-mes联合组三组治疗,最后一次治疗后24h进行血样采集,制备肿瘤组织匀浆,提取蛋白后westernblot法对各种激酶进行定量。结果如表3所示,lev-mes对各种激酶的抑制能力明显优于tace-spions,而联合治疗组也较好地保留了lev-mes多激酶抑制功能,提示联合治疗中免疫治疗和分子靶向治疗协同发挥抗肿瘤的理念是科学有效的。
表3化学免疫&分子靶向联合治疗对原发性肝癌模型肿瘤激酶(与内参比)影响评价
除上述实施外,本发明还可以有其他实施方式。凡采用等同替换或等效变换形成的技术方案,均落在本发明要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!