一种光电微针及其制备方法和应用与流程
本发明属于光电材料领域,更具体地,涉及一种光电微针及其制备方法和应用。
背景技术:
体表肿瘤是指长在体表上的肿物,有良性肿瘤与恶性肿瘤之分,常见的体表良性肿瘤包括:黑色素痣、血管瘤、神经纤维瘤、疣和黄色瘤等,常见的体表恶性肿瘤又称体表癌,包括:皮肤癌、黑色素瘤和皮肤肉瘤等。仅侵犯表皮和真皮的体表良性肿瘤,可选择合适的非手术疗法进行治疗,而一旦肿瘤深达真皮以下则以手术疗法为宜;体表癌以手术疗法为主。
随着人口老龄化、生活模式改变、环境污染等因素的影响,中国体表癌的发生率呈现升高的趋势,如果将所有体表癌统计在一起,比胃癌、肺癌、肝癌等常见内脏恶性肿瘤的发病率都高。目前,手术切除是体表癌最主要的治疗方法。传统的体表癌切除法通常为术中十字扩大切除法。然而,这仅是一种抽样检测,文献报道这样做的边界漏检率最多可以达到44%。对于原发性高风险和高复发基底细胞癌,其肿瘤的不完全切除率分别为18%和32%。mohs显微描记手术的出现,解决了传统扩大切除后随机送检的不足。该方法通过对所有切缘进行100%的病理检测,直至扩大切除到所有切缘都未检测到肿瘤细胞才视为彻底切除,这样就大大减少了传统术中十字扩大切除法的遗漏。对于复发性基底细胞癌,传统手术5年治愈率只有80.1%,而mohs显微描记手术可以达到94.4%。
但是,体表癌常呈皮下浸润扩散生长,其体表界限远不能反映肿瘤的真实边界,导致术前无法准确评估体表肿瘤的真实边界,很难将病灶彻底切除,容易复发。肿瘤复发后往往生长速度更快、侵袭范围更广、组织修复更困难,又进一步给手术治疗增加了难度。此外,体表癌常发生在头部、面部等暴露部位,术后会对患者容貌造成影响。因此,研究如何快速、高效的杀灭体表癌细胞,具有十分重要的临床价值。
技术实现要素:
本发明要解决的技术问题是克服现有杀灭体表癌的方法带来的病灶切除不干净、皮肤损伤面积大且容易复发的问题,提供一种可快速、高效杀灭体表癌细胞,彻底切除病灶,对皮肤无损伤且不会留下疤痕的方法。
本发明的第一个目的是提供一种光电微针的制备方法。
本发明的第二个目的是提供上述方法制备得到的光电微针。
本发明的第三个目的是提供上述光电微针在制备治疗体表癌的药物中的应用。
本发明上述目的通过以下技术方案实现:
本发明首先提供了一种光电微针的制备方法,由具有光电效应的纳米颗粒和生物可降解原料组成,所述纳米颗粒和生物可降解原料的质量比为3~8:5。
优选地,所述纳米颗粒和生物可降解原料的质量比为1:1。
优选地,所述光电微针的制备方法,将具有光电效应的纳米颗粒与浓度为31.25~1000μg/ml的生物可降解原料按照3~8:5的比例混合后,注入模具中,加热,冷却成型,即可得到所述光电微针。
当纳米颗粒的浓度过高(大于1000μg/ml)时,无法有效地杀死肿瘤细胞;当纳米颗粒的浓度过低(小于31.25μg/ml)时,会对正常组织产生较大的毒副作用。
优选地,所述纳米颗粒的浓度为250μg/ml。
当纳米颗粒和生物可降解原料的比例小于3~8:5,无法有效地杀死肿瘤细胞;当纳米颗粒和生物可降解原料的比例大于3~8:5,会对正常组织产生较大的毒副作用。
优选地,所述纳米颗粒与生物可降解原料混合的比例为1:1。
优选地,所述纳米颗粒为氧化银、氧化锌、二硫化钼、石墨烯或石墨相氮化碳中的任意两种或两种以上。
以上任意两种纳米颗粒的混合,与生物可降解原料组成光电微针,可以有效地提高光电微针的抗肿瘤性能。
当所述纳米颗粒为氧化银、氧化锌、二硫化钼、石墨烯或石墨相氮化碳中的任意一种时,与生物可降解原料组成的光电微针,不具有抗肿瘤活性。
所述纳米颗粒具有光电效应,生物相容性好、对细胞毒害作用小。
更优选地,所述纳米颗粒为氧化锌和石墨相氮化碳两种。
更进一步优选地,所述氧化锌和石墨相氮化碳的质量比为0.08~0.42:1。
再进一步优选地,所述氧化锌和石墨相氮化碳的质量比为0.21:1。
优选地,所述生物可降解原料为玻尿酸、聚乳酸、壳聚糖或聚乙醇酸中的任意一种或几种。
所述生物可降解原料在体内可降解,且降解产物不会在体内积累,对人体各主要器官无毒副作用。
更优选地,所述生物可降解原料为玻尿酸。
优选地,所述加热的温度为60℃~90℃。当加热的温度小于60℃时,温度过低;当加热的温度大于90℃时,对模具的实验寿命损害较大。
更优选地,所述加热的温度为80℃。
优选地,所述加热的时间为4~12h。当加热的时间小于4h时,微针片的干燥效果差;当加热的时间大于12h时,会造成能源浪费。
更优选地,所述加热的时间为8h。
优选地,所述加热的速度为2~7℃/min。当加热的速度为小于2℃/min时,速度太慢;当加热的速度为大于7℃/min时,会造成微针片皱缩。
更优选地,所述加热的速度为5℃/min。
优选地,所述模具为微针阵列模具。
优选地,所述注入模具时的压强为1~10mpa。
更优选地,所述注入模具时的压强为5mpa。
另外,上述方法制备得到的光电微针,也应在本发明的保护范围之内。
优选地,所述光电微针包括圆柱形部分和针尖形部分。
更优选地,所述光电微针圆柱形部分的直径为50~500μm,高度为50~500μm。
更进一步优选地,所述光电微针圆柱形部分的直径为100μm,高度为150μm。
更优选地,所述光电微针针尖形部分的长度为100~400μm,顶角为30°~60°。
更进一步优选地,所述光电微针针尖形部分的长度为200μm,顶角为45°。
所述光电微针在光照条件下,产生活性氧(ros),ros与其相邻的生物大分子发生氧化反应,产生细胞毒性作用,进而导致体表癌细胞受损甚至死亡。
因此,所述光电微针在制备治疗体表癌的药物中的应用,也应在本发明的保护范围之内。
所述光电微针具有足够的穿刺能力,可穿刺皮肤角质层,到达真皮层。
所述应用为:将所述光电微针贴附于体表癌处,进行光照。
优选地,所述光照的时间为10~120min。
更优选地,所述光照的时间为10~30min。
更进一步优选地,所述光照的时间为30min。
优选地,所述光照的强度为5~10lx。
更优选地,所述光照的强度为7lx。
优选地,所述光照的光源为日光灯、氙灯、白炽灯或激光灯中的任意一种或几种。
更优选地,所述光照的光源为氙灯。
与现有技术相比,本发明具有以下有益效果:
本发明首先提供了一种光电微针的制备方法,该方法操作简单、成本低、可重复性好。该光电微针具有足够的穿刺能力,可穿刺皮肤角质层,到达真皮层,能够将具有光电效应的纳米颗粒输送至肿瘤部位,在光照下产生ros,ros与其相邻的生物大分子发生氧化反应,产生细胞毒性作用,进而导致体表癌细胞受损甚至死亡,进而快速、高效杀灭体表癌细胞;而且该光电微针在体内可降解,不会在体内遗留微针残留物,降解产物对人体无毒副作用。
本发明提供的光电微针可快速、高效杀灭体表癌细胞,彻底切除病灶,对皮肤无损伤且不会留下疤痕,解决了当前杀灭体表癌的方法所带来的病灶难以彻底切除、容易复发、皮肤损伤过大等难题,在制备治疗体表癌的药物中具有良好的应用前景和广阔的发展空间。
附图说明
图1是本发明制备光电微针所用的微针阵列模具的示意图;其中,1代表微针阵列模具,10代表微针阵列模具的圆柱形部分,11代表微针阵列模具的针尖形部分。
图2是本发明实施例1制备得到的光电微针的示意图;其中,2代表光电微针,20代表生物可降解原料,21代表纳米颗粒。
图3是本发明制备得到的光电微针的应用的示意图;其中,2代表光电微针,3代表皮肤癌组织。
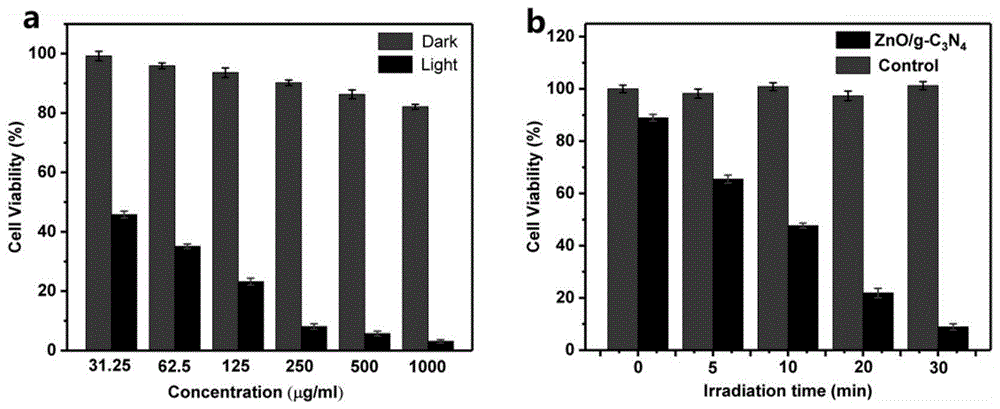
图4是本发明制备得到的光电微针的性能测试结果图;其中,图a是利用不同浓度的纳米颗粒制备得到的光电微针对人皮肤鳞癌a431细胞的毒性结果图;图b是照射不同时间时,光电微针对人皮肤鳞癌a431细胞的毒性结果图。
具体实施方式
以下结合具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
本发明制备光电微针所用的微针阵列模具的示意图如图1所示。
实施例1光电微针的制备
一种光电微针的制备方法,具体包括以下步骤:
s1.将氧化锌和石墨相氮化碳以质量比为0.21:1混合,得到具有光电效应的纳米颗粒,配制成浓度为250μg/ml的纳米颗粒;
s2.将步骤s1得到的纳米颗粒与玻尿酸以1:1的比例混合,搅拌,得到混合物;
s3.将步骤s2得到的混合物在压强为5mpa的条件下,注入微针阵列模具中,以5℃/min的速度加热至80℃,加热时间为8h;
s4.冷却成型后,从微针阵列模具中取出的即为光电微针。
步骤s1中,浓度为250μg/ml的纳米颗粒的配制方法为:将1mg纳米颗粒放入包含10%血清的dmem高糖培养基中,然后通过梯度稀释法配制浓度为250μg/ml的纳米颗粒。
本实施例1制备得到的光电微针圆柱形部分的直径为100μm,长度为150μm;针尖形部分的长度为200μm,顶角为45°。
本实施例1制备得到的光电微针的示意图如图2所示。本发明制备得到的光电微针的应用的示意图如图3所示。
实施例2光电微针的制备
一种光电微针的制备方法,具体包括以下步骤:
s1.将氧化锌和石墨相氮化碳以质量比为0.08:1混合,得到具有光电效应的纳米颗粒,配制成浓度为250μg/ml的纳米颗粒;
s2.将步骤s1得到的纳米颗粒与聚乳酸以3:5的比例混合,搅拌,得到混合物;
s3.将步骤s2得到的混合物在压强为1mpa的条件下,注入微针阵列模具中,以2℃/min的速度加热至60℃,加热时间为4h;
s4.冷却成型后,从微针阵列模具中取出的即为光电微针。
步骤s1中,浓度为250μg/ml的纳米颗粒的配制方法与实施例1相同。
本实施例2制备得到的光电微针圆柱形部分的直径为50μm,长度为50μm;针尖形部分的长度为100μm,顶角为30°。
实施例3光电微针的制备
一种光电微针的制备方法,具体包括以下步骤:
s1.将氧化锌和石墨相氮化碳以质量比为0.42:1混合,得到具有光电效应的纳米颗粒,配制成浓度为250μg/ml的纳米颗粒;
s2.将步骤s1得到的纳米颗粒与玻尿酸以8:5的比例混合,搅拌,得到混合物;
s3.将步骤s2得到的混合物在压强为10mpa的条件下,注入微针阵列模具中,以7℃/min的速度加热至90℃,加热时间为12h;
s4.冷却成型后,从微针阵列模具中取出的即为光电微针。
步骤s1中,浓度为250μg/ml的纳米颗粒的配制方法与实施例1相同。
本实施例3制备得到的光电微针圆柱形部分的直径为500um,长度为500μm;针尖形部分的长度为400μm,顶角为60°。
实施例4光电微针的制备
一种光电微针的制备方法,具体包括以下步骤:
s1.将氧化锌和石墨相氮化碳以质量比为0.25:1混合,得到具有光电效应的纳米颗粒,配制成浓度为250μg/ml的纳米颗粒;
s2.将步骤s1得到的纳米颗粒与玻尿酸以6:5的比例混合,搅拌,得到混合物;
s3.将步骤s2得到的混合物在压强为10mpa的条件下,注入微针阵列模具中,以6℃/min的速度加热至70℃,加热时间为10h;
s4.冷却成型后,从微针阵列模具中取出的即为光电微针。
步骤s1中,浓度为250μg/ml的纳米颗粒的配制方法与实施例1相同。
本实施例4制备得到的光电微针圆柱形部分的直径为200μm,长度为300μm;针尖形部分的长度为200μm,顶角为45°。
实施例5光电微针的制备
一种光电微针的制备方法,具体包括以下步骤:
s1.将氧化锌和石墨相氮化碳以质量比为0.35:1混合,得到具有光电效应的纳米颗粒,配制成浓度为250μg/ml的纳米颗粒;
s2.将步骤s1得到的纳米颗粒与玻尿酸以4:5的比例混合,搅拌,得到混合物;
s3.将步骤s2得到的混合物在压强为8mpa的条件下,注入微针阵列模具中,以4℃/min的速度加热至85℃,加热时间为9h;
s4.冷却成型后,从微针阵列模具中取出的即为光电微针。
步骤s1中,浓度为250μg/ml的纳米颗粒的配制方法与实施例1相同。
本实施例5制备得到的光电微针圆柱形部分的直径为400μm,长度为350μm;针尖形部分的长度为250μm,顶角为50°。
实施例6光电微针的性能测试
1、实验方法
利用浓度分别为31.25μg/ml、62.5μg/ml、125μg/ml、250μg/ml、500μg/ml和1000μg/ml的具有光电效应的纳米颗粒,按照实施例1的方法制备得到光电微针,与人皮肤鳞癌a431细胞共培养2h后,放置于氙灯下,分别照射0min、5min、10min、20min、30min,通过cck-8试剂检测人皮肤鳞癌a431细胞的活性。
2、实验结果
利用不同浓度的纳米颗粒制备得到的光电微针对人皮肤鳞癌a431细胞的毒性结果如图4中的a图所示,可以看出,当纳米颗粒的浓度为31.25μg/ml时,人皮肤鳞癌a431细胞的活性仅为45%;当纳米颗粒的浓度为250μg/ml时,人皮肤鳞癌a431细胞的活性仅为10%;当纳米颗粒的浓度为1000μg/ml时,人皮肤鳞癌a431细胞的活性仅为2%;以上结果说明:光电微针可使得人皮肤鳞癌a431细胞的活性下降90%以上。
利用浓度为250μg/ml的纳米颗粒制备得到的光电微针经氙灯照射不同时间后,对人皮肤鳞癌a431细胞的毒性结果如图4中的b图所示,可以看出,当照射时间为10min时,人皮肤鳞癌a431细胞的活性仅为50%;当照射时间为30min时,人皮肤鳞癌a431细胞的活性仅为10%;以上结果说明:光电微针可快速、高效的使得人皮肤鳞癌a431细胞的活性下降90%以上。因此,本发明制备得到的光电微针可快速、高效杀灭皮肤癌细胞。
以上具体实施方式为便于理解本发明而说明的较佳实施例,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!