靶向肿瘤细胞的给药体系及其制备方法及应用与流程
本发明涉及生物医药领域,具体地说,涉及一种靶向肿瘤细胞的给药体系及其制备方法及应用。
背景技术:
由于肿瘤的发生,人类的健康安全受到极大威胁,对肿瘤治疗的研究一直受到广泛关注。传统的肿瘤治疗方法有手术治疗,放射治疗,化学药物治疗等。其中,化学药物治疗即化疗,利用化学药物对肿瘤进行治疗,是临床上常用的重要手段之一。在化疗过程中,肿瘤细胞往往对化疗药物产生耐药性,严重影响了临床化疗的治疗效率,导致临床肿瘤化疗的失败。有调查发现大多数化疗患者治疗失败或术后复发是由耐药性导致的。此外,大多数抗肿瘤化疗的药物本身水溶性差,药物的选择性差,在抑制肿瘤生长的同时不可避免地对正常细胞产生损伤,引起一系列如脱发、食欲不振等不良反应。因此,研究克服肿瘤耐药问题以及减少抗肿瘤药物对正常细胞和组织的毒副作用对临床抗肿瘤治疗非常重要。目前克服化疗药物的耐药性和减少其毒副作用的重要策略之一就是寻找和开发新的药物载体材料并构建有效的靶向药物传递系统。
阿霉素属于蒽环类抗生素,是一种高效广谱的化疗药物,对实体瘤和液体瘤都有比较好的抑瘤作用,已经广泛用于治疗肺癌、宫颈癌、肺癌、肝癌、白血病、淋巴癌等肿瘤,是临床上常用的一线化疗药物之一。但是,阿霉素的水溶性较差,在溶液中不稳定,口服生物利用度低,药代动力学不稳定。此外,蒽环类抗肿瘤抗生素长期使用易产生耐药性(multidrugresistance,mdr)。耐药性是指经过化疗后,癌细胞对结构相似的药物产生耐药性,也可以对其他结构不具有相似性的药物产生耐药性。此外,有些癌细胞本身就有耐药性。因此,阿霉素在临床应用过程中,较易产生耐药现象,这严重影响了阿霉素的临床治疗效果。同时,阿霉素在应用中还会产生严重的毒副作用,长期使用可发生剂量依赖的不可逆的心脏毒性、肝脏损害、大脑和肾脏损伤。因此,构建阿霉素的药物传递系统,促进药物在肿瘤组织的分布,增加药效并减少毒副作用,是十分必要的。
金纳米棒由于其良好的物理化学性质一直受到广泛研究。通过对金纳米棒的表面修饰,可以使其表面的范德华力和静电作用保持相对平衡,提高其稳定性。金纳米棒独特的光学性质和光热效应,也是研究的热点。已有研究表明,金纳米棒生物相容性良好,目前有一些金的纳米药物已进入临床研究阶段,说明其对人体没有明显的毒副作用。金纳米棒是一种具有潜力的多功能药物载体材料。
金纳米棒的光学性质主要源于其表面等离子体共振的现象。金表面有很多自由电子,这些电子的集体激发即为等离子体,受到光照射时,当入射光子的频率和等离子体振动频率相当时,就会发生等离子共振的现象。等离子体共振现象可使光学性质显著增强,如在可见光及近红外波段具有强吸收,这些性质对于构建多功能的纳米药物传递系统具有重要意义。不仅可以利用其表面易于修饰的性质进行载药,结合药物的化学治疗和金纳米棒的光热效应可以提高纳米传递系统的抗肿瘤活性。
技术实现要素:
本发明的目的是提供一种靶向肿瘤细胞的给药体系及其制备方法及应用。
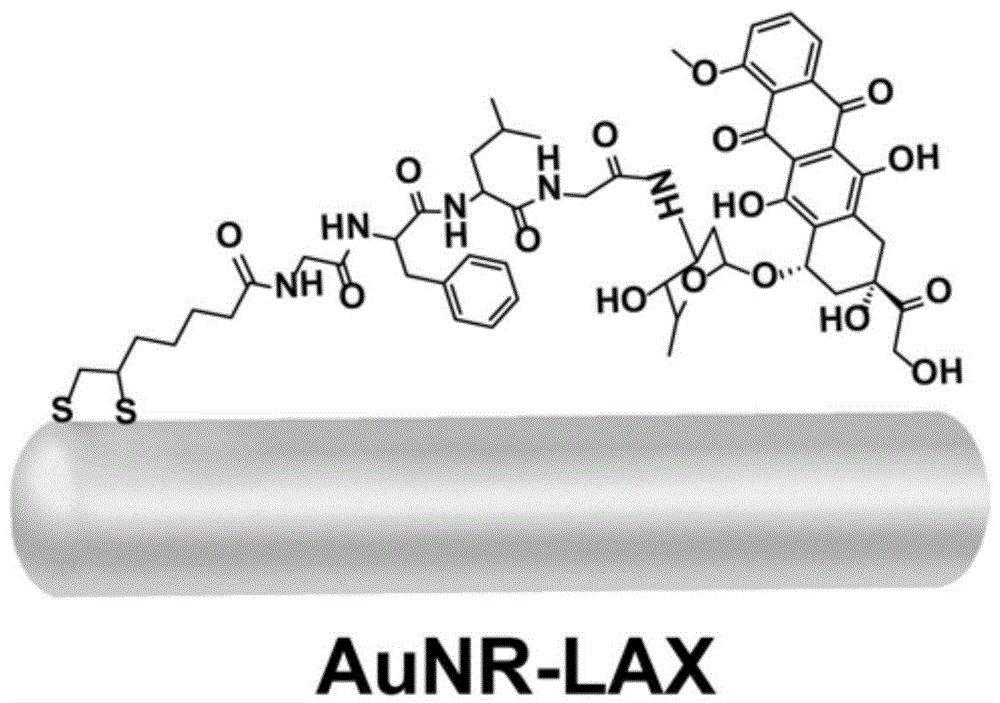
为了实现本发明目的,发明人预先设计出一种新的多肽和阿霉素的偶联化合物,命名为lax,其以gflg(甘氨酸-苯丙氨酸-亮氨酸-甘氨酸)为连接臂,一端修饰了易于与金连接的硫辛酸,一端连接有阿霉素(图1)。其中,硫辛酸通过其巯基和金的配位键键合,从而与金颗粒表面连接。硫辛酸通过酰胺键与甘氨酸的氨基连接。阿霉素通过酰胺键与甘氨酸的羧基连接。其结构中含有的gflg多肽具有肿瘤细胞内酶响应的特点。gflg是由甘氨酸,苯丙氨酸,亮氨酸,甘氨酸通过酰胺键连接形成的小分子四肽化合物。研究发现,多种肿瘤细胞的溶酶体中高表达组织蛋白酶b,而在正常细胞中组织蛋白酶b低表达。更重要的是,gflg可被组织蛋白酶b特异性地识别并水解,是一个具有良好应用前景的酶响应的小分子化合物,可作为药物与载体的连接臂。当偶联物进入肿瘤细胞,它可被肿瘤细胞溶酶体内高表达的组织蛋白酶b识别并水解,释放出其连接的药物,实现药物的可控释放,提高药物传递系统对肿瘤细胞的杀伤能力。同时,也可以减少药物在正常细胞的释放,从而减轻对正常细胞的损伤。
第一方面,本发明提供一种靶向肿瘤细胞的给药体系的制备方法,所述给药体系是由硫辛酸-甘氨酸-苯丙氨酸-亮氨酸-甘氨酸-阿霉素(简称lax)修饰的金纳米棒。制备方法包括以下步骤:
a、lax二甲基甲酰胺溶液的制备,其中所述lax为硫辛酸-甘氨酸-苯丙氨酸-亮氨酸-甘氨酸-阿霉素
按照多肽合成的常规方法合成甘氨酸-苯丙氨酸-亮氨酸-甘氨酸,然后进行酰胺化反应,使甘氨酸-苯丙氨酸-亮氨酸-甘氨酸通过多肽c端甘氨酸上的羧基与阿霉素连接,使甘氨酸-苯丙氨酸-亮氨酸-甘氨酸通过多肽n端甘氨酸上的氨基与硫辛酸连接,得到lax;将lax溶于二甲基甲酰胺中,配制成0.09mm的lax二甲基甲酰胺溶液;
b、金纳米棒的制备
b1、种子液的制备:室温搅拌下,将0.01mhaucl40.2~0.5ml和0.1mctab0.5~12.5ml混合,然后加入0.01mnabh4水溶液0.2~1.2ml,继续搅拌(2min),室温静置,即得种子液;
b2、室温搅拌下,将0.01mhaucl41.5~2.5ml和0.1mctab40ml混合,然后加入0.01m硝酸银水溶液0.2~1.0ml和0.1m抗坏血酸水溶液0.2~1.5ml,待溶液反应至无色,向其中加入b1所得种子液0.42ml,继续搅拌(2min),30℃静置过夜,10000rpm转速下离心15min收集沉淀,即得金纳米棒;
c、aunr-peg的制备
c1、peg-sh水溶液的制备,其中peg-sh的分子量为1000da:将peg-sh溶于水中,配制成4.0mm的peg-sh水溶液;
c2、将步骤b所得金纳米棒加水重新分散,配制成10nm的aunr溶液,将1mlaunr溶液与4.0mmpeg-sh水溶液25μl混合,室温搅拌反应24~36h,反应结束后,8000rpm转速下离心15min收集沉淀,即得aunr-peg;
d、靶向肿瘤细胞的给药体系的制备
将步骤c所得aunr-peg加水重新分散,配制成0.06nm的aunr-peg水溶液,向10.7mlaunr-peg水溶液中加入步骤a0.09mm的lax二甲基甲酰胺溶液350μl,室温搅拌反应24~36h,反应结束后,8000rpm转速下离心15min收集沉淀,即为靶向肿瘤细胞的给药体系,命名为aunr-lax。
在本发明的一个具体实施方式中,aunr-lax给药体系的制备如下:
1、lax二甲基甲酰胺溶液的制备
按照多肽合成的常规方法合成甘氨酸-苯丙氨酸-亮氨酸-甘氨酸,然后进行酰胺化反应,使甘氨酸-苯丙氨酸-亮氨酸-甘氨酸通过多肽c端甘氨酸上的羧基与阿霉素连接,使甘氨酸-苯丙氨酸-亮氨酸-甘氨酸通过多肽n端甘氨酸上的氨基与硫辛酸连接,得到lax;将0.34mglax溶于3.4ml二甲基甲酰胺中,配制成0.09mm的lax二甲基甲酰胺溶液。
2、金纳米棒(aunr)的制备
2.1种子液的制备:室温搅拌下,将0.01mhaucl40.25ml和0.1mctab7.5ml混合,然后加入0.01mnabh4水溶液0.6ml,继续搅拌2min,然后停止搅拌,室温静置,即得种子液。
2.2室温搅拌下,将0.01mhaucl41.7ml和0.1mctab40ml混合,然后加入0.01m硝酸银水溶液0.25ml和0.1m抗坏血酸水溶液0.27ml,待溶液反应至无色,迅速向其中加入2.1所得种子液0.42ml,继续搅拌2min,然后停止搅拌,30℃静置过夜,10000rpm转速下离心15min收集沉淀,即得金纳米棒。
3、aunr-peg的制备
3.1peg-sh水溶液的制备(peg-sh的mw=1000da)
取peg-sh10mg溶于1ml水中配制成10mmpeg-sh水溶液,然后加水稀释到4.0mm。
3.2将步骤2所得金纳米棒加水重新分散,配制10nmaunr溶液,将1mlaunr溶液与4.0mmpeg-sh水溶液25μl混合,室温搅拌反应24h,反应结束后,8000rpm转速下离心15min收集沉淀,即得aunr-peg。
用100μg/ml的aunr-peg孵育mcf-7细胞24h后,细胞存活率在85%以上,说明金纳米棒没有显著的细胞毒性。
4、靶向肿瘤细胞的给药体系aunr-lax的制备
将步骤3所得aunr-peg加水重悬,配制0.06nmaunr-peg水溶液,向10.7mlaunr-peg水溶液中加入步骤1所得0.09mmlax二甲基甲酰胺溶液350μl,室温搅拌反应24h,反应结束后,8000rmp转速下离心15min收集沉淀,即为靶向肿瘤细胞的给药体系aunr-lax
第二方面,本发明提供按照上述方法制备的靶向肿瘤细胞的给药体系。
所述给药体系为棒状结构,长宽比为3-5:1(优选3.4:1),消光吸收峰在519nm~730nm范围内。
第三方面,本发明提供所述给药体系的以下任一应用:
1)用于制备抗肿瘤药物或组合物;
2)用于制备提高耐药肿瘤细胞对化疗药物阿霉素敏感性的药物或组合物;
3)用于提高阿霉素(dox)抗肿瘤活性;
4)用于提高耐药肿瘤细胞对化疗药物阿霉素的敏感性;
5)降低化疗药物阿霉素对肿瘤患者正常细胞的损伤作用。
其中,所述肿瘤或肿瘤细胞高表达组织蛋白酶b,例如乳腺癌细胞mcf-7和mcf-7/adr。
第四方面,本发明提供一种抗肿瘤药物或组合物,其有效成分包括上述给药体系。
第五方面,本发明提供一种可提高耐药肿瘤细胞对化疗药物阿霉素敏感性的药物或组合物,其有效成分包括上述给药体系。
第六方面,本发明提供一种可降低化疗药物阿霉素对肿瘤患者正常细胞损伤作用的药物或组合物,其有效成分包括上述给药体系。
将本发明给药体系中的阿霉素替换成其它化疗药物或具有抗肿瘤活性的化合物、分子等,均属于本发明保护范围。
借由上述技术方案,本发明至少具有下列优点及有益效果:
本发明基于前期得到的前药小分子lax具有组织蛋白酶b响应的控释药物特点,将其修饰在金纳米棒表面,构建得到由肿瘤细胞内组织蛋白酶b触发的,可实现药物控制释放,且具有光热治疗功能的多纳米药物传递体系(aunr-lax,图1)。通过体外抗肿瘤活性评价表明,该药物传递体系可以提高肿瘤细胞对药物的摄取而明显提高抗肿瘤活性,特别是对于高度耐药的肿瘤细胞,可大大降低其耐药指数,使其耐药指数由>900降低到1.7。相比于阿霉素,aunr-lax对正常细胞16hbe的毒性明显减小。说明该体系具有克服肿瘤多药耐药性,并减轻化疗药物阿霉素毒副作用的潜力。
(一)体外抗肿瘤活性评价表明,aunr-lax可以对耐药细胞mcf-7/adr的耐药指数逐渐降低,明显低于阿霉素。aunr-lax的抗肿瘤活性相比于阿霉素有明显提高。
(二)体外抗肿瘤活性评价表明,与阿霉素相比,aunr-lax对正常细胞的毒性明显减弱。
附图说明
图1为本发明靶向肿瘤细胞的给药体系aunr-lax的结构示意图。其中,实心棒代表金纳米棒,其上连接的分子为lax。
图2为本发明实施例2中aunr-lax耐药指数的测定以及对正常细胞活力的影响。
图3为本发明实施例2中aunr-lax对培养细胞的光热实验结果。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
实施例1靶向肿瘤细胞的给药体系aunr-lax的制备
本实施例中,靶向肿瘤细胞的给药体系aunr-lax的制备包括以下步骤:
1、lax二甲基甲酰胺溶液的制备
其中,所述lax为硫辛酸-甘氨酸-苯丙氨酸-亮氨酸-甘氨酸-阿霉素。
按照多肽合成的常规方法合成甘氨酸-苯丙氨酸-亮氨酸-甘氨酸,然后进行酰胺化反应,使甘氨酸-苯丙氨酸-亮氨酸-甘氨酸通过多肽c端甘氨酸上的羧基与阿霉素连接,使甘氨酸-苯丙氨酸-亮氨酸-甘氨酸通过多肽n端甘氨酸上的氨基与硫辛酸连接,得到lax;将0.34mglax溶于3.4ml二甲基甲酰胺中,配制成0.09mm的lax二甲基甲酰胺溶液。
2、金纳米棒(aunr)的制备
2.1种子液的制备:室温搅拌下,将0.01mhaucl40.25ml和0.1mctab7.5ml混合,然后加入0.01mnabh4水溶液0.6ml,继续搅拌2min,然后停止搅拌,室温静置,即得种子液。
2.2室温搅拌下,将0.01mhaucl41.7ml和0.1mctab40ml混合,然后加入0.01m硝酸银水溶液0.25ml和0.1m抗坏血酸水溶液0.27ml,待溶液反应至无色,迅速向其中加入2.1所得种子液0.42ml,继续搅拌2min,然后停止搅拌,30℃静置过夜,10000rpm转速下离心15min收集沉淀,即得金纳米棒。
3、aunr-peg的制备
3.1peg-sh水溶液的制备(peg-sh的mw=1000da)
取peg-sh10mg溶于1ml水中配制成10mmpeg-sh水溶液,然后加水稀释到4.0mm。
3.2将步骤2所得金纳米棒加水重新分散,配制10nmaunr溶液,将1mlaunr溶液与4.0mmpeg-sh水溶液25μl混合,室温搅拌反应24h,反应结束后,8000rpm转速下离心15min收集沉淀,即得aunr-peg。
用100μg/ml的aunr-peg孵育mcf-7细胞24h后,细胞存活率在85%以上,说明金纳米棒没有显著的细胞毒性。
4、靶向肿瘤细胞的给药体系aunr-lax的制备
将步骤3所得aunr-peg加水重悬,配制0.06nmaunr-peg水溶液,向10.7mlaunr-peg水溶液中加入步骤1所得0.09mmlax二甲基甲酰胺溶液350μl,室温搅拌反应24h,反应结束后,8000rmp转速下离心15min收集沉淀,即为靶向肿瘤细胞的给药体系aunr-lax(图1)。
该方法首先通过两步合成法得到金纳米棒溶液,在其表面修饰peg作为稳定剂,进一步修饰lax分子得到aunr-lax这一纳米药物传递体系。aunr-lax呈棒状结构。长径为48.8nm,短径为14.4nm,长、短径比为3.4左右。消光吸收峰在519nm~730nm范围内,zeta电势为-15.8mv。
实施例2靶向肿瘤细胞的给药体系aunr-lax耐药指数的测定以及对正常细胞活力的影响
选择mcf-7细胞及mcf-7/adr细胞作为实验模型,采用mtt法对给药aunr-lax(实施例1制备)孵育24h、48h、72h分别进行耐药指数的测定。另外,选择人支气管上皮细胞16hbe作为正常细胞组,比较阿霉素和aunr-lax孵育细胞24h、48h、72h后的细胞活力。
样品配制:将aunr-lax重新分散于水溶液,以培养基稀释。
细胞株:mcf-7细胞、mcf-7/adr耐药细胞及16hbe细胞由首都医科大学化学生物学与药学院孵育传代。
实验仪器:全波长酶标仪enspire2300multilabelplatereader(perkinelmer),96孔板,viahova-i-dc-808激光器。
实验操作:细胞消化离心并计数,种于96孔板,每孔加入100μl5×104个/ml细胞,放入37℃,5%co2孵箱静置培养。待细胞贴壁后,吸弃培养液,进行给药。给药孵育24h、48h、72h后,吸弃给药培养液,pbs洗两次,加入100μl新鲜培养液,加入mtt溶液(5mg/ml)20μl,放入37℃,5%co2孵箱静置培养4h。4h后,吸弃96孔板内液体,每孔加入100μl二甲基亚砜,在振荡器摇晃15min。用酶标仪检测570nm处的od值(光密度)。
实验结果:计算细胞抑制率及存活率,用origin软件拟合得到ic50值。抑制率、ic50值和耐药指数见表1和图2。
耐药指数dri=ic50(mcf-7/adr)/ic50(mcf-7)
表1dox和au-lax的抗肿瘤活性数据
由表1和图2可见,与阿霉素相比,aunr-lax对敏感细胞mcf-7和耐药细胞mcf-7/adr都有比较好的抗增殖作用,特别是对耐药细胞mcf-7/adr有明显的克服耐药性的作用,使耐药指数降到1.7(72h)。
光热实验:细胞培养如上所述。光照采用808nm激光器,功率2wcm-2,照射5min,然后用酶标仪检测570nm处的od值(光密度)。结果如图3所示。
由图3可见,三株细胞mcf-7,mcf-7/adr和16hbe在808nm激光照射下都保持了较好的生长状态。给药au-lax,各株细胞也都保持了50%以上的细胞增殖。联合给药au-lax和激光照射5min后,mcf-7和mcf-7/adr细胞的增殖明显降低,细胞活力都在10%以下。对于正常细胞16hbe,在给药au-lax和联合光热治疗下,都保持了80%的细胞活力。结果表明,lax和金棒连接后,结合金棒的光热作用,可以大大提高抗肿瘤活性,同时大大降低了阿霉素对正常细胞的毒性。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!