具备氧化应激自放大功能的纳米复合物、制备方法及应用与流程
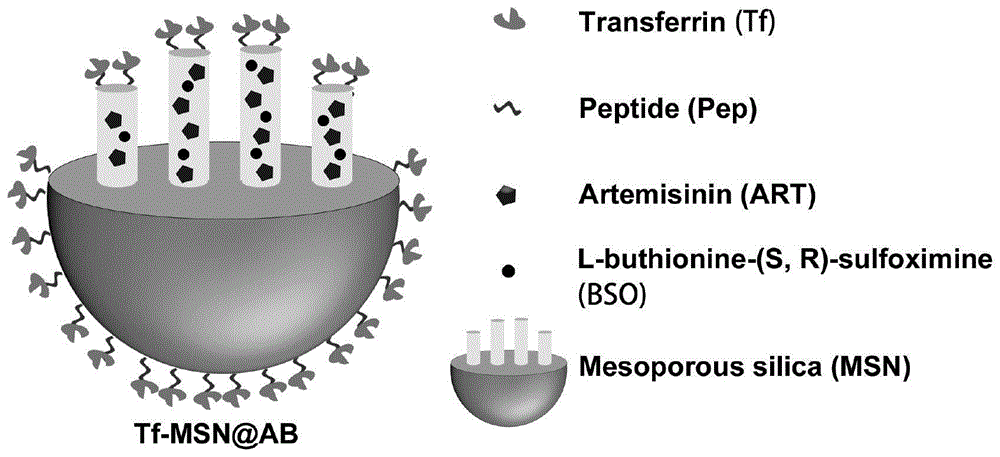
本发明涉及纳米复合材料及制备方法和应用,特别涉及具备氧化应激自放大功能的纳米复合物、制备方法及应用。
背景技术:
化疗作为肿瘤治疗的主要手段之一,在临床抗肿瘤过程中起着重要的作用。相比于手术治疗和放疗的局限性(只能针对治疗部位的肿瘤),化疗对治疗全身肿瘤或中晚期转移的肿瘤更具有优势。因而寻找、研发具有较高抗肿瘤活性的化疗药物是目前肿瘤治疗研究热点。
青蒿素来源于菊科植物黄花蒿Artemisia annua L,属倍半萜内酯类化合物,是临床上用于治疗疟疾的一线药物,在疟疾的治疗中发挥着重要的作用。青蒿素发挥抗疟活性主要是由于其结构中的过氧桥在Fe2+的催化下被破坏,致使青蒿素分子内电子重组形成自由基,进而导致疟原虫蛋白的烷基化,最终诱导疟原虫死亡。近年来,有文献报道青蒿素在Fe2+的催化下产生的活性氧(ROS)具有一定的抗肿瘤活性,对乳腺癌、卵巢癌、前列腺癌等具有一定的抑制作用。尽管高水平的ROS在在诱导肿瘤细胞凋亡过程中起着非常重要的作用,但是青蒿素在临床抗肿瘤中的应用仍受到诸多限制,主要有以下四方面的原因:1.青蒿素的肿瘤抑制效率远远低于传统的化疗药物,血浆半衰期短,并且需要高剂量和高频率的给药;2.青蒿素自身的水溶性差、靶向性弱,致使其在肿瘤细胞内的有效浓度较低;3.青蒿素的抗肿瘤活性依赖于肿瘤细胞内Fe2+的含量,尽管肿瘤细胞的Fe2+含量比正常细胞高,但是由于肿瘤细胞自身的生长与增殖需要较多的Fe2+,从而导致细胞内没有足够的Fe2+来催化青蒿素产生ROS。4.肿瘤细胞自身具有较高水平的谷胱甘肽(GSH),而高水平的GSH具有ROS清除能力,在一定范围内能调节细胞内ROS水平,使胞内ROS水平维持在无毒范围。GSH在肿瘤细胞内含量为1-15mM,这样的高浓度范围大大降低了青蒿素杀死肿瘤细胞的效率。因此,亟需寻找一种既能够有效增强青蒿素的抗肿瘤活性,又能降低其毒副作用及耐药性的方法。
技术实现要素:
发明目的:本发明目的是提供一种具备氧化应激自放大功能的纳米复合物。
本发明的另一目的是提供所述具备氧化应激自放大功能的纳米复合物的制备方法。
本发明的最后一个目的是所述具备氧化应激自放大功能的纳米复合物在制备抗肿瘤药物中的应用。
技术方案:本发明提供一种具备氧化应激自放大功能的纳米复合物,以介孔硅为载体,其孔道内部装载青蒿素和谷胱甘肽清除剂,其表面偶联组织蛋白酶B响应的功能性多肽,组织蛋白酶B响应的功能性多肽末端偶联转铁蛋白。
所述转铁蛋白具有三方面的功能:1.特异性识别肿瘤细胞。由于多种恶性肿瘤细胞膜表面高表达转铁蛋白受体,因此,所述转铁蛋白可作为靶向识别基团,实现对细胞膜表面高表达转铁蛋白受体的肿瘤细胞的主动靶向;2.作为Fe2+的供体。所述转铁蛋白能与2分子Fe3+结合形成聚集体,该聚集体可与某些肿瘤细胞膜表面高表达的转铁蛋白受体结合,并通过受体介导被内吞进入细胞的溶酶体中,在溶酶体低pH环境的刺激下,聚集体中的Fe3+可被快速还原成Fe2+,且还原后的Fe2+可转铁蛋白解离,进而实现Fe2+的释放;3.封闭介孔硅孔道。由于转铁蛋白分子量较大,能够作为门将介孔硅的孔道封闭,保证药物递送的安全。
进一步地,所述GSH清除剂为丁硫氨酸-亚砜亚胺。所述组织蛋白酶B响应的功能性多肽的氨基氨酸序列为Azido-Asp-Glu-Gly-Phe-Leu-Gly-Glu-Asp。所述青蒿素和谷胱甘肽清除剂通过物理吸附装载孔道内部。所述组织蛋白酶B响应的功能性多肽通过点击化学反应偶联在介孔硅表面上。所述组织蛋白酶B响应的功能性多肽末端通过酰胺键偶联转铁蛋白。所述介孔硅先进行氨基化处理,再进行炔基化修饰。
所述纳米复合物通过转铁蛋白受体介导的内吞途径进入细胞溶酶体后,溶酶体的酸性环境使得转铁蛋白释放出大量的Fe2+,同时组织蛋白酶B通过剪切功能性多肽,重新打开介孔硅的孔道,使装载在孔道中的青蒿素和丁硫氨酸-亚砜亚胺被释放,释放的青蒿素在Fe2+的催化下生成ROS,生成的ROS使得溶酶体破裂,溶酶体中的药物被释放到细胞质中,细胞质中的Fe2+进一步催化未被激活的青蒿素,从而升高细胞内的氧化态水平。同时,释放到细胞质中的丁硫氨酸-亚砜亚胺能降低细胞内的GSH水平,从而降低细胞内的还原态水平。因此,纳米复合物通过升高细胞氧化态水平并降低还原态水平来实现氧化应激自放大。
所述具备氧化应激自放大功能的纳米复合物的制备方法,包括如下步骤:
(1)将组织蛋白酶B响应的功能性多肽与转铁蛋白通过酰胺键偶联,得到多肽-转铁蛋白复合物;
(2)将介孔硅表面进行氨基化处理,得到氨基修饰的介孔硅;
(3)将上述步骤(2)得到的氨基修饰的介孔硅进行炔基化处理,得到炔基化修饰的介孔硅;
(4)将药物青蒿素和丁硫氨酸-亚砜亚胺装载于步骤(3)得到的炔基化修饰的介孔硅的孔道中;
(5)将步骤(4)得到的复合物与步骤(1)得到的复合物通过点击化学反应偶联,即可。
进一步地,所述步骤(2)氨基化处理方法为:将介孔硅粉末溶于甲醇中,加入N-[3-(三甲氧基硅基)丙基]乙二胺,室温下搅拌反应,即可;步骤(3)炔基化处理的方法为:将氨基化的介孔硅溶于甲醇中,加入炔丙基溴和三乙胺,室温下搅拌反应即可;步骤(4)装载方法为:将炔基化修饰的介孔硅、青蒿素及丁硫氨酸-亚砜亚胺溶于甲醇溶液中,室温下避光搅拌反应,即可;步骤(5)向装载有青蒿素及丁硫氨酸-亚砜亚胺的炔基化修饰的介孔硅的甲醇溶液中加入多肽-转铁蛋白复合物、五水硫酸铜和抗坏血酸钠,混合溶液在氮气保护下搅拌反应,即可。
所述具备氧化应激自放大功能的纳米复合物在制备抗肿瘤药物中的应用。
有益效果:本发明的具备氧化应激自放大功能的纳米复合物水溶性好;表面修饰有转铁蛋白,能特异性的靶向细胞膜表面高表达转铁蛋白受体的肿瘤细胞,具有高选择性;能响应组织蛋白酶B释放药物;具有Fe2+自供应能力,为催化青蒿素产生ROS提供物质基础;能同时降低肿瘤细胞的还原态水平,升高氧化态水平,从而实现肿瘤细胞内氧化还原自放大,最终诱导肿瘤细胞凋亡。
附图说明
图1是本发明的纳米复合物Tf-MSN@AB的结构示意图
图2是本发明的纳米复合物Tf-MSN@AB的工作原理图;
图3是本发明的纳米复合物Tf-MSN@AB的合成路线图,其中,a为合成路线的第一步,b为合成路线的第二步;
图4是实施例1制备纳米复合物Tf-MSN@AB的红外光谱图;
图5是MSN及实施例1制备纳米复合物Tf-MSN@AB的氮气吸附-解吸附等温曲线图;
图6是MSN及实施例1制备纳米复合物Tf-MSN@AB的BJH孔径分布;
图7是纳米复合物Tf-MSN@AB在不同的pH值的条件下,响应组织蛋白酶B的青蒿素释放曲线;
图8是纳米复合物Tf-MSN@AB在不同的pH值的条件下,响应组织蛋白酶B的丁硫氨酸-亚砜亚胺释放曲线;
图9是不同对照组诱导人乳腺癌细胞(MCF-7)产生活性氧的情况,从左至右依次为空白对照组,Tf-MSN@AB组,MCF-7细胞膜表面转铁蛋白受体阻断组,游离药物(青蒿素+丁硫氨酸-亚砜亚胺)简单组合组及载体组。
具体实施方式
实施例1:结合图3,合成Tf-MSN@AB,步骤如下:
1.合成多肽-转铁蛋白复合物(Pep-Tf)。
称量2mg Pep并将其溶于4mL的N,N-二甲基甲酰胺(DMF)溶液中。向Pep溶液中加入5mM N-羟基琥珀酰亚胺和1mM的N-乙基-N′-(3-(二甲基氨基丙基)碳二亚胺,并超声10min以活化羧基。活化完成后,向上述溶液加入4mg Tf并剧烈搅拌,使其在室温下避光反应24h。反应结束后,离心(8500rpm,10min),弃去有机溶液,并用DMF润洗三次,最后真空干燥得Pep-Tf。
2.介孔硅表面修饰氨基基团(MSN-NH2)。
将300mg的介孔硅粉末溶于30mL的甲醇中,超声助溶。溶解后向该溶液加入2mLN-[3-(三甲氧基硅基)丙基]乙二胺,室温下搅拌反应24h。反应结束后,离心(8500rpm,10min),弃去有机溶液,并用甲醇润洗三次,最后真空干燥得MSN-NH2。
3.合成炔基化的介孔硅纳米粒(MSN-alkyne)。
称量150mg MSN-NH2至30mL的甲醇中,超声分散。然后向溶液中加入1.5mL炔丙基溴和3mL三乙胺,使其在室温下搅拌反应24h。反应所得的溶液离心(8500rpm,10min),弃去有机溶液,并用甲醇润洗三次,最后真空干燥得MSN-alkyne。
4.合成Tf-MSN@AB。
分别称取4mg MSN-alkyne,0.7mg ART和0.3mg BSO,并将所称得的上述三种固体粉末溶于5mL的甲醇中得混合溶液。将该混合溶液在室温下避光搅拌反应24h,ART和BSO则会被包埋在介孔硅中。之后向混合溶液中加入4mg Pep-Tf,0.5mM五水硫酸铜和1mM抗坏血酸钠。混合溶液在氮气保护下搅拌反应3d。最终,MSN-alkyne与Azido-Pep-Tf在催化剂的作用下发生点击化学反应,使得Pep-Tf共价结合在介孔硅上,将介孔硅的孔径封住,形成最终产物Tf-MSN@AB。反应结束后,离心(8500rpm,10min),并用甲醇润洗三次,沉淀经真空干燥得Tf-MSN@AB。
步骤1-4的合成路线图如图3所示。
实施例2:Tf-MSN@AB的表征。
利用傅里叶红外光谱仪对制备得到的Tf-MSN@AB进行表征,结果如图4所示,图中MSN表示购买的介孔硅纳米粒;MSN-NH2表示步骤2制得的氨基修饰的介孔硅纳米粒;MSN-alkyne表示步骤3制得的炔基化修饰的介孔硅;Tf-MSN@AB表示步骤4最终制得的纳米复合物,由图中可以看出:
当介孔硅表面未经修饰时,MSN的红外光谱中在3000-2800cm-1处出现-C-H-的吸收峰,而该-C-H-吸收峰在MSN经氨基化修饰(MSN-NH2)后显著降低,当加入炔丙基溴和三乙胺反应后得到的炔基化介孔硅(MSN-alkyne)后,MSN-alkyne在2123cm-1处出现了强吸收峰,该吸收峰属于炔基的红外特征吸收峰,表明介孔硅表面炔基化修饰成功。而当通过点击化学反应得到终产物Tf-MSN@AB后,Tf-MSN@AB的红外光谱上观察到2123cm-1信号峰消失,这证明Pep-Tf通过点击化学反应成功的共价连接在介孔硅表面。
利用氮气吸附-解吸附法测定MSN在修饰前后的比表面积、空容积和孔径大小分布情况,由图5和图6可以看出:
MSN的吸附解吸附等温曲线属于国际纯粹与应用化学联合会(IUPAC)分类的IV型,在相对压力0.2-0.8的区间内吸附解吸附曲线出现突跃(图5),说明其具有典型介孔材料。MSN的介孔毛细管冷凝和挥发段滞后环为H1型,表明介孔为开孔状。当装载药物(ART和BSO)并共价连接Pep-Tf后,Tf-MSN@AB的吸附解吸附等温曲线与MSN完全不同,曲线开始变得相对平坦。在吸附分支利用BJH模型计算得到的MSN孔径分布很窄,平均孔径为2.61nm(图6),但是在Tf-MSN@AB观察到介孔硅孔径迅速减少。这主要时因为Pep-Tf修饰在介孔硅表面,使得介孔硅的孔道被堵。
表1 MSN及Tf-MSN@AB的比表面积和平均孔径
表1是MSN和Tf-MSN@AB的比表面积和孔径数据。结果表明,和MSN相比,Tf-MSN@AB的比表面积和孔径明显降低:比表面积由703.30m2g-1下降至117.83m2g-1。纳米药物的比表面积和孔径的下降再次证明药物分子已经装在介孔硅中,且介孔硅的孔道能被转铁蛋白封闭。
实施例3:青蒿素及丁硫氨酸-亚砜亚胺的体外释放实验。
本实施例是为了探究实施例1制得的Tf-MSN@AB在不同的pH环境下对组织蛋白酶B的响应的体外药物释放行为,具体方法为:
Tf-MSN@AB中ART和BSO在体外的释放曲线通过透析法测得。将Tf-MSN@AB分别溶于含10%胎牛血清(FBS)的不同pH的柠檬酸盐缓冲液中(pH 7.4和pH 5.0)。不同pH值组又分为含组织蛋白酶B和不含组织蛋白酶B两组。将配置好的溶液至于透析袋(Mn=30kDa,Millipore)内,再将透析袋进入到含有相同pH值的柠檬酸盐缓冲液中,37℃下以100rpm的转速搅拌缓冲液。在预先设定好的时间点取样,并用相同体积的释放介质替换。
青蒿素的药物释放量测定:
取500μL的样品经真空干燥并将其溶于200μL 95%乙醇,之后加入800μL 0.2%氢氧化钠溶液到上述乙醇溶液中。将上述溶液至于50℃水浴中反应30min。完成反应后离心(8000g,5min),取上清液在292nm处测定紫外吸收,并依据青蒿素的标准曲线计算其浓度。重复三次实验取平均值。
丁硫氨酸-亚砜亚胺的药物释放量测定:
取500μL的样品经真空干燥并将其溶于400μL的双蒸水中,向其加入100μL邻苯二甲醛,室温下反应3min,使丁硫氨酸-亚砜亚胺充分衍生化。在333nm处测定上述反应后的溶液的紫外吸收,依据丁硫氨酸-亚砜亚胺的标准曲线计算溶液中丁硫氨酸-亚砜亚胺的浓度。重复三次实验取平均值。
结果如图7所示,当不存在组织蛋白酶B时,无论时pH 7.4还是pH 5.0的缓冲体系中仅观察到少于10%的青蒿素在24h内被释放;当缓冲体系中存在组织蛋白酶B时,在24h内分别有60%(pH 7.4)和85%(pH 5.0)左右的青蒿素被释放。由于pH 5.0是组织蛋白B酶活最高的pH值,因此Tf-MSN@AB在pH 5.0(含组织蛋白酶B)缓冲体系比在pH 7.4(含组织蛋白酶B)缓冲体系中释放的青蒿素更多。丁硫氨酸-亚砜亚胺的释放行为青蒿素类似,如图8所示,在无组织蛋白酶B的不同pH缓冲体系中,仅有20%左右的丁硫氨酸-亚砜亚胺在24h内被释放;而当存在组织蛋白酶B时,在pH 7.4和pH5.0的缓冲体系中分别由65%和95%的丁硫氨酸-亚砜亚胺在24h内被释放。
实施例4:实施例1制得的Tf-MSN@AB诱导人乳腺癌细胞(MCF-7)产生活性氧的情况考察,具体方法为:
通过DCFH-DA荧光探针测定细胞内ROS生成量。具体操作如下:将MCF-7细胞按1×105/每孔的密度接种至96孔板,在37℃培养1d后,弃去培养基并用PBS润洗。加入含有不同药物的培养基,并在每孔加入10μM DCFH-DA,在37℃下孵育4h。弃去培养基并用PBS润洗。分别测定每孔的荧光值(激发/发射波长:485/530nm)。其中实验组为Tf-MSN@AB,对照组包括:空白对照组,MCF-7细胞膜表面转铁蛋白受体阻断组,游离药物(青蒿素+丁硫氨酸-亚砜亚胺)简单组合组及载体组。
实验结果如图9所示,空白对照组和转铁蛋白修饰的介孔硅组(Tf-MSN)测得的DCFH-DA荧光强度均较弱,且二者无明显的差别,说明Tf-MSN载体本身不能产生ROS,提示Tf-MSN具有无毒性或毒性较低的潜力。单纯的游离药物联用组(ART+BSO)中测得的DCFH-DA的荧光强度比空白对照组有所增高,但是远远低于Tf-MSN@AB组细胞内测得的DCFH-DA的荧光强度,Tf-MSN@AB组中DCFH-DA的荧光是空白对照组的5.7倍左右。Tfblock组测得的DCFH-DA的荧光强度虽然比空白对照组有所增加,但仍远远低于Tf-MSN@AB,说明Tf-MSN@AB可通过细胞膜表面转铁蛋白受体介导进入细胞内,并在Fe2+催化下产生ROS,表明设计的Tf-MSN@AB具有主动靶向性。
- 还没有人留言评论。精彩留言会获得点赞!