一种用于皮肤伤口治疗的pH响应型光子晶体凝胶基的制备方法与流程
本发明涉及抗菌纳米材料领域,尤其是涉及一种用于皮肤伤口治疗的ph响应型光子晶体凝胶基的制备方法。
背景技术:
水凝胶是指以水为分散介质的凝胶,具有交联结构的水溶性高分子中引入一部分疏水基团而形成能遇水膨胀的交联聚合物,是一种高分子网络体系,性质柔软,能保持一定的形状,能吸收大量的水。凡是水溶性或亲水性的高分子,通过一定的化学交联或物理交联,都可以形成水凝胶。水凝胶具有良好的物理化学性质和生物相容性,使其在药剂学领域有许多应用。
例如,一种在中国专利文献上公开的“用于制备医用创伤敷料的抗菌促愈凝胶材料及其制备方法”,其公告号cn101791425b,包括天然凝胶剂、壳聚糖、生物活性物、可溶性银盐和有机酸,加入水,水的含量为天然凝胶剂和生物活性物重量和的5~20倍,然后通过交联固化,再经后处理得到各种形态的抗菌促愈凝胶材料;所述的抗菌促愈凝胶材料按干基计量,各组分的配比以重量计为:天然凝胶剂57~90.9%;生物活性物5~25%;壳聚糖2~8%;可溶性银盐0.1~2%;有机酸2%~8%。该抗菌促愈凝胶材料生物相容性好,抗菌性好,促使组织再生能力强,且形态多样,制备成医用创伤敷料简单、方便。
但是负载纳米银的水凝胶要想有良好的抗菌效果,所需的纳米银的负载量大或使用时所需的剂量高,成本较高;且现有技术中的抗菌水凝胶用于皮肤伤口治疗时,无法直接观察伤口的感染程度,不便于观察伤口的愈合和变化情况。
技术实现要素:
本发明是为了克服现有技术中负载纳米银的具有抗菌效果的水凝胶要想有良好的抗菌效果,所需的纳米银的负载量大或使用时所需的剂量高,成本较高;且现有技术中具有抗菌效果的水凝胶用于皮肤伤口治疗时,无法直接观察伤口的感染程度,不便于观察伤口的愈合和变化情况的问题,提供一种用于皮肤伤口治疗的ph响应型光子晶体凝胶基的制备方法,制备出cs/paa/纳米cu2wse4复合水凝胶并负载ph响应型光子晶体基,得到的ph响应型光子晶体凝胶基不仅具有良好的生物安全性,而且在较低剂量下即可有效治疗伤口的感染并具有促进伤口愈合的能力;并且因为伤口感染处弱酸性,ph响应的光子晶体基能够在在布拉格衍射下进行颜色反应,人眼能进行祼视观察。
为了实现上述目的,本发明采用以下技术方案:
一种用于皮肤伤口治疗的ph响应型光子晶体凝胶基的制备方法,包括如下步骤:
(1)将壳聚糖、丙烯酸、n,n′-亚甲基双丙烯酰胺及cu2wse4溶于醋酸溶液中,充分溶解后通氮气除氧;
(2)加入第一光引发剂,密封并置于紫外光照射下反应;
(3)用去离子水反复浸泡所得产物,然后将所得产物切割并进行冷冻干燥后,得到cs/paa/纳米cu2wse4复合水凝胶;
(4)将偶氮二异丁腈、苯乙烯单体和聚乙烯基吡咯烷酮溶解在乙醇和水的混合溶剂中,搅拌均匀并通氮气除氧后,密封加热反应,得到单分散ps微球乳液;
(5)利用垂直沉积法将用无水乙醇稀释后的单分散ps微球乳液自组装在玻璃衬底上,得到胶体晶体模板;
(6)将甲基丙烯酸羟乙酯和丙烯酸单体与甲醇混匀,加入第二光引发剂,通氮气除氧后得到前体溶液;
(7)将步骤(5)中制得的胶体晶体模板用有机玻璃夹紧,浸入上述前体溶液中,待前体溶液完全渗透进模板中后,在紫外光照射下反应;
(8)反应结束后将产物浸入二甲苯溶液中,去除模板后抽滤得到膜状光子晶体;
(9)将上述膜状光子晶体切割后,超声分散在步骤(3)中制得的cs/paa/纳米cu2wse4复合水凝胶上,得到ph响应型光子晶体凝胶基。
本发明步骤(1)-(3)中先制得了cs/paa/纳米cu2wse4复合水凝胶。壳聚糖是自然界来源丰富的碱性多糖,具有无毒、可降解和良好的生物相容性等优点,是理想的药用材料,但壳聚糖在酸性介质中不稳定,易溶解而流失,从而限制了其广泛应用。壳聚糖大分子链上具有两种可用于接枝反应的活性基团:氨基、c-3和c-6位上的羟基,因此,本发明通过紫外光辐射光引发剂分解产生自由基引发接枝聚合反应,将聚丙烯酸接枝在壳聚糖上,制得了高稳定性且无毒副作用的cs/paa双网络水凝胶,并将cu2wse4分散在水凝胶中,得到cs/paa/纳米cu2wse4复合水凝胶。
无论在遮光或光存在的条件下,cu2wse4纳米材料对革兰氏阳性菌(金黄色葡萄球菌)、革兰氏阴性菌(大肠杆菌)和耐药菌(耐甲氧西林的金黄色葡萄球菌,mrsa)等均展示出优异的抗菌性能,在较低浓度(0.1~5μg/ml)下即可实现99.999%以上的杀菌率。cu2wse4纳米抗菌凝胶不仅具有良好的生物安全性,而且在较低剂量下(0.01~1mg/kg)即可有效治疗伤口的感染并具有促进伤口愈合的能力。因此本发明制得的cs/paa/纳米cu2wse4复合水凝胶具有制作工艺简单、无毒副作用、给药方便、低剂量、高疗效、成本低廉的特性。
步骤(4)-(8)中又制得了反蛋白石膜状光子晶体,通过引入丙烯酸单体,使光子晶体中含有弱酸型聚电解质水凝胶,从而具有ph响应。改变光子晶体环境的ph值,光子晶体会发生溶胀或者去溶胀的可逆变化,这种变化改变了光子晶体的晶格参数,由布拉格方程可知,光子晶体的衍射峰位或结构色将随晶格参数的变化而变化,从而发生红移或蓝移。
因此通过步骤(9)将光子晶体分散在cs/paa/纳米cu2wse4复合水凝胶表面,得到的ph响应型光子晶体凝胶基用于皮肤伤口治疗时,伤口感染处一般呈弱酸性,ph响应型光子晶体凝胶基能够在布拉格衍射下进行颜色反应,在不同的ph下显示不同的颜色,因此人眼能进行祼视观察,便于观察和了解伤口的感染和愈合情况。
作为优选,步骤(1)中所述壳聚糖、丙烯酸、n,n′-亚甲基双丙烯酰胺及cu2wse4的质量比为(5-25):(8-10):(10-15):(0.5-5),所述醋酸溶液的质量浓度为1-2%。采用此比例,制得的复合水凝胶活性位点多,孔隙率适中,稳定性好,cu2wse4负载量适中,杀菌性能良好。
作为优选,步骤(2)中所述的第一光引发剂为2,2-偶氮双(2-甲基丙脒)二盐酸盐,加入的第一光引发剂与壳聚糖的质量比为1:(30-50),紫外照射时辐照强度400-500mw/cm2,反应时间20-40min。在此条件下,以n,n′-亚甲基双丙烯酰胺为交联剂,在光引发剂的作用下,可以顺利通过自由基聚合接枝反应,将聚丙烯酸接枝在壳聚糖上,并形成双网络水凝胶。
作为优选,步骤(3)中用去离子水浸泡时,每隔4-5h换一次水,重复进行10-20次。以充分去除未反应的小分子物质。
作为优选,步骤(4)中偶氮二异丁腈、苯乙烯单体、聚乙烯基吡咯烷酮、乙醇及水的质量比为(0.15-0.2):(4-6):1:(50-60):(15-25),加热反应温度为65-75℃。在此比例和反应条件下,可以成功制备出单分散、小粒径、适合制备胶体晶体模板的ps微球。
作为优选,步骤(5)中垂直沉积法的步骤为:将玻璃衬底置于h2so4/h2o2(1:3v/v)的水溶液中浸泡12-24h,取出用蒸馏水反复清洗后,在氮气保护下干燥;将体积比为1:(10-12)的单分散ps微球乳液和乙醇混合均匀后,将上述干燥后的玻璃衬底竖直插入其中,室温下进行自组装,3-5d后得到胶体晶体模板。将玻璃衬底先在h2so4/h2o2的水溶液中浸泡,可以使玻璃衬底表面洁净,避免杂质对反应产生影响。将玻璃衬底插入乙醇稀释的ps微球乳液中,单分散微球可以在毛细力作用下在竖直玻璃衬底上自组装,得到膜状的胶体晶体模板。
作为优选,步骤(6)中所述的第二光引发剂为偶氮二异庚腈,所述甲基丙烯酸羟乙酯、丙烯酸单体、甲醇与第二光引发剂的质量比为:(1-1.2):(3-3.5):(6-8):(0.1-0.2)。
作为优选,步骤(7)中紫外照射时辐照强度400-500mw/cm2,反应时间30-60min。
采用按适当比例配置的前体溶液,并在适当的反应条件和反应时间下,丙烯酸单体可以顺利发生聚合、交联,在去除模板后可以得到具有反蛋白石晶体结构的聚合物膜材料,最终制得的光子晶体ph响应性好。
作为优选,步骤(8)中在二甲苯溶液中浸泡2-3d。以充分去除模板,得到膜状的光子晶体。
作为优选,步骤(9)中将膜状光子晶体切割成400-8000平方微米大小,超声分散时超声功率150-450w,超声时间5-15min,间隔超声,每超声5s休息30s,超声温度25-40℃。在此条件下可以将光子晶体充分均匀地分散在cs/paa/纳米cu2wse4复合水凝胶表面,得到杀菌性能良好,且人眼能进行祼视观察的ph响应型光子晶体凝胶基。
因此,本发明具有如下有益效果:先制得了cs/paa/纳米cu2wse4复合水凝胶,所述复合水凝胶具有制作工艺简单、无毒副作用、给药方便、低剂量、高疗效、成本低廉的特性;然后将具有ph响应性的反蛋白石光子晶体分散在复合水凝胶表面,得到的ph响应型光子晶体凝胶基能在酸性条件下进行颜色反应,在不同的ph下显示不同的颜色,人眼能进行祼视观察;将ph响应型光子晶体凝胶基用于皮肤伤口的治疗时,杀菌和治疗效果好,并且便于观察和了解伤口的感染和愈合情况。
附图说明
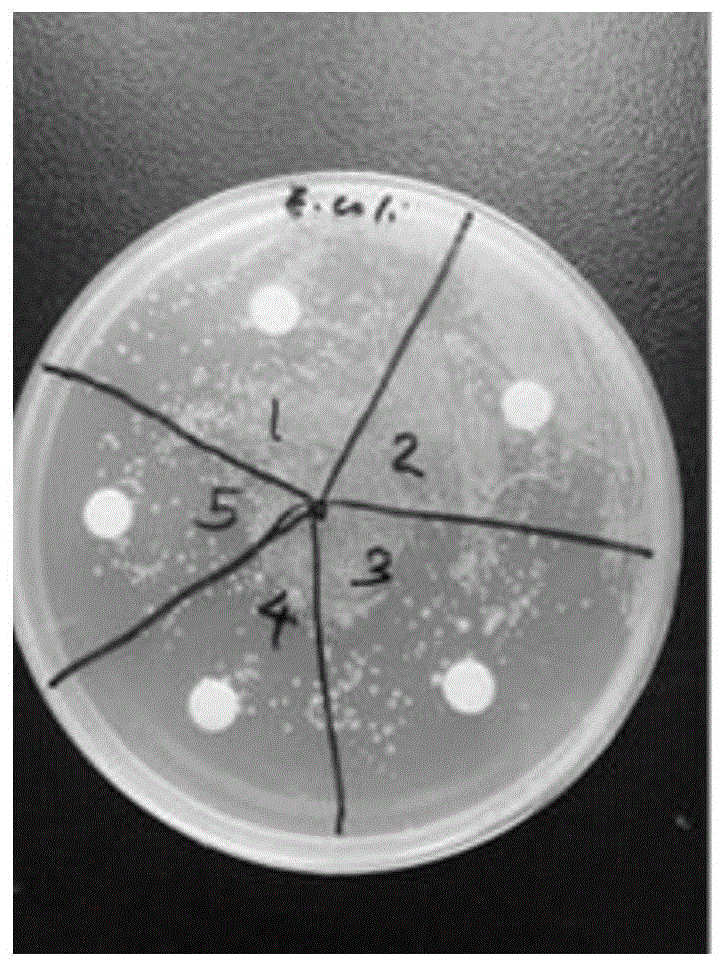
图1是实施例1对不同浓度的大肠杆菌的抗菌效果图;
图2是实施例2对不同浓度的金黄色葡萄球菌的抗菌效果图;
图3是实施例1对不同浓度的白色念珠菌的抗菌效果图;
图4是本发明在酸性条件下颜色与ph的对照图。
图中:1-浓度0.5mg/ml、2-浓度0.05mg/ml、3-浓度0.005mg/ml、4-浓度0.0005mg/ml、5-磷酸缓冲液空白对照。
具体实施方式
下面结合附图与具体实施方式对本发明做进一步的描述。
实施例1:
(1)将质量比为5:8:10:0.01的壳聚糖、丙烯酸、n,n′-亚甲基双丙烯酰胺及cu2wse4溶于1%的醋酸溶液中,充分溶解后通氮气除氧30min;
(2)加入与壳聚糖的质量比为1:30的2,2-偶氮双(2-甲基丙脒)二盐酸盐,密封并置于紫外光照射下反应,辐照强度400mw/cm2,反应时间40min;
(3)用去离子水浸泡所得产物,每隔4h换一次水,重复进行10次,然后将所得产物切割成1cm2的小块,冷冻干燥后得到cs/paa/纳米cu2wse4复合水凝胶;
(4)将偶氮二异丁腈、苯乙烯单体和聚乙烯基吡咯烷酮溶解在乙醇和水的混合溶剂中,偶氮二异丁腈、苯乙烯单体、聚乙烯基吡咯烷酮、乙醇及水的质量比为0.15:4:1:50:15,搅拌均匀并通氮气除氧30min,密封后在65℃下反应36h,得到单分散ps微球乳液;
(5)将玻璃衬底置于h2so4/h2o2(1:3v/v)的水溶液中浸泡12h,取出用蒸馏水反复清洗后,在氮气保护下干燥;将体积比为1:10的单分散ps微球乳液和乙醇混合均匀后,将上述干燥后的玻璃衬底竖直插入其中,室温下进行自组装,3d后得到胶体晶体模板;
(6)将甲基丙烯酸羟乙酯和丙烯酸单体与甲醇混匀,加入偶氮二异庚腈,甲基丙烯酸羟乙酯、丙烯酸单体、甲醇与偶氮二异庚腈的质量比为1:3:6:0.1,通氮气除氧30min后得到前体溶液;
(7)将步骤(5)中制得的胶体晶体模板用有机玻璃夹紧,浸入上述前体溶液中,待模板变透明后,证明前体溶液完全渗透进模板中,在紫外光照射下反应,辐照强度400mw/cm2,反应时间60min;
(8)反应结束后将产物浸入二甲苯溶液中浸泡2d,去除模板后抽滤得到膜状光子晶体;
(9)将上述膜状光子晶体切割成400平方微米大小,超声分散在步骤(3)中制得的cs/paa/纳米cu2wse4复合水凝胶上,得到ph响应型光子晶体凝胶基,超声功率150w,超声时间15min,间隔超声,每超声5s休息30s,超声温度25℃。
实施例2:
(1)将质量比为15:9:12:0.05的壳聚糖、丙烯酸、n,n′-亚甲基双丙烯酰胺及cu2wse4溶于1.5%的醋酸溶液中,充分溶解后通氮气除氧30min;
(2)加入与壳聚糖的质量比为1:40的2,2-偶氮双(2-甲基丙脒)二盐酸盐,密封并置于紫外光照射下反应,辐照强度450mw/cm2,反应时间30min;
(3)用去离子水浸泡所得产物,每隔4.5h换一次水,重复进行15次,然后将所得产物切割成1cm2的小块,冷冻干燥后得到cs/paa/纳米cu2wse4复合水凝胶;
(4)将偶氮二异丁腈、苯乙烯单体和聚乙烯基吡咯烷酮溶解在乙醇和水的混合溶剂中,偶氮二异丁腈、苯乙烯单体、聚乙烯基吡咯烷酮、乙醇及水的质量比为0.17:5:1:55:20,搅拌均匀并通氮气除氧30min,密封后在70℃下反应30h,得到单分散ps微球乳液;
(5)将玻璃衬底置于h2so4/h2o2(1:3v/v)的水溶液中浸泡20h,取出用蒸馏水反复清洗后,在氮气保护下干燥;将体积比为1:11的单分散ps微球乳液和乙醇混合均匀后,将上述干燥后的玻璃衬底竖直插入其中,室温下进行自组装,4d后得到胶体晶体模板;
(6)将甲基丙烯酸羟乙酯和丙烯酸单体与甲醇混匀,加入偶氮二异庚腈,甲基丙烯酸羟乙酯、丙烯酸单体、甲醇与偶氮二异庚腈的质量比为1.1:3.2:7:0.15,通氮气除氧30min后得到前体溶液;
(7)将步骤(5)中制得的胶体晶体模板用有机玻璃夹紧,浸入上述前体溶液中,待模板变透明后,证明前体溶液完全渗透进模板中,在紫外光照射下反应,辐照强度450mw/cm2,反应时间50min;
(8)反应结束后将产物浸入二甲苯溶液中浸泡2d,去除模板后抽滤得到膜状光子晶体;
(9)将上述膜状光子晶体切割成1000平方微米大小,超声分散在步骤(3)中制得的cs/paa/纳米cu2wse4复合水凝胶上,得到ph响应型光子晶体凝胶基,超声功率250w,超声时间10min,间隔超声,每超声5s休息30s,超声温度30℃。
实施例3:
(1)将质量比为25:10:15:0.1的壳聚糖、丙烯酸、n,n′-亚甲基双丙烯酰胺及cu2wse4溶于2%的醋酸溶液中,充分溶解后通氮气除氧30min;
(2)加入与壳聚糖的质量比为1:50的2,2-偶氮双(2-甲基丙脒)二盐酸盐,密封并置于紫外光照射下反应,辐照强度500mw/cm2,反应时间20min;
(3)用去离子水浸泡所得产物,每隔5h换一次水,重复进行20次,然后将所得产物切割成1cm2的小块,冷冻干燥后得到cs/paa/纳米cu2wse4复合水凝胶;
(4)将偶氮二异丁腈、苯乙烯单体和聚乙烯基吡咯烷酮溶解在乙醇和水的混合溶剂中,偶氮二异丁腈、苯乙烯单体、聚乙烯基吡咯烷酮、乙醇及水的质量比为0.2:6:1:60:25,搅拌均匀并通氮气除氧30min,密封后在75℃下反应24h,得到单分散ps微球乳液;
(5)将玻璃衬底置于h2so4/h2o2(1:3v/v)的水溶液中浸泡24h,取出用蒸馏水反复清洗后,在氮气保护下干燥;将体积比为1:12的单分散ps微球乳液和乙醇混合均匀后,将上述干燥后的玻璃衬底竖直插入其中,室温下进行自组装,5d后得到胶体晶体模板;
(6)将甲基丙烯酸羟乙酯和丙烯酸单体与甲醇混匀,加入偶氮二异庚腈,甲基丙烯酸羟乙酯、丙烯酸单体、甲醇与偶氮二异庚腈的质量比为1.2:3.5:7:0.2,通氮气除氧30min后得到前体溶液;
(7)将步骤(5)中制得的胶体晶体模板用有机玻璃夹紧,浸入上述前体溶液中,待模板变透明后,证明前体溶液完全渗透进模板中,在紫外光照射下反应,辐照强度500mw/cm2,反应时间30min;
(8)反应结束后将产物浸入二甲苯溶液中浸泡3d,去除模板后抽滤得到膜状光子晶体;
(9)将上述膜状光子晶体切割成8000平方微米大小,超声分散在步骤(3)中制得的cs/paa/纳米cu2wse4复合水凝胶上,得到ph响应型光子晶体凝胶基,超声功率450w,超声时间5min,间隔超声,每超声5s休息30s,超声温度40℃。
在琼脂培养基上接种浓度为0.5mg/ml、0.05mg/ml、0.005mg/ml、0.0005mg/ml的大肠杆菌、金黄色葡萄球菌及白色念珠菌,然后紧贴上述实施例中制得的ph响应型光子晶体凝胶基,于37℃下培养24h后,用放大镜观察菌类繁殖情况和试样周围无菌区的晕圈大小,与磷酸缓冲液空白对照样的试验情况比较,各实施例中的ph响应型光子晶体凝胶基的抗菌性能均良好。实施例1中的ph响应型光子晶体凝胶基的试验结果如图1至图3所示。
同时,上述实施例1中制得的ph响应型光子晶体凝胶基在酸性条件下,ph不同会显示不同的颜色,其ph与颜色对照图如图4所示。
因此本发明中制备出的ph响应型光子晶体凝胶基运用在皮肤伤口的治疗过程中,杀菌效果良好,且可以实现人眼裸视观察伤口情况。
- 还没有人留言评论。精彩留言会获得点赞!