扁担藤的新用途及其抗炎组分的提取方法与流程
本发明涉及中药领域。更具体地说,本发明涉及扁担藤的新用途及其抗炎组分的提取方法。
背景技术:
扁担藤是葡萄科,崖爬藤属木质大藤本,茎扁压,深褐色。扁担藤分布于中国福建、广东、广西、贵州、云南、西藏东南部,民间常用于祛风除湿、活血化瘀以及跌打损伤等。然而,扁担藤用于消除感染性炎症的用途未见报道。
技术实现要素:
作为各种广泛且细致的研究和实验的结果,本发明的发明人已经发现,基于民间广泛祛风除湿疗效,扁担藤的提取物中包含有消除感染性炎症的有效成分。基于这种发现,完成了本发明。
本发明的一个目的是解决至少上述问题和/或缺陷,并提供至少后面将说明的优点。
本发明还有一个目的是提供一种扁担藤的新用途,其能够利用扁担藤消除炎症。
本发明还有另一个目的是提供一种利用扁担藤提取抗炎组分的方法,其能够将扁担藤的有效抗炎组分进行提取浓缩,以增强扁担藤的抗炎效果。
为了实现根据本发明的这些目的和其它优点,提供了一种扁担藤的新用途,所述扁担藤用于消除感染引起的感染性炎症。
一种利用扁担藤提取抗炎组分的方法,包括以下步骤:
1)往扁担藤中添加乙醇溶液进行冷浸提1-3次,获得浸提液
2)将所述浸提液进行蒸发浓缩,获得乙醇浸膏;
3)往所述乙醇浸膏中添加水,制备混悬液,依次用石油醚、乙酸乙酯、正丁醇进行系统溶剂分离法进行分离,分别获得石油醚部位、乙酸乙酯部位以及正丁醇部位;
其中,石油醚部位、乙酸乙酯部位以及正丁醇部位均具有抗炎组分。
优选的是,所述乙醇溶液的体积分数为60-80%。
优选的是,所述扁担藤与乙醇溶液的质量比为1:5-10。
优选的是,所述石油醚部位用于抗炎的浓度为7.8125~500μg/mL,乙酸乙酯部位用于抗炎的浓度为7.8125~250μg/mL,正丁醇部位用于抗炎的浓度为15.625~1000μg/mL。该区间内对细胞生长无明显影响。
优选的是,所述石油醚部位、乙酸乙酯部位以及正丁醇部位用于抗炎的浓度均为250μg/mL。
优选的是,石油醚部位、乙酸乙酯部位以及正丁醇部位用于抑制细胞中 NO的生成。
优选的是,步骤3)中,所述乙醇浸膏与水的质量比为1:2-3。
优选的是,步骤2)中,使用旋转蒸发仪进行蒸发浓缩。
本发明至少包括以下有益效果:本发明提供了一种扁担藤新用途,利用扁担藤的提取物具有消除炎症的作用;本发明的扁担藤的有效组分具有抑制 NO产生,从而起到消除炎症的作用;本发明还提供了提取扁担藤抗炎组分的方法,本发明提供的方法具有提取过程简单、提取快速等特点。
本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
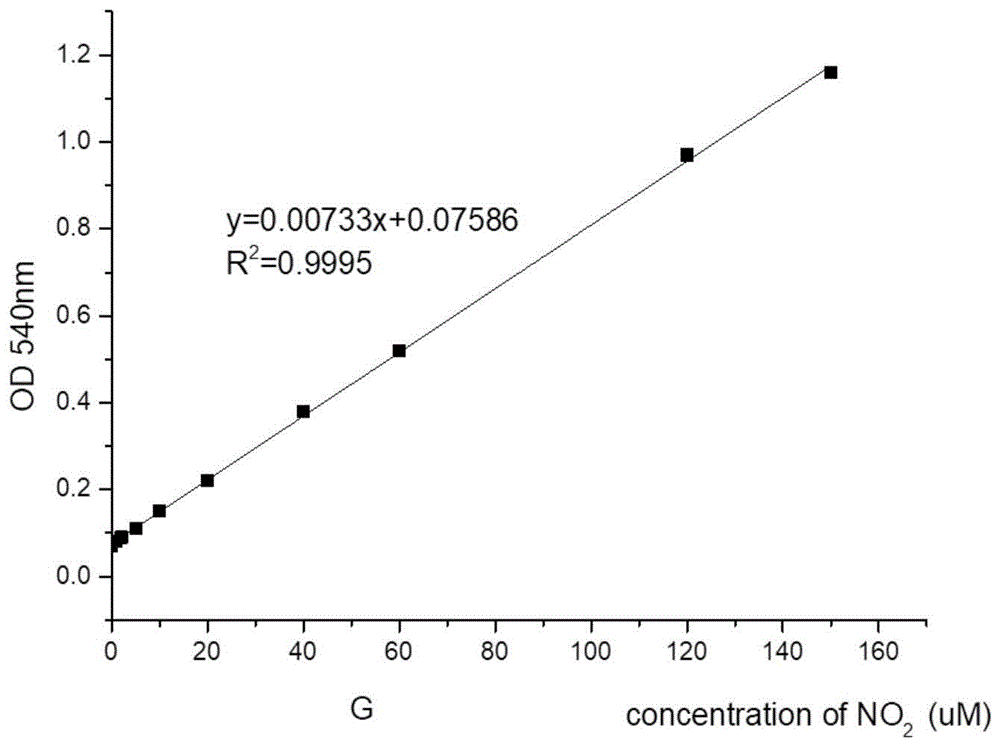
图1说明的是NO2-浓度与OD540值的关系。
具体实施方式
下面对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不配出一个或多个其它元件或其组合的存在或添加。
实施例1
一种利用扁担藤提取抗炎组分的方法,包括以下步骤:
1)往扁担藤中添加乙醇溶液进行冷浸提3次,将浸提液合并,获得浸提液;
2)将所述浸提液进行蒸发浓缩,获得乙醇浸膏;
3)往所述乙醇浸膏中添加水,制备混悬液,依次用石油醚、乙酸乙酯、正丁醇进行系统溶剂分离法进行分离,分别获得石油醚部位、乙酸乙酯部位以及正丁醇部位;
其中,石油醚部位、乙酸乙酯部位以及正丁醇部位均具有抗炎组分。
实施例2
一种利用扁担藤提取抗炎组分的方法,包括以下步骤:
1)往扁担藤中添加乙醇溶液进行冷浸提2次,获得浸提液;其中,所述乙醇溶液的体积分数为60%,所述扁担藤与乙醇溶液的质量比为1:5;
2)将所述浸提液进行蒸发浓缩,获得乙醇浸膏;
3)往所述乙醇浸膏中添加水,制备混悬液,依次用石油醚、乙酸乙酯、正丁醇进行系统溶剂分离法进行分离,分别获得石油醚部位、乙酸乙酯部位以及正丁醇部位;
其中,石油醚部位、乙酸乙酯部位以及正丁醇部位均具有抗炎组分。
实施例3
一种利用扁担藤提取抗炎组分的方法,包括以下步骤:
1)往扁担藤中添加乙醇溶液进行冷浸提1次,获得浸提液;其中,所述乙醇溶液的体积分数为80%,所述扁担藤与乙醇溶液的质量比为1:10;
2)将所述浸提液进行蒸发浓缩,获得乙醇浸膏;
3)往所述乙醇浸膏中添加水,制备混悬液,依次用石油醚、乙酸乙酯、正丁醇进行系统溶剂分离法进行分离,分别获得石油醚部位、乙酸乙酯部位以及正丁醇部位;
其中,石油醚部位、乙酸乙酯部位以及正丁醇部位均具有抗炎组分,所述石油醚部位用于抗炎的浓度为7.8125μg/mL,乙酸乙酯部位用于抗炎的浓度为7.8125μg/mL,正丁醇部位用于抗炎的浓度为15.625μg/mL。
实施例4
一种利用扁担藤提取抗炎组分的方法,包括以下步骤:
1)往扁担藤中添加乙醇溶液进行冷浸提3次,获得浸提液;其中,所述乙醇溶液的体积分数为70%,所述扁担藤与乙醇溶液的质量比为1:10;
2)将所述浸提液使用旋转蒸发仪进行蒸发浓缩,获得乙醇浸膏;
3)往所述乙醇浸膏中添加水,制备混悬液,依次用石油醚、乙酸乙酯、正丁醇进行系统溶剂分离法进行分离,分别获得石油醚部位、乙酸乙酯部位以及正丁醇部位;
其中,石油醚部位、乙酸乙酯部位以及正丁醇部位均具有抗炎组分,所述石油醚部位、乙酸乙酯部位以及正丁醇部位用于抗炎的浓度均为250μ g/mL,所述乙醇浸膏与水的质量比为1:2。
LPS作为一种炎症诱导剂,能够激活巨噬细胞,诱导NO、IL-6、TNF- α的合成和释放。
NO作为调节或转化成细胞间信号,作为一种炎性介质,具有提高或调节免疫细胞的功能。巨噬细胞是免疫系统中重要的免疫细胞,过多的NO会促进巨噬细胞释放IL-1、TNF-α等促炎因子,而这些促炎因子会刺激巨噬细胞释放更多的NO。
地塞米松具有抑制中性粒细胞和巨噬细胞渗出向炎症部位聚集的作用,具有抗炎作用。
分别取实施例4提取的石油醚部位、乙酸乙酯部位、正丁醇部位的20mg 于2mL离心管中,各加入500μL DMSO溶液,超声溶解,使用0.22μm微孔滤膜滤过,得到终浓度均为40mg/mL的药物母液。进行以下试验。
试验一、扁担藤提取物对细胞存活了率的影响
取上述扁担藤石油醚部位、乙酸乙酯部位、正丁醇部位的药物母液,用适量的DMEM培养基进行倍半稀释,确定石油醚部位、乙酸乙酯部位的终浓度分别为1000μg/mL、500μg/mL、250μg/mL、125μg/mL、62.5μg/mL、 31.25μg/mL、15.625μg/mL和7.8125μg/mL;正丁醇部位的终浓度分别为 2000μg/mL、1000μg/mL、500μg/mL、250μg/mL、125μg/mL、62.5μg/mL、 31.25μg/mL和15.625μg/mL。其中,稀释完成后DMSO浓度小于0.1%。以小鼠巨噬细胞(RAW264.7)为模型,采用CCK-8法检测不同扁担藤提取部位对对细胞存活率的影响。每组3个复孔,每个部位设置8个浓度。
给药组:上述不同浓度的样品溶液。
空白组:与样品溶液等体积的DMEM培养基。
实验步骤
取96孔板(其中96孔板最外围一圈加入100μL的PBS缓冲液),接种生长状态良好,且在对数生长期的RAW264.7细胞,细胞密度为1×104个/孔, (即1×105/mL),每孔100μL,置于37℃、5%CO2培养箱中培养24小时。待 24小时后细胞贴壁完全后,弃去原有培养液,以每孔100μL加入含不同浓度的给药组和空白组的培养基,置于37℃、5%CO2培养箱中培养24小时。待药物作用24小时后,弃去培养基,用PBS清洗两次,每孔加入含10%的DMEM 培养基,继续培养1h后,在酶标仪中测每孔在490nm的OD490值。
按照以下公式1计算给药组的细胞存活率,结果如表1所示。
公式1:细胞存活率=OD给药组/OD空白组×100%。
表1扁担藤不同极性部位对RAW264.7细胞存活率的影响(x±s)
与空白组比较:##P<0.01;#P<0.05
结果如表1所示,当给药浓度超过1000μg/mL时,三个部位在给药24 小时后对细胞存活率明显降低,均有明显的细胞毒性(##P<0.01),与空白组相比在统计学上有显著性差异。当给药浓度为31.25~500μg/mL区间时,石油醚部位对细胞无明显毒性;当给药浓度为500μg/mL和125μg/mL时,乙酸乙酯部位对细胞有轻微的毒性(#P<0.05);当给药浓度为31.25μg/mL时,给药 24小时后RAW264.7细胞的存活率有轻微的下降,但无统计学差异(#P>0.05);当1000μg/mL时,正丁醇部位作用对细胞存活率有轻微的下降,但无统计学差异(#P>0.05),当给药浓度为250μg/mL、31.25μg/mL、15.625μg/mL时,给药24小时后细胞有轻微的毒性(#P<0.05)。
综上所述,扁担藤的石油醚部位在7.8125~500μg/mL浓度区间内,乙酸乙酯部位在7.8125~250μg/mL浓度区间内,正丁醇部位则在 15.625~1000μg/mL浓度区间内,扁担藤三种不同极性部位在其浓度区间内对 RAW264.7细胞生长无明显影响。
试验二、Griess法检测一氧化氮含量
NO标准曲线制作
精确称取69.0mg NaNO2于容量瓶中,加超纯水溶解并定容至500mL,配制为2.0mmoL/L NaNO2标准品溶液,使用前用DMEM培养基将上述得到的2.0mmoL/L NaNO2标准品溶液稀释至终浓度为0μM、1μM、5μM、10μM、 20μM、40μM、60μM、120μM、150μM的NaNO2溶液,每个NaNO2浓度设 3个复孔,在96孔板中按每孔70μL加入不同浓度的标准品溶液,每孔加入等量的Griess试剂,避光反应15min,使用酶标仪分别测定上述不同终浓度的NaNO2溶液在540nm处测每孔的吸光度。以NO2-浓度为横坐标,吸光度 OD值为纵坐标制作标准曲线。标准曲线如图1所示。
实验分组
取扁担藤的石油醚部位、乙酸乙酯部位、正丁醇部位的药物母液,用适量的DMEM培养基进行倍半稀释,确定扁担藤的石油醚、乙酸乙酯部位的终浓度为250μg/mL、125μg/mL、62.5μg/mL;正丁醇部位的终浓度为500μg/mL、 250μg/mL、125μg/mL。其中DMSO浓度小于0.1%。以小鼠巨噬细胞 (RAW264.7)为模型,采用Griess法检测不同扁担藤提取部位对细胞NO产生的影响。每组3个复孔。
LPS组:含1μg/mL LPS的DMEM培养基。
空白组:DMEM培养基
给药组:含1μg/mL LPS的DMEM培养基,以及不同浓度的样品溶液。
阳性组:含1μg/mL LPS的DMEM培养基,地塞米松(配制后终浓度为2μg/mL)。
每组设置3个复孔。
实验步骤
取96孔板(其中96孔板最外围一圈加入100μL的PBS缓冲液),接种生长状态良好,且在对数生长期的RAW264.7细胞,细胞密度为1×104个/孔, (即1×105/mL),每孔100μL,置于37℃、5%CO2培养箱中培养24小时。待 24小时后细胞贴壁完全后,弃去原有培养液,设置空白组、LPS组、给药组、阳性组,每组3个复孔。空白组中每孔加入DMEM培养基100μL,LPS组中每孔加入含1μg/mL LPS的DMEM培养基100μL;给药组中每孔加入含 1μg/mL LPS的DMEM培养基配制的不同浓度的样品溶液;阳性组中每孔加入含1μg/mL LPS的DMEM培养基配制的地塞米松溶液,在37℃、5%CO2培养箱中继续培养24小时后,将96孔板在2500rpm离心5min,小心吸取上清70μL,且加入的Griess试剂70μL,避光反应15min,酶标仪在540nm处测每孔的吸光度。将实验得到的空白组、LPS组、给药组、阳性空白组中的吸光度代入标准曲线测NO的含量,根据公式(2)计算得到抑制率,并用IBM SPSS软件算出各个部位对RAW264.7细胞的IC50,结果如表2所示。
公式2:抑制率=(LPS组-不同浓度的给药组)/(LPS组-空白组)×100%。
表2扁担藤不同极性部位对LPS刺激RAW264.7细胞释放NO的影响 (n=3)
与空白组比较:##P<0.01 ###P<0.001;与LPS组比较:*P<0.05 **P<0.01 ***P<0.001,下同
从表2结果可知,使用1μg/mL LPS诱导后的LPS组,NO的释放量显著上升,且有显著差异(###P<0.001),表明已造模,而地塞米松作为阳性组, NO量显著下降,且有显著差异(**P<0.01),说明地塞米松能降低LPS诱导 RAW264.7细胞的NO的释放量,阳性组设置成功。扁担藤中不同极性部位中,石油醚部位、乙酸乙酯部位、正丁醇部位给药组与LPS组相比,能显著地抑制NO释放量,其中石油醚部位和乙酸乙酯部位的数据呈现剂量依赖性,当给药浓度为250μg/mL时,扁担藤石油醚部位、乙酸乙酯部位对NO释放量抑制率高达到76.07%(**P<0.01)和71.40%(**P<0.01),正丁醇部位对NO释放量抑制率为48.39%(**P<0.01)。相比于正丁醇部位,石油醚部位、乙酸乙酯部位对NO释放量抑制作用更强。
IC50表示扁担藤不同极性部位抑制50%NO所需的给药浓度,IC50值越大,说明不同极性部位抑制NO释放量所需的给药浓度越大,可能在生物体内或细胞内越难达到发挥药效的浓度。扁担藤不同极性部位的IC50值从小到大的顺序为:石油醚部位<乙酸乙酯部位<正丁醇部位。
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用。它完全可以被适用于各种适合本发明的领域。对于熟悉本领域的人员而言,可容易地实现另外的修改。因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。
- 还没有人留言评论。精彩留言会获得点赞!