一种实现可控释放壳聚糖/明胶壳核胶囊的制备方法与流程
本发明属于高分子材料、生物化学和生物医用材料领域,特别是一种实现可控释放壳聚糖/明胶壳核胶囊的制备方法,该方法可以在基于温度、酶协同响应下实现可控释放的壳聚糖/明胶壳核胶囊的制备。
背景技术:
聚合物壳核胶囊是由一个或多个核芯与壳层材料制备得到的微容器,其芯材包括气体、液体和固体等材料;大多数外壳是由天然或合成聚合物材料制成,而壳聚糖作为几丁质脱乙酰化得到的天然阳离子电介质多糖,具有良好的生物相容性、生物降解性、无毒和生物活性,因此壳聚糖基壳核胶囊在药物输送、酶的固定、生物传感器和生物反应器等生物医学和生物技术领域具有广阔的应用前景,已引起了研究者的广泛关注。此外壳聚糖壳核胶囊可被应用于刺激性响应释放控制体系,其刺激性释放机理可以大致分为两类:第一类,胶囊的壳层在外部或内部刺激下发生破损,然后包载物从壳核胶囊中释放出来,例如chu等人利用微流控技术制备了一种ph敏感性的壳聚糖壳核胶囊,在酸刺激下壳层发生破损,随后药物从壳核胶囊中释放到外部环境中[appliedmater&interfaces,2016,8(16):10524-10534];第二类,芯材受到外部环境刺激,使得芯材包埋的物质释放到外部环境中。与具有壳层刺激响应的微胶囊相比,芯材刺激响应胶囊可以稳定且连续地释放包埋物,且无需设计壳层的特定结构,当外部环境改变刺激胶囊芯材触发机制启动,芯核会发生自我破坏,从而可以快速、大量的释放包埋物质。一些研究者已对此类型胶囊进行了研究,例如在alireza等人的设计中,将药物载入到由凝胶基质和固体脂质组成的核芯中。然后使用脂肪酶消化脂质核芯从而释放药物[appliedmater&interfaces,2018,10(6):6046-6053]。然而,该方案受到脂肪酶浓度的限制,这限制了壳聚糖壳核胶囊在多种环境下的应用。
与脂质体不同,明胶是胶原蛋白水解的衍生物,具有来源广泛、生物相容性好、无毒性和可降解等特点,在生物医用领域具有良好的应用前景。明胶的溶胶-凝胶相转变温度接近人体温度[materscienceandengineeringc,2015,53:222-228],具体而言,当明胶溶液的温度升高到32℃左右时,明胶开始溶解形成溶胶;而当温度降低到32℃以下时,溶解的明胶溶胶又可逆转变为凝胶。因此,通过利用明胶的温敏特性,首先制备包载有壳聚糖酶的明胶微球,然后将其引入壳聚糖胶囊核芯中,通过升温使明胶微球溶解并释放壳聚糖酶,释放的壳聚糖酶会降解胶囊壳层中的壳聚糖产生寡聚糖,从而破坏胶囊壳层释放包埋物质。采用包覆有温敏性明胶微球制备具有自我破坏性能的壳核胶囊,达到可控释放包埋物质的方法具有制备过程简单,操作步骤简化,制备条件温和;反应时间短,易于控制,后处理过程简单,绿色环保,成本低廉等优点。本发明所制备的具有温度刺激响应性的壳聚糖/明胶壳核微球在药物传输、控制释放、生物检测和生物标记等领域具有广泛的应用前景。
技术实现要素:
本发明所要解决的技术问题是:提供一种实现可控释放壳聚糖/明胶壳核胶囊的制备方法,该方法可以在基于温度、酶协同响应下实现可控释放的壳聚糖/明胶壳核胶囊的制备。
本发明的技术原理:壳聚糖是一种带有氨基基团的阳离子聚合物,它可与阴离子聚电解质如阴离子型表面活性剂十二烷基苯磺酸钠通过静电作用形成胶囊壳层。明胶作为一种具有温敏性的天然高分子材料,可以采用温度条件控制的方法制备产生明胶微球。壳聚糖的降解方式主要包括化学法和酶解法,壳聚糖酶是酶法水解壳聚糖的专一活性酶,相比于化学降解,酶法水解壳聚糖因其作用条件温和、选择性高、无毒副性、产物无污染,满足现如今人们对环境保护的要求。首先将壳聚糖酶包载进明胶微球中,然后将明胶微球浸入壳聚糖溶液中并分散均匀,将含有明胶微球的壳聚糖溶液滴入十二烷基苯磺酸钠溶液中,制备得到壳聚糖/明胶壳核胶囊,室温下,明胶球稳定不会溶解,当温度升高到37℃超过明胶溶解温度时,明胶微球溶解并释放包埋物,释放的壳聚糖酶会与壳层中的壳聚糖发生水解作用,从而释放被包埋物至外部溶液中。
本发明解决其技术问题采用以下的技术方案:
本发明提供的实现可控释放壳聚糖/明胶壳核胶囊的制备方法,是一种温度、酶协同响应下实现可控释放壳聚糖/明胶壳核胶囊的制备方法,具体是:首先利用天然高分子明胶的温度刺激响应性,制备包载有壳聚糖酶的明胶微球;然后将明胶微球分散于壳聚糖溶液中,利用阳离子聚电解质壳聚糖和阴离子表面活性剂的静电吸引作用,进一步制备得到壳聚糖/明胶壳核胶囊。
上述方法中,所述制备包载有壳聚糖酶的明胶微球包括以下步骤:
1)配制壳聚糖和阴离子表面活性剂溶液:
将壳聚糖粉末加入体积百分比为0.2~0.8%的盐酸水溶液中,常温下搅拌5~10小时至壳聚糖充分溶解,采用布氏漏斗进行过滤,配制得到质量浓度为1~3g/100ml的壳聚糖溶液;取1~3g的阴离子表面活性剂粉末,加入到50~100ml的去离子水中,然后搅拌2~3小时至阴离子表面活性剂充分溶解,配制得到质量浓度为2~3g/100ml的阴离子表面活性剂溶液;
2)包载有壳聚糖酶的明胶溶液的配制:
将1.5~4.5g明胶粉末加入到10~30ml去离子水中搅拌使其充分溶胀,随后置于35~45℃恒温水浴环境下,磁力搅拌1~2小时至明胶粉末完全溶解,得到明胶溶液;再取一定量的壳聚糖酶粉末加入到明胶溶液中,并搅拌0.5~1小时至壳聚糖酶粉末完全溶解,配制得到含壳聚糖酶质量浓度为2%~8%的混合溶液,继续在35~45℃的恒温水浴中保温备用。
上述方法中,所述可控释放的壳聚糖/明胶核壳胶囊壳核胶囊的制备方法是:用容量为1ml的微量注射器吸取一定体积的步骤2)制备的明胶溶液,将其逐滴滴加到2~5℃冷的大豆油中,并转移置于4℃恒温冰箱中冷却降温,静置20~30分钟后取出,利用明胶的温敏性使得明胶液滴形成稳定的明胶微球;将制备得到的明胶微球移出并依次经过无水乙醇、蒸馏水进行淋洗,随后将明胶微球浸入步骤1)壳聚糖溶液中并分散均匀,用一次性滴管吸取一定体积的含有明胶微球的壳聚糖溶液,逐滴加入到步骤1)阴离子表面活性剂溶液中,孵化2~10分钟后,利用壳聚糖与阴离子表面活性剂的静电吸引作用形成微胶囊,最后取出微胶囊用去离子水清洗3~6次,制备得到核层为明胶微球、壳层为壳聚糖胶囊的壳聚糖/明胶壳核胶囊。这种通过对壳聚糖基壳核胶囊内核进行设计,制备了包载有壳聚糖酶的明胶内核,可实现胶囊破坏的可控性及其装载物质释放的可调控性。
上述方法中,所述阴离子表面活性剂为十二烷基苯磺酸钠或十二烷基硫酸钠。
上述方法中,可以将0.4~1.0g的壳聚糖酶粉末均匀分散到明胶溶液中。
本发明提供的上述方法制备的壳聚糖/明胶壳核胶囊,其在包括药物包埋、可控释放和化学检测器中的应用。
本发明将载有壳聚糖酶的明胶微球作为壳核胶囊的芯材,通过利用明胶的温敏性,实现胶囊破坏的可控性及其包埋物质释放的可调控性,即在常温环境下明胶微球保持稳定不会释放壳聚糖酶,因此壳聚糖胶囊结构保持稳定不会快速释放被包埋物质,而当温度升高到37℃,明胶微球溶解并释放壳聚糖酶,壳聚糖酶会水解壳层的壳聚糖生成低分子量的寡聚糖,破坏壳聚糖与阴离子表面活性剂所形成三维网状结构,达到快速释放包埋物质从而实现包埋物质释放的可调控性。该技术的制备步骤简单,设备简易,制备条件温和,易于控制,后处理简单,成本低廉等。该方法制备的基于温度刺激下实现可控释放的壳聚糖/明胶壳核胶囊在药物传输、控制释放、生物检测和生物标记等方面具有广阔的应用前景。
当前,壳核胶囊的制备方法多采用层层自组装法,该工艺方法制备过程复杂且费时,往往为了获得一定壳层厚度胶囊,制备时长高达十小时。而本发明采用通过注射器转移滴加的方式,操过过程简便且无需一系列的后处理工艺,可以大大缩短生产周期,提高效率。多重响应壳核胶囊的制备往往采用对壳层材料进行化学修饰等方法,因此需要使用多种具有一定毒性的有机试剂如戊二醛等,而这便限制了该胶囊在人体医药领域的应用,而本发明采用的明胶、壳聚糖、壳聚糖酶等属于天然大分子材料,不论是从环保角度还是从人体毒害性上考虑,均满足人们的要求。本发明中将明胶溶液制备成明胶球并载有壳聚糖酶,可以同时赋予壳核胶囊温度响应性和酶响应性,该响应过程只需要在温度刺激下便可以快速响应,随后壳聚糖酶从明胶球中释放,作用于胶囊壳层的壳聚糖,导致壳层的破坏,整个协同响应过程时间可以人为进行设计,从短短几分钟到长达几十分钟都可以通过酶含量进行控制,这种操作可调控性符合未来人们对多重响应胶囊的要求。此外该壳核胶囊能够分层包埋各种不同类型的物质,例如药物、纳米粒子和荧光物质等,在药物传输、控制释放、生物检测和生物标记等领域具有广泛的应用前景,满足多领域的需求。
本发明与现有技术相比具有以下主要的优点:
1)本发明基于温度、酶协同响应下实现可控释放壳聚糖/明胶壳核胶囊的制备方法,该方法制备过程方便,步骤简单,反应时间短,易于控制,绿色环保等。
2)本发明基于温度、酶协同响应下实现可控释放壳聚糖/明胶壳核胶囊的制备方法,通过在明胶球中引入壳聚糖酶,壳聚糖酶能够水解壳聚糖生成低聚物寡聚糖,在温度刺激作用下可实现胶囊破坏的可控性及其装载物质释放的可调控性,在生物医药方面具有广阔的应用前景。
3)本发明基于温度、酶协同响应下实现可控释放壳聚糖/明胶壳核胶囊的制备方法,本制备方法中所用的明胶、壳聚糖以及壳聚糖酶均为天然高分子材料,具有良好的生物相容性、生物可降解性、无毒性、来源丰富及价格低廉等特点,因此所制备的壳聚糖胶囊能广泛应用于生物医学领域。
4)本发明基于温度、酶协同响应下实现可控释放壳聚糖/明胶壳核胶囊的制备方法,该方法所制备的壳聚糖/明胶壳核胶囊,能够分层包埋各种不同类型的物质,例如药物、纳米粒子和荧光物质等,在药物传输、控制释放、生物检测和生物标记等领域具有广泛的应用前景。
附图说明
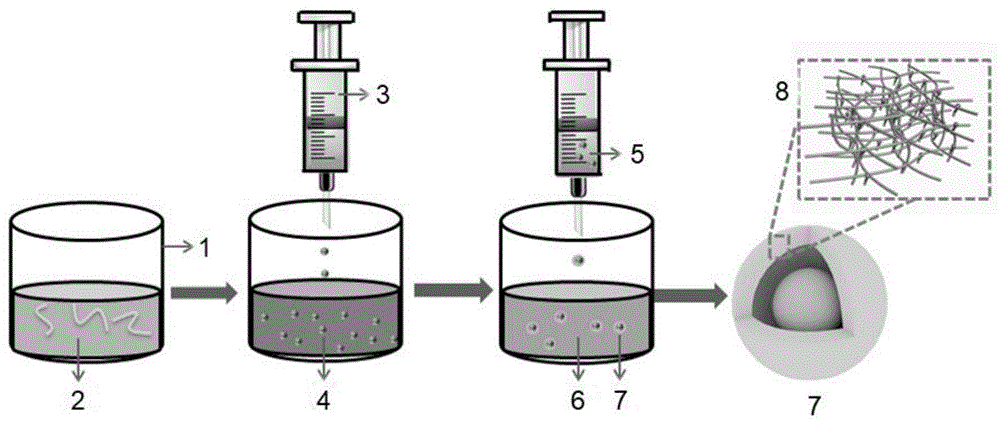
图1是本发明实施例1基于温度、酶协同响应下实现可控释放壳聚糖/明胶壳核胶囊的制备方法的示意图。
图2是本发明实施例2所制备的壳聚糖/明胶壳核胶囊在升温至40℃后被破坏的照片。
图中:1.烧杯,2.明胶溶液,3.注射器,4.大豆油,5.壳聚糖溶液,6.十二烷基苯磺酸钠溶液,7.壳聚糖/明胶壳核胶囊,8.壳层微观结构,9.培养皿。
具体实施方式
本发明提供的实现可控释放壳聚糖/明胶壳核胶囊的制备方法,是一种温度、酶协同响应下实现可控释放壳聚糖/明胶壳核胶囊的制备方法,具体是:用明胶具有的温度刺激下溶胶-凝胶转变性能,包载有壳聚糖酶的明胶溶液低温条件下制备得到明胶球,利用壳聚糖与阴离子表面活性剂之间的静电作用,从而制备得到可控释放壳聚糖/明胶壳核胶囊,在外部温度刺激作用下,明胶球开始溶解,壳聚糖酶能够迅速从明胶球中释放,并与可壳层的壳聚糖发生水解作用,生成低分子量的寡聚糖,破坏壳聚糖与阴离子表面活性剂之间所形成的三维网状结构,从而可实现胶囊可控破坏及包埋物质的可控释放。这种包覆有壳聚糖酶的壳聚糖/明胶壳核胶囊利用明胶的温度刺激响应性及壳聚糖酶对壳聚糖的降解作用,可实现壳核胶囊的破坏可控性及包埋药物的释放可控性。
下面结合实施例和附图对本发明作进一步的描述,当然下述实施例不应理解为对本发明的限制。
实施例1
本实施例提供的实现可控释放壳聚糖/明胶壳核胶囊的制备方法,包括以下具体步骤:
(1)配制壳聚糖和十二烷基苯磺酸钠溶液:
将壳聚糖粉末加入体积百分比为0.5%的盐酸水溶液中,常温下搅拌5小时至壳聚糖充分溶解,采用布氏漏斗进行过滤,配制得到质量浓度为1g/100ml的壳聚糖溶液;取1g的十二烷基苯磺酸钠粉末,加入到50ml的去离子水中,然后搅拌2小时至十二烷基苯磺酸钠充分溶解,配制得到质量浓度为2g/100ml的阴离子表面活性剂溶液;
(2)配制壳聚糖酶/明胶混合溶液:
取1.5g明胶加入到10ml的去离子水中,室温下搅拌使其充分溶胀,随后置于35℃恒温水浴环境下,磁力搅拌2小时至明胶粉末完全溶解,得到明胶溶液,然后向明胶溶液中加入0.6g壳聚糖酶,并搅拌0.5小时至壳聚糖酶充分溶解,配制得到壳聚糖酶/明胶混合溶液,并在35℃的恒温水浴中保温备用;
(3)可控释放的壳聚糖/明胶壳核胶囊的制备:
用容量为1ml的微量注射器吸取一定体积的步骤(2)制备的明胶溶液,将其逐滴滴加到4℃冷的大豆油中,并转移置于4℃恒温冰箱中冷却降温,静置30分钟后取出,利用明胶的温敏性使得明胶液滴形成稳定的明胶微球。将制备得到的明胶微球移出并依次经过无水乙醇、蒸馏水进行淋洗,随后将明胶微球浸入步骤(1)壳聚糖溶液中并分散均匀,用一次性滴管吸取一定体积的含有明胶微球的壳聚糖溶液,逐滴加入到步骤(1)十二烷基苯磺酸钠溶液中,孵化2分钟后,利用壳聚糖与阴离子表面活性剂的静电吸引作用形成微胶囊,最后取出微胶囊用去离子水清洗3次,制备得到核层为明胶微球、壳层为壳聚糖胶囊的壳聚糖/明胶壳核胶囊。
图1是本发明实施例1所制备的可控释放的壳聚糖/明胶壳核胶囊的制备方法。首先利用明胶的溶胶-凝胶转变性能,将明胶溶液逐滴加入到4℃冷大豆油中制备明胶微球,然后将明胶微球加入壳聚糖溶液并分散均匀中,再将含有明胶微球的壳聚糖溶液滴加到十二烷基苯磺酸钠溶液中,利用壳聚糖与十二烷基苯磺酸钠的静电作用制备可控释放的壳聚糖/明胶壳核胶囊。
实施例2
本实施例提供的实现可控释放壳聚糖/明胶壳核胶囊的制备方法,包括以下具体步骤:
(1)配制壳聚糖和十二烷基硫酸钠溶液:
将壳聚糖粉末加入体积百分比为0.2%的盐酸水溶液中,常温下搅拌10小时至壳聚糖充分溶解,采用布氏漏斗进行过滤,配制得到质量浓度为2g/100ml的壳聚糖溶液;取3g的十二烷基硫酸钠粉末,加入到100ml的去离子水中,然后搅拌3小时至十二烷基硫酸钠充分溶解,配制得到质量浓度为3g/100ml的十二烷基硫酸钠溶液;
(2)配制壳聚糖酶/明胶混合溶液:
取4g明胶加入到20ml的去离子水中,室温下搅拌使其充分溶胀,随后转移至40℃的恒温水浴中搅拌2小时至明胶充分溶解,配制得到明胶溶液,并向明胶溶液中加入0.8g壳聚糖酶,并搅拌1小时至壳聚糖酶充分溶解,配置得到壳聚糖酶/明胶混合溶液,继续在40℃的恒温水浴中保温备用;
(3)可控释放的壳聚糖/明胶壳核胶囊的制备:
用容量为1ml的微量注射器吸取一定体积的步骤(2)制备的明胶溶液,将其逐滴滴加到5℃冷的大豆油中,并转移置于4℃恒温冰箱中冷却降温,静置30分钟后取出,利用明胶的温敏性使得明胶液滴形成稳定的明胶微球。将制备得到的明胶微球移出并依次经过无水乙醇、蒸馏水进行淋洗,随后将明胶微球浸入步骤(1)壳聚糖溶液中并分散均匀,用一次性滴管吸取一定体积的含有明胶微球的壳聚糖溶液,逐滴加入到步骤(1)十二烷基苯磺酸钠溶液中,孵化5分钟后,利用壳聚糖与阴离子表面活性剂的静电吸引作用形成微胶囊,最后取出微胶囊用去离子水清洗6次,制备得到核层为明胶微球、壳层为壳聚糖胶囊的壳聚糖/明胶壳核胶囊。
图2是实施例2所制备的包覆明胶微球的壳聚糖胶囊在升温至40℃后被破坏的照片。从图中可以看出,当该胶囊升温之前,明胶微球结构完整,没有出现明显的溶解现象,且明胶核和壳聚糖壳层之间具有明显的界面,胶囊也没有出现变形及破损现象。这说明明胶微球包埋的壳聚糖酶并没有水解壳层壳聚糖。而当把胶囊浸入40℃恒温水浴中后,胶囊内部的明胶微球已全部溶解,胶囊壁出现了褶皱,甚至破裂。
实施例3
本实施例提供的实现可控释放壳聚糖/明胶壳核胶囊的制备方法,包括以下具体步骤:
(1)配制壳聚糖和十二烷基苯磺酸钠溶液:
将壳聚糖粉末加入体积百分比为0.6%的盐酸水溶液中,常温下搅拌7小时至壳聚糖充分溶解,采用布氏漏斗进行过滤,配制得到质量浓度为2g/100ml的壳聚糖溶液;取2g的十二烷基苯磺酸钠粉末,加入到100ml的去离子水中,然后搅拌2小时至十二烷基苯磺酸钠充分溶解,配制得到质量浓度为2g/100ml的阴离子表面活性剂溶液;
(2)配制壳聚糖酶/明胶混合溶液:
取3g明胶加入到30ml的去离子水中,室温下搅拌使其充分溶胀,随后置于45℃恒温水浴环境下,磁力搅拌1.5小时至明胶粉末完全溶解,得到明胶溶液,然后向明胶溶液中加入0.4g壳聚糖酶,并搅拌1小时至壳聚糖酶充分溶解,配制得到壳聚糖酶/明胶混合溶液,并在45℃的恒温水浴中保温备用;
(3)可控释放的壳聚糖/明胶壳核胶囊的制备:
用容量为1ml的微量注射器吸取一定体积的步骤(2)制备的明胶溶液,将其逐滴滴加到3℃冷的大豆油中,并转移置于4℃恒温冰箱中冷却降温,静置20分钟后取出,利用明胶的温敏性使得明胶液滴形成稳定的明胶微球。将制备得到的明胶微球移出并依次经过无水乙醇、蒸馏水进行淋洗,随后将明胶微球浸入步骤(1)壳聚糖溶液中并分散均匀,用一次性滴管吸取一定体积的含有明胶微球的壳聚糖溶液,逐滴加入到步骤(1)十二烷基苯磺酸钠溶液中,孵化6分钟后,利用壳聚糖与阴离子表面活性剂的静电吸引作用形成微胶囊,最后取出微胶囊用去离子水清洗6次,制备得到核层为明胶微球、壳层为壳聚糖胶囊的壳聚糖/明胶壳核胶囊。
实施例4
本实施例提供的实现可控释放壳聚糖/明胶壳核胶囊的制备方法,包括以下具体步骤:
(1)配制壳聚糖和十二烷基硫酸钠溶液:
壳聚糖粉末加入体积百分比为0.5%的盐酸水溶液中,常温下搅拌8小时至壳聚糖充分溶解,采用布氏漏斗进行过滤,配制得到质量浓度为1.5g/100ml的壳聚糖溶液;取2g的十二烷基硫酸钠粉末,加入到100ml的去离子水中,然后搅拌3小时至十二烷基硫酸钠充分溶解,配制得到质量浓度为2g/100ml的十二烷基硫酸钠溶液;
(2)配制壳聚糖酶/明胶混合溶液:
取4.5g明胶加入到30ml的去离子水中,室温下搅拌使其充分溶胀,随后转移至40℃的恒温水浴中搅拌2小时至明胶充分溶解,配制得到明胶溶液,并向明胶溶液中加入1g壳聚糖酶,并搅拌1小时至壳聚糖酶充分溶解,配置得到壳聚糖酶/明胶混合溶液,继续在40℃的恒温水浴中保温备用;
(3)可控释放的壳聚糖/明胶壳核胶囊的制备:
用容量为1ml的微量注射器吸取一定体积的步骤(2)制备的明胶溶液,将其逐滴滴加到3℃冷的大豆油中,并转移置于4℃恒温冰箱中冷却降温,静置25分钟后取出,利用明胶的温敏性使得明胶液滴形成稳定的明胶微球。将制备得到的明胶微球移出并依次经过无水乙醇、蒸馏水进行淋洗,随后将明胶微球浸入步骤(1)壳聚糖溶液中并分散均匀,用一次性滴管吸取一定体积的含有明胶微球的壳聚糖溶液,逐滴加入到步骤(1)十二烷基苯磺酸钠溶液中,孵化5分钟后,利用壳聚糖与阴离子表面活性剂的静电吸引作用形成微胶囊,最后取出微胶囊用去离子水清洗5次,制备得到核层为明胶微球、壳层为壳聚糖胶囊的壳聚糖/明胶壳核胶囊。
需要说明的是,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!