一种联合输送化疗药和基因编辑体系的多功能聚合物胶束及其制备方法和应用与流程
本发明涉及高分子化学与生物医学工程技术领域,更具体地,涉及一种联合输送化疗药和基因编辑体系的多功能聚合物胶束及其制备方法和应用。
背景技术:
化疗作为临床治疗肿瘤三大手段之一(化疗,放疗,手术),但是在化疗过程中,存在一个不可避免的问题,即由于化疗药物的大量应用,导致肿瘤细胞耐药性的产生,从而导致治疗效果的降低甚至治疗失败。紫杉醇是一中临床上常用的化疗药,它具有与β微管蛋白高的亲和力能稳定微管阻止肿瘤细胞的有丝分裂,从而进行抗肿瘤治疗。但低剂量的紫杉醇不足以达到有效的抗肿瘤作用,而高剂量的紫杉醇又容易使肿瘤细胞产生耐药性、降低治疗效果。所以单一的化疗不足以进行有效的抗肿瘤治疗,需要结合其它治疗方法来联合治疗。
基因编辑治疗肿瘤是近两年来肿瘤治疗研究的热点方向。2013年、2015年和2017年三次被science杂志评为十大科技突破之一的crispr基因编辑技术具有很强的基因调控能力,该系统由cas蛋白或dcas蛋白和grna组成,可同时对多个基因进行多种模式的调控(修改dna,增强或抑制基因表达)。
现在大多数的输送cas9基因编辑体系的非病毒载体,主要的输送dna质粒、mrna或直接输送cas蛋白和grna。直接输送cas9蛋白/grna是最有优势、最有前景的方向,不仅可避免了cas9蛋白和grna体内多步加工所导致的基因编辑效率低的问题,也易于调控cas蛋白和grna的体内作用时间和剂量,具有易调控、基因编辑效率高和脱靶率低的优点。但是输送cas9蛋白/grna具有较高的难度,需要在不破坏cas9蛋白活性的条件下高效的输送cas9蛋白/grna,并且在细胞内能有效的释放出cas9蛋白/grna。而可以直接输送cas9蛋白/grna的同时,还能够疏松化疗药的载体,则未见报道。
因此,有必要开发一种能够有效同时输送cas9蛋白/grna和化疗药物的多功能载体。
技术实现要素:
本发明的第一目的在于提供一种联合输送化疗药和基因编辑体系的多功能聚合物胶束。本发明所述多功能聚合物胶束为三层结构,其内核可负载化疗药物,由于大多数的化疗药物为疏水性的药物,因此内核为疏水的聚己内酯,中间层可与基因编辑体系偶联连接,同时还可与末端修饰有组氨酸标签的破溶酶体多肽结合;外层的dbco-peg20k-dbco,其一端的dbco基团可与中间层发生点击反应,形成屏蔽层,保护内层负载的药物和基因编辑体系,同时其另一端的dbco基团可以通过体内的点击化学反应,靶向叠氮糖高表达的肿瘤组织,发挥其靶向作用。
本发明的第二目的在于提供所述联合输送化疗药和基因编辑体系的多功能聚合物胶束的制备方法。
本发明的第三目的在于提供所述联合输送化疗药和基因编辑体系的多功能聚合物胶束的应用。
本发明的第四目的在于提供一种联合输送化疗药和基因编辑体系的载药聚合物胶束。
本发明的第五目的在于提供所述联合输送化疗药和基因编辑体系的载药聚合物胶束的制备方法。
本发明的第六目的在于提供所述联合输送化疗药和基因编辑体系的载药聚合物胶束的应用。
本发明的上述目的是通过以下方案予以实现的:
一种联合输送化疗药和基因编辑体系的多功能聚合物胶束,所述多功能聚合物胶束为三层结构,内核为用于负载化疗药物的疏水聚己内酯,中间层为可与基因编辑体系偶联的配体nta(n,n-双(羧甲基)-l-赖氨酸),外层为具有靶向作用的dbco-peg20k-dbco,同时外层可与中间层点击反应形成屏蔽层。
所述nta为(1s)-n-(5-amino-1-carboxypentyl)iminodiaceticacid(n,n-双(羧甲基)-l-赖氨酸),其结构如下式所示:
优选地,所述配体nta为可与含有组氨酸标签多肽偶联。
本发明提供的多功能聚合物胶束为三层结构,其内核可负载化疗药物,由于大多数的化疗药物为疏水性的药物,因此内核为疏水的聚己内酯,中间层可与基因编辑体系偶联连接,同时还可与末端修饰有组氨酸标签的破溶酶体多肽结合;外层的dbco-peg20k-dbco,其一端的dbco基团可与中间层发生点击反应,形成屏蔽层,保护内层负载的药物和基因编辑体系,同时其另一端的dbco基团可以通过体内的点击化学反应,靶向叠氮糖高表达的肿瘤组织,发挥其靶向作用。
此外,本发明所述多功能聚合物作为载体,负载化疗药物和基因编辑体系后,进入体内,由于具有靶向性,可高效进入肿瘤细胞,进而进入溶酶体,聚己内酯内核在溶酶体内脂肪酶的作用下降解,响应于溶酶体酸性环境,胶束解离,然后化疗药物和基因编辑体系被释放到胞质,进而发挥其作用;一方面,化疗药物在较低用量下,促进肿瘤细胞凋亡;另一方面,基因编辑体系进入细胞核进行基因编辑,敲除特定的基因,诱导肿瘤细胞凋亡;化疗药物和基因编辑体系共同发挥作用,同时进行化疗和基因治疗,从而可以保证在化疗药物用量较少,不会造成肿瘤细胞耐药性增强的情况下,同时具有很好的抗肿瘤细胞的效果。
优选地,所述基因编辑体系可敲除plk1基因。polo样激酶1(plk1)是一种细胞周期蛋白,在肿瘤细胞中高表达与肿瘤细胞的分裂和增值密切相关;当敲除肿瘤细胞的plk1相关基因,即可抑制plk1的表达,影响肿瘤细胞的分裂和增值,从而诱导肿瘤细胞凋亡,达到抗肿瘤治疗的目的。
本发明同时还保护所述联合输送化疗药和基因编辑体系的多功能聚合物胶束的制备方法,经如下步骤制备得到:
s1.将nta经巯基修饰,得到nta-sh;
s2.以ε-己内酯和烯丙基聚乙二醇为原料,在催化剂辛酸亚锡和无水无氧条件下经聚合反应制得两嵌段共聚物apeg-pcl;
s3.以步骤s2的apeg-pcl和nta-sh,加入aibn(偶氮二异丁腈),加热反应,制得nta-peg-pcl;
s4.以ε-己内酯和叠氮聚乙二醇羟基为原料,在催化剂辛酸亚锡和无水无氧条件下经聚合反应制得两嵌段共聚物n3-peg-pcl;
s5.以nh2-peg20k-nh2和二苯并环辛烯-活性酯(dbco-nhs)为原料,制得dbco-peg20k-dbco;
s6.将步骤s3的嵌段聚合物nta-peg-pcl、步骤s4的n3-peg-pcl和步骤s5的dbco-peg20k-dbco混溶于水中,即可制备得到所述多功能聚合物胶束。
优选地,步骤s1的具体过程为:
s11.以nε-cbz-lys、溴乙酸为原料在氢氧化钠溶液中制得nε-cbz-nta;
s12.以nε-cbz-nta和氢气为原料在pd/c催化下制得nta;
s13.以γ-硫代丁内酯和nta为原料,制得nta-sh。
优选地,步骤s11中,原料在冰浴条件下混合,并先在室温下反应8~16h,然后加热至50~90℃反应2~6h。
优选地,步骤s12中,所述反应在醇的水溶液中进行。
优选地,步骤s3中,所述反应在惰性气体氛围中,加热至60~80℃。
优选地,步骤s2和s4中,所述反应在惰性气体分为中进行,反应的温度为90~120℃;所述ε-己内酯和烯丙基聚乙二醇的反应摩尔比为3~5:1;所述ε-己内酯和叠氮聚乙二醇羟基的反应摩尔比为3~5:1;
优选地,步骤s3中,所述反应在无氧条件下进行,先冻融,然后加热至65~75℃反应12~24h;
优选地,步骤s5中,所述nh2-peg20k-nh2和二苯并环辛烯-活性酯的反应摩尔比为1:10~20。
优选地,步骤s6中,所述聚合物nta-peg-pcl和n3-peg-pcl的质量比为2:2~1。
所述联合输送化疗药和基因编辑体系的多功能聚合物胶束的应用也在本发明的应用之中,所述多功能聚合物胶束作为载体,同时负载化疗药和基因编辑体系。
优选地,所述化疗药为疏水性化疗药物;更优选地,为紫杉醇、阿霉素、替莫唑胺或索拉菲尼;更优选地,所述化疗药物为紫杉醇。
优选地,所述基因编辑体系为cas9/sgrna;更优选地,所述sgrna靶标plk1基因的sgrna。
所述cas9/sgrna基因编辑体系可敲除肿瘤细胞的plk1相关基因即可抑制plk1的表达,影响肿瘤细胞的分裂和增值,从而诱导肿瘤细胞凋亡,达到抗肿瘤治疗的目的。
本发明还保护一种联合输送化疗药和基因编辑体系的载药聚合物胶束,由上述所述多功能聚合物胶束,其内核负载紫杉醇、阿霉素、替莫唑胺或索拉菲尼中的一种或多种化疗药物;中间层的配体nta与cas9/sgrna偶联。
本发明所述载药聚合物胶束,通过nta配体以配位键的形式来连接cas9蛋白/grna,可以最大限度的保持cas9蛋白的活性;同样方式结合上修饰了组氨酸标签的破溶酶体多肽,可以确保蛋白在溶酶体中快速逃逸、然后释放;所述载药聚合物胶束表层的带dbco靶向分子量20k的peg可以起到保护蛋白的作用,使蛋白在体内循环的时候不被酶降解,而进入到肿瘤细胞之后,才进行降解,释放化疗药物和cas9/sgrna,从而提高了药物的生物利用度。
优选地,所述化疗药物为紫杉醇。
优选地,所述sgrna靶标plk1基因的sgrna。
优选地,当化疗药物为紫杉醇,基因编辑体系为cas9/sgrna时,则载药聚合物胶束为联合输送紫杉醇和cas9/sgrna的载药聚合物胶束。
所述载药聚合物胶束靶向进入肿瘤细胞后,聚合物胶束被溶酶体吞噬,聚己内酯内核在溶酶体内脂肪酶的作用下降解,响应于溶酶体酸性环境,带有组氨酸标签的cas9蛋白和破溶酶多肽和胶束解离,解离的破溶酶体多肽由于在酸性环境下构像的转变可以破坏溶酶体膜,然后化疗药物和cas9/sgrna被释放到胞质,进行化疗和基因治疗,协同的提高抗肿瘤效果。
所述联合输送化疗药和基因编辑体系的载药聚合物胶束的制备方法也同样在本发明的保护范围之类,经由上述所述多功能聚合物胶束的制备方法中步骤s1至s7制备得到nta-peg-pcl、n3-peg-pcl和dbco-peg20k-dbco后,先将nta-peg-pcl、n3-peg-pcl和化疗药物混溶于thf、dmf或dmso中,然后加入二价镍盐溶液,透析,超滤浓缩,制得nta/n3@化疗药物胶束溶液;
然后将nta/n3@化疗药物胶束溶液和cas9/sgrna复合物溶液、破溶酶体肽溶液依次混合,超滤,制得cas9/sgrna-pep-nta/n3@化疗药物胶束溶液;
最后,将cas9/sgrna-pep-nta/n3@化疗药物胶束溶液和dbco-peg20k-dbco溶液混合反应,超滤后,即可得到所述联合输送化疗药和基因编辑体系的载药聚合物胶束。
优选地,所述二价镍盐溶液为niso4溶液或nicl2溶液。二价镍离子与nta配位后,具有结合蛋白的能力。
优选地,所述破溶酶体肽的序列为hhhhhweaklakalakalakhlakalakalkacea。
本发明还保护所述联合输送化疗药和基因编辑体系的载药聚合物胶束在制备抗肿瘤药物中的应用。
与现有技术相比,本发明具有以下有益效果:
本发明提供的多功能聚合物胶束为三层结构,其内核可负载化疗药物,中间层可与基因编辑体系偶联连接,外层为dbco-peg20k-dbco,保护内层负载的药物和基因编辑体系,同时还具有靶向作用。
本发明所述多功能聚合物作为载体,负载化疗药物和基因编辑体系后,进行体内,由于具有靶向性,可高效进入肿瘤细胞,进而进入溶酶体,聚己内酯内核在溶酶体内脂肪酶的作用下降解,响应于溶酶体酸性环境,所述载体中间层带有组氨酸标签的cas9蛋白和破溶酶体多肽和胶束解离,解离的破溶酶体多肽由于在酸性环境下构像的转变可以破坏溶酶体膜,然后化疗药物和基因编辑体系被释放到胞质,进而发挥其作用;一方面,化疗药物在较低用量下,促进肿瘤细胞凋亡;另一方面,基因编辑体系进入细胞核进行基因编辑,敲除特定的基因,诱导肿瘤细胞凋亡;化疗药物和基因编辑体系共同发挥作用,同时进行化疗和基因治疗,从而可以保证在化疗药物用量较少,不会造成肿瘤细胞耐药性增强的情况下,同时具有很好的抗肿瘤细胞的效果。
附图说明
图1为nta-sh的合成路线示意图。
图2为nta-sh及其相关合成分子的核磁共振氢谱图。
图3为聚合物nta-peg-pcl和n3-peg-pcl的合成路线示意图。
图4为聚合物nta-peg-pcl和n3-peg-pcl的核磁共振氢谱图。
图5为聚合物dbco-peg20k-dbco的合成路线示意图。
图6为聚合物dbco-peg20k-dbco的核磁共振氢谱图。
图7为细胞摄取纳米粒子的共聚焦图。
图8为细胞凋亡的流式图。
具体实施方式
下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1
一种用于联合输送化疗药和cas9/sgrna基因编辑体系的多功能聚合物载体及其制备方法,所述聚合物胶束的合成路线过程如图1所示,其中负载的化疗药物为紫杉醇(ptx)包括如下步骤:
1、(1s)-n-[5-[(4-mercaptobutanoyl)amino]-1-carboxypentyl]iminodiaceticacid(hs-nta)的合成
(1)(1s)-n-(5-carbobenzyloxyamino-1-carboxypentyl)iminodiaceticacid(nε-cbz-nta)的合成:称取8.4gnε-cbz-lys(30mmol),加入45ml2m的氢氧化钠溶液溶解;再称取8.34g溴乙酸(60mmol)溶于30ml2m的氢氧化钠溶液中,在冰浴条件下,滴加nε-cbz-lys的氢氧化钠溶液;室温反应过夜,然后将反应加热到70℃反应两小时。反应完后,将反应在冰浴中冷却,加入90ml1n的盐酸溶液,溶液析出大量白色沉淀;将沉淀抽滤收集起来,用水洗两次、抽干、真空干燥,得到12.4g产物nε-cbz-nta。
(2)(1s)-n-(5-amino-1-carboxypentyl)iminodiaceticacid(nta)的合成:将6gnε-cbz-nta溶解在95ml甲醇和5ml水中,加入0.6g10%pd/c催化剂,在常压的氢气气氛中室温反应过夜。反应完后,加入100ml水到反应液中,将甲醇旋蒸除去;然后,过滤除掉催化剂,将滤液浓缩到5ml,加入200ml无水乙醇沉淀出产物,抽滤收集沉淀,真空干燥,得到2.9g产物nta。
(3)(1s)-n-[5-[(4-mercaptobutanoyl)amino]-1-carboxypentyl]iminodiaceticacid(nta-sh)的合成:称取1gnta(3.8mmol)和1g碳酸氢钠(11.9mmol)溶解在10ml水里,再加入0.6gγ-硫代丁内酯,在氮气气氛中加热到70℃反应过夜。反应完后,将溶液冷却至室温,用醋酸将溶液ph调至3;然后将溶液旋蒸浓缩,用乙醇沉淀出产物,离心收集沉淀,用乙醇洗两次,真空干燥等到0.95g产物nta-sh。
2、两嵌段共聚物nta-聚乙二醇-聚己内酯(nta-peg-pcl)的合成
(1)apeg-pcl的合成:称取1g的apeg-oh(mw3.4kda,0.29mmol)加入50ml反应瓶中,70℃真空干燥2h,加入1滴辛酸亚锡sn(oct)2继续干燥0.5h,再加入干燥的2g(17.5mmol)己内酯和10ml无水甲苯;在n2下110℃搅拌反应18h,沉淀在过量的乙醚中,抽滤,干燥得白色粉末状产物2.8g。
(2)nta-peg-pcl的合成:将1gapeg-pcl(mw9.6kda,0.1mmol)溶于1mldmf中,将0.36g的nta-sh(1mmol)溶于2ml水中,再将nta-sh的水溶液加入到apeg-pcl的dmf溶液;冻融循环2次基本除去氧气置换成n2后,加入5mgaibn(0.03mmol)到反应溶液中,再冻融1次,密封,70℃反应12h。反应完后,将反应液转移至透析袋(mwco:3.5kda)中,甲醇透析1d,去离子水透析2d,冻干得0.92g白色产物nta-peg-pcl。
3、两嵌段共聚物n3-peg-pcl的合成:与apeg-pcl的合成类似,称取1g的n3-peg-oh(mw3.4kda,0.29mmol)加入50ml反应瓶中,70℃真空干燥2h,加入1滴辛酸亚锡sn(oct)2继续干燥0.5h,再加入干燥的2g(17.5mmol)己内酯和10ml无水甲苯。在n2下110℃搅拌反应18h,沉淀在过量的乙醚中,抽滤,干燥得白色粉末状产物2.7g。
4、dbco-peg20k-dbco的合成:称取200mgnh2-peg20k-nh2(0.01mmol)和80mgdbco-nhs(0.2mmol),用5ml无水的二氯甲烷溶解,室温反应过夜。反应完后,用乙醚反复沉淀三次,真空干燥,得到dbco-peg20k-dbco。
5、制备载药胶束:
(1)将14mgnta-peg-pcl和7mgn3-peg-pcl于2mlthf中,加入0.1mgptx(紫杉醇)后,超声下滴入到20ml水中,用5mmpbs(ph为7.4)的水溶液透析(mwco:14kda)除去有机溶剂和游离的药物,超滤浓缩至5mg/ml,得到nta/n3@ptx胶束;
(2)将20μgcas9蛋白和5μgsgrna(plk1)的溶液混合,37℃复合五分钟,将cas9/sgrna(plk1)复合物和破溶酶体多肽依次和50μl的nta/n3@ptx胶束溶液(5mg/ml)混合,孵育半小时,得到cas9/sgrna(plk1)-pep-nta/n3@ptx胶束溶液;
(3)cas9/sgrna(plk1)-pep-nta/n3@ptx胶束溶液和dbco-peg20k-dbco聚合物溶液混合、反应4h,超滤除去未反应的dbco-peg20k-dbco制得dbco-peg20k-cas9/sgrna(plk1)-pep-nta@ptx胶束溶液。
同样的,按照上述制备方法,将sgrna(plk1)换成阴性对照的sgrna(aavs1),制得dbco-peg20k-cas9/sgrna(aavs1)-pep-nta@ptx胶束溶液。
同样的,按照上述制备方法,疏水内核不负载ptx,制得dbco-peg20k-cas9/sgrna(plk1)-pep-nta胶束溶液。
同样的,按照上述制备方法,疏水内核不负载ptx,将sgrna(plk1)换成阴性对照的sgrna(aavs1),制得空胶束dbco-peg20k-cas9/sgrna(aavs1)-pep-nta胶束溶液。
实施例2聚合物的结构分析
取实施例1各步产物约8mg溶于适量氘代溶剂,用1h-nmr400mhz核磁共振波谱仪进行测试,检测反应前后聚合物结构上1h化学位移的变化,结果如图2、图4和图6所示。
从图2、图4和图6中可知,所有聚合物的结构上的氢都在核磁共振氢谱图上有很好的归属,证明聚合物的成功合成。
实施例3聚合物胶束的性能检测
1、细胞摄取实验
按照实施例1中胶束的制备过程,将胶束内核负载的ptx替换成为疏水荧光染料尼罗红,模拟ptx在细胞内的释放和分布;同样地,按照实施例1中胶束的制备过程,将胶束内负载的替换成为cas9-gfp的融合蛋白,模拟cas9蛋白在细胞内的释放。
使用激光共聚焦显微镜系统拍摄a549细胞与胶束共孵育,测得结果如图7所示。通过观察尼罗红的荧光和cas9-gfp蛋白的荧光在细胞内的分布情况,从图7中可知,制备的胶束能很好被a549细胞摄取,2-4h开始从溶酶体逃逸,释放出尼罗红和cas9-gfp蛋白,尼罗红留在胞质中,而cas9-gfp蛋白进一步进入细胞核进行基因编辑。
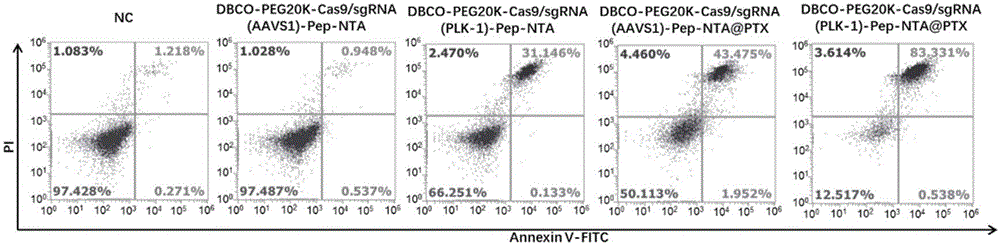
2、细胞凋亡实验
使用annexinv-fitc和pi双染色法流式细胞术检测细胞凋亡和坏死。先将每组细胞加入叠氮化的甘露糖mannaz孵育三天,使a549细胞膜表面表达带叠氮基团的多糖。然后加入相同浓度,不同的胶束进行孵育,然后检测细胞凋亡和坏死情况,检测结果如图8所示。图8中,图中q1区表示坏死的细胞,q2区表示早期凋亡细胞,q3区表示正常细胞,q4区表示晚期凋亡细胞。q1、q2与q4细胞数之和的大小可认为是样品诱导a549细胞凋亡的能力。
从图8中可知,单纯加叠氮化的甘露糖mannaz的nc组,细胞凋亡数很少,说明mannaz不诱导细胞凋亡。
加入空胶束dbco-peg20k-cas9/sgrna(aavs1)-pep-nta胶束溶液的对照组,细胞凋亡也很少,说明空胶束不诱导细胞凋亡。
加入dbco-peg20k-cas9/sgrna(aavs1)-pep-nta@ptx胶束溶液的单药组,细胞凋亡50%左右。
加入dbco-peg20k-cas9/sgrna(plk1)-pep-nta胶束溶液的单纯基因编辑治疗组,细胞凋亡34%左右。
加入dbco-peg20k-cas9/sgrna(plk1)-pep-nta@ptx胶束溶液的联合组,细胞凋亡88%左右。
以上结果表明,当胶束同时负载了ptx和sgrna(plk1),细胞凋亡的效果更为显著,表明二者联合使用时,在ptx较低剂量下,即可达到较高的细胞凋亡效果,同时又避免了肿瘤细胞对ptx耐药性的产生。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
序列表
<110>中山大学
<120>一种联合输送化疗药和基因编辑体系的多功能聚合物胶束及其制备方法和应用
<140>201910892360x
<141>2019-09-20
<160>1
<170>siposequencelisting1.0
<210>1
<211>35
<212>prt
<213>破溶酶体肽(lysosomalpeptide)
<400>1
hishishishishistrpglualalysleualalysalaleualalys
151015
alaleualalyshisleualalysalaleualalysalaleulysala
202530
cysgluala
35
- 还没有人留言评论。精彩留言会获得点赞!